第六章卤代烃
华中农业大学《有机化学》第六章 卤代烃

N
6.4 消除反应(elimination)
消除反应
卤代烷和碱醇溶液共热,可以脱去一分子卤化氢生成烯烃。
KOH/醇
H3
H3C
2
3
消除反应
如果存在两种β氢,则生成的主要烯烃遵循札依采夫规则。
NH2、–OR、
-
不同卤代烃反应活性:R–I>R– Br>R–Cl
卤代烃的亲核取代反应
①被羟基取代
R-X+H2O
R一X ②被氰基( -CN)取代
R-OH + HX
N
醇
常用于增长碳链
卤代烃的亲核取代反应
③被烷氧基取代
wil/iamson Rxn
④被氨基取代
R一x + H-NH2
2
卤代烃的亲核取代反应
⑤被硝酰氧基取代
R 一 X + Ag - ONO2
热乙醇溶液
鉴定卤代烃的常用 方法之一。
RNO一2○ —
硝酸酯
Br Br
+ Agx
6.3 亲核取代反应历程
亲核取代反应历程
亲核取代( SN )反应: S(Substitution)表示取代,N(Nucleophilic)表示亲核。
根据化学动力学的研究以及许多实验证明 : 亲核取代( SN )反应通常分为两种机理: SN 1 ; SN2
SN 1反应速率:叔卤代烷 > 仲 >> 伯 why?
产生碳正离子中间体为决速步骤,碳正离子的稳定性顺序: 叔碳正离子> 仲碳正离子>> 伯碳正离子
医学有机化学-第六章卤代烃

有机化学
全国中医药高职高专院校教材
2
第六章 卤代烃
湖南中医药高等专科学校 喻祖文
3
第六章 卤代烃
学习要点 1.卤代烃的定义、分类、命名和理化性质 2.扎伊采夫(Saytzeff)规则;卤代烃中双键位
置对卤素活泼性的影响
制作:喻祖文 审校:王志江4
卤代烃是指烃分子中的氢原子被卤原子取代 得到的化合物。卤原子X是卤代烃的官能团,常见 的卤代烃是氯代烃、溴代烃和碘代烃
CH 2— H
2.双分子消除反应(E2)(反应是一步完成)
H O H
C H 2— C — C H 2— X
H
H
δ-
C H 3— C C H 2 X
δ- H O H
过 渡 态
C H 3C H = C H 2+H 2O+X
制作:喻祖文22
消除反应和亲核取代反应历程很相似,它们的区别在于: 在亲核取代反应中,试剂进攻的是α-C原子 而在消除反应中,试剂进攻的是β-C原子上的H原子 在多数情况下,卤代烷的消除反应和亲核取代反应同时发生 ,且相互竞争,两种反应产物的比例受卤代烷结构、试剂的 碱性、溶剂的极性、反应温度等多种因素的影响
溶解性:难溶于水,可溶于醇、醚、烃等有机溶剂。氯 仿、四氯化碳常用的有机溶剂
密度:RCl < RBr < RI。多氯代烃、溴代烃和碘代烃密 度大于1
制作:喻祖文10
一、亲核取代反应
N u :-+ R - X R - N u+ X :(一)亲核取代反应
1.被羟基取代 卤代烃与氢氧化钠或氢氧化钾的水溶液共热, 则卤原子被羟基取代生成醇
第一步:叔丁基溴的碳溴键发生异裂,生成叔丁基碳正 离子和溴负离子,这一步的反应速率较慢
第六章--卤代烃

• 溶剂的影响(不讲) • 溶剂的极性增加对SN1历程有利,对SN2历程不 利。
H2O C6H5CH2Cl OH
-
SN1 丙酮 SN2
C6H5CH2OH + Cl-
R3C-X
叔卤代烃 三级卤代烃 3° ( )
Professor: Zhang Yan-Bing, E-mail: zhangyb@
二.命名
• 简单的卤代烃用普通命名或俗名,(称为卤代某 烃或某基卤)
CHCl3 CH3CH2CH2Cl (CH3)CHCl 2
3 (CH3) CBr
有机化学
郑州大学化学系
Professor: Zhang Yan-Bing, E-mail: zhangyb@
第六章 卤代烃
• 烃分子中的一个或多个氢原子被卤素原子 取代后生成的化合物,称卤代烃 (halohydrocarbon)。 • 卤代烃在自然界存在的数目很少(主要是合 成),但是有很多实际用途,如灭火剂、高 分子材料、杀虫剂、制冷剂、麻醉剂等, 也是重要的有机合成原料。
4.影响亲核取代反应的因素
• 卤代烃结构的影响(重点)
Professor: Zhang Yan-Bing, E-mail: zhangyb@
• 离去基团的性质(不讲) 无论是SN1还是SN2离去基团的碱性越弱,越易离 去,反应越容易进行。 碱性很强的基团(如 R3C 、R2N 、RO 、HO 等) 不能作为离去基团进行亲核取代反应,象R-OH、 ROR等,就不能直接进行亲核取代反应。
位 能
HO + CH3Br
E
H CH3OH + Br
06卤代烃

卤代烃的分类、 第一节 卤代烃的分类、命名及同分异构 现象 一、分类 根据与卤素相连的烃基结构分为: 根据与卤素相连的烃基结构分为: 伯卤代烃 CH3CH2CH2CH2X CH3 CH3CH2CHX 饱和卤代烃 仲卤代烃 CH3 叔卤代烃 C C X H
3
CH3
乙烯式卤代烃
不饱和卤代烃
结构变化: ② 结构变化:CSP3 →CSP2 →CSP3 立体化学: ③ 立体化学:构型反转 能量变化: ④ 能量变化: 2.单分子历程( SN1) 单分子历程( 单分子历程 ) 动力学特征: ⑴ 动力学特征:单分子一级反应
V1°=k[(CH3)3CBr] 一级反应 °
⑵ 反应历程
慢 (CH3)3C
RC C - RC ( CH) 、I-(NaI)、 )、NH3 ( )、
例 丁二烯制备己二胺
CH2 CHCH
CH2
CH2
CHCH CH2
H2NCH2CH2CH2CH2CH2CH2NH2
Cl2 CH2CH CHCH2 Cl
NaCN
Cl H2NCH2CH2CH2CH2CH2CH2NH2
2.脱卤化氢 消除反应 脱卤化氢—消除反应 脱卤化氢
RCH H CH2 X NaOH EtOH RCH CH2
消除反应活性: ° ① 消除反应活性:3°> 2°> 1° ° ° 消除方式: ② 消除方式:扎依切夫规则 消除的竞争反应: ③ 消除的竞争反应:亲核取代
3.与金属的反应 与金属的反应 的反应( ⑴ 与Na的反应(武兹反应) 的反应 武兹反应)
+
Br
[ (CH3)3Cδ
快
+
δ ] Br
(CH3)3C
+
第六章 卤代烃(答案)
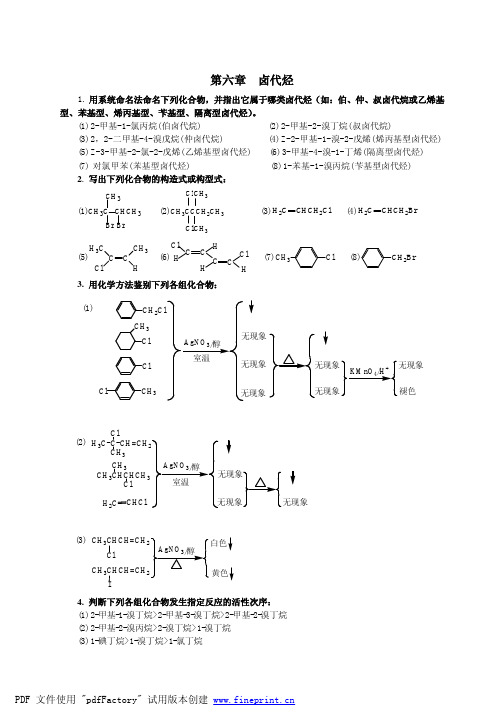
第六章 卤代烃1. 用系统命名法命名下列化合物,并指出它属于哪类卤代烃(如:伯、仲、叔卤代烷或乙烯基型、苯基型、烯丙基型、苄基型、隔离型卤代烃)。
(1) 2-甲基-1-氯丙烷(伯卤代烷) (2) 2-甲基-2-溴丁烷(叔卤代烷)(3) 2,2-二甲基-4-溴戊烷(仲卤代烷) (4) Z -2-甲基-1-溴-2-戊烯(烯丙基型卤代烃) (5) Z -3-甲基-2-氯-2-戊烯(乙烯基型卤代烃) (6) 3-甲基-4-溴-1-丁烯(隔离型卤代烃) (7) 对氯甲苯(苯基型卤代烃) (8) 1-苯基-1-溴丙烷(苄基型卤代烃) 2. 写出下列化合物的构造式或构型式:(1)CH 3C CHCH 3BrBr CH 3 (2)CH 3CCCH 2CH 3Cl Cl CH 3CH 3(3)CHCH 2Cl H 2C (4)CHCH 2Br H 2C (5)C CCH 3H 3C Cl(6)CCCl HC C ClHH H(7)CH 3Cl (8)CH 2Br3. 用化学方法鉴别下列各组化合物:(1)褪色2Cl CH 3Cl CH 3ClCl(2) C ClH 3C CH 3CH 3CHCHCH 3CH 3ClH 2CCHCl(3) CH 3CHCH=CH ClCH 3CHCH=CH I4. 判断下列各组化合物发生指定反应的活性次序: (1) 2-甲基-1-溴丁烷>2-甲基-3-溴丁烷>2-甲基-2-溴丁烷 (2) 2-甲基-2-溴丙烷>2-溴丁烷>1-溴丁烷 (3) 1-碘丁烷>1-溴丁烷>1-氯丁烷(4) 2-甲基-2-溴丁烷>2-甲基-3-溴丁烷>2-甲基-1-溴丁烷 5. 完成下列转化: (1)Br 2(CH 3)2CHCHCH Cl(CH 3)2C=CHCH 33)2CCHCH 3BrBrCH 32=CCH=CH 2(2) CH 2H +/H 2OCl CH 2CNClCH 2COOH(3)CH 222COOH(4)CHCH Br2CH 2Br2CH 2OCH 3(5) 4+3CCH 2CH 2CH 2COOH CH 3ClCH 3O6. 完成下列转化:(1) NaCN乙醇Br 2CCl 4H 2CCH 2BrH 2C CH 22C 2CNH +/H 2O2CH 2COOH(2) +243COOH CH 3CHCH 2CH Br 3CH=CHCH 3(3) NaHBrH 2CCH 2H 3C CH 23CH 2CH 2CH 3(4) HClNH 3CH 3CH 2CH 2Cl3CH=CH 23CHCH Cl3CHCH 3NH 2(5) HBr②2①2CH 3CHCH 2CH 33C=CH 2CH 3CH 3CCH CH 3Br Mg/无水乙醚3)3CCOOH(6) HBrNaCN乙醇H 2CH 3C=CH CH 3CH 3CHCH 2CH 33CHCH 2CN33CHCH 2CH 2NH 2CH 37. A CH 3C Br CH HCH 2 B CH 3CHCHCH 2Br Br BrC H 2C CH CH CH 2 8. A CH 3CHCHCH 3CH 3BrB CH 3C=CHCH 3CH 3C CH 3CCH 2CH 3BrCH 3或:A CH2CH2CHCH3Br CH3B CH3CHCH=CH2CH3C CH3CHCHCH3CH3Br或:A CH2CHCH2CH3Br CH3B CH3CH2C=CH2CH3C CH3CCH2CH3BrCH39. 单项选择题(1) C (2) C (3) A (4) C (5) B (6) A (7)A (8) B (9) B (10) A。
医学有机化学-第六章卤代烃PPT课件

制作:喻祖文
由亲核试剂进攻带部分正电荷的碳原子而引起的 取代反应称为亲核取代反应,用SN表示
- + δ δ R — C H — X + N u 2
R — C H — N u + X 2
卤 代 烃 亲 核 试 剂 产 物 离 去 基
制作:喻祖文
(二)亲核取代反应历程
1.单分子亲核取代反应(SN1)(反应分两步进行)
制作:喻祖文
课堂互动
试写出2,3-二甲基-3-溴戊烷发生消除反应时 主要产物的结构式
制作:喻祖文
(二)消除反应的历程
消除反应历程也有两种,即单分子消除反应(E1)和双分 子消除反应历程(E2) 1.单分子消除反应(E1)(反应分两步完成)
C H 3 ( C H ) C X 3 3 慢
- - X
C H 3
p-π共轭使C-X键的电子云密度增加,极性减弱 这类卤代烃极不活泼,不易发生取代反应,与硝酸银的 醇溶液共热,也无卤化银沉淀产生
制作:喻祖文
(二)卤代烯丙型
当卤素与双键(H)R-CH=CH-CH2-X或苯环C6H5CH2-X相隔一个碳原子时,称为卤代烯丙型
C H = C H C H C l 2 2 3 氯 丙 烯 ( 烯 丙 基 氯 ) C H C l 2 α 氯 甲 苯 ( 苄 氯 )
制作:喻祖文
(一)消除反应的取向
仲卤代烃和叔卤代烃发生消除反应时,可能生成两种 以上的烯烃
K O H / 乙 醇 C H H H C H 3C 2C 3 B r C H H C H C H = 3C 38 1 % 2 丁 烯 C H H H C H = 1 9 % 3C 2C 2 1 丁 烯
从上述反应可看出,卤代烃消去一分子的卤化氢后, 生成的主要产物是双键上连有烃基较多的烯烃,或者说被 消去的氢原子主要由含氢较少的碳原子提供。这一规则称 为扎伊采夫规则
第六章卤代烃

查依采夫规则
当2-溴丁烷在强碱条件下发生消除反应时,Br的 位有2个,消除时要去掉哪个-H呢?经测定
KOH / 醇
Br
19%
+
81%
通过大量实验,俄国化学家查依采夫(Saytzeff) 总结出卤烃发生消除反应的经验规律。
查依采夫规则:
卤代烷脱HX时,总是从含H较少的碳上脱去H原子。
Saytzeff规则应用
卤代烃
烃中氢原子被卤原子取代后生成的产物,称为卤 代烃。卤原子是其官能团,通常是氯、溴、碘, 氟的性质极活泼,用常规方法不能制得,故不在 本章重点讨论之列。卤代烃的性质较为活泼,可 转化成多种有机化合物,在工业、农业和医药方 面都有广泛的用途。
目录
7.1 7.2 7.3 7.4 7.5 7.6 7.7
RCl + R'Cl + Na
R R + R R' + R' R'
7.4.3.1 与金属Mg的反应
卤代烷与金属镁反应,生成有机镁化合物RMgX, 由法国化学家格利雅(Grignard)在1900年发现, 于是RMgX就被人们命名为格利雅试剂,简称格氏 试剂。 RMgX的性质非常活泼,可与水、CO2、羰 基化合物反应,通常需保存在无水乙醚中。
7.1 卤烃的分类及命名
2. 按卤原子所连碳原子种类分为:
① 伯卤烃(一级卤代烃) RCH2-X ② 仲卤烃(二级卤代烃) R2CH-X ③ 叔卤烃(三级卤代烃) R3C-X
① 饱和卤烃(卤代烷) C2H5Cl ② 不饱和卤烃(卤代烯、卤代炔)CH2=CHCl ③ 卤代芳烃 Ar-X
第六章 卤代烃 (2)

CH3CH2CH2CHCH3 Br
CH3CH2CH=CHCH3 + CH3CH2CH2CH=CH2
69% 31%
CH3 CH3CH2-C-CH3 Br
CH 3 CH 3 Cl
KOH, 乙醇
CH3CH=C
71%
CH3 CH3
+
CH3CH2CH=CH2
29%
KOH, 乙醇 主
CH 3 + CH 3
R-X + NH3(过量)
R-NH2 + NH4X
4.与醇钠(RONa)反应 与醇钠( 与醇钠 )
' R-X + RONa
R-O R' + NaX 醚
R-X一般为 °RX,(仲、叔卤代烷与醇钠反应时,主 一般为1° ,( ,(仲 叔卤代烷与醇钠反应时, 一般为 要发生消除反应生成烯烃)。 要发生消除反应生成烯烃)。 5.与AgNO3—醇溶液反应 与 醇溶液反应
CH3CH2-Cl 2.05
CH3CH2-Br 2.03
CH3CH2-I 1.91
CH3CH3 0
键的键能( 除外) 键小。 ②分子中C—X 键的键能(C—F除外)都比 分子中 除外 都比C—H键小。 键小 键 键能kJ/mol 键能 C—H 414 C—Cl 339 C—Br 285 C—I 218
例如: 例如:
CH3-CH2-CH--CH-CH3 H3C Cl
3- 甲基 -2- 氯戊烷
CH3-CH2-CH-CH2-CH-CH2-CH3 CH3 Cl
3- 甲基 -5- 氯庚烷 3- 氯 -5- 甲基庚烷 × 4- 甲基 -2- 氯己烷
CH3-CH-CH2-CH-CH2-CH3 Cl CH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3CCH3
NaI
CH3CHCH2CN
I
NaBr
丙酮的存在使生成的NaCl、NaBr不溶,使平 衡向右移动。
(5)与硝酸银-乙醇溶液作用 反应是典型SN1历程,生成沉淀的速度是: R3CX >R2CHX> RCH2X
可用于鉴别不同结构的卤烷。
RX
C2H5OH
AgNO3
RONO2
AgX
用化学方法鉴别: 1—溴丁烯 3—溴丁烯 4—溴丁烯 2—溴丁烷
(c)烯丙基型和苄基型卤代烃对SN反应的影响
++
CH2 CH CH2
++
CH2
由于这些碳正离子相当稳定,所以相应卤代烃 SN1反应活性很高。(比叔卤烷活性高)
SN2反应活性也很高(比伯卤烷活性高),因为 共轭而使过渡态活化能降低。
X δH
CCC H
Nu δ-
(d)乙烯型卤化物对SN反应活性的影响
支链增多对消除有利。 2、试剂碱性和亲核性 碱性强对消除有利,对E2更有利;(KOH/醇、
RONa/醇、RONa/DMSO)。 亲核性强对取代有利,SN2更有利,试剂体积
增大对消除有利。
3、反应温度
提高反应温度对取代、消除都有利,对消除更 有利。
六、有机氟化物
1、有机氟化物的命名
(1)含有一个或少数氟原子的化合物可采用系统 命名法命名。
C2H5OH/H2O
回流
CH3CH2CH2OH
NaBr
采用乙醇/水溶液作为溶剂,主要是增加卤烷在
反应体系中的溶解度。
此法常用于高级醇的制备。
(2)被氰基取代得到腈 伯卤烷与氰化钠在乙醇-水溶液中反应,可以得
到相应的腈化物;仲和叔卤烷易生成消除产物。
CH3CH2CH2CH2I
C2H5OH
NaCN
H2O
R' C OMgBr R"
本反应在有机合成中是很好的增碳和制醇方法。
O
合成
CH3CCH2CH3 , CH3CH2MgBr
OH CH3CH2CCH2CH3
CH3
如何避免格氏试剂 分解?
CH3 CH3CH2C O
CH3
CH2CH2CH3
用不超过三个碳的有机物 合成上述丙基叔戊基醚
三、影响卤代烃亲核取代反应活性的因素
(4)含氟和氯或溴化合物用商品名氟里昂表示 原则:FXXX ,个位数表示氟原子数;十位数表示
氢原子数加1;百位数表示碳原子数减1;氯不表示; 溴用B表示在最后;环状化合物C表示F后。
FCCl3
F11
CBr2F2
F12B2
CF(Cl)2CF(Cl)2 F112
CF2
CF2
CF2
FC318
CF2
2、氟化物的制备 (1)不饱和烃与HF的加成 低温对加成反应有利;高温对聚合反应有利。
CH2 CH X
2、亲核试剂的影响 SN1反应:决速步骤与亲核试剂浓度无关;但
亲核性增强将会导致反应历程的改变。 SN2反应:试剂亲核性增强对反应有利。 亲核性的比较:(结合碳原子的能力)
RO- > OH- > ArO- > RCOO- >H2O (与碱性顺序一致) I- > Br- > Cl- > F- (与碱性顺序相反) 为什么?
Grignard试剂能与醛、酮、酯等反应, 在有机合成上具有广泛用途。
CH3
CH3
例如:由 D2O ,
CH3
Br2 Fe
D
CH3
Mg (C2H5)O
CH3
D2O
Br
MgBr
CH3 D
羰基与Grignard试剂加成
R
C O + R"δ MgδBr
R
R'
R'
H3O
R C OH + Mg(OH)Br
R"
第六章 卤代烃
一、卤代烃的物理性质 二、卤代烃的化学性质 三、影响卤代烃亲核取代反应活性的因素 四、影响卤代烃消除反应活性的因素 五、取代反应与消除反应的竞争 六、有机氟化物 七、卤代烃的制备
卤素直接与烃分子中的碳原子相连的化合物称
为卤代烃。通常卤代烃可以分为以下三种类型:
卤代烷烃:CH3Cl 、CH3CH2Br、CCl4 等
3、离去基团的影响
离去基团的离去能力增强对亲核取代反应有利, 对SN1反应更有利。
通常亲核性强的基团,往往是差的离去基团。但 有例外。
卤素离去能力:I > Br > Cl > F 4、溶剂的影响
极性溶剂对SN1反应有利;(对碳正离子溶剂化效 应强)
极性溶剂对SN2反应不利。(导致亲核试剂溶剂化)
四、影响卤代烃消除反应的因素
CH3CH2CH2Br
ONa
C2H5OH
CH3CHCH3
CH3CH2CH2 O CH(CH3)2
由于醇钠是强碱,若采用仲或叔卤烷将得到烯 烃。 若要制备下列化合物,应如何选择试剂:
CH3 CH3CH2C O
CH3
CH2CH2CH3
O CH2
若反应在相转移催化剂存在下,则反应可有醇
在氢氧化钠水溶液中与卤代烷作用制得醚。反应条件
卤原子的活泼性 : RI> RBr> RCl 消除反应的取向遵循Saytzeff规则:
生成支链较多的烯烃。
CH3
CH3 CH CH
Br
CH3
NaOH
CH3 C2H5OH CH3C CHCH3
但是:当碱的体积特大或离去基团离去能力 较差(氟原子)时,消除取向按Hofmann规则,即 生成支链较少的烯烃。
1、烃基结构的影响 E1反应活性:叔卤烷 > 仲卤烷 > 伯卤烷 E2反应活性:叔卤烷 > 仲卤烷 > 伯卤烷
(碱进攻β-H,叔卤烷β-H较多,反应活性高)
CH3 CH3 C X
CH2
H
B
相同级数的卤代烃,烃基支链越多,对消除越有利。
CH3CH2Br CH3CH2CH2Br
0.9%
8.9%
2、碱的强度影响
Br (1)
CH3 快 CH3 C OH (2)
CH3
(1)是慢反应,是决速步骤。
SN2反应是协同的一步反应:
H
H
HO H C BrHOδ NhomakorabeaC
Brδ
H
H
H
H HO C H
SP2杂化
Br
H
(1)被羟基取代得到醇 卤甲烷或伯卤烷与NaOH/乙醇-水作用,可得到
醇;仲醇或叔醇易生成消除产物。
NaOH
CH3CH2CH2Br
亲核取代反应历程主要是SN1和SN2。影响因素主 要是烃基结构、亲核试剂、离去基团、溶剂极性等。
1、烃基结构影响 (a)烃基结构对SN1反应的影响 RBr + H2O HCOOH ROH + HBr (典型的SN1反应)
反应速率:CH3Br 1 ; CH3CH2Br 1.6 (CH3)2CHBr 3.2 ; (CH3)3CBr 107
(CH3)2CHCH2Br 60%
无论E1还是E2,碱性增强对反应有利。
(CH3)3C Br
碱浓度
NaOH
C2H5OH 55℃
CH3
C CH2 CH3
0 ml/l
28%
0.05
34%
2.00
93%
3、溶剂的影响
极性溶剂对E1反应有利。
4、反应温度的影响
由于反应过程中需要断裂C-H键,提高反应温度 对消除反应有利。
RLi + LiX
RLi + RX
R-R + LiX
Corey-House反应:
2RLi + CuI R2CuLi + R’I
R2CuLi +LiI R-R’+ RCu + LiI
Wurtz反应: RX + Na RNa + RX
RNa + NaX R-R + NaX
(2)与金属镁作用(生成Grignard试剂) 卤代烃在绝对乙醚或四氢呋喃等溶剂中与金属镁
ROMgX H2O ROH Mg(OH)X
RMgX
HX
R'OH H2O NH3 R'C CH
MgX2 R'OMgX
Mg(OH)X
RH
Mg(NH2)X R'C CMgX
在有机分析中,将含有活泼氢的化合物与甲基碘
化镁作用,通过生成的甲烷计算出化合物中的活泼氢。
在制备Grignard试剂时,必须使用绝对乙醚(不 含乙醇和水)。
2、消除反应 往往一个好的亲核试剂同时又是一个碱试剂,所
以在发生亲核反应的同时会发生消除反应,所不同的 是亲核试剂作用于α-C,而碱试剂作用于β-H。
CH3CH2CH2Br
dil. NaOH
C2H5OH/H2O CH3CH2CH2OH
con.NaOH
C2H5OH
CH3CH CH2
不同结构的卤烷发生消除反应的活性顺序为: 叔卤烷> 仲卤烷> 伯卤烷
CH3CHFCH3
F CH3
O F3C C OH
2-氟丙烷
2-氟甲苯
三氟乙酸
(2)全氟有机化合物的命名
CF3CF2CF2CF2CF3
CF3CF2COOH
全氟戊烷
全氟丙酸
(3)多氟有机化合物的命名
分子中氟原子数超过碳链上其它原子数目时, 未取代的氢可以用“氢代”表示。
CF3CF2CH2OH
1,1-二氢代全氟-1-丁醇
H C
CH3
