替吉奥说明书完整版10.6
单药替吉奥维持治疗老年晚期胰腺癌29例临床分析

单药替吉奥维持治疗老年晚期胰腺癌29例临床分析作者:姚小健来源:《中国实用医药》2014年第19期【摘要】目的观察替吉奥单药化疗对老年晚期胰腺癌的疗效、不良反应及生活质量评分改善情况。
方法29例IV期胰腺癌, 单药替吉奥胶囊口服化疗, 服用4周, 休息2周;均使用至肿瘤进展或不能耐受毒性。
每2个周期后影像学检查并按实体瘤疗效评价标准(RECIST)评价疗效、观察化疗毒性并评估生活体能评分。
结果CR 0例, PR 11例, SD 5例, PD 13例, 总有效率37.9%(11/29), 疾病控制率为55.2%(16/29);胃肠道毒性、神经毒性、骨髓抑制分别为24.1%(7/29)、13.8%(4/29)、79.3%(23/29);仅见轻度肝、肾毒性, 未发现3~4级毒性及手足综合征;体能评分及生活治疗评估获得6例改善、9例稳定和14例下降, 生存质量改善率为51.7%(15/29)。
结论单药替吉奥可以作为老年晚期胰腺癌姑息化疗的方案之一。
【关键词】替吉奥胶囊;晚期胰腺癌;口服化疗胰腺癌为全世界肿瘤致死的第八大原因[1]。
超过90%的胰腺癌患者就诊时出现远处转移, 无法手术治疗;未予治疗的晚期胰腺癌预期寿命仅为2~4个月。
以“吉西他滨或奥沙利铂”化疗为主的方案作为晚期胰腺癌主要的治疗策略化疗反应相对较重, 尤其是老年患者。
本院近几年来使用替吉奥胶囊单药口服维持化疗治疗老年晚期胰腺癌, 无论肿瘤控制、生活治疗均明显提高, 且化疗毒性耐受性较好, 现报告如下。
1资料与方法1. 1一般资料本院2010年1月~2013年10月收治的29例老年晚期胰腺癌, 均为Ⅳ期。
年龄75~92岁, 平均年龄81.6岁;男14例, 女15例;胰头癌8例, 胰体癌11例, 胰尾癌10例;均经CT引导穿刺或彩超引导穿刺病理证实;其中高分化腺癌11例, 中分化腺癌10例, 低分化腺癌5例, 黏液腺癌2例, 囊腺癌1例;其中腹主动脉旁淋巴结转移10例, 肝转移13例, 锁骨上淋巴结转移6例, 肺转移10例, 皮肤转移6例, 多发骨转移18例;至少一个可测量病灶, 排除肝肾功能损害、血液系统疾病及周围神经病变。
替吉奥与5-氟尿嘧啶联合奈达铂治疗晚期食管癌的疗效比较

替吉奥与5-氟尿嘧啶联合奈达铂治疗晚期食管癌的疗效比较彭方慧;王峰;何炜;樊青霞【摘要】目的:比较替吉奥与5-氟尿嘧啶联合奈达铂治疗晚期食管癌的效果.方法:收集80例晚期食管癌患者,分为替吉奥联合奈达铂治疗组(A组,40例)和5-氟尿嘧啶联合奈达铂治疗组(B组,40例).A组替吉奥胶囊每天80 mg/m2,分2次,餐后口服,第1~14天;服用14 d后停药7 d;奈达铂80 mg/m2,静脉滴注,第1天.B组奈达铂80 mg/m2,静脉滴注,第1天;5-氟尿嘧啶1 000 mg/m2,静脉滴注,第1~5天;亚叶酸钙100 mg,第1~5天,静脉滴注.21 d为1个周期.比较2组患者的疗效、不良反应及生存期的差异.结果:2组患者总有效率(χ2=0.051,P=0.822)和临床获益率(χ2=0.092,P=0.762)差异均无统计学意义.A组患者中位生存时间为9.9个月,B组为9.6个月(χ2= 0.335,P=0.563).A组患者中位肿瘤进展时间为6.8个月,B组为6.5个月(χ2=1.274,P=0.259).结论:替吉奥联合奈达铂组治疗晚期食管癌疗效与5-氟尿嘧啶联合奈达铂组差异无统计学意义,但不良反应较轻.%Aim:To compare the clinical efficacy of advanced esophageal cancer treated with S-l and 5-fluorouracil combined with nedaplatin. Methods:Eighty patients with advanced esophageal cancer were randomly divided into S-l combined with Nedaplatin treatment group ( group A ) and 5-fluorouracil combined with Nedaplatin treatment group ( group B ). The constituent ratio of the two groups' age, gender, and staging had no significant differences. The group A administered with a dose of 80mg/m S-l given orally twice a day from days 1 through 14, plus Nedaplatin at a dose of 80 mg/m by intravenous infusion on day 1; The group B administered with Nedaplatin at a dose of 80 mg/m given by intravenous infusion on day 1, plus 5-fluorouracil at a dose of 1 000 mg/m and CF 100 mg/m by intravenous infusion on days 1 and 5. Three weeks was a cycle and compared to the differences of the two groups in treatment effect, adverse reaction, and survival time. Results:The total effective rate(X2 =0.051 ,P =0.822)and clinical benefit rate (X2 = 0.092,P =0.762)had no significant differences in the two groups. In group A and in group B,the median survival time was respective 9. 9 months and 9. 6 months(X2 = 0. 335 ,P = 0. 563 ),the median time to tumor progression was 6. 8 months and 6. 5months (X2 = 1.274,P =0.259 ). Adverse effects and serious adverse reactions in group A were significantly lower than in group B. Conclusion:The clinical efficacy of advanced esophageal cancer treated with S-l with Nedaplatin compared control group had no significant differences, but adverse effects were milder.【期刊名称】《郑州大学学报(医学版)》【年(卷),期】2013(048)002【总页数】3页(P160-162)【关键词】替吉奥;5-氟尿嘧啶;奈达铂;晚期食管癌【作者】彭方慧;王峰;何炜;樊青霞【作者单位】郑州大学第一附属医院肿瘤科,郑州,450052【正文语种】中文【中图分类】R735.1在我国,食管癌居恶性肿瘤发病率和病死率的第2位,仅次于胃癌[1-2]。
替吉奥的严重不良反应及应对策略

Vo 1 . 2 3 , No . 1 9 , Oc t o b e r 5 , 2 0 1 4
Chi n a Ph ar mac e u t i c a l s
中目茜
・
药事组织 ・
P h a r ma c e u t i c a l Ad mi n ht r a t i o n
便, 但 需 密切 注 意 其 不 良反 应 所 引起 的危 害 , 尤 其 是 严 重 的 不 良反 应 。
关键词 : 替吉奥 ; 药品 不 良反 应 ; 应 对 策略
中图 分 类 号 : R 9 6 9 . 3 ; R9 7 9 . 1 文 献标 识码 : A 文章编号 : 1 0 0 6 —4 9 3 1 ( 2 0 1 4 ) 1 9— 0 0 7 3—0 2
N a 1 2 9 . 5 m m o l / L, 提示低钠血症 ; 肝 肾功能正常。 但皮肤症状进
行 性加重 。 1 0月 3 日 , 患 者背部 、 臀部 、 四肢 、 面 部 皮 肤 可 见 大 量 红斑伴水疱 , 且I = I 腔溃疡 , 结膜充血 , 心肺未 闻及病理性杂音 , 肝 脾 及 神经 系统 检查 无 异 常 发 现 , 考 虑 患 者 皮 疹 为 替 吉 奥 胶 囊 所 致
向性 杀伤 细 胞 的作 用 及 高效 低 毒 的特 点 。 其 主要 是 由替加 氟 ( r r ) 、 吉美 嘧啶( C D H P ) 和奥替拉西钾 ( O X O) 组成 , 其 中替加氟具 有 良好的 口服 生物利用度 , 能在体 内转化为氟尿 嘧啶 ; 吉美嘧啶
可 抑 制 氟 尿 嘧 啶 的分 解 , 使 其 在 血 浆 和 肿 瘤 组 织 中保 持 稳 定 的血
汉贝泰(贝伐珠单抗)注射液说明书

核准日期:2021年11月30日修改日期:2022年07月18日2022年09月16日2022年10月14日汉贝泰®(贝伐珠单抗)是安维汀®(贝伐珠单抗)的生物类似药1贝伐珠单抗注射液说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名:贝伐珠单抗注射液商品名:汉贝泰®英文名:Bevacizumab Injection汉语拼音:Beifazhu Dankang Zhusheye【成份】活性成份:贝伐珠单抗(人源化抗-VEGF单克隆抗体)100 mg(4 ml)/瓶,每瓶含贝伐珠单抗100mg,不含防腐剂,以一次性小瓶包装。
本品中辅料的组成如下:α,α-海藻糖二水合物,磷酸二氢钠一水合物,无水磷酸氢二钠,聚山梨酯20和无菌注射用水。
【性状】本品为静脉注射用无菌溶液,pH 5.9~6.3,澄清至微带乳光、无色至棕黄色液体。
【适应症】转移性结直肠癌1生物类似药是指支持此生物制品获得上市批准的数据已证明该生物制品与国家药品监督管理局批准的参照药高度相似,并且没有临床意义上的差异。
本品说明书与原研产品说明书保持一致。
贝伐珠单抗联合以氟嘧啶为基础的化疗适用于转移性结直肠癌患者的治疗。
晚期、转移性或复发性非小细胞肺癌贝伐珠单抗联合以铂类为基础的化疗用于不可切除的晚期、转移性或复发性非鳞状细胞非小细胞肺癌患者的一线治疗。
复发性胶质母细胞瘤贝伐珠单抗用于成人复发性胶质母细胞瘤患者的治疗。
肝细胞癌本品联合阿替利珠单抗治疗既往未接受过全身系统性治疗的不可切除肝细胞癌患者。
【规格】100 mg(4 ml)/瓶,每瓶含贝伐珠单抗100mg,浓度为25mg/ml,装量为4ml。
【用法用量】贝伐珠单抗应该由专业卫生人员采用无菌技术稀释后才可输注。
贝伐珠单抗采用静脉输注的方式给药,首次静脉输注时间需持续90分钟。
如果第一次输注耐受性良好,则第二次输注的时间可以缩短到60分钟。
如果患者对60分钟的输注也具有良好的耐受性,那么随后进行的所有输注都可以用30分钟的时间完成。
替吉奥及希罗达对比

客观分析国产替吉奥、进口替吉奥、希罗达对治疗胃癌单今天看到几个朋友因为家人受病魔折磨而烦恼,但又苦于化疗用药选择。
大家提到最多的就是替吉奥和希罗达(紫杉醇之类的忽略不计了),大家关心的就是替吉奥与希罗达疗效及价格。
现在我为大家做一个专业的分析。
先做价格的对比维康达与TS-1及希罗达比较维康达国产替吉奥胶囊鲁南制药集团规格:20mg*42粒/盒25mg*36粒/盒价格:2500元左右用药疗程:一天两次早晚各一次,一次40mg,14天一个疗程患者日均治疗费用158元TS-1进口替吉奥胶囊日本大鹏工业株式会社规格:20mg*140粒/盒价格:18500元用药疗程:一天两次早晚各一次,一次40mg,14天一个疗程患者日均治疗费用352元希罗达(卡培他滨)上海罗氏规格:500mg*12片/盒用药疗程:同样14天一疗程,一天6片一疗程价格3200患者日均治疗费用228元再做疗效的对比维康达治疗晚期胃癌:维康达单药有效率达44.6%S-1单药治疗晚期胃癌有效率达44.6%在Ⅱ期临床试验中S-1单药治疗晚期胃癌患者101例80mg/m2/d,连服4w,休息2w为一疗程结果平均有效率达44.6%(24%-54%)中位生存期为244d1年生存率36.6%2年生存率16.5%Maehara Y. S-1 in gastric cancer: a comprehensive review. Gastric Cancer. 2003;6 Suppl 1:2-8.S-1单药治疗晚期胃癌有效率达44.6%维康达(替吉奥胶囊)治疗晚期胃癌的临床试验总结报告临床试验批件号:2003L03165研究人员中国人民解放军总医院:主要研究者:焦顺昌杨俊兰军事医学科学院附属307医院主要研究者:徐建明山西省肿瘤医院主要研究者:牛润桂河北医科大学第四医院主要研究者:刘巍大连医科大学附属第二医院主要研究者:张阳中国人民解放军沈阳军区总医院主要研究者:谢晓冬山东省肿瘤医院主要研究者:宋恕平上海第二医科大学附属仁济医院主要研究者:张凤春福建医科大学附属协和医院主要研究者:卢辉山第二军医大学长征医院主要研究者:王杰临床试验统计单位:北京大学第一医院医学统计室姚晨接下来是一些专业的研究(由于我的资料是王金万教授给的幻灯片,在这里不能使用只能这样)ACTS-GC study(替吉奥术后辅助化疗)大型多中心随机临床试验结论:S-1术后辅助化疗对于胃癌是可行有效的,这种方法可以作为Ⅱ/Ⅲ期胃癌患者行D2切除术后的标准治疗!生存率:80.5%S-1胃癌术后辅助化疗与单纯手术的比较1059 例Ⅱ、Ⅲ期胃癌D2手术切除痊愈的患者随访3年S-1单药治疗组529 例生存率:70.1%Randomized phase III trial comparing S-1 monotherapy versus surgery alone for stage II/III gastric cancer patients (pts) after curative D2 gastrectomy (ACTS-GC study). 2007Gastrointestinal cancer symposium, sasako M单纯手术组530例ACTS-GC study JCOG术后3年生存率对比ACTS-GC study JCOG80.5%70.1%3年内无复发生存率对比ACTS-GC study JCOG72.2%60.1%S-1胃癌术后辅助化疗与单纯手术的比较临床结果:术后3年生存率单纯手术组70.1%,试验组80.5%3年内无复发生存率单手术组60.1%,试验组72.2%试验组死亡率比单纯手术组低32%!试验组复发率比单纯手术组低38%!S-1辅助化疗比单纯手术治疗降低胃癌死亡风险38%!ACTS-GC study JCOG维康达治疗AGC:维康达+CDDP 疗效优于单药S-1 + 顺铂vs S1Ⅲ期临床试验,日本38家临床中心,305例晚期胃癌患者,随机分配:联合:S-1 40mg/m2,每日2次,连用21天,DDP 60 mg/m2,第8天,休息2周,5周为一周期S-1单药:40mg/m2,bid,连4周休2周,6周为一周期Koizumi W, ASCO,2008SPIRITS trial转移性胃癌n=305例S-1单药: 40mg/m2, bid,连4周休2周S-1: 40mg/m2, bid, d1-21,DDP: 60mg/m2, iv, d8S-1 + 顺铂vs S1S-1+DDP,n=148S-1,n=150pORR54%(43-65%)31%(23-41%)mPFS6m4m<0.0001mOS13m11m0.04?度粒细胞减少39.9%10.7%?贫血25.7%4.0%?度恶心11.5%1.3%结果:Koizumi W, ASCO,2008SPIRITS trial结论S-1+CDDP 的生存期长于S-1 单药S-1中位生存11.0 MS-1+CDDP 13.0 MS-1+CDDP 耐受性好,两组均无治疗相关性死亡SPIRITS trialS-1+CDDP 方案可以作为AGC 的一线治疗方案S-1+CDDP方案被日本推荐作为治疗胃癌基本方案CAPE VS S-1转移性或复发性老年胃癌患者,随机、多中心II期临床研究65岁以上老年患者,随机分配,主要观察终点为有效率(RR)NCT00278863Journal of Clinical Oncology, 2007,ASCO转移性或复发性胃癌n=91例S-1: 40-60 mg/m2, bid,d 1–28,6 weeksCAPE: 1250 mg/m2,bid, d 1–14,3 weeks?CAPE VS S-1Journal of Clinical Oncology, 2007,ASCO6.8%手足综合症HFS2.3%腹泻9.5%6.8%厌食4.8%6.8%3/4粒细胞减少22.2%(10/45)21.7%(10/46)病情进展PD40.0%(18/45)38.6%(17/46)病情稳定SD26.7%(12/45)29.5%(13/46)部分缓解PR2.2%(1/45)完全缓解CR3.0m4.4m治疗失败时间TTF4.2m4.8m治疗进展时间TTP7.9m(4.1-11.7)10m(8.0-12.0)mOSS-1(S,n=45)卡培他滨(X,n=46)CAPE VS S-1研究结论:无论是卡培他滨还是S-1作为老年患者进展期胃癌的一线治疗都是有效、耐受的RR无统计学差异(P>0.05)不良反应无统计学差异(P>0.05)CAPE与S-1治疗胃癌都有很好的疗效,没有统计学差异,患者都可耐受对于二者的比较尚需大型的临床试验进一步探讨Journal of Clinical Oncology, 2007,ASCO另外根据研究表明替吉奥治疗胃癌在亚洲人种要明显优于希罗达(当然专业人士应该明白亚洲人种与欧美人种的差异,这就是美国学术界打得文字牌,只强调替吉奥对欧美人种有效率没有希罗达好,但避重就轻的不谈替吉奥对于亚洲人种有效率要优于希罗达,并且替吉奥化疗副作用要比希罗达轻)以上是我对三种化疗药物的泛泛浅谈请大家指点替吉奥和希罗达的区别(转载)发表者:单成祥740人已访问替吉奥口服治疗晚期胃癌在日本已经运用了10多年。
替吉奥

替吉奥药品信息晚期胃癌新药--替吉奥胶囊【药品名称】:替吉奥胶囊江苏恒瑞医药股份有限公司齐鲁制药有限公司【药品规格】:进口原研:20mg*140粒 25mg*140粒国产仿制:20mg规格(以替加氟计):14粒/盒,28粒/盒,42粒/盒25mg规格(以替加氟计):12粒/盒,24粒/盒,36粒/盒(替吉奥)是一种氟尿嘧啶衍生物口服抗癌剂,它包括替加氟(FT)和以下两类调节剂:吉美嘧啶(CDHP)及奥替拉西(Oxo)。
其三种组分的作用如下:FT是5-Fu的前体药物,具有优良的口服生物利用度,能在活体内转化为5-Fu。
CDHP能够抑制在二氢嘧啶脱氢酶作用下从FT释放出来的5-Fu的分解代谢,有助于长时间血中和肿瘤组织中5-Fu有效深度,从而取得与5-Fu持续静脉输注类似的疗效。
Oxo能够阻断5-Fu的磷酸化,口服给药之后,Oxo在胃肠组织中具有很高的分布浓度,从而影响5-Fu在胃肠道的分布,进而降低5-Fu毒性的作用。
替吉奥与5-Fu相比具有以下优势:①能维持较高的血药浓度并提高抗癌活性;②明显减少药毒性;③给药方便。
在日本,替吉奥于1999年被批准用来治疗晚期胃癌,2001年被批准用来治疗头颈部癌症,2003年被批准用来治疗结直肠癌,2004年被批准用来治疗非小细胞肺癌。
多年的临床应用证明,替吉奥是安全有效的抗癌药物。
据统计,日本晚期胃癌的化疗,有80%以上的病例使用替吉奥,治疗有效率(CR+PR)可达%。
替吉奥简要说明:【成分】呋喃脲嘧啶+5-氯-2,4-二羟吡啶,氧晴镁钾(OXO植物生长抑制素),替加氟【适应症】胃癌、头颈部肿瘤、无法手术或切除的乳腺癌、非小细胞癌、结肠癌、胰腺癌、胆道癌替吉奥胶囊说明书请仔细阅读说明书并在医师指导下使用【警示语】1、本品的剂量限制性毒性为骨髓抑制,与以往的口服氟尿嘧啶类药物不同,使用时应特别注意经常进行临床检查。
2、本品偶可引起重症肝炎等严重的肝损害,因此需定期检查肝功能,以便及早发现。
替吉奥说明书

替吉奥
【规格】
20mg/片
【适应症】
不能切除的局部晚期或转移性胃癌。
【禁忌症】
1、对本品成份有严重过敏史的患者。
2、严重的骨髓抑制患者(可能导致症状恶化)。
3、严重的肾功能障碍患者。
4、严重的肝功能障碍患者。
5、正在使用其他氟尿嘧啶类抗肿瘤药(包括与这些药物的联合化疗)的患者。
6、正在使用氟胞嘧啶的患者。
【用法用量】
1、单独给药:按体表面积计算成人首次给药剂量的基准量(1次剂量),一天2次,于早饭后和晚饭后各服1次,连服28天,之后停药14天。
此为一个周期,可以反复进行,最高不得超过75mg/次。
2、联合用药:口服替吉奥胶囊80mg/m2/天,一天2次,于早饭后和晚饭后各服1次,连服14天,停药7天;顺铂:75mg/m2,分三天静脉滴注(第1、2、3天)。
每3周为1个周期,应至少进行2个周期的治疗。
【不良反应】
骨髓抑制、间质性肺炎、胃肠道症状:恶心、呕吐、食欲不振、腹泻
【注意事项】
1、饭后服用。
2、用药过程中应密切观察呼吸状态,有无咳嗽、发热等临床症状,
并进行胸部X线检查。
注意间质性肺炎的出现和恶化。
发现异常情况应停药并采取适当措施。
特别是非小细胞肺癌患者,发生间质性肺炎等肺功能损害的可能性大于其他肿瘤患者。
替吉奥治疗晚期胃癌临床观察
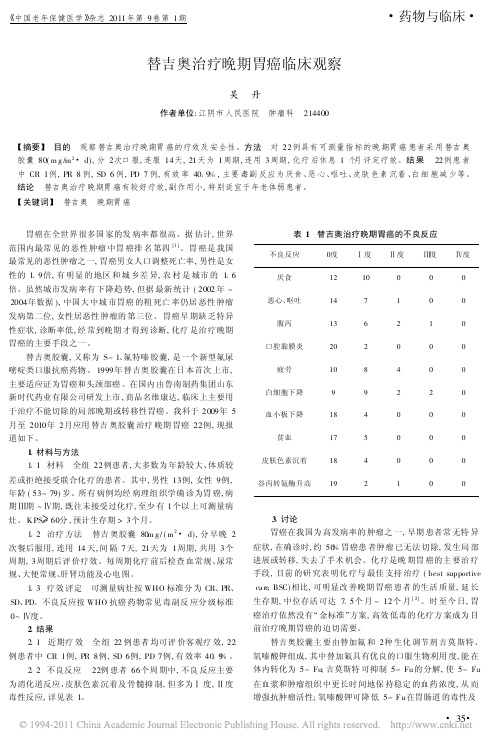
中国老年保健医学 杂志2011年第9卷第1期药物与临床替吉奥治疗晚期胃癌临床观察吴!丹作者单位:江阴市人民医院!肿瘤科!214400∀摘要#!目的!观察替吉奥治疗晚期胃癌的疗效及安全性。
方法!对22例具有可测量指标的晚期胃癌患者采用替吉奥胶囊80(m g/m2d),分2次口服,连服14天,21天为1周期,连用3周期,化疗后休息1个月评定疗效。
结果!22例患者中CR1例,PR8例,SD6例,PD7例,有效率40 9%,主要毒副反应为厌食、恶心、呕吐、皮肤色素沉着、白细胞减少等。
结论!替吉奥治疗晚期胃癌有较好疗效,副作用小,特别适宜于年老体弱患者。
∀关键词#!替吉奥!晚期胃癌!!胃癌在全世界很多国家的发病率都很高。
据估计,世界范围内最常见的恶性肿瘤中胃癌排名第四[1]。
胃癌是我国最常见的恶性肿瘤之一,胃癌男女人口调整死亡率,男性是女性的1 9倍,有明显的地区和城乡差异,农村是城市的1 6倍。
虽然城市发病率有下降趋势,但据最新统计(2002年~ 2004年数据),中国大中城市胃癌的粗死亡率仍居恶性肿瘤发病第二位,女性居恶性肿瘤的第三位。
胃癌早期缺乏特异性症状,诊断率低,经常到晚期才得到诊断,化疗是治疗晚期胃癌的主要手段之一。
替吉奥胶囊,又称为S-1、氟特嗪胶囊,是一个新型氟尿嘧啶类口服抗癌药物。
1999年替吉奥胶囊在日本首次上市,主要适应证为胃癌和头颈部癌。
在国内由鲁南制药集团山东新时代药业有限公司研发上市,商品名维康达,临床上主要用于治疗不能切除的局部晚期或转移性胃癌。
我科于2009年5月至2010年2月应用替吉奥胶囊治疗晚期胃癌22例,现报道如下。
1 材料与方法1 1!材料!全组22例患者,大多数为年龄较大、体质较差或拒绝接受联合化疗的患者。
其中,男性13例,女性9例,年龄(53~79)岁。
所有病例均经病理组织学确诊为胃癌,病期∃期~%期,既往未接受过化疗,至少有1个以上可测量病灶。
K PS&60分,预计生存期>3个月。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
替吉奥胶囊说明书请仔细阅读说明书并在医师指导下使用【警示语】1、本药仅可用于有必要使用替古奥胶囊的肿瘤患者。
患者须在具备急救设施的医院就诊、并在有丰富肿瘤化疗经验的医生指导下使用。
在决定使用含替古奥胶囊化疗方案前,应仔细阅读所有合并用药的说明书。
在化疗开始前,须向患者详细解释疗效和风险,并取得患者本人或其监护人的知情同意。
2、与传统的口服氟尿嘧啶类药物不同,替吉奥胶囊的剂量限制毒性(DLT)是骨髓抑制(详见【不良反应】),须经常进行实验室检查,并严密观察检查结果。
3、本药有可能导致重度肝功能异常,如暴发性肝炎,须定期检查肝功能并严密观察,以便尽早发现肝功能异常。
若发现早期肝功能异常或乏力伴随食欲减退等症状,须严密观察。
若发现黄疸(巩膜黄染),须立即停药,并采取相应措施。
4、本药不得与其它氟尿嘧啶类抗肿瘤药、含氟尿嘧啶类药物的化疗方案[如亚叶酸盐/替加氟-尿嘧啶(UFT)联合化疗]、抗真菌药氟胞嘧啶等合用,可能导致严重造血功能障碍等不良反应(见【药物相互作用】)。
5、本药不得与索利夫定或溴夫定等抗病毒药合用,可能导致严重造血功能障碍等不良反应,部分患者可危及生命(详见【药物相互作用】)。
6、使用本药前须仔细阅读本说明书并严格遵守【用法用量】的规定。
【药品名称】通用名称:替吉奥胶囊商品名称:维康达英文名称:Tegafur ,Gimeracil and Oteracil Porassium Capsules汉语拼音:Tiji′ao Jiaonang【成份】本品为复方制剂,每粒胶囊含:20mg规格:替加氟20mg,吉美嘧啶5.8mg,奥替拉西钾19.6mg。
25mg规格:替加氟25mg,吉美嘧啶7.25mg,奥替拉西钾24.5mg。
【性状】本品为硬胶囊剂,内容物为白色或类白色颗粒或细粉。
【适应症】不能切除的局部晚期或转移性胃癌。
【规格】(1)20mg(2)25mg【用法用量】替吉奥胶囊联合顺铂用于治疗不能切除的局部晚期或转移性胃癌患者:一般情况下,根据体表面积按照下表决定成人的首次剂量。
用法为每日2天,为一个治疗周期。
给药直至患可根据患者的情况增减给药量,每次给药量按40mg、50mg、60mg、75mg 四个剂量等级顺序递增或递减。
若未见本药所导致的实验室检查(血常规、肝肾功能)异常和胃肠道症状等安全性问题,且医师判断有必要增量时,则可按照上述顺序增加一个剂量等级,上限75mg/次。
如需减量,则按照剂量等级递减,下限为40mg/次。
连续口服21天、休息14天,给药第8天静脉滴注顺铂60mg/ m2,为一个治疗周期。
给药直至患者病情恶化或无法耐受为止。
用法用量的注意事项:1、可根据患者情况,参照下述标准增减给药量。
每个周期内增量不得超过一个剂量等级。
2、若需缩短化疗间期,须确认无本药所导致的实验室检查(血常规、肝肾功能)异常和胃肠道症状等安全性问题,但化疗间期不得少于7天。
不能手术或复发性乳腺癌患者缩短化疗间期的安全性尚未得到证实(无临床用药经验)。
3、为避免骨髓抑制和暴发性肝炎等严重不良反应,每次化疗开始前须进行实验室检查(血常规和肝肾功能)、全面观察患者的状况,化疗期间至少每2周进行1次检查。
如发现任何异常,必须采取相应措施,如延长化疗间期、按上述规定减量或停药。
第一治疗周期或增量时更须密切观察和检查(详见【临床试验】)。
4、基础研究(大鼠)发现空腹服药可改变奥替拉西钾的生物利用度,导致其对氟尿嘧啶磷酸化的抑制作用减弱,从而降低本药的抗肿瘤作用,故须餐后服用。
患者使用注意事项:患者用药时应注意:本药为铝塑泡罩包装(PTP),应告知患者服药前需将药物由泡罩中压出。
曾有报道患者误将铝箔板服下,导致食道穿孔,引起严重并发症如纵膈炎。
【不良反应】一、国外临床试验:1、联合治疗在日本进行的以晚期胃癌患者为对象、比较替吉奥胶囊单药(连续28天口服替吉奥胶囊40~60mg/次,每日2次,休息14天)和替吉奥胶囊联合顺铂(连续21天口服替吉奥胶囊40~60mg/次,每日2次,第8天时给予60mg/ m2顺铂)治疗的多中心Ⅲ期随机对照试验,298例可评估不良反应的患者的主要不良反应如下表所示。
非小细胞肺癌联合化疗(连续感21天口服替吉奥胶囊,第8天时给予60mg/ m2顺铂)的晚Ⅱ期临床试验发现,可评价不良反应的55例患者均发生不良反应,其主要不良反应如下表所示.#4:按美国癌症研究所常见毒性判定标准分级。
2、单药治疗在可评估不良反应的578例患者中(不包括下述既往接受过治疗的乳腺癌、胰腺癌和胆管癌患者),不良反应发生率为87.2%(504例)。
与其它类型肿瘤相比,既往接受过紫杉醇治疗的不能手术或复发的乳腺癌、胰腺癌和胆管癌患者的不良反应发生率较高,分别为96.4%、98.3%和94.9%。
胰腺癌患者不良反应发生率较高,食欲减退、恶心、呕吐和腹泻等胃肠道反应尤为明显。
单药使用时,#1:包括在日本进行的胃癌、结直肠癌、非小细胞肺癌、头颈癌、乳腺癌Ⅱ期多中心注册临床试验;不包括既往接受过治疗的乳腺癌、胰腺癌及胆管癌患者;#2:使用美国癌症研究所常见毒性判定标准或日本临床肿瘤学会的分级;#3:包括乏力。
3、不良反应的发生时间和恢复时间分析替吉奥胶囊治疗胃癌、结直肠癌、头颈癌、非小细胞肺癌(单药治疗)、不能手术或复发性乳腺癌、胰腺癌以及胆管癌晚Ⅱ期临床试验入选的453例患者的不良反应发生时间,其结果如下:在整个周期中,从给药开始到白细胞计数<3000/mm3、血红蛋白<8g/dL、血小板计数<7.5×104/mm3的最低值所需时间中位值分别为27天、25天和24天;其中确与本药有关的腹泻、皮疹和口腔炎等不良反应从首次给药开始至发生不良反应所需时间的中位值分别为24.5天、21天和28天;上述不良反应从最严重等级4、肾功能异常患者的不良反应国外产品上市后1年内的药品应用情况(胃癌)分析,根据性别、年龄、体重、血清肌酐值等用Cockcroft-Gault公式计算的肌酐清除率(Ccr估算值)分组,其不良反应发生率如下表所示。
不良反应发生率随肌酐清除率下降而上升,同时不良反应严重程度升高。
与首次给药采用标准剂量的患者相比,用量降低(比标Cockcroft-Gault公式男性:Cc r=(140-年龄)×体重(kg)72×血清肌酐(mg/dL)女性: Cc r=(140-年龄)×体重(kg)×0.8572×血清肌酐(mg/dL)5.重要不良反应1>骨髓抑制、溶血性贫血:可能发生重度骨髓移植如全血细胞减少、粒细胞减少(症状:发热、咽痛和全身不适)、白细胞减少、贫血及血小板减少(发生率如上)和溶血性贫血(发生率不明),须密切观察。
如发现异常,须采取停药等必要措施。
2>弥散性血管内凝血(DIC):因可能出现DIC(0.4%),应密切注意患者状况。
如血小板计数、血清FDP和血浆纤维蛋白原等血液学检查发现异常,须采取停药等必要措施。
3>暴发性肝炎等严重肝功能异常(发生率不明)(详见【警告】)。
4>脱水:可能因严重腹泻导致脱水(发生率不明),须密切观察。
如发现异常,须停药并采取补液等相关措施。
5>重度肠炎:可能发生重度肠炎(0.5%),须密切观察。
若发生严重腹痛、腹泻等症状,须停药并采取相应措施。
6>间质性肺炎*:可能发生间质性肺炎(0.3%)(早期症状:咳嗽、气短、呼吸困难和发热),须密切观察。
如发现异常,须停药并进行胸部X光检查和给予肾上腺皮质激素等相应措施。
7>重度口腔炎、消化道溃疡、消化道出血和消化道穿孔;可能发生严重的口腔炎(发生率不明)、消化道溃疡(0.5%)、消化道出血(0.3%)和消化道穿孔(发生率不明),须密切观察。
如发现异常,须停药,根据需要进行腹部X光等检查,并采取相应措施。
8>急性肾功能衰竭:可能发生严重的肾脏疾病如急性肾功能衰竭(发生率不明),须密切观察。
如发现异常,须停药并采取相应措施。
9>Steven-Johnson综合症和中毒性表皮坏死症(Lyell综合症):可能会发生Steven-johnson综合症和中毒性表皮坏死症(发生率不明),须密切观察。
如发现异常,须停药并采取相应措施。
10>脑白质病等神经精神系统异常:可能发生脑白质病(主要症状为意识障碍、小脑共济失调和痴呆样症状等)、意识障碍、定向力障碍、嗜睡、记忆力减退、椎体外系症状、语言障碍、四肢瘫痪、步态障碍、尿失禁或感觉障碍(发生率不明),应密切观察。
若出现上述症状,须停药。
11>急性胰腺炎:可能出现急性胰腺炎(发生率不明)应密切观察。
如果出现腹痛或血清淀粉酶升高,须停药并采取相应措施12>横纹肌溶解症:可能出现横纹肌溶解症(发生率不明)症状包括肌肉痛、虚弱、CK升高和血/尿肌红蛋白升高,须停药并采取相应措施,并注意防止横纹肌溶解所导致的急性肾功能衰竭。
13>嗅觉丧失:可能发生嗅觉障碍(0.1%)、嗅觉丧失(发生率不明),须密切观察。
如发现异常,须停药并采取相应的措施。
*对非小细胞肺癌患者进行了间质性肺炎和其他肺部疾病发生率的研究。
药物上市后在非小细胞肺癌的用药研究表明间质性肺炎的发生率为0.7%(11/1669),其他肺部疾病包括放射性肺炎,呼吸困难和呼吸衰竭的发生率为0.7%(12/1669)。
6.其他不良反应可能发生下列不良反应,如发现异常,须采取减量或停药等相应措施。
如发现药物过敏,须停药并采取相应措施。
既往接受过治疗的乳腺癌患者的手足综合征发生率较高(21.8%)。
本药上上述发生率根据本品获得批准前的单药临床试验结果计算。
7、不良反应注意事项(1)曾报告接受替吉奥胶囊治疗的患者出现急性白血病(个别病例伴随白血病前期)或骨髓增生异常综合征(MDS)。
(2)有极少数患者缺乏氟尿嘧啶代谢酶-二氢嘧啶脱氢酶(DPD),若使用氟尿嘧啶类药物,则在给药初期可能出现严重不良反应(如口腔炎、腹泻、造血功能异常和神经系统疾病)。
(3)曾发现脑梗死,但与替吉奥胶囊的因果关系并不确定。
(4)奥替拉西钾在强酸环境下易分解(犬),而奥替拉西钾的浓度降低可减弱其抑制消化道不良反应的作用(大鼠),故胃ph值明显降低时有可能导致腹泻。
(5)犬反复给药后曾发现球结膜巩膜色素沉着和角膜云翳。
二、国内临床试验结果显示,与本品有关的不良反应发生率为83.78%,其中主要为血液系统68.47%(白细胞减少的发生率为45.05%,血小板减少的发生率为20.72%,多为I、II度下降),消化系统46.85%(恶心、呕吐39.64%、腹泻7.21%),其他14.41%。
本品的血液系统不良反应与替加氟相当,但其消化道反应明显好于替加氟。
