易瑞沙中文说明书
超药品说明书用药目录(2018年版)
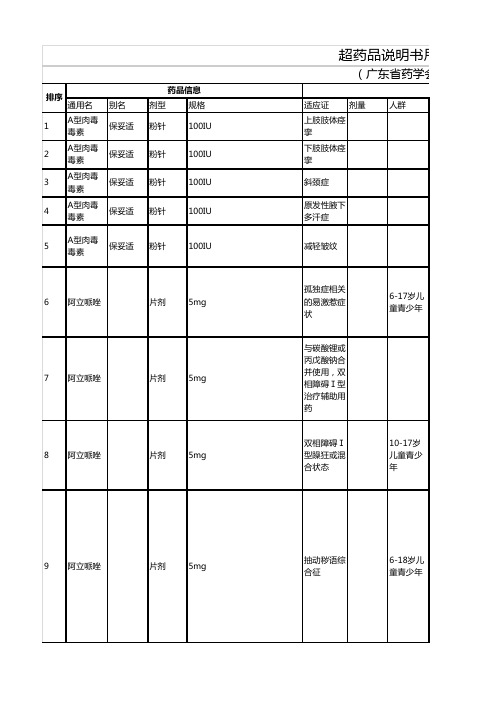
通用名别名剂型规格适应证剂量人群1A型肉毒毒素保妥适粉针100IU上肢肢体痉挛2A型肉毒毒素保妥适粉针100IU下肢肢体痉挛3A型肉毒毒素保妥适粉针100IU斜颈症4A型肉毒毒素保妥适粉针100IU原发性腋下多汗症5A型肉毒毒素保妥适粉针100IU减轻皱纹6阿立哌唑片剂5mg 孤独症相关的易激惹症状6-17岁儿童青少年7阿立哌唑片剂5mg 与碳酸锂或丙戊酸钠合并使用,双相障碍Ⅰ型治疗辅助用药8阿立哌唑片剂5mg 双相障碍Ⅰ型躁狂或混合状态10-17岁儿童青少年9阿立哌唑片剂5mg 抽动秽语综合征6-18岁儿童青少年超药品说明书用药(广东省药学会2排序药品信息10阿立哌唑片剂5mg 重症抑郁辅助用药11阿立哌唑片剂5mg精神分裂症13-17岁儿童青少年12阿司匹林拜阿司匹灵肠溶片100mg预防子痫前期13埃索美拉唑钠耐信注射液40mg急性上消化道出血14艾司西酞普兰来士普片剂10mg抑郁症12岁-17岁青少年15艾司西酞普兰来士普片剂①5mg ②10mg焦虑症16艾司西酞普兰来士普片剂①5mg ②20mg强迫症17氨溴索沐舒坦注射液2ml:15mg 胸外科手术的预防用药1000mg/天18奥氮平再普乐片剂5mg精神分裂症13-17岁青少年19奥氮平再普乐片剂5mg 化疗相关呕吐20奥氮平再普乐片剂5mg抑郁症21奥沙利铂草酸铂粉针50mg 结肠癌,辅助性II期,与5-氟尿嘧啶/亚叶酸组合22奥沙利铂乐沙定粉针50mg 食管癌、胃癌、结直肠癌的辅助化疗,胆道恶性肿瘤及淋巴瘤的二线治疗23巴利昔单抗舒莱粉针20mg肝移植抗排斥反应的预防24贝伐珠单抗安维汀注射液①100mg:4ml ②400mg:16ml继发于年龄相关性黄斑变性的脉络膜新生血管化25贝伐珠单抗安维汀注射液①100mg:4ml ②400mg:16ml转移性肾癌26贝伐珠单抗安维汀注射液①100mg:4ml ②400mg:16ml转移性乳腺癌27贝伐珠单抗安维汀注射液①100mg:4ml ②400mg:16ml铂耐药型复发卵巢癌28贝伐珠单抗安维汀注射液①100mg:4ml ②400mg:16ml复发或转移性宫颈癌29贝伐珠单抗安维汀注射液0.1g卵巢上皮癌30吡格列酮片剂30mg糖尿病预防31泊沙康唑混悬液400mg毛霉菌32布洛芬胶囊300mg骨关节炎33地塞米松①片剂 ②注射液①0.75mg②1ml:5mg缓解化疗药物所致呕吐34地塞米松注射液①1ml:5mg②1ml:2mg③1ml:1mg突发性聋35丁苯酞恩必普胶囊100mg 非痴呆型血管性认知障碍36度洛西汀欣百达胶囊①30mg ②60mg 糖尿病周围神经病性疼痛37度洛西汀欣百达胶囊①30mg ②60mg纤维肌痛38度洛西汀欣百达胶囊①30mg ②60mg 广泛性焦虑障碍7岁以上儿童青少年39度洛西汀欣百达胶囊①30mg ②60mg 慢性肌肉骨骼痛40多西他赛艾素注射液①20mg ②80mg 局部晚期头颈部鳞状细胞癌41多西他赛艾素注射液①20mg ②80mg 宫颈癌(二线治疗)42多西他赛艾素注射液①20mg ②80mg食管癌43多西他赛艾素注射液①20mg ②80mg小细胞肺癌44多西他赛艾素注射液①20mg ②80mg卵巢上皮癌45多西他赛艾素注射液①20mg ②80mg 胃癌化疗,联合5-氟尿嘧啶和顺铂46多西他赛艾素注射液①20mg ②80mg食管癌47厄贝沙坦安博维片剂150mg糖尿病肾病48厄洛替尼特罗凯片剂150mg 转移性非小细胞肺癌一线治疗49厄洛替尼特罗凯片剂150mg 局部晚期,不可切除或转移性的胰腺癌,联合吉西他滨作为一线治疗方案50二甲双胍格华止片剂500mg 多囊卵巢综合征51伐地那非艾力达片剂20mg肺动脉高压52氟尿嘧啶注射液10ml:0.25g 头颈部鳞癌全身化疗及辅助化疗53氟西汀百优解分散片20mg抑郁症8岁及以上儿童青少年54氟西汀百忧解分散片20mg 经前焦虑障碍55氟西汀百忧解分散片20mg惊恐障碍56氟西汀百忧解分散片20mg强迫症7岁以上儿童青少年57骨化三醇胶囊0.25ug 甲状旁腺功能减退症引起的低钙血症58环孢素新赛斯平胶囊25mg 系统性红斑狼疮59环孢素新赛斯平胶囊25mg干燥综合征60环孢素新赛斯平胶囊25mg 重度溃疡性结肠炎61环磷酰胺粉针200mg 系统性红斑狼疮62环磷酰胺粉针200mg 韦格纳肉芽肿63吉非替尼易瑞沙片剂0.25g EGFR突变者一线抗非小细胞肺癌64吉西他滨健择注射液①1g ②200mg 非霍奇金淋巴瘤65吉西他滨健择粉针①1g ②200mg 外周T细胞淋巴瘤66吉西他滨健择粉针①1g ②200mg肉瘤67吉西他滨健择粉针①1g ②200mg子宫颈癌68吉西他滨健择粉针①1g ②200mg 晚期卵巢癌,联合卡铂,治疗在以铂类药物为基础的治疗后至少6个月复发的患者69吉西他滨健择注射液①1g ②200mg 不能手术切除或伴有转移的进展期胆管癌70吉西他滨健择粉针①1g ②200mg头颈部癌71甲氨蝶呤片剂 2.5mg 类风湿关节炎72甲氨蝶呤①片剂 ②粉针①2.5mg ②5mg系统性红斑狼疮73甲氨蝶呤密都注射液①5mg ②100mg异位妊娠74卡铂①伯尔定②波贝注射液①15ml:150mg ②10ml:100mg非小细胞肺癌75卡铂①伯尔定②波贝注射液①15ml:150mg ②10ml:100mg胸膜间皮瘤76卡铂①伯尔定②波贝注射液①15ml:150mg ②10ml:100mg转移性乳腺癌77卡托普利开博通片剂12.5mg糖尿病肾病78坎地沙坦酯片剂8mg心力衰竭79喹硫平思瑞康片剂①25mg ②100mg ③200mg④300mg与碳酸锂或丙戊酸钠合并使用,双相障碍维持期治疗辅助用药80喹硫平思瑞康片剂①25mg ②100mg ③200mg④300mg双相障碍Ⅰ型躁狂相急性期10-17岁青少年81喹硫平思瑞康片剂①25mg ②100mg ③200mg④300mg精神分裂症13-17岁青少年82喹硫平思瑞康缓释片①25mg ②100mg ③200mg④300mg重症抑郁辅助用药83拉莫三嗪片剂①25mg ②50mg ③100mg 双相障碍Ⅰ型84来氟米特片剂10mg 成人斯蒂尔病85来曲唑弗隆 芙瑞片剂 2.5mg 子宫内膜异位症及多囊卵巢综合症的促排卵治疗86雷珠单抗诺适得注射液10mg 糖尿病性黄斑水肿87雷珠单抗诺适得注射液10mg 静脉栓塞引起的黄斑水肿88雷珠单抗诺适得注射液10mg 近视性脉络膜新生血管89雷珠单抗诺适得注射液10mg 糖尿病性视网膜病变90利拉鲁肽Victoza,Saxenda注射液3mL:18mg治疗BMI>27kg/m2 合并至少一项肥胖并发症的患者;或者BMI>30kg/m2的单纯性肥胖患者成人91利培酮维思通①片剂 ②口服液①2mg ②30mg:30ml精神分裂症13岁及以上儿童92利培酮维思通①片剂 ②口服液①2mg ②30ml:30mg孤独症相关的易激惹症状5岁以上儿童青少年93利培酮维思通①片剂 ②口服液①2mg ②30ml:30mg双相障碍Ⅰ型10岁以上儿童青少年94利妥昔单抗美罗华注射液500mg慢性移植物抗宿主病95利妥昔单抗美罗华注射液①10ml:100mg ②50ml:500mg血栓性血小板减少性紫癜96利妥昔单抗美罗华注射液①10ml:100mg ②50ml:500mg慢性淋巴细胞性白血病,联合氟达拉滨和环磷酰胺97利妥昔单抗美罗华注射液①10ml:100mg ②50ml:500mg难治性重症系统性红斑狼疮98利妥昔单抗美罗华注射液①10ml:100mg ②50ml:500mg类风湿关节炎99利妥昔单抗美罗华注射液①10ml:100mg ②50ml:500mg韦格纳肉芽肿100利妥昔单抗美罗华注射液①10ml:100mg ②50ml:500mg显微镜下多血管炎101硫代硫酸钠针剂320mg 640mg作为非特异性抗炎药,用于皮炎、湿疹、荨麻疹、药物性皮炎,副银屑病的治疗。
肺癌靶向药4002民间版说明书

肺癌靶向药4002民间版说明书以下均为患者用药总结,内容仅供参考一、4002简介对EGFR突变的非小细胞肺癌(NSCLC)患者,第一代EGFR类药易瑞沙和特罗凯的有效率相当高,但可惜的是都有耐药问题。
2005年发现,在EGFR类药耐药后的癌细胞中发现癌细胞获得了第2个突变——T790M突变。
癌细胞具有“EGFR+T790M”双突变后,所需要的药物浓度以几何倍数急剧上升,药物浓度不够后,就耐药了。
有些对易瑞沙敏感的患者,所需要的药物浓度较低,耐药后换血浆浓度是易瑞沙3倍以上的特罗凯,也就多得几个月,有效时间明显短于之前的易瑞沙,就是因为易瑞沙耐药后所需要的药物浓度上升较快。
针对T790M耐药机制,美国哈佛大学Dana-Farber肿瘤研究所研制出了4002。
因为官司,专利不能申请,药也不能开展后续开发,所以仅进行了体外肿瘤细胞实验和老鼠实验,而没有进行人体临床实验。
二、适用人群及特征适用人群自然是EGFR类药耐药后具有“EGFR+T790M”双突变的非小细胞肺癌患者。
很少患者有条件在EGFR类药耐药后再穿刺或其他手段取样本做基因检测,所以可根据某些特征来大致判断哪些患者可能适用。
1、耐药至少出现在第4个月或更晚,耐药出现得越晚越可能有效。
模型实验中,在一定浓度的EGFR类药中,经过120天才开始显现T790M突变。
即使略早一些,恐怕前3个月内出现的耐药患者,其耐药原因并非由于出现T790M突变,若没有T790M突变,自然也就不适合用4002。
2、原先吃EGFR类药,肿瘤体积至少要缩小一半以上,或CEA至少要下降一半以上。
4002压制T790M,目的就是恢复EGFR类药的药敏,也就意味着原先癌细胞大部分要对EGFR类药敏感。
三、使用注意事项1、4002的最大缺陷是EGFR部分效能不够,需要与EGFR类药联用,以双药来对付“EGFR+T790M”双突变。
把4002的EGFR部分效能不够、用时间不长CEA又回升,误以为是4002耐药,是4002使用过程中的常见问题。
甲磺酸奥希替尼片说明书

核准日期:甲磺酸奥希替尼片说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:甲磺酸奥希替尼片商品名称:泰瑞沙®/TAGRISSO®英文名称:Osimertinib Mesylate Tablets汉语拼音:Jiahuangsuan Aoxitini Pian【成份】本品活性成份为甲磺酸奥希替尼化学名称:N-{2-{[2-(二甲氨基)乙基](甲基)氨基}-4-甲氧基-5-{[4-(l-甲基-l H-吲哚-3-基)嘧啶-2-基]氨基}苯基)丙-2烯酰胺甲磺酸盐化学结构式:分子式: C28H33N7O2 . CH4O3S分子量: 595.71【性状】本品为浅褐色的薄膜衣片,除去包衣后显白色至浅棕色。
甲磺酸奥希替尼片 40 mg :一面印有“AZ”和“40”字样,另一面空白。
甲磺酸奥希替尼片80 mg:一面印有“AZ”和“80”字样,另一面空白。
【适应症】本品适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者的治疗。
【规格】(1)40 mg; (2) 80 mg (按C28H33N7O2计)【用法用量】本品应由在抗肿瘤治疗方面富有经验的医生处方使用。
在使用本品治疗局部晚期或转移性NSCLC前,首先需要明确EGFR T790M突变的状态。
应采用经过充分验证的检测方法确定存在EGFRT790M突变方可使用本品治疗(详见【注意事项】)。
剂量本品的推荐剂量为每日80 mg,直至疾病进展或出现无法耐受的毒性。
如果漏服本品1次,则应补服本品,除非下次服药时间在12小时以内。
本品应在每日相同的时间服用,进餐或空腹时服用均可。
剂量调整根据患者个体的安全性和耐受性,可暂停用药或减量。
如果需要减量,则剂量应减至40 mg,每日1次。
出现不良事件(AE)和毒性后的减量原则请见表1。
venetocla原厂说明书-中文版

处方信息要点这些要点并不包括安全有效地使用Venclexta所需的所有信息。
请参阅Venclexta的完整处方信息。
口服Venclexta®(Venetoclax片剂)美国初步批准日期:2016年最近的重大变化适应症和用法,CLL()05/2019指征和用法,AML()2018年11月11日剂量和给药(,,,)05/2019警告及预防措施,中性粒细胞减少症()2018年11月11日警告和预防措施,感染()05/2019适应症和用法Venclexta是一种Bcl-2抑制剂,表明:•用于治疗成人慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)。
()•联合阿扎胞苷或地西他滨或小剂量阿糖胞苷治疗75岁或75岁以上成人新诊断的急性髓系白血病(AML),或合并不能使用强诱导化疗的疾病。
这一指示是在根据答复率加速核准的情况下核准的。
对此适应症的持续批准可能取决于验证和对验证性试验中的临床益处的描述。
()剂量和给药•有关推荐的Venclexta起始剂量和递增剂量,请参阅完整的处方信息。
()•VENCLEXTA片应每日口服一次,随餐加水服用。
切勿咀嚼、压碎或打碎药片。
()•对肿瘤溶解综合征进行预防。
()剂型和强度片剂:10毫克,50毫克,100毫克(3。
)禁忌证CLL/SLL患者在起病时和上升期同时使用强CYP3A抑制剂是禁忌。
(,4。
,)警告和预防措施•肿瘤溶解综合征(TLS):预期的TLS 评估所有患者的风险。
使用抗高尿酸血症药物前,确保足够的水合。
随着整体风险的增加,采取更严格的措施(静脉补水、频繁监测、住院治疗)。
(,)•中性粒细胞减少症:监测血细胞计数和感染体征;根据医学需要进行管理。
(,)•感染:监测感染症状和体征,及时治疗。
3级及以上感染停止治疗,直至痊愈。
()•免疫接种:在Venclexta治疗之前、期间或之后不要接种减毒活疫苗。
()•胚胎-胎儿毒性:可引起胚胎-胎儿损害。
告知女性胎儿的潜在生殖风险,并在治疗期间使用有效的避孕方法。
泰瑞沙甲磺酸奥希替尼片说明书
核准日期:2017年03月22日修改日期:2018年01月10日修改日期:甲磺酸奥希替尼片说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:甲磺酸奥希替尼片商品名称:泰瑞沙®/TAGRISSO®英文名称:Osimertinib Mesylate Tablets汉语拼音:Jiahuangsuan Aoxitini Pian【成份】本品活性成份为甲磺酸奥希替尼化学名称:N-{2-{[2-(二甲氨基)乙基](甲基)氨基}-4-甲氧基-5-{[4-(l-甲基-l H-吲哚-3-基)嘧啶-2-基]氨基}苯基)丙-2烯酰胺甲磺酸盐化学结构式:分子式: C28H33N7O2 . CH4O3S分子量: 595.71【性状】本品为浅褐色的薄膜衣片,除去包衣后显白色至浅棕色。
甲磺酸奥希替尼片40mg:一面印有“AZ”和“40”字样,另一面空白。
甲磺酸奥希替尼片80mg:一面印有“AZ”和“80”字样,另一面空白。
【适应症】本品适用于:具有表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
既往经EGFR酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性NSCLC成人患者的治疗。
【规格】(1)40mg;(2) 80mg(按C28H33N7O2计)【用法用量】本品应由在抗肿瘤治疗方面富有经验的医生处方使用。
在使用本品治疗前,首先应采用经过充分验证的检测方法确定肿瘤或血浆样本中存在EGFR突变方可使用本品治疗(详见【注意事项】)。
剂量本品的推荐剂量为每日80mg,直至疾病进展或出现无法耐受的毒性。
如果漏服本品1次,则应补服本品,除非下次服药时间在12小时以内。
本品应在每日相同的时间服用,进餐或空腹时服用均可。
剂量调整根据患者个体的安全性和耐受性,可暂停用药或减量。
Leqvio(inclisiran)中文说明书

Leqvio(inclisiran)中文说明书2020年12月11日,Novartis Pharma GmbH诺华制药公司宣布欧盟已经正式批准该公司的Leqvio®(inclisiran),作为饮食控制的一种辅助手段,用于治疗成人原发性高胆固醇血症(杂合子家族性和非家族性)或混合型血脂异常,具体为:(1)Leqvio联合他汀类药物或他汀类药物和其他降脂疗法,用于治疗接受最大耐受剂量他汀类药物无法达到LDL-C治疗目标的患者;(2)Leqvio联合其他降脂疗法,用于治疗他汀类药物不耐受或他汀类药物禁忌症的患者。
值得一提的是,随着此次批准,Leqvio成为了全球第一个也是唯一一个小干扰RNA(siRNA)降胆固醇(LDL-C)疗法;是一款全球首批的“first-in-class”的治疗药物,因此具有里程碑意义。
【生产企业】:诺华制药公司【规格】: 284mg 预填充注射器 1支×1.5mL【商标】:Leqvio【英文名称】:inclisiran【性状】:一种透明、无色至淡黄色的注射液,可通过预填充注射器皮下注射。
【贮藏】:本药品不需要任何特殊的储存条件。
不冻结。
【Leqvio(inclisiran)适应症和用途】用于治疗成人原发性高胆固醇血症(杂合子家族性和非家族性)或混合型血脂异常:(1)Leqvio联合他汀类药物或他汀类药物和其他降脂疗法,用于治疗接受最大耐受剂量他汀类药物无法达到LDL-C 治疗目标的患者;(2)Leqvio联合其他降脂疗法,用于治疗他汀类药物不耐受或他汀类药物禁忌症的患者。
【Leqvio(inclisiran)剂量和给药方法】皮下注射给药,在第0、3个月各给药一次后,维持期每6个月给药一次,一年只需注射2次。
给药方法:皮下注射使用:Leqvio(inclisiran)用于腹部皮下注射;替代注射部位包括上臂或大腿。
不应在活动性皮肤病或损伤部位注射,如晒伤、皮疹、炎症或皮肤感染。
joint ease中文说明书
joint ease中文说明书
【药品名称】
通用名称:Osteo Joint Ease 关节灵消炎止疼超强速效
商品名称:webber naturals Osteo Joint Ease 关节灵消炎止疼超强速效
拼音全码:webber naturals Osteo Joint Ease GuanJieLingXiaoYanZhiTengChaoQiangSuXiao
【主要成份】硫酸氨基葡萄糖、MSM消炎灵、硫酸软骨素、超水果混合、姜黄。
【性状】白色固体
【规格型号】 180粒
【用法用量】 2粒/日随餐服用或遵医嘱(最少使用四周以上)。
【注意事项】如果您怀孕或哺乳,或者您有胆结石或胆管阻塞,胃溃疡或胃酸过多,或者症状持续或恶化,服用前请咨询医生。
有些人可能会出现轻微的肠胃胀气,便秘或消化不良。
远离儿童存放。
【贮藏】阴凉干燥处,避光。
【有效期】 24 月
【批准文号】无
【生产企业】加拿大天然维他命公司
【品牌商】 webber naturals
【产品介绍】
webber naturals Osteo Joint Ease 关节灵消炎止疼超强速效是最新一代天然
产品。
这种创新配方包含InflamEase专利抗氧化合成物、消炎、植物缓解疼痛等成分。
最新的关节炎症研究加强了传统水果合成物的使用,以解决疼痛和关节僵硬。
关节消炎灵和InflamEase水果养分联合作用,通过解决发炎而从源头解决关节疼痛。
泰瑞沙甲磺酸奥希替尼片说明书
泰瑞沙甲磺酸奥希替尼片说明书一、药品名称通用名称:甲磺酸奥希替尼片商品名称:泰瑞沙英文名称:Osimertinib Mesylate Tablets汉语拼音:Jiahuangsuan Aoxitini Pian二、成份本品主要成份为甲磺酸奥希替尼。
化学名称:N(2-{2-二甲氨基乙氧基}-4-甲氧基-5-{4-(1-甲基吲哚-3-基)嘧啶-2-基氨基}苯基)丙烯酰胺甲磺酸盐化学结构式:略分子式:C₂₈H₃₃N₇O₂·CH₄O₃S分子量:59571三、性状本品为浅褐色的薄膜衣片,除去包衣后显白色至类白色。
四、适应症本品适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在 EGFRT790M 突变阳性的局部晚期或转移性非小细胞肺癌成人患者的治疗。
五、规格40mg、80mg。
六、用法用量1、本品的推荐剂量为每日 80mg,直至疾病进展或出现无法耐受的毒性。
2、如果漏服本品 1 次,则应补服本品,除非下次服药时间在 12 小时以内。
3、本品应在每日相同的时间服用,进餐或空腹时均可服用。
七、不良反应1、常见不良反应(发生率大于10%)包括腹泻、皮疹、皮肤干燥、指甲毒性、口腔炎、疲劳等。
2、较少见但严重的不良反应包括间质性肺病(ILD)/肺炎、QTc 间期延长等。
八、禁忌对本品活性成分或任何辅料过敏者禁用。
九、注意事项1、间质性肺病/肺炎:在服用本品期间,应密切监测患者是否出现新的或加重的肺部症状,如呼吸困难、咳嗽、发热等。
如果怀疑有间质性肺病/肺炎,应立即停止使用本品,并进行适当的治疗。
2、 QTc 间期延长:本品可能导致 QTc 间期延长。
在服用本品前,应评估患者是否有QTc 间期延长的风险因素,如先天性长QT 综合征、心力衰竭、电解质紊乱等。
在服用本品期间,应定期监测心电图和电解质。
3、心肌收缩力改变:本品可能导致心肌收缩力改变。
在服用本品期间,应定期监测心脏功能。
泰瑞沙最佳服用时间,奥希替尼9291什么时候吃效果最好?看完再决定!
泰瑞沙最佳服用时间,奥希替尼9291什么时候吃效果最好?看完再决定!泰瑞沙是甲磺酸奥希替尼片的商品名,研发阶段代号azd9291,主要适用于治疗是对第一代易瑞沙或特罗凯耐药后产生T790M基因突变的晚期非小细胞肺癌患者,属于第三代针对EGFR基因突变的肺癌靶向药。
然而患者购买到的奥希替尼说明书上只写着要一天一片,80mg,口服或与食物同服,也没有准确的说什么时段吃合适,很多患者比较冥茫,泰瑞沙azd9291是处方药,最佳的时间使用会让药品起到事半功倍的效果。
那么泰瑞沙什么时候吃合适呢?奥希替尼泰瑞沙正确的用法用量泰瑞沙azd9291是口服靶向药。
患者在服用奥希替尼过程中,应用温水整片吞下,不要压碎、掰断或咀嚼。
随餐或空腹都行,根据奥希替尼说明书上的推荐肺癌脑转移患者每天服用一次80mg的剂量。
而对于肺癌脑膜转移患者是160mg 每天一次的剂量。
如果因为特殊原因患者身体不耐受,可在主治医生的建议下暂停用药,或减量将剂量减至40mg,每日1次。
安百健海外医疗提醒各位患者或者家属,奥希替尼9291应在专业的医生指导下正确服用,以确保安全,患者不可私自修改剂量。
另外,奥希替尼在去年已经被国家医保局正式纳入医保,目前的售价在1.53万左右一盒,在国内除了进口的奥希替尼,比较常见的就是印度粉盒和孟加拉黑盒白盒奥希替尼。
相比较而言,只要几千元的仿制版奥希替尼性价比更高。
泰瑞沙最佳服用时间1.大多数人在早上吸收最好的, 这样更有利于奥希替尼药效的发挥,所以建议最好在每天早饭前半个小时左右;半空腹服用一般可以选择两顿饭中间的时间。
2.对于胃肠道不好的患者,建议在饭后半个小时到1小时之间服用。
在打算服用泰瑞沙的前后半小时最不要吃强碱性食物,浓茶也不要喝。
3.对于年老体弱的患者来说,可以选择在睡前服用,这样可以减少泰瑞沙对胃有刺激作用。
安百健海外医疗:以上建议仅供参考,具体的还是要按照医生的指示服用药物,但其实对于长期服药来说,不管是晨起服药,还是睡前服药,这个药物在长期服用过程中,它的药效都是持续发挥的,但最好是在每天相对固定的时间服用为宜。
吉非替尼片说明书
核准日期:吉非替尼片说明书请仔细阅读说明书并在医师指导下使用。
【药品名称】通用名称:吉非替尼片英文名称:Gefitinib Tablets汉语拼音:Jifeitini Pian【成份】本品主要成份为吉非替尼。
化学名称:N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉丙氧基)喹唑啉-4-胺化学结构式:分子式:C22H24ClFN4O3分子量:446.90【性状】褐色薄膜衣片,除去包衣后显白色或类白色。
【适应症】本品单药适用于表皮生长因子受体(EGFR)基因具有敏感突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者的一线治疗(见【注意事项】)。
两个大型的随机对照临床试验结果表明:吉非替尼联合含铂化疗方案一线治疗局部晚期或转移性非小细胞肺癌(NSCLC)未显示出临床获益,所以不推荐此类联合方案作为一线治疗。
本品单药可试用于治疗既往接受过至少一次化学治疗失败的局部晚期或转移性非小细胞肺癌(NSCLC)。
不推荐本品用于EGFR野生型非小细胞肺癌患者。
【规格】0.25g。
【用法用量】本品的推荐剂量为250mg(1片),一日1次,口服,空腹或与食物同服。
如果漏服本品一次,应在患者记起后尽快服用。
如果距离下次服药时间不足12小时,则患者不应再服用漏服的药物。
患者不可为了弥补漏服的剂量而服用加倍的剂量(一次服用两倍剂量)。
当不能整个片剂给药时,例如患者只能吞咽液体,可将片剂分散于水中。
片剂应分散于半杯饮用水中(非碳酸饮料)无需压碎,搅拌至完全分散(约需15分钟),即刻饮下药液。
以半杯水冲洗杯子,饮下洗液。
也可通过鼻胃管给予该药液。
无需因下述情况不同调整给药剂量:年龄,体重,性别,种族,肾功能,因肝转移而引起的中至重度肝功能损害。
剂量调整:当患者出现不能耐受的腹泻或皮肤不良反应时,可通过短期暂停治疗(最多14天)解决,随后恢复每天250mg的剂量 (见【不良反应】)。
儿童中使用目前尚无本品用于儿童或青少年患者安全性与疗效的资料,故不推荐使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
易瑞沙中文说明书.txt易瑞沙说明书
【药品名称】通用名:吉非替尼 本品主要成份为吉非替尼,其化学名称为:N-(3-氯苯基)-7甲氧基-6-(3-吗啉丙氧基)喹唑啉-4-胺 分子式:C22H24CLFN4O3 分子量:446.90 【药理毒性】药效学特性 吉非替尼是一种选择性表皮生长因子受体(EGFR)酪氨酸激酶抑制剂,该酶通常表达于上皮来源的实体瘤。吉非替尼广泛抑制异种移植于裸鼠的人肿瘤细胞的生长,抑制其血管生成。在体外,可增加人肿瘤细胞衍生系的凋亡,并抑制血管生成因子的侵入和分泌。在动物试验或体外研究中已证实,吉非替尼可提高化疗、放疗及激素治疗的抗肿瘤活性。 毒理研究 非临床(休外)研究表明吉非替尼具有抑制心脏动作电位复极化过程(如QT间期)的可能性。但由临床研究和上市后监测获得的安全资料未提示吉非替尼对心脏有任何不良作用。 致癌,致畸和生殖毒性 未进行吉非替尼的致癌研究。在基因突变分析(细菌和体外哺乳动物细胞)和裂解试验(体外哺乳动物细胞和体内大鼠微核试验)中,吉非替尼未显示基因毒性作用。 在交配前4周至妊娠7天期间给予吉非替尼20mg/kg/天(按体表面积计为临床用药剂量的0.7倍),可对雌鼠排卵产生患得影响,导致共黄体量下降。 在器官发和期给予可产生母体毒性剂量的吉非替尼,在大鼠中可观察到成骨不全的发生率升高,在家兔中可观察到胎儿体重下降。在大鼠中未观察到畸形,仅在产生严重母体毒性的剂量下可在家兔中观察到畸形。 当给予哺乳大鼠中服5mg/kg吉非替尼(按体表面积计为临床用药剂量 0.2倍),吉非替尼及某些代谢产物广泛分泌入乳汁。 在大鼠妊娠及分娩期间给予吉非替尼20mg/kg/天(按体表面积计为临床用药剂量的0.7倍)剂量,可减少幼鼠的存活率。 临床研究 两项大型的II期临床研究评估了本品单药治疗局部晚期或转移性非小细胞肺癌(NSCLC)的有效性和安全性。患者的WHO体力状况评分为0-2,并且必须为既往化疗失败者: IDEAL1(研究0016),既往接受了1或2个化疗方案,并且至少有一个包括铂类治疗(中位年龄为59.6岁[28-85岁] ;n=209)。 IDEAL2(研究0039),既往接受了2个或以上化疗方案,该化疗方案包括同时或先后接受了铂类和多西紫杉醇的治疗(中位年龄为61岁[30-84岁];n=216)。 两个研究设计相似,均为双盲、平行组、多中心,评估了两个吉非替尼口服剂量:250 mg/天和500 mg/天。患者被随机分配在这两个剂量组。在IDEAL1中主要研究终点为肿瘤客观缓解率,次要研究终点为疾病相关症状改善 ;在IDEAL2中主要研究终点为肿瘤客观缓解率以及疾病相关症状改善率(每周以LCS进行测定)。 疗效结果 对于IDEAL1和IDEAL2疗效结果的总结见下表。不考虑WHO体力状况评分(0,1或2)和既往接受的化疗次数,两个 研究中得到的肿瘤客观缓解率以及疾病相关症状改善率结果相似。大多数患者肿瘤客观缓解发生于治疗的第1个月,少部分患者的客观缓解可迟至治疗的第四个月发生。 a 在IDEAL1试验中,无论是250 mg还是500 mg,日本患者的客观缓解率要比非日本患者的高(250 mg为27.5%:9.6%,500 mg为27.5%:11.1%),未调整的比值比(两组合并)为3.27,p=0.002。在多变量分析时,调整了性别,组织学和身体状况后,这一差异不再有统计学意义(调整后的比值比为2.13,p=0.068)。 b 基于症状改善可评估人群(250 mg,n=67;500 mg,n=73)。 + 数据截止时仍在继续。 FACT-L肺癌患者生活质量测定量表。 NC未计算。 PFS无进展生存。 安全性 :本品的安全性情况在两项研究中是相似的,不良事件的发生率和严重程度呈剂量相关性(见"不良反应")。 结 论 :临床研究资料证明局部晚期或转移性非小细胞肺癌患者以本品进行治疗可达到持续的客观缓解。在中国进行的临床研究 在中国的5个临床研究:基地中进行了临床研究,以评估吉非替尼片250mg/日在既往接受过化学治疗的非小细胞肺癌患者中的客观缓解率。 共有159名受试者至少服用了一次吉非替尼片250 mg,受试者的人口学和疾病特征情况如下: 男性91人(57.2),女性68人(42.8) ; 年龄均数(标准差)为56.5岁(11.3),中位数为57岁,范围(最小值,最大值)在31.0-84.0岁。 年龄组情况 :18-60岁组有91人(57.2%),60-70岁组有46人(28.9%),70岁以上组有22人(13.8%)。 吸烟状况 :不吸烟者有90人(56.6%),曾吸烟者有37人(23.3%),偶尔吸烟者有3人(1.9%),经常吸烟者有29人(18.2%)。 组织学分型 :鳞癌有29人(18.2%),腺癌有105人(66%),未分化癌有5人(3.1%),大细胞癌有1人(0.6%),腺鳞癌有7人(4.4,细支气管肺泡癌(BAC)有12人(7.5%)。 入选时非小细胞肺癌状态 :局部晚期MO有26人(16.4%),转移性M1有133人(83.6%)。 WHO体力状况 :0分有23人(14.5%),1分有101人(63.5%),2分有34人(21.4%),3分有1人(0.6%)。 其中在入选前曾接受过1个化疗方案治疗的受试者有75名(47.2%),2个及3个以上(含3个)化疗方案治疗的受试者分别为50名(31.4%)和34名(21.4%)。对于159名受试者(意向性治疗人群集)进行了有效性分析。 以下为疗效总结 : 客观缓解率为27.0%, 95%可信区间为20.3-34.7%, 中位PFS为97天, 95%可信区间为67-120天, 中位生存期为11.1月(生存期数据截止至2004年11月22日) 在不同治疗亚组中客观缓解率显示有一定的差异性(根据入组时基线特征进行分组,受试者的客观缓解率情况如下表,类似的差异性同样见于其他国际临床研究。尽管在某些亚组的受试者数不够多,但吉非替尼对这些受试者的效果和预期的相一致。 安全性 吉非替尼的总体耐受性良好。大部分不良事件为轻度,无需处理。超过10%的受试者报告的不良事件为皮疹(44.0%)、皮肤瘙痒(15.7%)和腹泻(11.3%)。所出现的不良事件严重程度及发生频率与在其他临床研究中观察到的相一致。
第 1 页
UnRegistered易瑞沙中文说明书.txt 【药代动力学】 静脉给药后,吉非替尼迅速清除,分布广泛,平均清除半衰期为48小时。癌症患者口服给药后,吸收较慢,平均终末半衰期为41小时。吉非替尼每天给药1次出现2-8倍蓄积,经7-10剂给药后达到稳态。达到稳态后,24小时间隔用药,血浆药物浓度最高和最低值之比一般维持在2-3倍范围之间。 吸收 :本品口服给药后,吉非替尼的血浆峰浓度出现在给药后的3-7小时。癌症患者的平均绝对生物利用度为59%。进食对吉非替尼吸收的影响不明显。 分布 :在稳态时吉非替尼的平均分布容积为1400 L,表明其在组织内分布广泛。血浆蛋白结合率约为90%。吉非替尼与血清白蛋白及α1-酸性糖蛋白结合。 代谢 :体外研究数据表明参与吉非替尼氧化代谢的P450同工酶主要是CYP 3A4。 体外研究显示吉非替尼可有限地抑制CYP 2D6(见"药物相互作用")。 吉非替尼的代谢中三个生物转化的位点已被确定 :N-丙基吗啉基团的代谢,喹唑啉上甲氧取代基的脱甲基作用及卤化苯基基团类的氧化脱氟作用。 在人血浆中鉴别到的主要代谢物是O-去甲基吉非替尼。它对EGFR刺激细胞生长的抑制作用比吉非替尼弱14倍,因此对吉非 替尼的临床活性不太可能有显著作用。 消除: 吉非替尼总的血浆清除率约为500 mL/分。主要通过粪便排泄,少于4%通过肾脏以原型和代谢物的形式清除。 特殊人群 :人群动力学 在以人群为基础的数据分析中,未发现预期的稳态血药谷浓度与患者年龄、体重、性别、种族、或肌酐清除率之间有任 何关系。 肝功能损害:在一项有31名实体瘤患者(他们中肝功能为正常的有14名,中度肝功能损害的有13名,由于肝转移出现重度肝功能损害的有4名)参加的临床研究中对吉非替尼进行了药代动力学评价。研究表明,日服250 mg本品28天后,达到稳态的时间,总血浆清除率及稳态值(Cmaxss,AUC24SS)在肝功能正常组和中度肝功能损害组之间是相似的。4名由于肝转移出现重度肝功能损害的患者其稳态值与肝功能正常组也相似。未在由肝硬化或肝炎引起肝功能损害的患者中进行本品的研究。 【适 应症】本品适用于治疗既往接受过化学治疗的局部晚期或转移性非小细胞肺癌(NSCLC)。既往化学治疗主要是指铂剂和多西紫杉醇治疗。 对于化学治疗失败的局部晚期或转移性非小细胞肺癌患者的疗效,是基于客观反应率指标而确立的,尚无对照性的研究显示改善疾病相关症状和延长生存期方面的临床受益。本品用于非小细胞肺癌二线治疗的现有数据仅基于非对照的临床研究,尚待设计良好的对照的临床试验进一步证实。 对于非小细胞肺癌的一线治疗,两个大型的随机对照临床试验结果表明 :基于铂剂的二联化疗方案合用本品治疗后未显示任何受益,因此,吉非替尼不适用于此种治疗。 【用法用量:本品的成人推荐剂量为250 mg(1片),1日1次,口服,空腹或与食物同服。 如果有吞咽困难,可将片剂分散于半杯饮用水中(非碳酸饮料),不得使用其他液体。将片剂丢入水中,无需压碎,搅拌至完全分散(约需10分钟),即刻饮下药液。以半杯水冲洗杯子,饮下。也可通过鼻-胃管给予该药液。 无需因下述情况不同调整给药剂量 :年龄、体重、性别、种族,肾功能,因肝转移而引起的中至重度肝功能损害。 剂量调整 :当患者出现不能耐受的腹泻或皮肤不良反应时,可通过短期暂停治疗(最多14天)解决,随后恢复每天250 mg的剂量。 【儿童中使用】目前尚无本品用于儿童或青春患者安全与疗效的资料,故不推荐使用。 【不良反应】最常见(发生率20%以上)的药物不良反应为腹泻、皮疹、瘙痒、皮肤干燥和痤疮,一般见于服药后的第1个月内,通常是可逆性的。大约8%的患者出现严重的药物不良反应(CTC标准3或4级)。因不良反应停止治疗的患者仅有1% 各身体系统发生的不良事件按发生频率以降序排列(多见 :≥ (greater than or equal to) 10% ;常见 :≥ (greaterthan or equal to) 1%且<10% ;少见 :≥ (greater than or equal to) 0.1%且<1%;罕见 :≥ (greater than or equalto) 0.01%且<0.1% ;极罕见 :<0.01%)。 可出现的不良事件总结如下 : 消化系统 :多见腹泻,主要为轻度(CTC1级),少有中度(CTC2级),个别报道严重伴脱水的腹泻(CTC3级)。 常见恶心,主要为轻度(CTC1级) ;呕吐,主要为轻度或中度(CTC1或2级) ;厌食,轻度或中度(CTC1或2级) ;口腔粘膜炎,多为轻度(CTC1级) ;继发于腹泻,恶心,呕吐或厌食的脱水口腔溃疡。 少见胰腺炎。 皮肤及附件 :多见皮肤反应,主要为轻度或中度(CTC1或2级) ;脓疱性皮疹,在红斑的基础上有时伴皮肤干燥发痒。常见指甲异常。极罕见中毒性表皮坏死松懈症和多形红斑的报道,过敏反应,包括血管形水肿和荨麻疹。 代谢和营养 :常见肝功能异常,主要包括无症状性的轻度或中度转氨酶升高(CTC1或2级)。 全 身 :常见乏力,多为轻度(CTC1级) ;脱发 ;体重下降 ;外周性水肿。 眼 科 :常见结膜炎和睑炎,主要为轻度(CTC1级) ;弱视。 少见可逆性角膜糜烂,有时伴睫毛生长异常。 极罕见角膜脱落 ;眼部缺血/出血。 血液和淋巴 :常见出血,如鼻衄和血尿。少见在服用华法林的一些患者中出现INR(International Normalised Ratio)升高及/或出血事件 ;出血性膀胱炎。 呼 吸 :常见呼吸困难。少见间质性肺病,常较严重(CTC3-4级。在全球进行的临床研究,扩大用药/同情用药,上市后使用中,约有158348名患者接受了本品治疗,在日本以外的地区,包括约92821名患者,间质性肺病总的发生率约为0.28%,在日本其发生率约为1.70%,包括约65527名患者,数据截至2004年6月2日),已有致死性病例的报道。 【禁忌症】已知对该活性物质或该产品任一赋形剂有严重过敏反应者禁用。 【注意事项】接受本品治疗的患者,偶尔观察到发生间质性肺病,患者通常出现急性的呼吸困难,伴有咳嗽,低热,呼吸道不适和动脉血氧不饱和。短期内该症状可发展得很严重,并报告有死亡。放射学检查常显示肺浸润或间质有毛玻璃样阴影。已观察到在出现该状况的患者中,伴有原发性肺纤维化/间质性肺炎/尘肺/放射性肺炎/药物诱导性肺炎的患者死亡率较高。 处方医生应密切监测间质性肺病发生的迹象,如果患者呼吸道症状加重,应中断本品治疗,立即进行检查。当证实有间质性肺病时,应停止使用本品,并对患者进行相应的治疗。 已观察到无症状性肝转氨酶升高。因此,建议定期检查肝功能。肝转氨酶轻中度升高的患者应慎用本品。如果肝转氨酶升高加重,应考虑停药。 已报道在服用华法林的一些患者中出现INR(InternationalNormalised Ratio,国际标准化比率)升高及/或出血事件。服用华法林的患者应定期监测凝血酶原时间或INR的改变。应告诫患者当以下情况加重时即刻就医: 任何眼部症状 ;严重或持续的腹泻,恶心,呕吐或厌食 ;这些症状应按临床需要进行处理。 随机对照试验证明,在晚期非小细胞肺癌患者中将本品和以铂类为基础的标准两药联合化疗方案合用,不会有额外的益处。因此,本品应单用于既往接受过细胞毒性化疗的非小细胞肺癌患者 在一项对儿科患者进行本品和放疗治疗的I/II期临床研究中,33名入选患者(这些患者为新诊断出脑干神经胶质瘤或
