第一节 构成物质的基本微粒 第三课时
分子与原子

3、原子与分子的区别与联系:
区别:在化学变化中,分子可以再分,而原子不能再分。 联系:分子是由原子构成的;分子和原子都可以直接
构成物质。
4、由原子直接构成的物质:
① 常见的金属:铁、铜、金 等。 ② 稀有气体:氦气、氖气、氩气 等。 ③ 金刚石、石墨 等。
分子与原子的比较
分子
原子
概念 分子是保持物质化学 原子是化学变化中 性质的一种微粒。 的最小微粒。
特性 不断地运动;微粒分子可分,原子不可分。
分子和原子都是构成物质的微粒; 分子是由原子构成的。
世界会向那些有目标和远见 的人让路!
课堂练习
1、下列关于原子、分子的叙述中,正确的是(1 4 5)
分子
构成物质的一种微粒
1、分子都是由原子构成的。
2、定义:分子是保持物质化学性质的一种粒子。
(同种物质的分子,化学性质相同,不同种物质的 分子,化学性质不同。)
注:分子不能保持物质的物理性质。
3、由分子直接构成的物质:
①常见的气体:O2、H2、N2、CO2、CO、SO2等。 ②一些液体:H2O、H2O2、酒精 等。 ③某些固体:干冰、蔗糖、碘、塑料、橡胶等。
从宏观角度看,纯净物是由一种物质组 成,而混合物是由两种或两种以上物质组成。
从微观角度看,由同种微粒构成的物质就是 纯净物,如果是由不同种微粒构成的就是混合物。
同种分子性质相同,不同种分子性质不同, 所以纯净物有固定的性质和组成,混合物则没有。
5、用分子的观点解释物理变化和化学变化。
物质发生物理变化时:
为什么水不具有氧气、氢气的性质呢?
不同的物质具有不同的性质,这是 由于构成物质的微粒不同。
3.1.1微粒的性质

知识点二 构成物质的微粒
构成物质的微粒有__分__子__、_原__子___和_离_子____。
二氧 化碳分子
碳原子
铜原子
钠离子 氯离子
知识点二 构成物质的微粒
探究点二 物质是由微粒构成的 [情景展示]
阅读下列图片,思考并回答问题。
[问题探究]
知识点二 构成物质的微粒
通过上图,你对物质的构成有哪些新的认识?
浓氨水___能___ 使酚酞试液变 色
知识点一 微粒的性质
(3)在烧杯C中重新配制 甲溶液,在烧杯B中加入 3~5 mL浓氨水,用一 个大烧杯将两个烧杯罩 在一起
烧杯C中 构成物质的
的溶液变 微粒在不断
成____ 地
红
色
运动
________
[说明] 温度越高,微粒的运动速率越快。
知识点一 微粒的性质
分子、原 子和离子
微 粒
构成
物质
性质
课堂小结
微粒的质量、 体积都很小
微粒在不 断运动
温度升高,运动 速率加快
微粒间 有空隙
同种物质,状态不同,构成 的微粒间的空隙不同
课堂小结
微粒间 有空隙
课堂反馈
知识点1 微粒的性质
1.6000 L氧气在加压的情况下可装入容积为40 L的钢瓶中。这 主要说明( D ) A.微粒在不断运动 B.微粒体积很小 C.温度越高微粒运动速率越快 D.微粒间有空隙
有 ___空_气___ 的注射器 的栓塞容 易推动
在固体和液体中, 微粒之间的空隙 __比__较_小___,在气 体物质中,微粒 之间的空隙 __比_较__大___
知识点一 微粒的性质
探究点一 微粒的性质 [情景展示1]
《物质构成的奥秘》教学设计-优质教案

学生回顾填表 学生思考,积极回答
活动意图说明:知道分子与原子的区别联系,巩固本课题的知识要点。引导学生运用本节课题的知 识,去解答一些问题。
7、板书设计
构成物质的基本微粒(2) 分子:如水、二氧化碳、氧气等
构成物质的基本微粒 原子:常见金属、稀有气体、固体非金属碳等
离子:氯化钠、氯化钙等 一、分子与原子 1、在物理变化中微粒本身不变,改变的是微粒的空隙大小;而化学变化中微粒发生改变; 2、不同物质有不同化学性质,这是由于构成物质的微粒不同; 3、分子是保持物质化学性质的一种微粒; 4、在化学变化中,原子是最小的微粒; 5、分子与原子的根本区别:在化学变化中,分子可分,原子不可分;
环节二:分子
教师活动 2
学生活动 2
【预习检查】构成物质的基本微粒有哪些
学生回答
呢? 【讲解】构成物质的基本微粒有原子、分子 和离子。(举例)
了解分子、原子、离子的真实存在。知道一些常 见物质各由什么微粒构成。
【联想与启示】水的煮沸过程和水的电解过 程有什么不同?构成水的微粒发生怎样的
观察两个过程的微观示意图
环节三:原子
教师活动 3 【视频】水电解过程的微观模型
学生活动 3
1、在上述过程中,发生变化的是什么?不
观看视频
变的又是什么??
交流讨论,组织思考
2、你能用分子原子的观点解释水电解这个
化学变化吗 【回答】化学变化的实质是分子分成原子,原子
【设疑】通过对电解水过程中微粒的变化, 再重新组合成新的分子。 你从微粒变化的角度如何理解化学变化的
4、学习重点难点 (1)了解构成物质的基本微粒; (2)从分子、原子观点认识物理变化和化学变化; (3)建立微观粒子运动的想象表象,体会它与宏观物体运动的不同点。
沪科版九年级化学第三章构成物质的微粒知识点填空(无答案)

第三章物质构成的奥秘第一节构成物质的基本微粒(1)阅读教材,完成以下问题:一、构成物质的微粒1.构成物质的微粒有、、。
2.由原子直接构成的物质有:(Fe、Cu、Mg)、(He、Ne)、金刚石(C)、石墨(C)、Si等。
3.由分子构成的物质有:常见气体:H2、O2、N2、、CO2、NH3、SO2、HCl等。
液体:酒精、H2O等。
固体:五氧化二磷、蔗糖等。
4.由离子构成的物质有:是由钠离子和氯离子构成的。
二、微粒的性质(一)物质是由肉眼________________的、___________的微粒构成的。
(二)微粒是不断运动的1.【观察与思考】实验1:向盛水的烧杯中滴入无色酚酞试液,得到溶液甲:现象:结论:再向其中滴入浓氨水现象:结论:实验2:在烧杯C中重新配制甲溶液。
在烧杯B中加入浓氨水,用一个大烧杯把两个小烧杯罩一起。
现象:结论:浓氨水中的氨,并进入到滴有酚酞的蒸馏水中,使溶液变红。
由上述实验得出:☆备注:浓氨水是色、有_______________味体,有性,显性,可以使色的酚酞试液变成色。
思考::a.湿衣服在阳光下比阴凉处干的快 b.相同质量的白糖在热水中溶解比在同样多的冷水中快。
两个事例说明:影响微粒运动快慢的因素是,而且越高,微粒运动的速率越,可以解释的现象有:a.湿衣服在阳光下比阴凉处干的快 b.相同质量的白糖在热水中溶解比在同样多的冷水中快。
练习1:如图所示,将滴有酚酞的滤纸条放在试管里,如图所示放在实验桌上:⑴用仪器A吸取浓氨水,滴在管口的棉花球上,仪器A的名称是,该仪器的主要用途是⑵实验中,往往在试管下放一张白纸,白纸的作用是⑶实验中,观察到的现象是这一实验说明。
(三)微粒之间有空隙1.【活动与探究】实验1:取一根约30cm长一端封口的细玻璃管,按图进行实验。
现象:结论:实验2:取一支针筒,抽取一定量的空气,用手指堵住针筒末端小孔,将栓塞慢慢推入,观察现象;用刚才的针筒抽取相同量的水,用手指堵住针筒末端小孔,将栓塞慢慢推入,观察现象。
3.1 构成物质的基本微粒 背记知识点-2020秋沪教版(全国)九年级化学上册

3.1 构成物质的基本微粒第1课时微粒的性质一、微粒的性质1.微粒的质量和体积都很小例如:1个水微粒的质量大约是3×10-26 kg。
用胶头滴管滴下的一滴水中大约含有1.7×1021个水微粒。
2.微粒在不断地运动,且温度越高运动速率越快探究微粒运动的实验(1)现象:试管中酚酞溶液变红;A烧杯中的酚酞溶液变红,B烧杯中酚酞溶液不变色。
(2)解释:试管中酚酞溶液变红证明酚酞溶液遇浓氨水变红;A烧杯中的酚酞溶液变红证明C烧杯中浓氨水中的氨气微粒运动到了A烧杯中,所以A中的溶液变红,由于大烧杯的遮挡作用,氨气微粒不能运动到B烧杯中,所以B中的溶液不变色。
其他示例:酒香不怕巷子深、湿衣服晾干、打开酒精试剂瓶瓶塞能闻到酒精气味、闻到花园里的花香……都能证明微粒在不断地运动着。
3.微粒之间有间隔实验一:水与酒精的混合实验(提示:水中含有红墨水)现象:酒精与水混合后体积小于二者体积之和。
结论:实验证明微粒之间有间隔。
实验二:水和空气的压缩实验(1)水和空气都可以被压缩,因为构成物质的微粒之间有间隔。
(2)比较是一种很好的实验探究方法,通过上图对比发现,空气要比水更易被压缩,说明:气体微粒间的间隔大于液体微粒间的间隔。
二、构成物质的微粒构成物质的微粒有:分子、原子、离子。
1.由分子构成的物质:如氧气、水、酒精等。
2.由原子直接构成的物质:如铁、金刚石等。
3.由离子直接构成的物质:如氯化钠由氯离子和钠离子构成。
第2课时分子原子一、分子1.分子的基本性质(1)分子的质量和体积均很小、分子在不停地运动、分子之间有间隔。
(2)同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
如:氧气和液氧均能支持燃烧是因为二者均是由氧分子构成的。
(3)由分子构成的物质,分子是保持该物质化学性质的最小微粒。
(4)分子由原子构成,分子可以分成原子。
2.用分子的观点解释物质的变化及分类(1)区别物理变化和化学变化对于由分子构成的物质,发生物理变化时,分子本身不变,分子间间隔可能变化;发生化学变化时,分子本身发生变化,变成了其他物质的分子。
初中化学北京课改版九年级上册第3章 构成物质的微粒第三节 分子-章节测试习题(4)
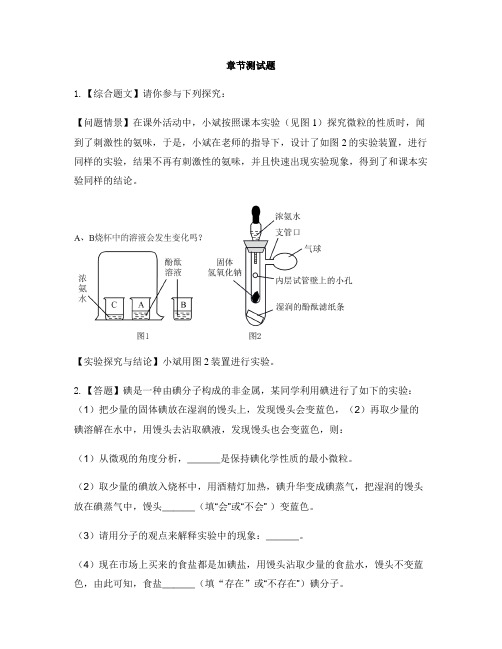
章节测试题1.【综合题文】请你参与下列探究:【问题情景】在课外活动中,小斌按照课本实验(见图1)探究微粒的性质时,闻到了刺激性的氨味,于是,小斌在老师的指导下,设计了如图2的实验装置,进行同样的实验,结果不再有刺激性的氨味,并且快速出现实验现象,得到了和课本实验同样的结论。
【实验探究与结论】小斌用图2装置进行实验。
2.【答题】碘是一种由碘分子构成的非金属,某同学利用碘进行了如下的实验:(1)把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色,(2)再取少量的碘溶解在水中,用馒头去沾取碘液,发现馒头也会变蓝色,则:(1)从微观的角度分析,______是保持碘化学性质的最小微粒。
(2)取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头______(填“会”或“不会” )变蓝色。
(3)请用分子的观点来解释实验中的现象:______。
(4)现在市场上买来的食盐都是加碘盐,用馒头沾取少量的食盐水,馒头不变蓝色,由此可知,食盐______(填“存在”或“不存在”)碘分子。
【答案】(1)碘分子(2)会(3)碘是由碘分子构成的,分子是保持物质的化学性质的一种微粒,在上述实验中碘分子都没有发生改变,所以都能使淀粉变蓝色(4)不存在【分析】本题考查分子的性质和应用。
【解答】(1)分子是保持物质化学性质的最小粒子,所以碘分子是保持碘化学性质的最小微粒。
(2)馒头中含有淀粉,淀粉遇碘变蓝。
(3)碘是由碘分子构成的,分子是保持物质的化学性质的一种微粒,在上述实验中碘分子都没有发生改变,所以都能使淀粉变蓝色。
(4)淀粉遇碘变蓝,是淀粉遇碘分子变蓝,馒头遇食盐水不变色,说明食盐中不含碘分子。
3.【综合题文】“用微观的眼光看世界”是我们学习化学的重要思想方法。
试根据以下材料,结合你所学过的知识,简要回答问题。
材料一一滴水里大约有15万亿亿个水分子,如果10亿人来数一滴水里的水分子,每人每分钟数100个,日夜不停,需要数3万多年才能完成。
构成物质的微粒
第二节构成物质的基本微粒检测题一、选选试试1.下列关于分子和原子的说法中,不正确的是()A.分子、原子都在不停地运动B.分子、原子都是构成物质的微粒C.原子是不能再分的最小微粒D.原子是化学变化中的最小微粒2.分子和原子的主要区别是()A.分子质量大,原子质量小B.在化学变化中,分子可分,原子不可分C.分子间有间隙,原子间无间隙D.分子体积大,原子体积小3.由分子构成的物质是纯净物还是混合物,主要看构成物质的()A.分子中原子的种类是否相同B.分子种类是否相同C.分子大小是否相同D.分子质量是否相同4.下列关于原子的说法中,正确的是 ( )A. 原子不显电性,说明原子核内的质子数等于中子数B. 同种原子内的质子数相同C. 含有相同中子数的原子,一定是同种原子D. 原子是最小的微粒5.下列关于原子核的叙述:①通常是由中子和电子构成;②通常是由质子和中子构成;③带正电荷;④不显电性;⑤不能再分;⑥跟原子比较体积很小,但却集中了原子的主要质量。
其中正确的是()A.②④⑥B. ②③⑥ C.①③⑤ D.①④⑤6.据中央电视台2001年6月3日在云南抚仙湖底古城考古现场报道,科学家曾通过测定古生物遗骸中的碳-14含量来推断古城年代。
碳-14原子的核电荷数为6,相对原子质量为14,下列关于碳-14原子的说法中,错误的是()A.中子数为6 B. 质子数为6 C.电子数为6 D.中子数为87.下列符号表示阳离子的是( )8.原子中决定相对原子质量大小的主要粒子是( ) A.质子数和中子数B.中子数和电子数C.质子数和电子数D.核电荷数和电子数9.以下生活、学习经验,不能说明分子间有空隙的是()A. 打气筒能将气体压缩B. 酒精和水混合后,总体积变小C. 物体有热胀冷缩的现象D. 海绵能吸水10.1999年度诺贝尔化学奖获得者哈迈德·泽维尔开创了“飞秒(10-15s)化学”的新领域,使运用激光谱技术观测化学反应时分子中原子的运动成为可能,你认为该技术不能观测到的是()A. 氧分子的不规则运动B. 氧原子结合成氧分子的过程C. 氧分子分解成氧原子的过程D. 氧原子内部的质子、中子、电子的运动11.”“”分别表示两种不同质子数的原子,其中可能表示氧气的是()12.美英联军在伊拉克战场上,不顾全世界人民的反对,使用了后患无穷的贫铀炸弹. 其中含有23892U,它的相对原子质量为238,质子数为92,则23892U中含有的中子数为()A. 238 B. 92 C. 146 D. 33013.核电荷数取决于()A.原子核的大小B.原子核内质子数C.原子核内中子数D.原子核内质子数和中子数14.关于原子的叙述错误的是()A.原子还能再分B.原子均有质子、中子和电子构成C.原子在不断地运动着D.原子的质量主要集中在原子核上15.有两种不同的原子,一种原子核内有6个质子和6个中子,另一种原子核内有7个中子和6个质子,它们不相等的是()A.核电荷数B.核外电子数C.原子的质量D.原子所带电量二、填填试试1.右图为某种原子的结构模型图。
沪科版化学九年级上册第三章《构成物质的基本微粒》 知识点汇总必背概念
分解(化变) 钠原子(Na ): 构成 构成 构成 第三章 《构成物质的基本微粒》 3.1 构成物质的基本微粒 一.微粒的性质性质 示例 1微粒是不断运动 在花园里散步,能闻到花香 2 微粒间有空隙。
气体微粒间空隙较大,液体、固体微粒间空隙较小水与酒精混合后,总体积减小 ①热胀冷缩: 微粒间的空隙 随温度的改变而改变②三态变化: 构成物质的微粒不改变,改变的是微粒间的空隙二.分子、原子1.分子、原子、物质之间的关系原子 分子 物质由分子构成物质有:水、氮气、氧气、二氧化碳、氢气 …由原子直接构成物质有金属、稀有气体、碳、硫、磷、硅、金刚石(由碳原子构成)2.原子的构成⑴原子结构的发现汤姆生发现电子;卢瑟福通过a 粒子轰击金箔实验揭开了原子的内部结构。
⑵原子结构核电荷数(原子核所带电荷数)=质子数=电子数3.相对分子质量概念:分子中所有原子的相对原子质量的总和(注:相对分子质量没有单位)三.离子1.原子结构图电子分布规律:第1层最多分布2个电子,第2、3层最多分布8个电子 核电荷数 (质子数) 电子数最外层电子数2.离子形成离子是原子得或失电子形成的带电微粒。
得或失电子规律:最外层电子数<4,失去最外层电子;最外层电子数>4,得到电子达到最大化失去两个电子Mg Mg2+ (阳离子:核电荷数(质子数) > 电子数)得到1个电子Cl Cl— (阴离子:核电荷数(质子数)< 电子数)3.离子符号在符号的右上角依次标电量、电性(电量为1时,省略不写)4.由离子构成的物质:氯化钠(由钠离子和氯离子构成)等盐类物质3.2 组成物质的化学元素一.元素1.概念:元素是同一类原子的总称。
(元素是宏观概念:只论种类,不论个数)金属元素(除金、汞外,偏旁:钅)2.分类非金属元素(偏旁:气、石、氵)3.元素符号⑴书写:第一个字母大写,第二个字母小写⑵含义:宏观:元素微观:1个原子O 氧元素1个氧原子注:某些元素符号还可以表示物质。
三章一节 构成物质的基本微粒1
固态
固态
液态
液态
气态
结论3、微粒间有间隔.
(且间隔的大小是可以改变的) ★一般来说:固、液体微粒间隔较小,所以很难 被压缩;气体微粒间隔较大,容易被压缩。
★物质热胀冷缩现象的原因:
问题:是微粒本身体积变小了,还是微粒 间的间隔变小了?
受热微粒间隔变大,遇冷微粒间隔缩小。
用火柴去点燃 水 酒精 白酒
实验现象 不能点燃 能燃烧 能燃烧
相同 4、同种微粒性质__, 不同 不同种微粒性质__。
已知馒头遇到固态碘会变蓝
色。那么遇到碘溶液,碘蒸 气会变蓝色吗?为什么?
下列现象主要反映了微粒的哪种性质?
1、给篮球打气 微粒间有间隔,间隔可以改变。 2、打开香水瓶盖,慢慢的整个房间都充满了 微粒在不断的运动 香味。 3、油库附近严禁烟火 微粒在不断的运动 4、温度计中的水银会热胀冷缩 汞原子的间隔受热变大,遇冷缩小 5、1毫升水中约含有3.3×1022个水分子 分子体积很小
结论: 微粒间有间隔
水分子、酒精分子互 相进入了对方的间隔。
实验探究4:水和空气的压缩
思考:哪一支针筒内的物质容易被压缩? 气体分子间的间隔比液体分子间的间隔 大,易被压缩。
物质状态的变化微观三维模拟动画
构成物质的微粒间都有一定的间隙。 物质的“三态”变化实际上就是微粒之 间的间隙发生改变的过程。
将食盐加到水中,水变咸了。
墙内开花墙外香。 衣柜中的樟脑片一段时间以后会不见了。
实验探究3:水与酒精的混合
实验操作 1、100mL水与 100mL水混合 2、100mL酒精与 100mL酒精混合 3、100mL水与 100mL酒精混合 体积变化情况 预测结果 测量结果
水与酒精混合前后总体积的变化: 取量筒分别量取酒精和水各 100mL ,混合倒入 200mL 量筒,振荡,混匀静置,观察记录现象。
构成物质的基本微粒微粒的性质
课堂小结:
1、物质都是由极其细小的、肉眼看不见的微粒 构成的。
2、微粒总在不停地运动。温度越高,运动越快。 3、构成物质的微粒间都有一定的空隙。
①不同物质微粒间的空隙大小不同。 ②气体微粒间空隙较大,液体、固体微粒间空隙较小 ③ 一般而言,微粒间的空隙随温度的升高而增大。
学以致用
解释下列生活中的现象: 1、放在衣橱中的“樟脑丸”一段时间后会消
④一般而言,物质微粒间的空隙随温度的升高 而增大。
为什么物质会有热胀冷缩现象?
微粒之间的空隙与温度有关,受热时,微粒间空隙 变大,而遇冷时微粒间空隙变小,所以物质一般存 在热胀冷缩现象。
微粒间空隙还与压强有关,增大压强,微粒间空隙 减小,减小压强,微粒间空隙增大。
运用微粒的知识来解释物质三态变化的原因?
下图是电子隧道扫描显微镜观察到的苯微粒 图像,你想到了什么
1、微粒是真实存在的 2、微粒间有空隙
说明:水的微粒和酒精的微粒之间都有一定的空隙,且空隙大 小不同,混合时由于微粒的运动,微粒填充了之间的空隙。
结论:(三) 微粒间有空隙
实验探究:水与酒精的混合
实验操作
1、25mL水与25mL 水混合 2、25mL酒精与 25mL酒精混合 3、25mL水与25mL 酒精混合
笨,没有学问无颜见爹娘 ……” • “太阳当空照,花儿对我笑,小鸟说早早早……”
4
长短一尺的东西,今天取走一半,
明天在剩余的一半中再取走出一半, 以后每天都在剩下的取一半出来, 这样永远都不会分完......
世界是由物质组成的。
▪
物质本身又是由什么构成的呢? 这些物质能被分割吗?分割到肉眼看不见时 还存在吗?糖溶于水,消失了,水变甜了。糖还在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题 第三章 第一节 构成物质的基本微粒 时间
2013年 10月 23日
星期三
课型 新授课 课时 第3课时 姓名 申 正 华
【知识目标】1、了解原子是由质子、中子和电子构成的。
2、初步了解相对原子质量的概念,并会查相对原子质量表。
3、逐步提高抽象思维的能力、想象力和分析、推理能力。
【学习重点】1、知道原子是由原子核和核外电子构成的
2、能根据相对原子质量求算相对分子质量
【学习难点】1、原子不显电性的原因。 2、相对原子质量概念的形成。
【教学方法】 讲解讨论式 【教具】多媒体
【复习旧知】
① 化学反应的实质是 。
② 分子是由 构成的不同物质的分子其构成的 可能不同。
③ 在化学变化中 ,而 ,这是分子和原子的 。
【导入】我们知道在化学变化中分子可分原子不可分,那么脱离了“化学变化”这一前提,原
子是否还可以继续再分呢?而且它的质量如何计算?这节课我们带着这些疑问来学习原子的
构成和质量。
【教学新知】 知识点六 原子的结构
[交流与讨论]
1911年英国科学家卢瑟福用一束带正电荷的a粒子轰击金箔时,发现大多数粒子能穿透金
箔,而且不改变原来的前进方向,但有一小部分a粒子改变了原来的运动途径,甚至有极少数
的a粒子好像碰到了不可穿透的坚硬指点而被弹了回来。你能对上述实验现象进行解释吗?
[提问]下列对原子结构的认识错误的是( )
A、原子核体积很小,质量很大 B、原子核带正电
C、原子内部有很大的空间 D、原子是实心的球体
[总结] 科学家们研究发现,原子是由 和 构成的。两者所带的
相等, 相反,因而原子呈电中性。原子核在原子中所占的 极小,核外电子在
核外空间作 。原子核的体积虽然很小,但原子的质量主演集中在 上,电子
的质量相对要小得多。
[拓展视野] 原子核内有什么? 教科书第69页
实验证明,有一种氢原子核内只有 ,没有 ,核外有一个 ;有一种碳原子核内
有 、 ,和核外有 ;有一种碳原子核内有 、 ,和核外
有 。
[板书]
原子的构成:
公式: (原子核所带的正电荷数)= =
[注意] 并不是所有的原子核内多有中子,氢原子核内无中子。
[随堂检测]
1、原子核是( )
A、 由电子和质子构成 B、 由电子和中子构成
C 、由质子和中子构成 D、 不能再分
2、某原子中共有40个微粒,其中14个微粒是中子,则它的质子数为( )
A、13 B、14 C、40 D、27
3、下列粒子带正电荷的是( )
①电子 ②质子 ③中子 ④原子核 ⑤原子 ⑥分子
知识点七 原子的质量
[讲解] 原子的质量若以千克作单位,无论是书写、读数、记忆、使用起来都极不方便,就像以
吨来表示一粒米的质量一样,很不方便。因此需要寻找一种标准来衡量原子的质量大小。
[板书] 相对原子质量
概念:规定以一种 作为标准, 跟它比较所得的值,就是该原子
的相对原子质量。
公式:
单位:
[注意点]
①相对原子质量不是原子的真实质量,而是相对质量。
②相对原子质量是一个比值,它的国际单位制(SI)单位是1(单位1一般不写出)。
[随堂检测]
1、10.已知一个碳12原子的质量为1.993×10-26 kg,一个氧原子的质量为2.657×10-26 kg,求氧原子的相对原子质量。 2、碳的相对原子质量是 ( )。 A 、12 B 、12 C、 l.66×10-27kg D、 l.993×10-26kg [讲解] 质子和中子的质量大约相等,都约等于碳12原子质量的1/12,即约等于1个氢原子的质量(约为1.66×10-27 kg) ,电子的质量很小,仅相当于质子(或中子)质量的1/1836。因此,电子的质量可以忽略不计,原子的质量主要集中在原子核上。 公式2: [随堂检测] 1、磷原子核内有15个质子,16个中子,15个电子,磷的相对原子质量是多少? 2、北约轰炸南联盟时,广泛使用了美制贫铀弹,造成了严重的生态灾难。已知贫铀弹中含有铀236(236为相对原子质量),它具有放射性,其质子数为92,则这种铀原子里中子数与核外电子数之差为 。 3、俄罗斯科学家1999年合成了核电荷数为114的原子,经测定该原子的相对质量为289,则其中子数与电子数的差是 。 4、下列有关碳14原子的叙述正确的是( ) A.其核外有8个电子 B.其核内有6个中子 C.核电荷数为6 D.质子数和中子数之和为14 [讲解] 分子是由原子结合而成的,我们可以用相对原子质量表示分子质量的大小。 [板书] 相对分子质量等于构成分子的各原子的相对原子质量的总和。 根据这点,查阅P73页表3—4的相对原子质量数据,,可算得O2、H2O、CO2的 相对分子质量。 O2的相对分子质量 : ; H2O的相对分子质量: ; CO2的相对分子质量: 。 【总结】 【课内习题】 1、下列关于原子核的叙述中,正确的是( )。 ①通常由中子和电子构成 ②通常由质子和中子构成 ③带负电荷 ④不显电性 ⑤不能再分 ⑥体积大约相当于原子 ⑦质量大约相当于原子 A.①⑤ B.②⑦ C.③④ D.②⑥⑦ 2、下列叙述正确的是 ( )。
A、 所有原子的原子核都是由质子和中子构成的 B、 相对原子质量表示原子的相对质量
C、 分子是保持物质化学性质的最小微粒 D、 分子是构成物质的唯一微粒
3、美国铱星公司(已破产)原计划发射77颗卫星,以实现全球卫星通讯,其原本准备发射的
卫星数目恰好与铱原子的原子核外电子数目相等,下列关于铱原子的各种说法中正确的是
( )
A、铱原子的核电荷数为77 B、铱原子的相对原子质量为77
C、铱原子的中子数为77 D、卫星通讯需要依靠铱原子
4、下列叙述中,正确的是( )。
A、相对原子质量就是原子质量的简称 B、相对原子质量可用千克或克作单位
C、相对原子质量是一个没有单位的比值D.原子质量约等于原子核内质子质量和中子质量之
和
5、 在分子、原子、质子、中子、电子、原子核、这些粒子中:
(1)能直接构成物质的粒子有 ;
(2)能保持物质化学性质的粒子有_____________;
(3)显示电中性的粒子有__________________;
(4)带正电的粒子有______________________;
(5)带负电的粒子有______________________;
(6)质量最小的粒子是_____________________。
6、 已知每个电子的质量约为每个质子(或中子)质量的1/1836.下表是教材里的部分内容,通过此
表,及所提供信息,你能总结出的结论有:
原子种类 质子数 中子数 核外电子数 原子量
氢
1 0 1 1
碳
6 6 6 12
氧
8 8 8 16
钠
11 12 11 23
铁
26 30 26 56
(1) 。
(2) 。
(3) 。
【课内反思】
