化学反应热的计算_6
《反应热的计算》 讲义

《反应热的计算》讲义一、反应热的基本概念在化学反应中,不仅存在着物质的变化,还伴随着能量的变化。
当反应物和生成物具有相同的温度时,所吸收或放出的热量,就称为反应热。
反应热通常用符号 Q 表示,单位是焦耳(J)或千焦(kJ)。
从宏观角度来看,反应热等于生成物所具有的总能量减去反应物所具有的总能量。
如果生成物的总能量高于反应物的总能量,反应为吸热反应,Q 为正值;反之,如果生成物的总能量低于反应物的总能量,反应为放热反应,Q 为负值。
从微观角度理解,反应热等于断键吸收的总能量减去成键释放的总能量。
断开化学键需要吸收能量,形成化学键会释放能量。
二、常见的反应热类型1、燃烧热在 101 kPa 时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
需要注意的是,这里的“完全燃烧”是指物质中所含的碳元素转化为二氧化碳,氢元素转化为液态水,氮元素转化为氮气等。
例如,甲烷(CH₄)的燃烧热为89031 kJ/mol,表示在101 kPa 下,1 mol 甲烷完全燃烧生成二氧化碳和液态水时放出 89031 kJ 的热量。
2、中和热在稀溶液中,强酸跟强碱发生中和反应生成 1 mol 液态水时所释放的热量叫做中和热。
这里强调的是“稀溶液”,因为浓溶液在混合时会有额外的热量变化;同时,生成的水必须是液态的。
例如,盐酸(HCl)和氢氧化钠(NaOH)的中和热为 573 kJ/mol,表示在稀溶液中,强酸盐酸和强碱氢氧化钠发生中和反应生成 1 mol 液态水时放出 573 kJ 的热量。
三、反应热的计算方法1、利用热化学方程式进行计算热化学方程式不仅表明了化学反应中的物质变化,还标明了反应的热效应。
通过热化学方程式,可以直接根据化学计量数与反应热的对应关系来计算。
例如,对于反应:2H₂(g) + O₂(g) = 2H₂O(l) ΔH =-5716kJ/mol如果有 2 mol H₂参与反应,放出的热量就是 5716 kJ;如果只有 1 mol H₂参与反应,放出的热量就是 2858 kJ。
化学反应热的计算(完整版)2

学方程式。
2N2H4(g)+2NO2(g)====3N2(g)+4H2O(l) ΔH=-1135.2 kJ/mol
ΔH1= -870.3 kJ/mol
⑵C(s)+ O2(g)==== CO2(g) ΔH2= -393.5 kJ/mol
1 2
⑶H2(g)+ O2(g) ====H2O(l) ΔH3= -285.8 kJ/mol
试计算下述反应的反应热:
2C(s) + 2H2 (g) + O2 (g) ==== CH3COOH (l)
换句话说,化学反应的反应热只与反应体系的始态 和终态有关,而与反应的途径无关。这就是盖斯定律。
1.看图理解盖斯定律
海拨400 m B
A 海拨100 m
2.用能量守恒定律论证盖斯定律
ΔH1+Δ0H2=
3.盖斯定律直观化
ΔH = ΔH1+ΔH2
4.盖斯定律在科学研究中的重要意义 有些反应进行得很慢,有些反应不容易直接发生,有些 反应的产品不纯(有副反应发生)…这些都给测量反应 热造成了困难,利用盖斯定律可以间接地把它们的反应 热计算出来。
1.有关热化学方程式的计算 【例1】25 ℃、101 kPa时,使1.0 g钠与足量的氯气反 应,生成氯化钠晶体并放出17.87 kJ的热量,求生成 1 mol氯化钠的反应热。 解析: Na(s) + Cl2(g12 ) ==== NaCl(s) 17.87 kJ/g ×23 g/mol = 411 kJ/mol 答:生成1 mol NaCl时放出热量411 kJ。
1.盖斯定律
根据热化学方程式进行计算 2.有关反应热的计算
根据盖斯定律进行有关反应热的计算
6焓与焓变,热容,反应热

基础化学
思考题 化学热力学中什么情况下,焓变△H 可用来直接表示反应热?
基础化学
(三)、 热容
1. 等压热容Cp和等容热容CV 在不发生相变和化学变化时,体系与环境所交换
基础化学
因为式中U 、p、V 均为状态函数,故H也 为状态函数,称为焓(enthalpy),它是一个具 有能量量纲的抽象的热力学函数,其本身的物 理意义并不象热力学能U那样明确。
此外,由于体系内能U的绝对值不能确定, H的绝对值也无法确定。
基础化学
焓的导出虽借助于特殊的等压过程,但不 是说其它过程就没有焓变。根据焓的定义式 , 一般情况下的焓变为
Cp=CV+nR Cm,p=Cm,V+R 其等压摩尔热容Cm,p和等容摩尔热容Cm,V之间只相差 一个R。利用气体分子运动论可得理想气体热容的近 似值。
对于单原子分子,其Cm,V =3R/2;对于双原子分 子,其Cm,V =5R/2;对于多原子分子,其Cm,V≥3R。
基础化学
思考题 热力学引进热容的概念意义何在?
△U = Q - p外△V = Qp- p△V 即 U2 - U1=Qp- p(V2-V1) 移项整理 (U2 + p2V2)-(U1 + p1V1)= Qp
定义 H = U + pV
得
基础化学
U2 + p2V2=H2 , U1 + p1V1=H1 △H = H2-H1= Qp
如化学反应通常在大气压恒定下的敞口容器 中的液态溶液里进行,此时p外与p差别很小, 此反应过程可视为上述特殊的等压过程。
高一化学化学反应热的计算

1、写出石墨变成金刚石的热化学方程式(25℃,101kPa时) 说明: (1)可以在书中查找需要的数据。 (2)并告诉大家你设计的理由。 查燃烧热表知: ①C(s ,石墨)+O2(g) = CO2(g) △H1= -393.5kJ/mol ②C(s ,金刚石)+O2(g) = CO2(g) △H2= -395.0kJ/mol 所以, ①- ②得: C(s ,石墨)= C(s ,金刚石) △H=+1.5kJ/mol
练习4:已知: 2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol 某H2和CO的混合气体完全燃烧时放出113.74kJ热 量,同时生成3.6g液态水,求原混合气体中H2和CO的 物质的量之比。 3.6g 解: n (H2) = n (H2O) = 18g/mol = 0.2mol
一.盖斯定律:
⒈盖斯定律的内容: 化学反应的反应热只与反应体系的始态和终态 有关,而与反应的途径无关。
⒉盖斯定律直观化:
海拔400m
△H2 C △H1 B
△H
A
山的高度与上 山的途径无关 △H= △H1+ △H2
⒊应用能量守恒定律对盖斯定律进行论证
△H1<0
S
L
△H2>0
△H1+ △H2≡ 0
第三节 化学反应热的计算
盖斯简介
G.H. Hess (1802~1850)瑞士(俄国)化学家。 1802年8月7日生于瑞士日内瓦,1850年12月12日卒于俄国 圣彼得堡(现为列宁格勒)。3岁随父侨居俄国,并在俄国受教育。 1825年于多尔帕特大学获医学专业证书,同时受到了化学和地 质学的基础教育。1826~1827年,在斯德哥尔摩J.J.贝采利乌 斯的实验室工作并从其学习化学。回俄国后在乌拉尔作地质勘探 工作,后在伊尔库茨克做医生并研究矿物。1830年当选为圣彼 得堡科学院院士,专门研究化学,任圣彼得堡工艺学院理论化学 教授并在中央师范学院和矿业学院讲授化学。1838年成为俄国 科学院院士。 1836年盖斯发现,在任何一个化学反应过程中,不论该反应 过程是一步完成还是分成几步完成,反应所放出的总热量相同, 并于1840年以热的加和性守恒定律公诸于世,后被称为盖斯定 律。此定律为能量守恒定律的先驱。当一个反应不能直接发生时, 应用此定律可间接求得反应热。因此,盖斯也是热化学的先驱者。 著有《纯粹化学基础》(1834),曾用作俄国教科书达40年。
化学反应热效应的计算
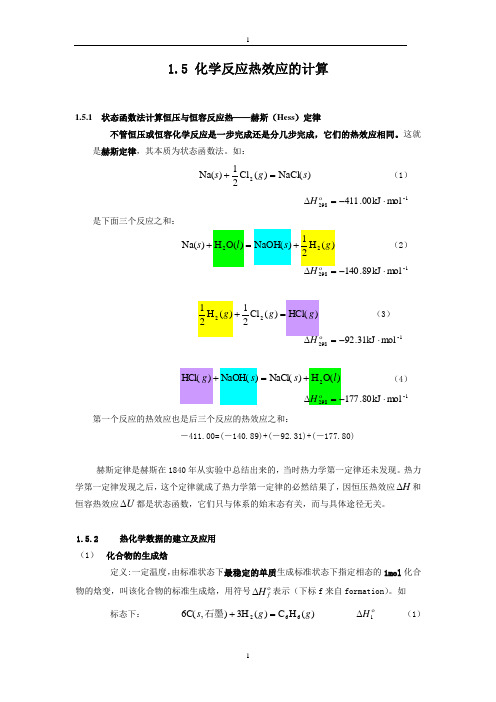
1.5 化学反应热效应的计算1.5.1 状态函数法计算恒压与恒容反应热——赫斯(Hess )定律不管恒压或恒容化学反应是一步完成还是分几步完成,它们的热效应相同。
这就是赫斯定律,其本质为状态函数法。
如:)NaCl()(Cl 21)Na(2s g s =+(1)-1298mol kJ 00.411⋅-=∆ H是下面三个反应之和:)NaOH()O(H )Na(2s l s =+ (2)-1298mol kJ 89.140⋅-)HCl()(Cl 212g g =+ (3)-1298mol kJ 31.92⋅-=∆H)O(H)NaCl()NaOH()HCl(2l s s g +=+ (4)-1298mol kJ 80.177⋅-=∆ H第一个反应的热效应也是后三个反应的热效应之和:-411.00=(-140.89)+(-92.31)+(-177.80)赫斯定律是赫斯在1840年从实验中总结出来的,当时热力学第一定律还未发现。
热力学第一定律发现之后,这个定律就成了热力学第一定律的必然结果了,因恒压热效应H ∆和恒容热效应U ∆都是状态函数,它们只与体系的始末态有关,而与具体途径无关。
1.5.2 热化学数据的建立及应用 (1) 化合物的生成焓定义:一定温度,由标准状态下最稳定的单质生成标准状态下指定相态的1mol 化合物的焓变,叫该化合物的标准生成焓,用符号f H ∆表示(下标f 来自formation )。
如标态下:)(H C )(3H ),C(6662g g s =+石墨1H ∆ (1)标态下:)(H C )(H ),C(2222g g s =+石墨2H ∆ (2)那么)(H C ,66g f H ∆= 1H ∆)(H C ,22g f H ∆=2H ∆什么是最稳定的单质呢?如25℃,1atm.下,碳有石墨、无定型及金刚石三种相态,其中只有石墨是最稳定的相态,故生成反应中当涉及到最稳定的单质碳时必须是石墨。
化学反应的热效应计算

化学反应的热效应计算化学反应的热效应是指在化学反应过程中释放的热量或吸收的热量。
了解和计算化学反应的热效应对于理解反应过程的热力学性质和化学平衡有着重要的作用。
本文将介绍热效应的概念及其计算方法。
一、热效应的概念热效应是化学反应中热量的变化量,可分为两种情况:吸热反应和放热反应。
吸热反应是指在反应过程中吸收热量,反应物的内能增加;放热反应是指在反应过程中释放热量,反应物的内能减少。
根据热力学第一定律,热效应可以用以下公式计算:ΔH = H(生成物) - H(反应物)其中,ΔH表示热效应,H(生成物)表示生成物的焓,H(反应物)表示反应物的焓。
二、热效应的计算方法根据化学反应的平衡方程式,可以通过化学方程式中物质的摩尔系数和热效应的关系来计算热效应。
1. 单一物质热效应对于单一物质的热效应,可以通过该物质的标准热效应计算。
标准热效应是指在标准状态下,1摩尔物质完全反应产生的热效应。
2. 化学反应热效应对于化学反应的热效应计算,需要根据反应方程式中物质的摩尔系数和标准热效应来计算。
以以下反应为例:2H2(g) + O2(g) → 2H2O(g)可以根据反应方程式中的摩尔系数和标准热效应来计算热效应:ΔH = 2ΔH(H2O) - [2ΔH(H2) + ΔH(O2)]其中,ΔH(H2O)表示水的标准热效应,ΔH(H2)表示氢气的标准热效应,ΔH(O2)表示氧气的标准热效应。
三、热效应计算的实例以氯化钠的溶解反应为例进行热效应的计算。
NaCl(s) → Na+(aq) + Cl-(aq)根据该反应方程式和已知的标准热效应数据,可以计算出热效应的值。
ΔH = [ΔH(Na+(aq)) + ΔH(Cl-(aq))] - ΔH(NaCl(s))其中,ΔH(Na+(aq))表示钠离子在水溶液中的标准热效应,ΔH(Cl-(aq))表示氯离子在水溶液中的标准热效应,ΔH(NaCl(s))表示氯化钠晶体的标准热效应。
高中化学化学反应热的计算新人教版选修
其二,加合法:即运用所给方程式就可通过加减的方法得 到新化学方程式。 如:求 P4(白磷)―→P(红磷)的热化学方程式。 已知:P4(白磷,s)+5O2(g)===P4O10(s) 5 1 P(红磷,s)+ O2(g)=== P4O10(s) 4 4 ΔH2 ΔH1 ① ②
即可用①-②×4 得出白磷转化为红磷的热化学方程式。
不可分,但以_____ 物质 为主。
3.盖斯定律的应用
对于进行得______ 很慢 的反应,不容易___________ 直接发生 的反应, 产品不纯 即有___________) 副反应发生 的反应,______ 测定 这些反应的反应 __________( 盖斯定律 ,就可以________ 间接 地把它们的 热有困难,如果应用__________ 反应热计算出来。
4.反应热计算的主要依据:
热化学方程式 、盖斯定律 燃烧热 的数据。 ______________ _________和________ 5.计算反应热的常用解题方法有: 列方程法 、估算法 __________ ______、十字交叉法 __________等。
●自主探究 1 . 登山的高度与上山的途径是否有关?化学反应的反应 热是否与反应的途径有关?
少,只会从一种形式转化为另一种形式。
3.盖斯定律在科学研究中的重要意义
因为有些反应进行得很慢,有些反应不容易发生,有 反应的产品不纯(有副反应发生),这给测定反应热造成 算出来。 些 了困
难。此时如果应用盖斯定律,就可以间接地把它们的反应热计
4.运用盖斯定律解题的常用方法。
通常有两种方法: 其一,虚拟路径法:如C(s)+O2(g)===CO2(g),可设置如 下:ΔH1=ΔH2+ΔH3
(2)从反应热总值角度
高中反应热的公式
高中反应热的公式高中反应热的公式是热反应物质间发生化学反应时所释放或吸收的热量。
反应热的计算对于理解化学反应的能量变化非常重要,因为它可以告诉我们反应是否是放热或吸热的,以及反应的强度和方向。
在化学反应中,反应物会发生化学变化,生成新的产物。
在这个过程中,化学键会被打破和形成,从而释放或吸收能量。
反应热的公式可以通过测量反应前后的温度差来计算,或者根据已知的热值来推导。
一般情况下,反应热可以根据下面的公式来计算:反应热 = 生成物的热量 - 反应物的热量其中,生成物的热量是指反应产物形成时释放或吸收的能量,反应物的热量是指反应物发生化学变化时释放或吸收的能量。
反应热的计算需要知道反应物和生成物的热量。
这些热量可以通过实验测量得到,也可以根据已知的标准热量值来推导。
在实验中测量反应热时,可以使用热量计来测量反应前后的温度变化,从而计算出反应热。
反应热的符号表示也很重要。
如果反应热为正值,表示反应是吸热的,即反应物吸收了热量;如果反应热为负值,表示反应是放热的,即反应物释放了热量。
这个符号可以告诉我们反应的强度和方向。
如果反应热为正,表示反应是不利的,需要消耗能量才能进行;如果反应热为负,表示反应是有利的,能够自发进行。
反应热的计算可以帮助我们理解化学反应的能量变化。
例如,在燃烧反应中,燃料与氧气发生化学反应,产生二氧化碳和水。
这个过程是放热的,因为燃料释放了能量。
反应热的计算可以告诉我们燃烧反应的强度和方向,以及所释放的能量数量。
总结起来,高中反应热的公式是热反应物质间发生化学反应时所释放或吸收的热量。
通过计算反应热,我们可以了解化学反应的能量变化,判断反应的强度和方向。
反应热的计算需要知道反应物和生成物的热量,可以通过实验测量或者已知的标准热量值来得到。
符号表示反应热的正负,正值表示吸热反应,负值表示放热反应。
反应热的计算对于理解化学反应的能量变化非常重要,有助于我们深入研究化学反应的本质和特性。
高二化学反应热的测量与计算
5、判断下列实验操作对中和热测定的数 值有如何影响?填变大变小或者不变。 ①大烧杯上没有盖硬纸板 变小 ②用相同浓度和体积的氨水代替NaOH 溶液进行实验 变小 ③用相同浓度和体积的醋酸代替稀盐酸 溶液进行实验 变小 ④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验
减少热量损失
【问题探究】
3、实验中能否用环形铜丝搅拌棒代替 环形玻璃搅拌棒?为什么?
不能。因为铜丝易导热,使热量损 失较大
【问题探究】
4、有人建议用50mL0.55mol/LNaOH 进行上述实验,测得的中和热数值会 更加准确。为什么?
可以保证盐酸完全反应。 使测得的热量更加准确。
【问题探究】
【活动与探究】 二、中和热的测定
⑴实验药品: 50 mL0.50 mol/L的盐酸 50 mL0.50 mol/L的氢氧 化钠溶液
⑵实验仪器:简易量热计
简易量热计
(3)实验步骤:
1.组装量热器 在大烧杯底部垫泡沫塑料 (或纸条),使放入的小烧杯杯 口与大烧杯杯口相平。然后再在 大、小烧杯之间填满碎泡沫塑料 (或纸条),大烧杯上用泡沫塑 料板(或硬纸板)作盖板,在板 中间开两个小孔,正好使温度计 和环形玻璃搅拌棒通过,如上图 所示。
专题1
第一单元 化学反应中 的热效应
反应热的测量与计算
2课时
【交流与讨论】 热化学方程式中,提供了反应 热的数据,那么,这些数据是通过什 么途径获得的呢?
量热计
【实 验 原 理】
公式一: Q=Cm△t 公式二: △H=Q÷n C为比热容,为定值。 m为质量,可以测定。 n为物质的量。
一、中和热:
在稀溶液中,酸和碱发生中和反应而 生成1mol水时放出的热量。 研究条件:稀溶液 反应物:酸与碱 生成物及其物质的量:1mol H+(aq)+OH-(aq)=H2O(l); H = -57.3 kJ/mol 注:强酸与弱碱反应,强碱与弱酸、弱酸和弱 碱反应生成1molH2O放出的热小于57.3KJ/mol
化学反应的放热量计算
化学反应的放热量计算化学反应中的放热量是指化学反应过程中释放或吸收的热量。
放热量的计算对于研究化学反应的能量变化以及控制化学反应的温度等方面都具有重要意义。
本文将介绍化学反应放热量的计算方法以及相关实例。
一、热量和化学反应的关系热量是物体内部分子之间相对运动的能量转移形式,而化学反应则涉及物质的化学变化和能量转化。
在化学反应中,会释放出或吸收一定量的热量。
二、化学反应放热量的计算方法化学反应的放热量可以通过实验测量得到,也可以通过热力学计算推导得到。
下面将介绍两种常见的计算方法。
1. 单位摩尔反应热单位摩尔反应热是指化学反应中,每个摩尔反应物参与反应时所释放或吸收的热量。
它可以通过实验测量的方法来获得。
具体步骤如下:(1)准备反应物和试剂,确保它们纯度高且浓度准确;(2)将反应物和试剂放入绝热容器中,在一定的条件下进行反应,同时测量温度的变化;(3)根据反应物的量和温度变化,计算出单位摩尔反应热。
2. 反应焓变和反应热反应焓变是指在恒压的条件下,化学反应所伴随的焓变化。
通过计算反应焓变可以得到化学反应的放热量。
(1)根据反应方程式写出反应物和生成物的化学式;(2)使用相应的热化学数据表,查找每个物质的标准生成焓;(3)根据反应物和生成物的物质量以及标准生成焓的差值,计算出反应焓变;(4)根据反应焓变的大小,判断化学反应是放热反应还是吸热反应。
三、实例分析为了更好地理解放热量的计算过程,下面通过一个实例进行分析。
假设有以下反应方程式:2H2(g) + O2(g) → 2H2O(l) (ΔH = -483.7 kJ)根据反应焓变的计算方法,我们可以得到该反应的放热量为-483.7 kJ。
如果我们需要计算该反应在特定条件下的放热量,可以根据消耗的反应物量和反应焓变的关系进行计算。
例如,假设反应中消耗了1 mol的H2气体,在标准状况下,根据反应的化学方程式和反应焓变的数值,可以计算出放热量为-483.7 kJ。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应热的计算 学校:临清实验高中学科:化学 选修四章化学反应与能量 第三节 课前预习学案 一、预习目标: 掌握反应热计算的几种常见方法。 了解反应热计算的常见题型。 二、预习内容: 自学课本例1,例2,例3,总结计算反应热有哪几种方法? 三、提出疑惑 同学们,通过你的自主学习,你还有哪些疑惑,请把它填在下面的表格中: 疑惑点疑惑内容 课内探究学案 一、学习目标: .掌握反应热计算的几种常见方法。 .了解反应热计算的常见题型。 学习重难点:掌握反应热计算的几种常见方法。 二、学习过程: 探究二:反应热的计算 例1、利用热化学方程式求解 归纳总结:各物质的n之比等于△H之比 例2、利用燃烧热求解 归纳总结:Q=燃烧热×n 例3、运用盖斯定律求解 三、反思总结: 本节课,你学到了些什么?说说看。 四、当堂检测: 将0.3ol的气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5j热量,该反应的热化学方程式为_____________。又已知:H2o=H2o;△H2=-44.0j/ol,则11.2L乙硼烷完全燃烧生成气态水时放出的热量是_____________j。 .已知充分燃烧ag乙炔气体时生成1ol二氧化碳气体和液态水,并放出热量bj,则乙炔燃烧的热化学方程式正确的是 A.2c2H2+5o2=4co2+2H2o;ΔH=-2bj/ol B.c2H2+5/2o2=2co2+H2o;ΔH=2bj/ol c.2c2H2+5o2=4co2+2H2o;ΔH=-4bj/ol D.2c2H2+5o2=4co2+2H2o;ΔH=bj/ol 科学家盖斯曾提出:“不管化学过程是一步完成或分几 步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。 + 则白磷转化为红磷的热化学方程式_____________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________。 Tio2Ti,涉及到的步骤为:: Tio2Ticl4Ti 已知:①cso2gco2gH3935j•ol1 ②2cogo2g2co2gH566j•ol1 ③Tio2s2cl2gTicl4so2gH=+141j•ol1 则Tio2s2cl2g2csTicl4s2cogH=。 进行有关反应热的计算或比较大小)已知下列两个热化学方程式: H2+1/2o2==H2oH285.8j•ol1 c3H8+5o2==3co2+4H2oH2220.0j•ol1 实验测得氢气和丙烷的混合气体共5ol,完全燃烧时放热3847j,则混合气体中氢气和丙烷的体积比是_______,两者放出的热量之比约为_____ A、1:3B、3:1c、1:4D、5:13 .已知:; ;欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为 A.2:3.25B.12:3.25c.1:1D.393.5:241.8 在同温同压下,下列各组热化学方程式中,的是 A. B. c. D. .cH3—cH3→cH2=cH2+H2;有关化学键的键能如下。 化学键c-Hc=cc-cH-H 键能414.4615.3347.4435.3试计算该反应的反应热 五、课后练习与提高 一、选择题 已知1ol白磷转化为红磷时放出18.39j的热量。在下列两个反应中: P+5o2=2P2o5;ΔH=-aj/ol4P+5o2=2P2o5;ΔH=-bj/ola和b的关系为 A.abD.无法确定 已知⑴H2+1/2o2====H2o;△H1=aj•ol-1 ⑵2H2+o2===2H2o;△H2=bj•ol-1 ⑶H2+1/2o2====H2o;△H1=cj•ol-1 ⑷2H2+o2===2H2o;△H2=dj•ol-1 下列关系式中正确的是 A.a<b<0B.b>d>0c.2a=b<0D.2c=d>0 已知:H2o=H2o △H=Q1j/olc2H5oH=c2H5oH △H=Q2j/ol c2H5oH+3o2=2co2+3H2o△H=Q3j/ol。若使23g酒精液体完全燃烧,最后恢复到室温,则放出热量为…. A.Q¬1+Q2+Q3B.0.5 c.1.5Q1—0.5Q2+0.5Q3 D.0.5Q1—1.5Q2+0.5Q3 一定条件下,充分燃烧一定量的丁烷放出热量为Qj,经测定完全吸收生成的二氧化碳需消耗5ol•L-1的oH溶液100l,恰好生成正盐,则此条件下反应:c4H10+13/2o2==4co2+5H2o的△H为 A.+8QjB.+16Qjc.-8QjD.-16Qj 在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117j/ol~125j/ol的热量,但1,3—环己二烯失去2个氢原子变成苯是放热反应,△H=-23.4j/ol,以上事实表明 A.1,3—环己二烯加氢是吸热反应 B.苯加氢生成环己烷是吸热反应 c.1,3—环己二烯比苯稳定 D.苯比1,3—环己二烯稳定 已知反应X+y==+N为放热反应,对该反应的下列说法中正确的 A.X的能量一定高于 B.y的能量一定高于N c.X和y的总能量一定高于和N的总能量 D.因该反应为放热反应,故不必加热就可发生 热化学方程式c+H2oco+H2;△H=+131.3j/ol表示 A.碳和水反应吸收131.3j能量 B.1ol碳和1ol水反应生成一氧化碳和氢气并吸收131.3j热量 c.1ol固态碳和1ol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3j D.1个固态碳原子和1分子水蒸气反应吸热131.1j 以NA代表阿伏加德罗常数,则关于热化学方程式c2H2+5/2o2=2co2+H2o;△H=-1300j/ol的说法中,正确的是 A.有10NA个电子转移时,该反应放出1300j的能量 B.有NA个水分子生成且为液体时,吸收1300j的能量 c.有2NA个碳氧共用电子对生成时,放出1300j的能量 D.有8NA个碳氧共用电子对生成时,放出1300j的能量 下列说法正确的是 A.需要加热才能发生的反应一定是吸热反应 B.任何放热反应在常温条件下一定能发生反应 c.反应物和生成物所具有的总能量决定了放热还是吸热 D.吸热反应在一定条件下也能发生反应 0、已知:cH4+2o2=co2+2H2o;△H1,2H2+o2=2H2o;△H2,2H2+o2=2H2o;△H3。常温下取体积比为4:1的甲烷和氢气的混合气体11.2L,经完全燃烧后恢复至常温,则放出热量为 A.0.4△H1+0.05△H3B.0.4△H1+0.05△H2 c.0.4△H1+0.1△H3D.0.4△H1+0.2△H3 1、X、y二元素的原子,当它们分别获得两个电子形成稀有气体元素原子层结构时,X放出的热量大于y放出的热量;Z、两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量大于Z。则X、y和Z、分别形成的化合物中,离子化合物可能性最大的是 A.Z2X B.Z2y c.2X D.2 人体内葡萄糖的消耗可用下述化学方程式表示 c6H12o6+6o26co2+6H2o△H=—2800j/ol如果某人每天消耗12540j热量,他每天至少要摄入葡萄糖 A.806gB.1000g c.1250gD.1500g 二、填空题 3、1840年盖斯根据一系列实验事实得出规律,他指出:“若是一个反应可以分步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同。”这是在各反应于相同条件下完成时的有关反应热的重要规律,称为盖斯定律。已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:c+o2=co2;△H=-393.51j/ol,则金刚石转化石墨时的热化学方程式为:___________。由此看来更稳定的碳的同素异形体为:____________。若取金刚石和石墨混合晶体共1ol在o2中完全燃烧,产生热量为Qj,则金刚石和石墨的物质的量之比为_____________。 磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷在3.2g氧气中燃烧,至反应物耗尽,并放出Xj热量。 通过计算确定反应产物的组成是,其相应的质量为。 已知单质磷的燃烧热为yj/ol,则1olP与o2反应生成固态P2o3的反应热ΔH=。 写出1olP与o2反应生成固态P2o3的热化学方程式:。 火箭发射时可用肼为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知N2+2o2=2No2 △H=+67.7j/ol N2H4+o2=N2+2H2o△H=-534j/ol 则N2H4和No2反应的热化学方程式为____________________________________________ 目前大部分城市居民所使用的燃料主要是管道煤气,使用天然气作为居用燃料对环境更为有利。管道煤气的主要成分是co、H2和少量烃类,天然气的主要成分是cH4。它们的燃烧反应如下: 根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是_________。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是_________进风口,如不作改进可能产生的不良结果是_________________。管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丁烷等,它们的某些性质见下表: 试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是 _______________________。 六、参考答案: 解析:0.3ol乙硼烷完全燃烧生成液态水放出649.5j热
