第三节 分子的性质(第三课时)
【高中化学】手性分子 2022-2023学年高二化学同步课件(人教版2019选择性必修2)

巴斯德 法国微生物学家、化学 家,第一个发现致病微 生物——病菌,研制霍 乱疫苗、狂犬病疫苗等
巴斯德名言“科学虽没有国界,但是科学家有自己的祖国。”
D 1.下列说法不正确的是
A.互为手性异构体的分子互为镜像 B.利用手性催化剂可主要得到一种手性分子 C.手性异构体分子组成相同 D.手性异构体性质相同
B 7.下图中两分子所表示的物质间的关系是( )
A.互为同分异构体 C.互为手性异构体
B.为同一种物质 D.互为同系物
解析 题图中的分子不含手性碳原子,所以两分子不是手性分子; 两分子的分子式相同,结构相同,故两分子表示的物质是同一种物质。
**
8.(1)3氯2丁氨酸的结构简式为
,该有机物分子中
含有 2 个手性碳原子,其中—NH2中N原子的杂化轨道类型是 sp3。
2.下列化合物分子中含有手性碳原子的是( D )
A. CCl2F2
B. CH3CH2OH
C.
D.
D 3.下列物质不存在手性异构体的是( )
A.BrCH2CHOHCH2OH
B.
C.CH3CHOHCOOH
D.CH3COCH2CH3
解析:含有一个手性碳原子的物质存在手性异构体。 D项中物质不含手性碳原子,不存在手性异构体。
【思考与讨论】CH3X、CH2XY、CHXYZ的分子是否存在手性异构?
CHXYZ
绕轴旋转 不能叠合
互为镜像关系的分子不能叠合,不是同种分子
存在手性异构
思考:手性分子形成的条件?
三、分子的手性 P60
3.手性分子形成的条件
同一个碳原子上连有4个不同的原子(或基团)
手性碳原子
互为镜像的分子在三维空间里不能叠合
人教版高中化学选修3 物质结构与性质 第二章 第三节 分子的性质(第3课时)

⑴如果存在氢键,则溶剂和溶质之间的氢键作用力越大,
好 溶解性越_______ 。相反,无氢键相互作用的溶质在有氢键 小 的水中的溶解度就比较_______ 。
⑵“相似相溶”还适用于分子结构的相似性 _________。
增大 3.如果溶质与水发生化学反应可_________ 其溶解度。
2014年7月25日星期五 3
2014年7月25日星期五 8
手性
判断分子是否手性的依据:
※ 凡具有对称 面、对称中心的分子,都是非手性分子。 ※ 有无对称轴,对分子是否有手性无决定作用。 一般: ※ 当分子中只有一个C* ,分子一定有手性。 ※ 当分子中有多个手性中心时,要借助对称因素。无对称 面,又无对称中心的分子,必是手性分子。
2014年7月25日星期五
14
手性
H CH3—C—CH2CH3
OH O
CH2—CH—CH—CH—CH—C—H OH OH OH OH OH
CH2—CH—CH—CH—CH—CH2OH
OH
2014年7月25日星期五
OH OH OH OH
15
手性
手性分子在生命科学和生产手性药物方面有 广泛的应用。由德国一家制药厂在1957年10 月1日上市的高效镇静剂,学名肽氨哌啶酮就 是典型的手性药物。其中的一种手性异构体 (右旋)是有效的镇静剂,而另一种异构体 (左旋)则对胚胎有很强的致畸作用。这种 药物曾被用做孕妇的镇静剂,仅4年的时间就 导致全世界诞生了1.2万多名形似海豹的畸形 儿。所以有选择的生成手性异构体,以及分 离出单一的异构体,将对人类的健康生活具 有重要的意义。
C.与金属钠发生反应
—CH2OH →—CH2ONa
D.与H2发生加成反应 —CHO→ —CH2OH
分子结构与物质的性质 第3课时 示范教案
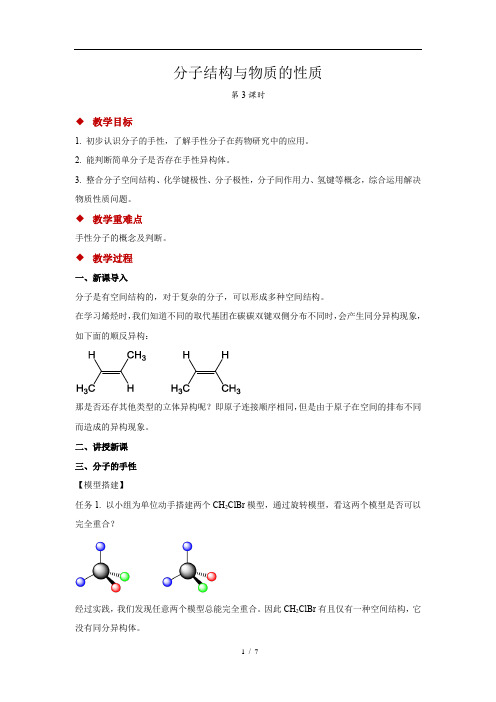
分子结构与物质的性质第3课时◆教学目标1. 初步认识分子的手性,了解手性分子在药物研究中的应用。
2. 能判断简单分子是否存在手性异构体。
3. 整合分子空间结构、化学键极性、分子极性,分子间作用力、氢键等概念,综合运用解决物质性质问题。
◆教学重难点手性分子的概念及判断。
◆教学过程一、新课导入分子是有空间结构的,对于复杂的分子,可以形成多种空间结构。
在学习烯烃时,我们知道不同的取代基团在碳碳双键双侧分布不同时,会产生同分异构现象,如下面的顺反异构:那是否还存其他类型的立体异构呢?即原子连接顺序相同,但是由于原子在空间的排布不同而造成的异构现象。
二、讲授新课三、分子的手性【模型搭建】任务1. 以小组为单位动手搭建两个CH2ClBr模型,通过旋转模型,看这两个模型是否可以完全重合?经过实践,我们发现任意两个模型总能完全重合。
因此CH2ClBr有且仅有一种空间结构,它没有同分异构体。
任务2. 以小组为单位动手搭建两个CHFClBr模型,通过旋转模型,看这两个模型是否可以完全重合?经过实践,我们发现存在两个模型不能完全重合的情况,并且它们总是除C外有两个原子交换了位置。
因此CHFClBr有两种空间结构,它们互为同分异构体。
【提问】(1)对比上面的两种CHFClBr分子,它们的空间结构呈现出怎样的特征?【讲解】它们的关系像一双手,不能相互重合,但是却互为镜像。
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子。
自然界中手性是很普遍的现象,许多天然产物和人体内的活性分子都是手性分子。
例如,作为生命活动重要基础的生物大分子,如蛋白质、多糖、核酸等几乎都是手性的。
存在人体内用于合成蛋白质的氨基酸仅有20种,这20种氨基酸中,除了甘氨酸(R=H)外,其他均有手性。
氨基酸的通式可以下面的结构表达:在机体的代谢和调控过程中所涉及的物质(如酶和细胞表面的受体)一般也都具有手性,在生命过程中发生的各种生物——化学反应过程均与手性的识别和变化有关。
分子的性质-高二化学课件(人教版2019选择性必修2)

2.键的极性对化学性质的影响
分子结构 化学键的极性 物质的化学性质
2.键的极性对化学性质的影响
CH3COOH
CH3COO- + H+
Ka = c(CH3COO-)∙ c(H+ ) c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越强
【思考与交流】
分析表2-6中pKa数据的变化规律及原因
即,对于双原子分子,键有极性,分子有极性 ③含有极性键的多原子分子,立体构型对称的是非极性分子; 立体构型不对称的是极性分子。 判断方法:((12))化正学电键中的心极和性负的电向中量心和是是否否重等合于零
注意:键的极性具有方向性,由正电荷中心指向负电荷中心
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A 所受合力是否为零来判断,F合=0,为非极性分子,F合≠0,为极性分子
BF3 CH4 CCl4
极性分子 极性分子 非极性分子
判断分子的极性
H2
Cl2
同种原子构成的双原子分子是非极性分子
HF HCl NH3
BF3 CH4 CCl4
不同原子构成的双原子分子是极性分子
判断分子的极性
H2
Cl2
相同原子构成的多原子分子大多是非极性分子 (O3例外)
HF HCl NH3
BF3 CH4 CCl4
→极性分子与非极性分子并不取决于分子内部是极性键还是非极性键, 而是取决于分子的对称性
①稀有气体分子是非极性分子,但不含共价键 ②臭氧是极性分子,共价键为极性键 ③H2O2是由极性键和非极性键构成的极性分子
理解应用
C 1.下列说法正确的是
A.含有非极性键的分子一定是非极性分子 B.非极性分子中一定含有非极性键 C.由极性键形成的双原子分子一定是极性分子 D.两个原子之间共用两对电子对,形成的化学键一定有极性
高中化学选修3第二章第三节《分子的性质》第三课时

好好学习 天天向上
磷酸H3PO4>碳酸H2CO3
原因:磷酸Ka1=7.6×10-3,碳酸Ka1=4.17×10-7
若用通式R-H表示无氧酸,则其酸性的强弱主要取决于R的电负性。
如果R原子的电负性大,对氢原子的束缚力强,则 其酸性弱。
如果R原子的电负性小,对氢原子的束缚力弱,则 其酸性就强。
练习:比较下列物质的酸性强弱 (1)CH4、NH3、H2O、HF (2)HF、HCl、HBr、HI
若已知H3PO3(亚磷酸)为中强酸,H3AsO3(亚 砷酸)为极弱酸,试写出亚磷酸和亚砷酸的结构 简式
1. 利用元素周期律,只能判断最高价含氧酸的强弱; 2. 利用非羟基氧的个数,可粗略判断各种含氧酸的强弱; 3. 利用强酸制弱酸的反应,可判断两种酸的强弱; 4. 最精确的判断方法,是比较酸的电离常数Ka大小。 例如:磷酸H3PO4、碳酸H2CO3的酸性谁更强?
化学史上十大最美实验之首
十九世纪中叶 , 巴斯德(Pasteur) 在显微镜下手工分离右旋和左旋酒 石酸盐(1848)。 这是人类历史上第一次成功地人工 分离光学异构体,并且是通过如此 具有艺术性的方式。是科学的美学 意义的绝佳体现。
2
安托万-洛朗·德·拉瓦锡 (Antoine Lavoisier) 著名的钟罩实验,拉瓦锡第 一次提出了氧化和燃烧学说 (1775)
2001 年 , 诺 贝 尔 化 学 奖 授 予 三位用手性催化剂生产手性 药物的化学家。手性催化剂 只催化或者主要催化一种手 性分子的合成,可以比喻成 握手--手性催化剂像迎宾的主 人伸出右手,被催化合成的 手性分子像客人,总是伸出 右手去握手。这种的合成方 法被称为手性合成。手性合 成是当代化学的热点之一, 是 21 世 纪 化 学 研 究 的 重 要 领 域。
分子的性质__第3课时_导学案

《选修三第二章第三节分子的性质》导学案(第3课时)高二班第组姓名组内评价教师评价_______【课标要求】1、从分子结构的角度,认识“相似相溶”规律。
2、了解“手性分子”在生命科学等方面的应用。
3、能用分子结构的知识解释无机含氧酸分子的酸性。
【重点难点】1、应用“相似相溶”规律。
2、了解“手性分子”在生命科学等方面的应用。
【新课导学】1、通过对许多实验的观察和研究,人们得出了一个经验性的“相似相溶”规律:。
如果存在氢键,则溶解性。
此外,“相似相溶”还适用于分子结构的相似性。
2、手性异构体指;手性分子指。
手性碳原子指。
3、举例:哪些物质易溶于水?哪些物质易溶于有机溶剂?有什么规律吗?一、溶解性1、“相似相溶”规律非极性溶质一般能溶于________溶剂,极性溶质一般能溶于________溶剂。
如蔗糖和氨____溶于水,____溶于CCl4,而萘和碘却____溶于CCl4,____溶于水。
思考:(1)比较NH3和CH4在水中的溶解度,怎样解释?(2)为什么在日常生活中用有机溶剂溶解油漆而不用水?(3)乙醇是有机溶剂,为什么能与水互溶?(分子结构的相似性)戊醇呢?2、影响溶解性的因素除了温度、压强外,还有许多制约因素影响物质的溶解性。
(1) 氢键。
溶剂和溶质之间的氢键作用力越大,溶解性越_______。
(2) 分子结构的相似性。
CH3CH2OH中的—OH与水中的—OH相近,因而乙醇能与水________;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的—OH跟水中—OH的相似因素小得多,因而在水中的溶解度明显减小。
(3) 溶质与溶剂发生化学反应,如SO2与水反应生成H2SO3,H2SO3可溶于水,因此将增加SO2的________。
(4)其他影响物质溶解性的因素A 、 B、发生反应二、手性(手性分子、手性异构体)1、手性异构体具有完全相同的________和_____________的一对分子,如同左手与右手一样互为镜像,却在三维空间里____________,互称手性异构体。
人教版高二化学选修3教学案:第二章 第三节 分子的性质含答案
1.了解共价键的极性及分子的极性及其产生的原因。
2.知道范德华力、氢键对物质性质的影响。
3.了解影响物质溶解性的因素及相似相溶原理。
4.了解手性分子在生命科学等方面的应用。
5.了解无机含氧酸分子酸性强弱的原因。
细读教材记主干1.共价键依据电子对是否偏移分为非极性键和极性键,依据电子云的重叠方式分为σ键和π键。
2.分子间作用力是化学键吗?其主要影响物质的物理性质还是化学性质?提示:不是,其主要影响物质的物理性质,如熔、沸点,溶解性等。
3.极性分子中一定有极性键,含极性键的分子不一定是极性分子。
非极性分子中可能有极性键,也可能含有非极性键。
4.分子的相对分子质量越大,范德华力越大,其熔、沸点越高。
若分子之间存在氢键,会使物质的熔、沸点升高。
5.非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂;溶质和溶剂之间形成氢键,可增大其溶解度。
6.无机含氧酸的通式(HO)m RO n,若成酸元素R相同,n值越大,酸性越强。
[新知探究]1.键的极性2.分子的极性3.键的极性和分子极性的关系(1)只含非极性键的分子一定是非极性分子。
(2)含有极性键的分子有没有极性,必须依据分子中极性键的极性的向量和是否等于零而定,等于零时是非极性分子。
[名师点拨]分子极性的判断方法只含非极性键→非极性分子(单质分子,如Cl2,N2,P4,I2)等[对点演练]1.(2016·桓台高二检测)下列含有极性键的非极性分子是( )①CCl4②NH3③CH4④CO2⑤N2⑥H2O ⑦HFA.②③④⑤B.①③④⑤C.①③④ D.以上均不对解析:选C ①CCl4中含有极性键,空间结构为正四面体,正负电荷的中心重合,属于非极性分子;②NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子;③CH4中含有极性键,空间结构为正四面体,正负电荷的中心重合,属于非极性分子;④CO2含有极性键,空间结构为直线型,属于非极性分子;⑤N2是由非极性键构成的非极性分子;⑥H2O中含有极性键,空间结构为V型,属于极性分子;⑦HF是极性键形成的极性分子;含有极性键的非极性分子是①③④,C项正确。
高中化学选修3第二章 分子结构与性质第三节 分子的性质
氢 键 键 能 28.1 (kJ/mol)
共 价 键 键 568 能(kJ/mol)
18.8 462.8
20.9 390.8
结论:氢键介于范德华力和化学键之间,是一种较弱的作用力
3、氢键的类型:(阅读课文P50 第四段)
分子内氢键 (不属于分子间作用力) 分子间氢键 (属于分子间作用力)
思考题:为什么冰的密度比液态水小?
原子之间通过 共用电子对形 成的化学键
作用微粒
分子之间 分子间或分子内氢原子与电 相邻原子之间 负性很强的F、O、N之间
强弱
弱
较强
很强
对物质性质 的影响
范德华力越 大,物质熔 沸点越高
对某些物质(如水、氨 气)的溶解性、熔沸点 都产生影响
物质的稳定性
-114.8 -98.5 -50.8
沸点/℃
-84.9 -67
-35.4
单质
相对分子质量 熔点/℃
沸点/℃
F2
38
Cl2
71
Br2
160
I2
254
-219.6 -101.0 -7.2 113.5
-188.1 -34.6 58.8 184.4
结论:结构相似,相对分子质量越大,范德华力越大
(3)范德华力与分子的极性的关系
HCl 21.14 431.8
HBr 23.11 366
HI 26.00 298.7
结论:范德华力很弱,约比化学键能小1-2数量级
(2) 范德华力与相对分子质量的关系
分子
HCl
HBr
HI
Ar
相对分子质量
36.5 81
128
40
范德华力(kJ/mol) 21.14 23.11 26.00
高中化学 2.3《分子的性质》(第3课时)教学设计3
现吨市安达阳光实验学校第三节分子的性质第三课时学习目标:1.从分子结构的角度,认识“相似相溶”规律。
2.了解“手性分子”在生命方面的用。
3.能用分子结构的知识解释无机含氧酸分子的酸性。
教学方法:采用比较、讨论、归纳、总结的方法进行教学教学、难点:手性分子和无机含氧酸分子的酸性学习过程:[复习]分子的极性判断,分子间作用力对物质性质的影响。
[过渡]今天我们利用已学过的分子结构理论,继续研究物质的其它性质。
[板书]四、溶解性[讲述]物质相互溶解的性质十分复杂,有许多制约因素,如温度、压强。
从分子结构的角度,存在“相似相溶”的规律。
蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水。
如果分析溶质和溶剂的结构就可以知道原因了:蔗糖、氨、水是极性分子,而萘、碘、四氯化碳是非极性分子。
通过对许多的观察和研究,人们得出了一个经验性的“相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
[板书]1.“相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
[讲述]水是极性溶剂,根据“相似相溶”,极性溶质比非极性溶质在水中的溶解度大。
如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较小。
[板书]2. 溶解度影响因素:溶剂的极性、溶剂和溶质之间的氢键作用、[讲述]此外,“相似相溶”还适用于分子结构的相似性。
例如,乙醇的化学式为CH3CH20H,其中的一OH与水分子的一OH相近,因而乙醇能与水互溶;而戊醇CH3CH2CH2CH2CH20H中的烃基较大,其中的一OH跟水分子的一OH的相似因素小得多了,因而它在水中的溶解度明显减小。
[板书] 分子结构的相似性。
[强调]另外,如果遇到溶质与水发生化学反的情况,如SO2与水发生反生成亚硫酸,后者可溶于水,因此,将增加SO2的溶解度。
[思考练习]1.比较NH3和CH4在水中的溶解度。
邳州市第二中学2013年高中化学选修三课件第三节 分子的性质
题型探究技法归纳
题型1
例1
共价键的极性与分子极性的关系
(2012· 北京朝阳区高二检测)下列物
质中既有极性键,又有非极性键的非极性分
子是( ) B.CCl4 D.HCN
A.CH2==CH2 C.H2O2
【思路点拨】
解答此题注意以下两点:
(1)判断极性键和非极性键的方法。
(2)判断极性分子和非极性分子的方法。
解析:选D。氯化氢和水是极性分子,而甲烷 是非极性分子,由相似相溶规律知A正确。 甲醇分子中的羟基与水分子中的羟基相近,因 而甲醇与水互溶;戊醇分子中的烃基大,因 而戊醇在水中的溶解度明显减小,B正确。 HNO3可写成HONO2,HNO2可写成HONO,
HNO3的非羟基氧原子比HNO2的非羟基氧原
自主体验 1.下列分子中属于极性分子的是( A.Cl2 C.CO2 B.HF D.CH4 )
解析:选B。Cl2只含有非极性键,故属于极
性分子;CO2是直线形分子,CH4是正四面
体形分子,空间结构都是对称的,正负电荷 中心重合,故都属于非极性分子。HF是由极
性键形成的双原子分子,属于极性分子。
2.(2012· 岳阳高二质检)下列关于范德华力和 氢键的叙述中,不正确的是( )
形成 分子 的共 价键
分子 分子结构特点 类型
双原子化 AB 合物分子 型
实例
极 性
空间 结构 只有 不对 非极 称, 性键 正电 荷中
AB2 多 V形 型 原 子 三角 AB3 化 锥形 型 合 CH3Cl、 非正
HCl、 CO、NO 等 H2O、 H2S等 NH3、 PCl3等
即时应用 1.(2012· 蚌埠一中高二竞赛选拔)下列叙述中
键能很大,在较高温度时也难打开,所以H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
思考与交流
思考感悟
4.CH3OH能与水以任意比互溶而戊醇在水中的溶 . 能与水以任意比互溶而戊醇在水中的溶 解度却较小,原因是什么? 解度却较小,原因是什么? 【提示】 提示】 CH3OH中的烃基较小,分子极性 中的烃基较小, 中的烃基较小
大,—OH与H2O中的 中的—OH相近,甲醇能与 2O互 相近, 与 中的 相近 甲醇能与H 互 中烃基较大, 溶,而CH3CH2CH2CH2CH2OH中烃基较大,分子 中烃基较大 极性小,其中的 跟水分子中的—OH相似的因 极性小,其中的—OH跟水分子中的 跟水分子中的 相似的因 素小得多,因而戊醇在水中的溶解度明显减小。 素小得多,因而戊醇在水中的溶解度明显减小。
第三节 分子的性质
(第3课时 第 课时 课时)
2012年3月6日星期二
探究实验: 探究实验:
1.准备两个烧杯,分别在两个烧杯中注 入水和四氯化碳。 2.分别在两个烧杯中加入少量的蔗糖, 轻轻地用玻棒搅拌,观察这两个培养皿 中的蔗糖,有何变化。 3.同样地,在另外两个烧杯中注入水 和四氯化碳。分别加入少量的碘,轻轻 地用玻棒搅拌,观察这两个烧杯中的碘 有何变化。
l2F2
B.CH3—CH—COOH
C.CH3CH2OH
D.CH3—OH
六. 无机含氧酸的酸性
1.在同一周期中,处于最高价态的元素,其含氧 在同一周期中,处于最高价态的元素, 在同一周期中 酸的酸性随原子序数递增,自左至右增强。 酸的酸性随原子序数递增,自左至右增强。
如:H3PO4 < H2SO4 < HClO4
拓展体验
1. 下列说法不正确的是( A ) 下列说法不正确的是( A. 互为手性异构的分子组成相同,官能 互为手性异构的分子组成相同, 团不同 B. 手性异构体的性质不完全相同 C. 手性异构体是同分异构体的一种 D. 利用手性催化剂合成可得到或主要得 到一种手性分子
拓展体验
2. 下列化合物中含有手性碳原子的是 B 下列化合物中含有手性碳原子的是( )
3.同一元素若能形成几种不同价态的含氧酸, 同一元素若能形成几种不同价态的含氧酸, 同一元素若能形成几种不同价态的含氧酸 其酸性依化合价的递增而递增; 其酸性依化合价的递增而递增;
如:HClO< HClO2< HClO3 <HClO4
无机含氧酸酸性规律 相同 1. (HO)mROn,如果成酸元素 R相同 ,则 n值越大,即酸性越 强 。 例如 值越大, 值越大
高氯酸是非金属含氧酸中酸性最强的无机酸
2.在同一主族中,处于相同价态的不同元 在同一主族中, 在同一主族中 素,其含氧酸的酸性随成酸元素的原子序 数递增,自上而下减弱。 数递增,自上而下减弱。
如
HClO>HBrO>HIO > > HClO2>HBrO2>HIO2 HClO3>HBrO3>HIO3 HClO4>HBrO4>HIO4
现象?结论? 现象?结论?
四、溶解性
1、相似相溶原理 、 极性溶剂(如水) 极性溶剂(如水)易溶解极性物质 非极性溶剂(如苯、汽油、四氯化碳、 非极性溶剂(如苯、汽油、四氯化碳、 能溶解非极性物质( 等)能溶解非极性物质(Br2、I2等)
2.影响溶解度的因素 2.影响溶解度的因素
• (1)内因:相似相溶原理 • (2)外因:影响固体溶解度的主要因素是温度; 影响气体溶解度的主要因素是温度和压强。 • (3)其他因素: A)如果溶质与溶剂之间能形成氢键,则溶解度增 大,且氢键越强,溶解性越好。如:NH3。 B)溶质与水发生反应时可增大其溶解度,如:SO2。
自然界中的手性
右旋与左旋
自然界中的手性
珍贵的法螺左旋贝。百万分之一,十分罕见。 珍贵的法螺左旋贝。百万分之一,十分罕见。
科学史话: 科学史话 : 了解巴斯德实验室合成的有机物 酒石酸盐并制得手性有机物酒石酸盐过程。 酒石酸盐并制得手性有机物酒石酸盐过程。
5、手性的应用(P52) 、手性的应用 手性合成 手性催化
(1)H2SO3和H2SO4 ) H2SO3: (HO)2SO (2)HNO2和HNO3 ) n=1 ∴H2SO4 ﹥ H2SO3 ; H2SO4 : (HO)2SO2 n=2
∴ HNO3 > HNO2 ; HNO3 : (HO)NO2 n=2
HNO2: (HO)NO n=1
(3) HClO、 HClO2、 HClO3 、HClO4 ) 、 HClO: (HO) Cl n=0 ; n=2 HClO2: (HO) ClO ; n=1 n=3
“反应停”事件 反应停” 反应停
手性分子在生命科学和生产手性药物方面有广泛的应用。 手性分子在生命科学和生产手性药物方面有广泛的应用。 如图所示的分子,是由一家德国制药厂在1957 10月 1957年 如图所示的分子 , 是由一家德国制药厂在 1957年 10 月 1日 上市的高效镇静剂,中文药名为“反应停” 上市的高效镇静剂,中文药名为“反应停”,它能使失眠 者美美地睡个好觉, 者美美地睡个好觉,能迅速止痛并能够减轻孕妇的妊娠反 然而,不久就发现世界各地相继出现了一些畸形儿, 应。然而,不久就发现世界各地相继出现了一些畸形儿, 后被科学家证实, 后被科学家证实,是孕妇服用了这种药物导致的随后的药 物化学研究证实,在这种药物中, 物化学研究证实,在这种药物中,只有图左边的分子才有 这种毒副作用,而右边的分子却没有这种毒副作用。 这种毒副作用,而右边的分子却没有这种毒副作用。人类 从这一药物史上的悲剧中吸取教训,不久各国纷纷规定, 从这一药物史上的悲剧中吸取教训,不久各国纷纷规定, 今后凡生产手性药物,必须把手性异构体分离开, 今后凡生产手性药物,必须把手性异构体分离开,只出售 能治病的那种手性异构体的药物。 能治病的那种手性异构体的药物。
观察一下两组图片,有何特征? 观察一下两组图片,有手互为镜像
乳酸分子CH3CH(OH)COOH 乳酸分子 有以下两种异构体: 有以下两种异构体:
五. 手性
1. 手性:镜像对称,在三维空间里不能重叠。 手性:镜像对称,在三维空间里不能重叠。 2. 手性异构体 具有完全相同的组成和原子排列的一对分子,如同 具有完全相同的组成和原子排列的一对分子, 左手与右手一样互为镜像,却在三维空间里不能重叠, 左手与右手一样互为镜像 , 却在三维空间里不能重叠 , 互称手性异构体。 互称手性异构体。 有手性异构体的分子叫 手性分子: 3. 手性分子: 做手性分子。 做手性分子。 手性碳原子: 4. 手性碳原子:连有四个不同的原子 或原子团的碳原子。 或原子团的碳原子。
HClO3 : (HO) ClO2
HClO4 : (HO) ClO3
∴ HClO4 > HClO3 > HClO2 > HClO
再认识拓展
2. (HO)mROn,如果成酸元素 不同时,则非 如果成酸元素R不同时 不同时,
羟基氧原子数n值越大 即酸性越强 羟基氧原子数 值越大,即酸性越强。 值越
