共线生产风险评估报告
前处理车间多品种共线风险评估实施报告才

前处理提取车间多品种共线风险评估报告编号:1.概述前处理提取车间于2013年10月建成,主要用于中成药前处理及提取工序的生产,现对5个品种进行共线风险评估(增加品种后再进行多品种共线生产的风险评估评估)。
厂房、设施、生产设备根据所生产药品特性、工艺流程及相应洁净度级别要求合理设计;配套了相应的GMP文件软件系统;具备了防止污染与交叉污染的措施。
对生产线的各个关键操作环节进行同步监控。
通过对拟认证的三黄片、通便灵胶囊、大山楂丸、舒肝健胃丸、麦味地黄丸5个品种的公用设施、设备生产产品的药理、毒理、适应症、处方成分的分析;厂房设施、设备清洁(清洁方法和残留水平)、防止混淆(物料、产品)人为差错(工艺不一同使用的模具、筛网不同等)等项目进行评估,以此确定多品种公用设备的可行性。
1.1 共线产品特性信息品名产品类别药理、毒理致敏性主要活性成份三黄片中药清热解毒,泻火通便无大黄酚、大黄素、黄芩苷、盐酸小檗碱大山楂丸中药开胃消食无熊果酸舒肝健胃丸中药疏肝开郁,导滞和中。
无厚朴酚麦味地黄丸中药滋肾养肺无毛蕊花糖苷通便灵胶囊中药泻热导滞,润肠通便无番泻苷1.2 共线产品的预定用途信息品名功能与主治用药剂量三黄片用于热结便秘,长期卧床便秘,一时性腹胀便秘,老年习惯性便秘一次4片﹐一日2次﹐小儿酌减。
通便灵胶囊泻热导滞,润肠通便一次5~6粒,一日1次大山楂丸用于食积内停所致的食欲不振,消化不良,脘腹胀闷一次1~2丸,一日1~3次;小儿酌减麦味地黄丸滋肾养肺。
用于肺肾阴亏,潮热盗汗,咽干,眩晕耳鸣,腰膝软一次6克(约五分之四瓶盖),一日2次。
舒肝健胃丸疏肝开郁,导滞和中。
用于肝胃不和引起的胃脘胀痛,胸胁满闷,呕吐吞酸,腹胀便秘一次3~6克,一日3次。
通便灵胶囊泻热导滞,润肠通便一次5~6粒,一日1次1.3共线产品工艺步骤信息1.3.1 G1生产线共线产品共用设备信息:★表示产品生产使用设备页脚设备编号设备名称设备型号三黄片通便灵胶囊舒肝健胃丸麦味地黄丸大山楂丸滚筒筛选除尘、杂机GS-1200 ★★★★★振动筛ZDS-3 ★★★★★循环水清洗机XYS-600 ★★★★★循环水清洗机XYS-750 ★★★★★汽相置换式润药机QRY-2000 ★★★★★微波医药干燥设备BDMD-M-P-50 ★热风循环烘箱CT-C-II ★★★★★剁刀式切药机QYJI-300C ★★★★★多功能切药机DQJ-480 ★★★自控温电热炒药机CYD-600 ★★★★电热炒药机CY550-Ⅲ★★★★颚式破碎机PSJB-125 ★★★万能粗碎机WSJB-120 ★★★粗碎机CSJ-200 ★★★页脚射流真空泵ZL-600 ★★★提取浓缩系统6m³★★提取浓缩系统3m³★★三效浓缩器WN3-2000 ★★搪玻璃反应罐6m³★★多功能提取罐3m³★★多功能提取罐0.5m³★贮罐CG-SH ★★(真空)贮罐(ZG-1.0 ★★★酒精储罐★★★球形浓缩罐QN-SH ★多功能酒精回收浓缩器JH-SH ★★★酒精回收塔JH-600 ★★酒精回收塔JH-SH ★★页脚单效浓缩器WN-1000 ★★★渗漉罐200L ★碟式分离机PTSX125 ★中药粉灭菌柜ZYF-2.5 ★★★★水冷式药物粉碎机组CW700 ★★★★页脚2.风险评估小组及职责2.1风险评估小组小组职务姓名所在部门工作职务组长前处理提取车间主任组员生产技术部部长组员设备动力部部长组员质量保证部部长组员质量控制部部长组员质量控制部QC组员前处理提取车间QA2.2职责部门职责组长风险管理提供适当的资源,对风险管理工作负领导责任。
共线生产风险评估报告90849

精品文库风险评估报告风险评估名称综合车间冻干生产线共线产品风险评估参加人起草人/日期批准人/日期一、前言我公司综合车间建于2022年,为了降低污染和交叉污染的风险,并根据所生产药品的特性、工艺流程及相应洁净度级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,于2022年3月取得药品GMP证书。
本报告拟对生产共线产品安全进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险预见的控制措施,使生产质量的风险降低到可以接受的水平。
二、目的本报告是对公司多品种共线生产的安全性进行风险管理的报告,报告对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定。
对于每种风险可能产生伤害的严重度(S)和危害的发生概率(P)进行估计。
在某一风险水平不可接受时,提出降低风险预见的控制措施,以期将剩余风险降低到可以接受的水平。
三、合用范围本报告合用于综合生产车间冻干线的产品生产四、引用资料药品生产质量管理规范2022(国家食品药品监督管理局)五、共线产品说明1、共线产品情况综合车间冻干线粉针线1、注射用哌拉西林钠1、注射用美洛西林钠2、注射用哌拉西林钠他唑巴坦钠8:1 2、注射用阿洛西林钠3、注射用哌拉西林钠他唑巴坦钠4:1 3、注射用氨苄西林钠舒巴坦钠4、注射用哌拉西林钠舒巴坦钠4:1 4、注射用氨苄西林钠氯唑西林钠5、注射用替卡西林钠克拉维酸钾2、冻干线共线产品特性序号共线产品名称共线产品性质1 注射用哌拉西林钠高致敏性化学药品、β-内酰氨类。
主要成份:哌拉西林钠、白色,无臭极易引湿、该品在水中或者甲醇中极易溶解,在无水乙醇中溶解,在丙酮中不溶,随温度升高溶解度增加。
2 注射用哌拉西林钠他唑巴坦钠8:1高致敏性化学药品、β-内酰氨类。
主要成份:1、哌拉西林钠:白色,无臭极易引湿、该品在水中或者甲醇中极易溶解,在无水乙醇中溶解,在丙酮中不溶,随温度升高溶解度增加。
2、他唑巴坦钠:白色,在水中易溶,在乙醇、丙酮中溶解,随温度升高溶解度增加。
共线生产的风险分析报告

共线生产的风险分析报告摘要:共线生产是一种生产方式,在这种模式下,不同的产品、子系统或组件同时在同一个生产流程中进行生产。
共线生产的优势包括提高生产效率、减少生产时间和成本,并能够更好地满足市场需求。
然而,共线生产也存在许多潜在的风险和挑战。
本文将对共线生产的风险进行详细分析,并提出相应的应对措施,以帮助企业更好地应对共线生产带来的风险。
1. 引言共线生产是一种在同一个生产流程中同时生产不同产品、子系统或组件的方式。
这种生产模式可以提高生产效率、减少生产时间和成本,并能够更好地满足市场需求。
然而,在共线生产中也存在一些潜在的风险,这些风险可能会对企业的生产和盈利能力产生负面影响。
2. 风险分析2.1 制造过程冲突风险在共线生产中,不同产品或组件的制造过程可能存在冲突。
例如,一台机器可能同时需要用于生产两种不同产品的加工,这就可能导致生产计划的冲突。
当出现这种冲突时,可能会延误整个生产流程,并影响产品的交付时间和质量。
2.2 供应链风险共线生产需要协调不同供应商的供应,以满足生产线上的需求。
然而,如果供应商出现延误或缺货的情况,将会直接影响共线生产的正常进行。
供应链中的任何一环出现问题都可能导致整个生产流程的中断,并对企业的交货能力和声誉造成损害。
2.3 需求不确定性风险共线生产的核心目标是更好地满足市场需求。
然而,如果市场需求发生变化或预测错误,将可能导致生产线上产品的过剩或不足。
这种不确定性可能会导致资源浪费、库存过剩或错过市场机会,对企业的盈利能力产生负面影响。
2.4 质量控制风险在共线生产中,由于不同的产品和组件同时进行生产,质量控制可能面临更大的挑战。
不同产品或组件的质量要求有可能不同,导致生产线上的质量控制变得更加复杂。
如果质量控制不到位,可能会导致产品质量下降、客户投诉增加,最终影响企业的声誉和市场竞争力。
3. 应对措施为了应对共线生产带来的风险,企业可以采取以下措施:3.1 制定完善的生产计划和排产方案,及时发现和解决制造过程冲突,确保生产线的正常运转。
共线生产风险评估报告

风险评估报告一、前言我公司综合车间建于2009年,为了降低污染和交叉污染的风险,并根据所生产药品的特性、工艺流程及相应洁净度级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,于2010年3月取得药品GMP证书;本报告拟对生产共线产品安全进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险预见的控制措施,使生产质量的风险降低到可以接受的水平;二、目的本报告是对公司多品种共线生产的安全性进行风险管理的报告,报告对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定;对于每种风险可能产生损害的严重度S和危害的发生概率P进行估计;在某一风险水平不可接受时,提出降低风险预见的控制措施,以期将剩余风险降低到可以接受的水平;三、适用范围本报告适用于综合生产车间冻干线的产品生产四、引用资料药品生产质量管理规范 2010国家食品药品监督管理局五、共线产品说明1、共线产品情况本公司生产厂房—综合车间,车间为封闭式厂房,室内墙和吊顶采用表面光滑、易清洗的彩钢板防火材料,为青霉素专用生产车间;内设的两条生产线,分别为冻干粉针剂生产线和粉针剂生产线,所有产品均为青霉素类;空调系统两条生产线,共有5条HVAC系统,相互独立的送风系统,每条系统均有一台独立的中央空调箱,初、中效过滤器采用联袋式无纺布过滤袋;回风与进风混合开初效前,用止回阀防止新风倒灌,在空调箱中,新风和回风一起经初级过滤后,经温湿度调节,最后经中效过滤后,由风管送至每个房间独立的高效送风口,为生产区提供净化空气;其中冻干生产线有组空气净化系统:JK1-1,额定风量31000 m3/h,为冻干十万级与万级有菌区域提供净化空气;JK1-2,额定风量28000 m3/h,为冻干万级无菌区域提供净化空气;JK2-1额定风量30000 m3/h,为粉针十万级与万级有菌区域提供净化空气;JK2-3额定风量3500 m3/h,为粉针万级无菌区域分装室提供净化空气;JK2-2额定风量30000 m3/h,为粉针万级无菌区域混合、称量、辅助等提供净化空气新风风口位于本综合车间南侧,冻干线排风位于厂房东侧,粉针线排风位于厂房西侧,排风均经过NaOH及高效过滤排放;各生产线、空调系统互不干扰;纯化水系统采用一级反渗透+二级反渗透,产水量为5吨/小时;原水经砂滤、活性炭过滤、保安过滤、一级反渗透、二级反渗透后进入贮罐;贮罐中的纯化水再经紫外灯消毒后送入循环管道,循环管道分别分为C1支路冻干、C2支路粉针与C3在线清洗支路;贮罐和循环管道均采用内壁抛光的316L不锈钢,贮罐的通气口安装μm的疏水性除菌滤器;纯化水储罐和输送管道定期用纯蒸汽消毒,炭滤器定期用巴氏消毒;注射用水采用纯化水为原水,经过六效蒸馏水机蒸馏,产水量为1吨/小时;注射用水循环管道分别分为Z1支路冻干、Z2支路粉针与Z3在线清洗支路;贮罐和循环管道均采用内壁抛光的316L不锈钢,贮罐的通气口安装μm的疏水性除菌滤器;注射用水采用70℃以上循环,80℃以上保温,储罐和输送管道定期用纯蒸汽消毒;压缩空气为采用:空气→螺杆空压机→冷却储气罐→油水分离器→冷干机→F178IG 常规保护过滤器→F178IH精密过滤器→F178IA活性炭过滤器→各压缩空气使用岗位→聚四氟过滤→使用点;进入洁净车间的管道采用304不锈钢;冻干线共用的生产设备主要有洗瓶机、隧道、配制系统、无菌过滤系统、灌装机、轧盖机、包装贴标机;车间工艺流程布局基本合理,人流、物流分开,生产工序按工艺要求划分为一般生产区、十万级洁净区洗瓶,万级有菌区配料、轧盖、容器具清洗、辅助,万级无菌区无菌灌装,各自有相应的更衣室、卫生通道、缓冲区;为了防止药品的交叉污染和混淆,车间每一操作间及生产用设备、容器均有能够指明正在生产的产品或物料的名称、批号及数量等的状态标志;生产用的设备、容器、输送药液的管道等用后均立即按规定进行清洁;各生产操作严格依照公司管理规定和岗位操作法执行,有防止物料混淆、交叉污染的检查和措施;车间生产采用的是阶段性生产,一个品种生产结束清场合格后才生产另外的品种,避免了混淆的发生;车间按生产区域环境、个人、设备工具、物料的卫生要求,建立有清洁卫生制度及清洁规程,定期检查并记录;质量管理部派专职质监员QA到车间代表质量管理部行使质量监督管理的职权,对药品生产的全过程实行质量监控,各工序配备兼职质检员对进入工序的原辅料、进入下道工序的中间产品、半成品进行质量监督,管理监督层次清晰,能够保证生产产品质量;品、半成品进行质量监督,管理监督层次清晰,能够保证生产产品质量;六、多品种共线生产风险识别14个品种均为青霉素类冻干制剂,功能主治相近,基本工艺流程相同,因此确定了产品共线的可行性;2沿工艺路线,产品的共线生产从配制开始,配制罐、配制管路等为产品共用,存在残留超标风险;洗瓶阶段有10ml、20ml、30ml三种规格西林瓶,存在清场不彻底不同规格相混的风险;贮液桶、管路、陶瓷泵、分液器、灌装针等器具共用,存在残留超标风险;胶塞为同一规格,经超声波清洗、注射用水漂洗后送灭菌烘干箱中灭菌干燥后使用,暂无因共线生产导致的风险;轧盖过程中产生的铝屑造成产品污染粒子的风险;灯检存在清场不彻底混批的风险;包装存在清场不彻底混批的风险;七、风险分析根据产品生产工艺,我们对车间生产可能出现的导致产品质量风险进行分析,认为多品种共线产品引起的交叉污染主要存在可以从以下几个方面分析:1、多品种共用生产厂房情况:厂房从设计上易于清洁、维护、保养;符合特殊药品生产要求2、工艺布局、人流、物流情况:工艺布局设计合理;人流、物流分开,各操作区域能得到有效控制;3、共用设备清洁不彻底,及清洁的有效性:①洗瓶机:将西林瓶用超声波清洗后,用注射用水和压缩空气交替冲洗,再送入隧道烘箱中经一定温度灭菌一定时间送入分装区使用;不接触产品,交叉污染的风险可以接受;规格不同,瓶大、小不同,清场易辨识;②胶塞清洗灭菌:胶塞经超声波清洗、注射用水漂洗后送灭菌烘干箱中灭菌干燥,送入分装区使用;不接触产品,交叉污染的风险可以接受;③称量:分别按指令称量原辅料;在称量过程可能存在交叉污染的风险④配料:不同产品共用设备,因清洁不彻底风险较大;⑤无菌过滤:滤芯专用,滤壳、管路产品共用,因清洁不彻底风险较大;⑥灌装:贮液桶、管路、陶瓷泵产品共用,因清洁不彻底风险较大;⑦轧盖:轧盖过程中产生的铝屑造成产品污染粒子的风险;⑧灯检:人工目检,独立生产线,产品已密闭,产生交叉污染的风险可以接受;⑨包装:一条独立包装生产线,QA清场检查,产生混淆的风险可以接受;4、物料管理暴露状态:从物料在贮存、使用、加工过程中因物料管理及暴露可能产生污染与交叉污染的风险;七、风险等级评估方法FMEA说明1、进行风险评估所用的方法遵循FMEA 技术失效模式与影响分析,它包括以下几点:风险确认:可能影响产品质量、产量、工艺操作或数据完整性的风险;风险判定:包括评估先前确认风险的后果,其基础建立在严重程度、可能性及可检测性上;严重程度S:测定风险的潜在后果,主要针对可能危害产品质量、病患健康及数据完整性的影响;严重程度分为四个等级,如下:可能性程度P:测定风险产生的可能性;根据积累的经验、工艺/操作复杂性知识或小组提供的其他目标数据,可获得可能性的数值;为建立统一基线,建立以下等级:可检测性D:在潜在风险造成危害前,检测发现的可能性,定义如下:RPN定量分级值计算,将各不同因素相乘:严重程度、可能性及可检测性,可获得风险系数RPN = SPD高风险水平:RPN> 16 或严重程度= 4由严重程度为4 导致的高风险水平,必须将其降低至RPN最大= 8;中等风险水平:16 ≥ RPN ≥ 8低风险水平:RPN ≤ 7八、风险评估九、结论:上述风险要素在采取相应的预防措施后,生产安全的剩余风险降低到可以接受的水平;在综合考虑药品的特性、工艺、清洁验证的结果和有效性和国家相关法规的前提下,该车间采用多品种共用厂房、设施和设备的方式进行生产,生产安全的剩余风险是可以接受的;。
多品种共线生产质量风险评估报告

评价人:日期: -4-15 批准人:日期: -4-15目录1.前言2. 风险评估目旳3. 风险评估范畴4. 风险评估小组5.评估流程6.风险级别评估措施(FMEA)阐明7.共线产品信息8.共线旳可行性9.支持性文献10.风险评估实行11.风险评估结论我公司化妆品(普通液态单元、膏霜乳液单元和蜡基单元)生产车间,根据国家化妆品生产质量管理规范及可生产品种特性、工艺流程及相应法规规定,对厂房、生产设施和设备进行了合理设计造型和布局,设计多品种多规格共线生产,根据新版 GMP 第四十六条(为减少污染和交叉污染旳风险,厂房、生产设施和设备应当根据所生产药物旳特性、工艺流程及相应干净度级别规定合理设计、布局和使用,并符合规定)规定,本着对生产安全和有效性进行风险评估,以期对其生产安全风险能对旳结识并采用减少安全风险意见旳控制措施,使生产质量及风险减少到可以接受旳水平。
2.1.评估厂房、生产设施和设备多产品共用旳可行性;2.2.提出减少避免污染与交叉污染措施实行过程中也许发生质量风险旳措施;2.3.根据风险评估旳成果拟定旳验证活动范畴及深度。
本次评估仅限于对配料、乳化、静置、灌装、包装车间多品种多规格共线生产时也许存在旳潜在风险旳评估,其他与共线生产无关旳质量风险不在本次评估范畴内。
本次质量风险评估项目为“多品种共线生产”,因此选择旳成员旳资质应对该项目有相适应旳科学知识及经验,为此特拟定如下人员为本次质量风险评估小构成员:姓名部门职务组内职务签名日期5.1.列出公司在共线生产采用旳避免污染与交叉污染、避免混淆与差错旳措施;5.2.对各项措施进行风险级别评估:本次进行风险评估所用旳措施遵循FMEA 技术(失效模式与影响分析);5.3.提出避免质量风险发生旳措施,以及根据风险评估旳成果拟定旳验证活动范畴及深度。
进行风险评估所用旳措施遵循 FMEA 技术(失效模式与影响分析),它涉及如下几点:6.1.风险确认:也许影响产品质量、产量、工艺操作或者数据完整性旳风险;6. 2.风险鉴定:涉及评估先前确认风险旳后果,其建立在严重限度、也许性及可检测性上;6.3.严重限度(S):重要针对也许危害产品质量数据完整性旳影响。
药品生产设备共线生产风险评估范例
中等偏上可能性
目前的方法有中等偏上的可能性可以检测出失败模式
4
可能性大
目前的方法可以检测出失败模式的可能性大
3
非常大的可能性
目前的方法可以检测出失败模式的可能性非常大
2
几乎肯定能
目前的方法几乎可以肯定的检测出失败模式;有可靠的检测方法
1
表五:
风险评估值(R)=风险发生概率(P)×风险严重程度(S)×风险的可检测能力(D),根据风险评估值可以判定风险控制的级别:
4
较小
对生产线造成较小破坏,部分产品需进行返工。一半的顾客可以发现到缺陷
3
非常小
对生产线造成较小破坏,部分产品需进行返工。但很少有顾客可以发现到缺陷
2
无
无影响
1
表中“顾客”一词,可以是内部顾客,例如下一个工序,也可以是最终用户
表三:
失败发生的可能性
失败的几率
举例
得分
非常高:几乎不可避免失败
≥1/2
——
2、QA检查签发清场合格证
3
3
5
表一:
工序
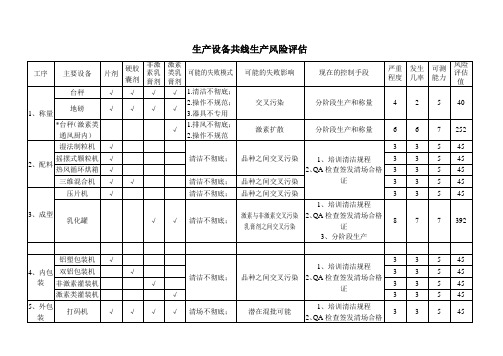
主要设备
片剂
硬胶囊剂
非激素乳膏剂
激素类乳膏剂
可能的失败模式
风险评估值
改进的措施
可能的失败影响
现在的控制手段
严重
程度
发生
几率
可测
能力
风险评估值
3、成型
乳化罐
√
√
清洁不彻底;
392
设非激素专用配膏室
非激素间交叉污染
1、培训清洁规程
2、QA检查签发清场合格证
3、定期清洁验证
得分
绝对不可能
完全没有有效的方法可以检测出失败模式
公共生产线生产激素类药品风险评估报告
激素类药品与非激素类药品公共生产线生产激素类药品风险评估报告1、前言我公司此次认证的固体制剂生产车间1#车间、2#车间,根据国家药品生产质量管理规范(2010版)及可生产品种特性、工艺流程及相应法律制度级别要求,对厂房、生产设施和设备进行了合理设计造型和布局,设计激素类药品与非激素类药品共线生产,依据2010版GMP第四十六条规定,本着对生产安全和有效性进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险意见的控制措施,使生产质量及风险降低到可以接受的水平。
2、目的对我公司激素类品种与非激素类药品的共线生产的安全性进行风险管理发生报告对激素类与非激素类共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定,对于每种风险可能产生危害的严重度(S)和危害的发生概率(P)进行估计,在某一风险水平不可接受对提出降低风险预见的控制措施,以期将产生风险降低到可接受的水平。
3.风险评估3.1风险评估过程激素类药品与非激素类药品共线生产---风险识别---风险评估---风险控制---风险管理评审3.2生产安全风险可接受性准则RL3.2.1危害程度(S)评价准则:危害程度用0-9,0表示不严重,9表示非常严重。
3.2.2危害发生几率(P)评价准则:发生几率用0-9表示,0表示未发生,9表示经常发生。
3.2.3风险可能性(D)评价准则:可能性用0-9评价,0表示风险发生时一定可能发现,9表示发生不可能发现。
3.3风险评价(RE)准则按风险等级评价安全风险可接受性:风险等级(RL)=严重程度(S)×发生概率(P)×可发生性(D)当风险等级为1-9 可忽略风险,不需要采取措施;当风险等级为10-24 中等风险,需采取预防措施;当风险等级为25-47 中等风险,需采取预防措施;当风险等级>48 风险不可接受,要求必须调查和跟踪。
3.4可能影响其生产安全性的风险因素根据产品生产工艺,我们对车间生产可能出现的导致产品质量风险进行分析认为激素类与非激素类共线生产主要存在以下风险。
共线生产风险评估报告
共线生产风险评估报告风险评估报告一、前言我公司灌装等车间装修于2011年,为了降低污染和交叉污染的风险,并根据所生产产品的特性、工艺流程及相应洁净度级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,于2013年6月取得SGS公司颁发GMPC证书并每年验证审核,2016年1月13日、5月26日由**市**区质量监督质量检验所验证洁净区空气洁净度达到10万级水平、次清洁区符合标准并颁发报告。
本报告拟对生产共线产品安全进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险预见的控制措施,使生产质量的风险降低到可以接受的水平。
二、目的本报告是对公司多品种共线生产的安全性进行风险管理的报告,报告对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定。
对于每种风险可能产生损害的严重度(S)和危害的发生概率(P)进行估计。
在某一风险水平不可接受时,提出降低风险预见的控制措施,以期将剩余风险降低到可以接受的水平。
三、适用范围本报告适用于综合生产车间灌装线、乳化制作生产线的产品生产四、引用资料化妆品安全技术规范(2015年版)、本公司ISO22716\GMPC质量管理体系文件等相关资料。
五、共线产品说明1、共线产品情况本公司生产厂房—乳化制作和灌装车间,车间为封闭式厂房,室内墙和吊顶采用表面光滑、易清洗的彩钢板防火材料,为专用生产车间。
2楼灌装间内设的5台灌装生产设备,3楼灌装间为3台灌装生产设备;2楼半自动灌装生产设备生产膏霜乳液产品,其余设备生产一般液态产品。
空调系统两条,灌装、静置间相互独立的送风系统,每条系统均有一台独立的中央空调箱,初、中效过滤器采用联袋式无纺布过滤袋。
回风与进风混合开初效前,用止回阀防止新风倒灌,在空调箱中,新风和回风一起经初级过滤后,经温湿度调节,最后经中效过滤后,由风管送至每个房间独立的高效送风口,为生产区提供净化空气。
其中灌装生产线有多组空气净化系统:模块化风冷式(热)水机组ZJ TCA201CC,组合式空调机组ZK012-4MR、净化通风换气柜式机组KPG065-JHT、风管送风式空调机组FG12/A2-N4,空气压缩机G22PA 85FA,储气罐1502A-80,空气干燥机ND-30 AC为灌装、静置间、储瓶(洁净包材)等空间(十万级区域)提供净化空气,排风均经过高效过滤排放;各生产线、空调系统互不干扰。
共线生产风险评估报告
内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)我公司综合车间建于 2022 年,为了降低污染和交叉污染的风险,并根据所生产药品的特性、工艺流程及相应洁净度级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,于 2022 年 3 月取得药品 GMP 证书。
本报告拟对生产共线产品安全进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险预见的控制措施,使生产质量的风险降低到可以接受的水平。
本报告是对公司多品种共线生产的安全性进行风险管理的报告,报告对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定。
对于每种风险可能产生伤害的严重度(S)和危害的发生概率(P)进行估计。
在某一风险水平不可接受时,提出降低风险预见的控制措施,以期将剩余风险降低到可以接受的水平。
本报告合用于综合生产车间冻干线的产品生产药品生产质量管理规范 2022 (国家食品药品监督管理局)综合车间冻干线1、注射用哌拉西林钠2、注射用哌拉西林钠他唑巴坦钠8:13、注射用哌拉西林钠他唑巴坦钠4:14、注射用哌拉西林钠舒巴坦钠 4:粉针线1、注射用美洛西林钠2、注射用阿洛西林钠3、注射用氨苄西林钠舒巴坦钠4、注射用氨苄西林钠氯唑西林钠15、注射用替卡西林钠克拉维酸钾序号共线产品名称1 注射用哌拉西林钠注射用哌拉西林钠他唑巴坦钠8:1注射用哌拉西林钠他唑巴坦钠4:14 注射用哌拉西林钠舒巴坦钠 4:1序号共线产品名称1 注射用哌拉西林钠2 注射用哌拉西林钠他唑巴坦钠8:13 注射用哌拉西林钠他唑巴坦钠4:14 注射用哌拉西林钠舒巴坦钠 4:1共线产品性质高致敏性化学药品、β-内酰氨类。
主要成份:哌拉西林钠、白色,无臭极易引湿、该品在水中或者甲醇中极易溶解,在中溶解,在中不溶,随温度升高溶解度增加。
高致敏性化学药品、β-内酰氨类。
主要成份: 1、哌拉西林钠:白色,无臭极易引湿、该品在水中或者甲醇中极易溶解,在中溶解,在中不溶,随温度升高溶解度增加。
口服液体制剂多品种共线生产风险评估报告
口服液体制剂车间多品种共线生产风险评估报告1 概述:本公司的口服液体制剂包括糖浆剂、煎膏剂、酊剂三个剂型共12个品种。
根据生产任务的不同,每个生产工序配备了符合GMP要求的生产设备。
配料有2 套生产设施、设备,灌装机2台,内外包装线有2条生产线。
其中酊剂有独立的一套配料、灌装、灯检、内外包装线;煎膏剂与糖浆剂共用一套配料、灌装、内外包装线。
3个剂型产品共用厂房有称量间、洁净走道及中间站、洁具清洗存放间、人流、物流通道;生产设施有纯化水系统、压缩空气、空调净化系统等设施。
每台(套)设备产品批量生产计划完成以后,才转而生产另一种产品。
口服液体制剂车间常年生产3个品种,工艺成熟,质量稳定,不存在相互反应及配伍禁忌。
2 目的:对口服液体制剂车间多品种共线生产进行风险评估,通过风险识别、风险评估及风险控制,制定纠正和预防措施,从而降低或避免这些潜在风险在执行过程中可能造成的危害,并持续地改进风险降低措施,保证产品质量,避免交叉污染。
3 范围:口服液体制剂车间多品种共线生产。
4 引用资料4.1 《药品生产质量管理规范》(2010版)4.2 公司制定的《质量风险管理规程》。
5 成立风险评估管理小组:风险评估前,公司质量管理部、工程部及口服液体制剂车间管理人员及岗位主要人员共同组建成立“口服液体制剂车间多品种共线风险评估管理小组”。
由质量保证部担任组长、口服液体制剂车间主任担任副组长,正式启动风险管理程序。
风险评估小组成员6 风险分析活动流程:6.1活动流程图6.2 现状调查:收集口服液体制剂多品种共线的相关信息,包括生产品种简介、厂房及设备布局、设备基本信息、岗位关键工艺控制项目及监控参数,各岗位人员配备及资质情况等。
6.3 风险识别:根据口服液体制剂生产线多品种共线实际情况,从人、机、物、法、环五个方面分析,分析多品种共线程序可能出现的失效模式,同时对每一项进行分析编号。
6.4 风险分析:针对潜在的失效模式进行分析,通过失效的潜在后果、失效的潜在因素、现阶段减轻风险的措施进行分析,对严重程度、发生可能性、可检测性进行评分,计算其RPN 值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
XXXXXX有限公司 共线生产风险评估报告 编号:RA/05/01 方案批准 方案审核/批准签字 日期
起草人
生产部 审核人 质管部
生产部 设备基建部
批准人 质量负责人 1. 目的和范围 1.2. 2.
3. 3.1.
3.2.
目的 通过对多品种共线生产的安全性进行风险管理,对多品种共线生产过程中可能产生混淆和交叉污染的风险要素进行分析判定。通过对产品特性、生产场地、生产设备、生产人员进行定性估计。在某一风险水平不可接受时,提出降低风险预见的控制措施,将剩余风险降低到可以接受的水平。 范围 适用于我公司XXX剂药品生产车间的共线安全风险评估。 概括
我公司XXX剂药品生产车间建于2015年,位于XXXX工业园。根据所生产药品的特性、工艺流程和洁净级别要求,对厂房、生产设施和设备进行了合理设计、选型和布局,有效地降低污染和交叉污染的风险。本报告通过对XXX剂生产过程风险评估,使风险能正确认识并采取控制措施降低风险,使生产质量的风险降低到可以接受的水平。 共线生产品种描述
基本生产情况 我公司生产的XXX剂品种有5个品种,共10个规格,其中没有细胞毒性类、激素类、高活性化学药、卩-内酰胺结构类药品、性激素类避孕药及特殊性质的药品(如高致敏性和生物制品),所有品种均为非无菌制剂,且为外用XXX剂,属低风险品种。 共线生产的全部10个品种规格均为普通药品,彼此间不存在相互反应或配伍禁忌;配备了先进的符合最新GMP要求的生产设备,配套了完善的GMP文件软件系统,对生产线的各个关键操作环节进行同步监控。 品种明细
序号 药品名称 剂型 规格 批准文号 常年生产 1 A1 XXX剂 50ml/瓶、100ml/瓶 国药准字ZXX 是
2 A2 XXX剂 25ml/瓶、50ml/瓶、 100ml/瓶、250ml/瓶 国药准字ZXX 是
3 A3 XXX剂 1% 国药准字HXX 否
4 A4 XXX剂 45ml/瓶 国药准字ZXX 否 4. 4.1.
4.2. 5 A5 XXX剂 25ml/瓶、45ml/瓶 国药准字ZXX 否
各品种情况简介 A1 【药品名称】 通用名称:Al 汉语拼音: 【成份】XXXX,XX,XXX,XX。 【性状】本品为棕色的溶液;XXXXXXXo 【功能主治】活血化瘀,消肿止痛。XXXX损伤,症见关节肿胀、疼痛、活动受限。 【规格】50ml/瓶、100ml/瓶 【用法用量】外用,涂于患处,热敷20〜30分钟,一次2〜5ml,—日2〜3次,十四日为一疗程,间隔一周,一般用药二疗程或遵医嘱。 【不良反应】偶见皮肤瘙痒。 【禁忌】尚不明确。 【注意事项】孕妇禁用;使用过程中皮肤出现发痒、发热及潮红时,就停用。 【临床试验】本品于2000年及2005年经国家食品药品监督管理局批准进行过共453例临床试验。 【药理毒理】A1对热板法致痛的小鼠有明显的镇痛作用,对二甲苯致炎的小鼠耳廓炎肿胀及蛋清所致大鼠足跖炎症肿胀均有明显抑制作用。通过对大白鼠的完整及破损皮肤的急性毒性试验、长期毒性试验、刺激性试验及过敏性试验、均未见毒副反应及过敏反应。 【贮藏】密封,置阴凉处(不超过20°C)。 【有效期】36个月。 【执行标准】《中国药典》2010年版一部 【批准文号】国药准字ZXX。 A2 【药品名称】 通用名称:A2 汉语拼音:i 【成份】XXXXXo 【性状】本品为黄棕色的液体,久XXXX;气微香。 【功能主治】泻火解毒、消肿止痛、燥湿敛疮。用于烧烫伤,症见:疮面腐烂,分泌物增多, 局部水肿,水泡饱满,红肿疼痛;XXXXxo 【规格】50ml/瓶,25ml/瓶,100ml/瓶,200ml/瓶。 【用法用量】外用。新鲜烧伤创面用无菌生理盐水清创后,将本品涂于(或湿敷)创面,根据创面大小适量用药,一日一次,至愈合为止。 【不良反应】尚不明确。 【禁忌】尚不明确。 【注意事项】1.外用药,切勿口服。用前摇匀; 2. 如发现对本品过敏者请立即停用; 3. 根据患者病情,注意采用适宜的综合治疗措施: 4. 孕妇慎用。
【临床试验】本品于1997年经国家卫生部批准进行过301例临床试验。 【药理毒理】试验药理学结果显示:本品具有抑菌、消肿作用。1・可缩短兔皿度烫伤和豚鼠 碱烧伤的红肿消退、结痂、痊愈时间;2对碱烧伤引起的大鼠白细胞、血红蛋白下降及肌酐、尿素氮升高有对抗作用;3.并能减少碱烧伤皮肤的含水量;4.对绿脓假单胞菌,金黄色葡萄球菌等五种烧伤常见致病菌有体外抑菌和杀菌作用。 小鼠急性毒性试验结果:口服最大给药量240g/kg,皮下注射LD50为10g/kg。 局部毒性试验:家兔完整皮肤和破损皮肤外涂1ml含2g生药XXX剂未见刺激反应,豚鼠皮肤给药未见皮肤过敏反应。 【贮藏】密封,置阴凉处(不超过20°C)。 【有效期】36个月。 【执行标准】国有药品标准标准编号XXXXo 【批准文号】国药准字ZXXXXXo 4.3.A3
【药品名称】 通用名称:A3汉语拼音:e 英文名称: 【成份】本品每毫升含主要成份XX0.01克。 【性状】本品为红棕色液体。 【作用类别】本品为皮肤科用药类非处方药药品。 【适应症】用于化脉性皮炎、皮肤具菌感染、小面积轻度烧烫伤,也用于小面积皮肤、和膜创口的消毒。 【规格】1% 【用法用量】外用。用棉签蘸取少量,由中心向外用局部涂搽。一日1-2次。 【不良反应】极个别病例用药时创面黏膜局部有轻微短暂剌激,片刻后即自行消失,无需特别处理。 【禁忌】孕妇及哺乳期妇女禁用。 【注意事项】 1. 本品为外用药,切忌口服;如误服中毒,应立即用淀粉糊或米汤洗胃,并送医院救治。 2. 用药部位如有烧灼感、红肿等情况应停药,并将局部药物洗净,必要时向医师咨。 3. 对本品过敏者禁用,过敏体质者慎用。 4. 本品性状发生改变时禁止使用。 5. 请将本品放在儿童不能接触的地方。 6. 儿童必须在成人监护下使用。 7. 如正在使用其他药品,使用本品前请咨询医师或药师。 【药物相互作用】 1. 本品不得与碱、生物碱、水合氯醛、酚、硫代硫酸钠、淀粉、鞣酸同用或接触。 2. 如与其他药物同时使用可能会发生药物相互作用,详情咨询医师或药师。 【药理作用】本品为消毒防腐剂,对多种细菌、芽胞、病毒、真菌等有杀灭作用。其作用机制是本品接触创面或患处后,能解聚释放出所含碘发杀菌作用。特点是对组织刺激性小,适用于皮肤、黏膜感染。 【贮藏】遮光、密封、在阴凉处保存。 【有效期】36个月。 执行标准】《中国药典》2010年版二部 4.5. A4 【药品
【批准文号】国药准字HXX。 4.4.A5
【药品名称】 通用名称:A5 汉语拼音: 【成份】XXX,XXX。 【性状】本品为棕红色的油状液体。 【功能主治】清热解毒,凉血祛腐止痛。用于I、U度烧烫伤和酸碱灼伤。 【规格】每瓶装25ml。 【用法用量】外用。创面经消毒清洗后,用棉球将药涂于患处,盖于伤面,必要时可用纱布浸药盖于创面。 【不良反应】尚不明确。 【禁忌】尚不明确。 【注意事项】1.外用药,切勿口服。 2.孕妇慎用;忌食辛辣食物。 【贮藏】密封。 【有效期】36个月。 【执行标准】《中国药典》2010年版一部。
【批准文号】国药准字ZXX。 通用名称:A4汉语拼音:i
【成份】XXXXXXo 性状】本品为浅黄色的澄清液体;气香,具辛凉感。 功能主治】消炎、止痒。用于夏季皮炎,痱子,皮肤瘙痒等 规格】每瓶装45ml。 用法用量】外用,涂抹患处,一日数次。 5. 5.1.
5.2.
【不良反应】尚不明确。 【禁忌】尚不明确。 【注意事项】1.外用药,切勿口服。 2.运动员慎用。
【贮藏】密封,置阴凉处(不超过20°C) 【有效期】36个月。 【执行标准】《卫生部药品标准》中药成方制剂第九册标准编号XXX。 【批准文号】国药准字ZXXO XXX剂车间生产场地风险评估
评估标准 以房间的功能为依据,具体定义风险级别标准是: 高:生产2个以上品种且有共用生产设备的房间; 中:生产2个以上品种但无共用生产设备或有2个以上品种的物料周转或暂存的房间;低:单品种生产的房间、无产品生产的房间、单一包材周转或暂存的房间、单品种物料周转或暂存的房间。 房间风险评估表 房间编号 房间名称 洁净级别 生产品种 风险级别 评估说明 2E042 前处理室1 一般生产区 共用 高
2E039 前处理室2 一般生产区 共用 高
2E040 粉碎室1 一般生产区 共用 高
2E041 粉碎室2 一般生产区 A1 低
2E038 提取室 一般生产区 A2、A5 中
1E009 浓缩、回收区 一般生产区 A1、A4 高
1E014 双效浓缩室 一般生产区 A2 低
1E025 外包装室 一般生产区 共用 中
1E026 废弃物通道 一般生产区 N/A 低
1E027 外清室 一般生产区 共用 中
1D053 更工衣更鞋室 D级洁净区 N/A 低
1D054 更洁净衣室 D级洁净区 N/A 低
1D055 洁净走廊 D级洁净区 共用 中
1D056 中控室 D级洁净区 N/A 低 检验品不返回生产线
1D057 分装室 D级洁净区 共用 高
1D058 配制室 D级洁净区 共用 高
