第6讲金属之铝及其化合物
高中化学铝及其重要化合物35页PPT

56、极端的法规,就是极端的不公。 ——西 塞罗 57、法律一旦成为人们的需要,人们 就不再 配享受 自由了 。—— 毕达哥 拉斯 58、法律规定的惩罚不是为了私人的 利益, 而是为 了公共 的利益 ;一部 分靠有 害的强 制,一 部分靠 榜样的 效力。 ——格 老秀斯 59、假如没有法律他们会更快乐的话 ,那么 法律作 为一件 无用之 物自己 就会消 灭。— —洛克
60、人民的幸福是至高无个的法。— —西塞 罗
46、我们若已接受最坏的,就再没有什么损失。——卡耐基 47、书到用时方恨少、事非经过不知难。——陆游 48、书籍把我们引入最美好的社会,使我们认识各个时代的伟大智者。——史美尔斯 49、熟读唐诗三百首,不会作诗也会吟。——孙洙 50、谁和我一样用功
铝及其化合物教学设计

<<铝及其化合物复习>>教学设计【三维目标】知识与技能:1、掌握Al2O3、Al(OH)3的两性及其相互转化2、掌握Al(OH)3的制法过程与方法:1、通过分组合作实验探究Al(OH)3的两性2、通过启发诱导,增强化学学习兴趣。
情感、态度、价值观:1、通过对Al2O3、Al(OH)3性质和用途的教学,激发学生学习化学的热情。
2、通过对Al2O3、Al(OH)3两性的探讨,培养学生思维能力和综合分析能力。
【复习重点,难点】教学重点:氧化铝和氢氧化铝的化学性质教学难点:氧化铝和氢氧化铝与氢氧化钠溶液的反应及其相互转化把握重点、突破难点:(设计两个题目)1、你将如何设计从铝土矿中提取铝单质?你能设计出几种提取方案?请用流程图表示出来,并写出相应的离子方程式(试剂自选)2、用Al来制取Al(OH)3,你又该如何设计方案?设计意图:为了不让学生对学过的知识只是一个简单的回顾而是通过对问题的思考、讨论从中得出要学的化学知识。
通过循循善诱的引导教学方式,逐渐深入,使学生在讨论和练习中完成本节课的教学任务,既使学生参与到教学中,又体现了学生是学习的主体,适应新课改的要求,达到课堂教学高效率。
再通过对题目中涉及的知识点进行归纳,使知识网络化,系统化。
【教学方法】方法:探索法、比较归纳法、讲练结合手段: “分组讨论、电脑辅助教学” 教学中,把学生分成小组讨论学习。
讨论时,既可以是同学间互相讨论,提出方案,发现问题,还可以通过师生互动发现问题解决问题。
【教学过程】【多媒体展示】考试说明要求①掌握铝及其化合物的性质、制法和重要应用;②了解铝及其化合物的相互转化关系。
设计意图:让学生明确本节课所要掌握的内容,了解本节在高考中的重要性。
引起学生对本节的重视,有利于集中学生上课的注意力。
一.铝的化学性质①与非金属反应:②与碱反应③与酸反应④铝热反应二.铝的重要化合物1.Al2O3(两性氧化物)Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O 2.Al2O3(两性氧化物Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2OAl(OH)3+NaOH=NaAlO2+2H2O Al(OH)3+OH-=AlO2-+2H2O 3.化合物相互转化【教学反思】在本节课的设计中,在引课时,从生活经验出发,立足于学生已有的认知,激发学生的认知矛盾。
高考重点知识—铝及其重要化合物

高考重点知识—铝及其重要化合物铝、镁的性质及应用1.铝的性质⑴铝的结构和存在:铝位于元素周期表第三周期ⅢA 族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
⑵金属铝的物理性质:银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
⑶金属铝的化学性质①4Al +3O 2=====△2Al 2O 3 ;②2Al +Fe 2O 32Fe +Al 2O 3③2Al +6H +===2Al 3++3H 2↑④2Al +2OH -+2H 2O===2AlO -2+3H 2↑⑷铝的用途:纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
⑸对比记忆镁的化学性质铝"镁与非金属反应 能被Cl 2、O 2氧化 2Mg +O 22MgO 3Mg +N 2Mg 3N 2与水反应 反应很困难能与沸水反应 Mg +2H 2OMg(OH)2+H 2↑ 与碱反应%能溶于强碱溶液不反应与某些氧化物反应能与Fe 2O 3、MnO 2、Cr 2O 3等金属氧化物发生铝热反应能在CO 2中燃烧:2Mg +CO 22MgO +C2.铝与酸或碱反应生成H 2的量的关系2Al +6HCl===2AlCl 3+3H 2↑ 2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑ (1)等质量的铝与足量的盐酸、氢氧化钠溶液分别反应::①产生H 2的物质的量相等; ②消耗H +、OH -的物质的量之比为n (H +)∶n (OH -)=3∶1。
(2)足量的铝分别与等物质的量的HCl 和NaOH 反应:①消耗Al 的物质的量之比为1∶3; ②生成H 2的物质的量之比为1∶3。
(3)一定量的铝分别与一定量的盐酸、氢氧化钠溶液反应:若产生氢气的体积比为13<V HCl H 2V NaOHH 2<1,则必定 ①铝与盐酸反应时,铝过量而HCl 不足; ②铝与氢氧化钠溶液反应时,铝不足而NaOH 过量。
铝的化合物及图像讲解

Al2(SO4)3 +6NaOH=2Al(OH)3↓ +3Na2SO4
Al(OH)3+NaOH=Na[Al(OH)4]
Al2(SO4)3 +6NH3· H2O= 2Al(OH)3↓+3(NH4) 2SO4
Al2(SO4)3与NaOH、NH3· H2O均可反应生成Al(OH)3↓,
Al(OH)3溶于强碱而不溶于弱碱,所以应该用氨水 制取。
3[Al(OH)4]- + Al3+ == 4Al(OH)3
小结:Al3+与碱、 [Al(OH)4]-与酸的反应
AlCl3中逐滴加入NaOH?
AlCl3中逐滴加入氨水?
Al3++3NH3.H2O=Al(OH)3 ↓+3NH4+ 故:用Al3+制取Al(OH)3用弱碱更合适
Na [Al(OH)4]中逐滴加入盐酸? Na [Al(OH)4]中缓慢通入CO2?
练习2
1989年世界卫生组织把铝确定为食品污染源 之一,应加以控制使用。铝在下列应用时应 加以控制的是: ①制铝合金 ②制电线 ③制炊具 ④ 用氢氧化铝凝胶胃舒平药品 ⑤ 银色漆颜料 ⑥ 易拉罐 ⑦ 包装糖果和小食品 ( D) A、全部 B、③ ④ ⑦ C、③⑤ ⑥ D、③ ④ ⑥ ⑦
(4)氢氧化铝实验室制法
3
1
1
2
3
4
n(HCl)
6.往AlCl3溶液中加入Na [Al(OH)4]溶液 Al3+ + 3 [Al(OH)4]- = 4Al(OH)3↓
4
n[Al(OH) ] ↓
3
1
2
3
4
n(Na [Al(OH)4] )
7.往Na[Al(OH)4]溶液中加入AlCl3溶液 Al3+ + 3[Al(OH)4]- = 4Al(OH)3↓
2020届高考化学二轮复习教师用书:第6讲 金属及其化合物
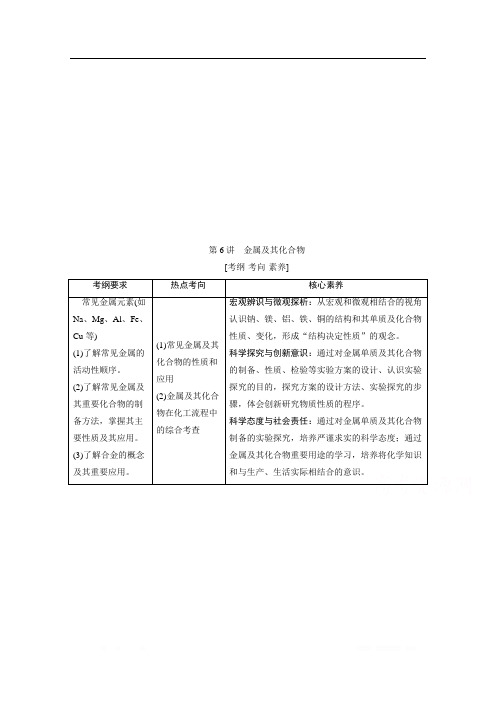
第6讲金属及其化合物[考纲·考向·素养]考纲要求热点考向核心素养常见金属元素(如Na、Mg、Al、Fe、Cu等)(1)了解常见金属的活动性顺序。
(2)了解常见金属及其重要化合物的制备方法,掌握其主要性质及其应用。
(3)了解合金的概念及其重要应用。
(1)常见金属及其化合物的性质和应用(2)金属及其化合物在化工流程中的综合考查宏观辨识与微观探析:从宏观和微观相结合的视角认识钠、镁、铝、铁、铜的结构和其单质及化合物性质、变化,形成“结构决定性质”的观念。
科学探究与创新意识:通过对金属单质及其化合物的制备、性质、检验等实验方案的设计、认识实验探究的目的,探究方案的设计方法、实验探究的步骤,体会创新研究物质性质的程序。
科学态度与社会责任:通过对金属单质及其化合物制备的实验探究,培养严谨求实的科学态度;通过金属及其化合物重要用途的学习,培养将化学知识和与生产、生活实际相结合的意识。
1.一念对错(正确的划“√”,错误的划“×”)(1)(2019·全国ⅡT11C改编)Na2O2在空气中放置后由淡黄色变为白色的原因为2Na2O2===2Na2O+O2↑(×)(2)(2019·全国ⅡT10B改编)将镁条点燃后迅速伸入集满CO2的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生(√)(3)(2019·全国ⅡT11B改编)澄清的石灰水久置后出现白色固体是因为Ca(OH)2+CO2===CaCO3↓+H2O(√)(4)氢氧化铝具有弱碱性,可用于制胃酸中和剂(√)(5)明矾溶于水能形成胶体,可用于自来水的杀菌消毒(×)(6)Fe2O3是红棕色粉末,Fe2O3常用作红色涂料(√)(7)MgO的熔点很高,可用于制作耐高温材料(√)(8)钠钾合金通常状况下呈液态,可做原子反应堆的导热剂(√)(9)Al2O3和MgO均可与NaOH溶液反应(×)(10)FeCl3、Na2O2、CuO均可由相应单质直接化合生成(√)(11)一定条件下,镁能与一些非金属氧化物反应,铝能与一些金属氧化物反应(√)(12)Na2O2与CO2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2(×)(13)金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步进行(×)(14)为鉴别Na2CO3和NaHCO3两种白色固体,通过在这两种物质的溶液中,加入少量澄清的石灰水进行。
铝及其化合物知识点

△ 点燃△ 铝 及 其 化 合 物一、铝得结构:1、原子结构示意图:2、周期表中位置:第三周期ⅢA族镁原子核外有三个电子,在化学反应中,容易失去最外层得三个电子,显+3价。
二、铝单质得性质1、物理性质:银白色金属,硬度与密度小,具有良好得导电导热性与延展性。
在空气中具有很好得耐腐蚀性。
2、化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2Al Cl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4A l+3O 2 ========= 2Al 2O 3思考:在金属活泼性顺序中铝排在铁得前面,那为什么铁在空气中易生锈而铝在空气中不易被腐蚀呢?铝与空气中得氧气反应生成致密得氧化膜并牢固地覆盖在铝表面,阻止了内部得铝与空气接触。
(2)与盐溶液反应:2A l+3CuSO 4 =3Cu +Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + F e2O 3 == 2Fe + Al 2O3铝热剂[现象]:发出耀眼得光芒、放出大量得热、有熔融物生成。
[试一试]:写出Al 分别与M nO2 、V 2O5 得反应方程式(4)与沸水微弱反应:2Al+6H 2O ========= 2A l(OH)3 + 3H 2↑(5)与酸反应::2A l+6HCl ====== 2AlCl 3+H2↑2A l+3H 2S O4 ====== Al 2(SO 4)3+ 3H 2↑注意:铝在冷得浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密得氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应:2Al+2NaOH +2H 2O=2NaAlO 2+3H 2↑ 反应得实质:分两步进行:(2)A l(OH)3+NaOH ======== NaAl O2+2H 2O化合价降低,被还原,得6e —(1)化合价升高,被氧化,失6e —+4H 2O—得6×e —三、铝得重要化合物1、氧化铝(Al2O3)(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
高中化学铝及其重要化合物35页PPT
21、没有人陪你走一辈子,所以你要 适应孤 独,没 有人会 帮你一 辈子, 所以你 要奋斗 一生。 22、当眼泪流尽的时候,留下的应该 是坚强 。 23、要改变命运,首先改变自己。
24、勇气很有理由被当作人类德性之 首,因 为这种 德性保 证了所 有其余 的德性 。--温 斯顿. 丘吉尔 。 25、梯子的梯阶从来不是用来搁脚的 ,它只 是让人 们的脚 放上一 段时间 ,以便 让别一 只脚能 够再往 上登。
பைடு நூலகம்
1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、有勇气承担命运这才是英雄好汉。——黑塞 4、与肝胆人共事,无字句处读书。——周恩来 5、阅读使人充实,会谈使人敏捷,写作使人精确。——培根
铝及铝的化合物一轮复习
(2)当 n[KAl(SO4)2]∶n[Ba(OH)2]=1∶2 时,铝元素的 存在形式是什么?
提示 铝元素的存在形式是AlO-2:KAl(SO4)2
+2Ba(OH)2===KAlO2+2BaSO4↓+2H2O。
考点精讲
考点一 铝与强酸、强碱的反应 1.等质量的两份铝分别与足量的盐酸、 氢氧化钠溶液反应,所得 H2 的体积之比是多 少?为什么?
4.8,2.7 8mol/L
应用Ⅱ
铝元素在溶液中的存在形式的判断
观察方程式可知:找到恰好完全反应的两个点
①Al3++3OH-=Al(OH)3 ②Al3++4OH-= AlO2-+2H2O
a mol b mol
Al(OH)3 AlO2-
Al(OH)3 和Al3+ ○
Al(OH)3 和AlO2
○
AlO2-
铝及其化合物
思考 4
学案部分
向明矾溶液中逐滴加入 Ba(OH)2 溶液,
(1)当 n[KAl(SO4)2]:n[Ba(OH)2]=2∶3 时,铝元 素的存在形式是什么? 提示 铝元素的存在形式是Al(OH)3:
2KAl(SO4)2+3Ba(OH)2===2Al(OH)3↓+ 3BaSO4↓+K2SO4。
⑵铝的特性——与碱的反应
化学方程式: 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 离子方程式: 2Al+2OH-+2H2O===2AlO2-+3H2↑
反应的实质分析: 该反应的氧化剂是什么?
2Al +6H2O=== 2Al(OH)3+3H2 ↑ Al(OH)3+OH-===AlO2-+2H2O
4Al+3O2
2Al2O3
问题:铝是活泼金属,为什 么铝制品却有非常广泛的用途?
铝及其化合物知识点讲解共82页文档
•
30、风俗可以造就法律,也可以废除 法律。 ——塞·约翰逊
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
铝及其化合物知识点讲解
•
26、我们像鹰一样,生来就是自由的 ,但是 为了生 存,我 们不得 不为自 己编织 一个笼 子,然 后把自 己关在 里面。 ——博 莱索
•
27、法律如果不讲道理,即使延续时 间再长 ,也还 是没有 制约力 的。— —爱·科 克
•
28、好法律是由坏风俗创造出来的。 ——马 克罗维 乌斯
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
45、自己的饭量自己知道。——苏联
高考化学总复习 :铝及其化合物(68张PPT)
离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH+4 。
人教版化学
第二节 铝及其化合物
回
提
扣
升
主
干
3.明矾及其净水原理
学 科
知 识
明矾的化学式为 KAl(SO4)2·12H2O ,其净水的
素 养
突 原理用离子方程式表示
演
破 核
为 Al3++3H2O Al(OH)3(胶体)+3H+ 。
知
素
识 促进的反应,且 S2-与 ClO-之间能发生氧化还原反应;C 养
突 项中各离子在酸性条件下能大量共存;D 项,在碱性溶液 演
破
练
核 心
中 NH+4 、Mg2+不能大量存在,在酸性溶液中,不能产生
知 能
要 点
H2。
检 测
答案:C
人教版化学
第二节 铝及其化合物
3.为确定某铝热剂(含氧化铁和铝)的组成,分别进行下
回 (1)化学性质:
扣 主 干 知 识
突
破
核
心
要 点
(2)制备方法:
提
升
Al(OH)3+OH-===AlO-2 +2H2O
学 科
素
养
Al(OH)3+3H+===Al3++3H2O 演
△ 2Al(OH)3=====Al2O3+3H2O
练 知 能
检
测
常用铝盐[如 Al2(SO4)3]溶液与氨水反应制备 Al(OH)3,
识
C.硝酸铜
D.氢氧化钠
素 养
突
解析:钝化的实质是浓H2SO4或浓HNO3在Fe、Al的 演
破
表面形成了一层致密的氧化物保护膜。由于铝的氧 练
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
七宗七宗““最”第六讲
金属之铝及其化合物
ⅠAⅡA○
一ⅢAⅣAⅤAⅥAⅦA
二
B
三Al
四
Ga
五
In
六
Tl
七
★★★★★★★★★★★★★★★★★★★★★★★★★★★★★★★★★★★★★★★
重要思维导图
1、两性性质分析
氧化铝的两性
氢氧化铝的两性
铝的两性
铝在溶液中的存在形式与明矾与氢氧化钡反应问题以及双水解进行到底
2、铝与金属冶炼以及氯碱工业
金属冶炼
氯碱工业
3、净水与结晶时是否得到原物质的判断
