脂质体制备方法
脂质体的制备方法

脂质体的制备方法脂质体是一种在生物医学领域中具有广泛应用前景的载体,它可以用于药物传递、基因治疗等方面。
脂质体的制备方法有多种,下面将介绍其中常用的几种方法。
首先,膜溶解法是一种常见的脂质体制备方法。
在这种方法中,磷脂溶解在有机溶剂中,然后将水相缓慢注入有机相中,通过超声或搅拌等手段使两相混合,形成脂质体。
这种方法制备的脂质体粒径分布较窄,适用于一些需要较为均匀粒径的应用。
其次,薄膜水合法也是一种常用的脂质体制备方法。
在这种方法中,磷脂溶解在有机溶剂中,然后将溶液旋转蒸发,形成薄膜,最后通过加入适量的缓冲液使薄膜迅速水合膨胀,形成脂质体。
这种方法制备的脂质体结构较为稳定,适用于一些需要长期保存的应用。
另外,脂质体凝胶法也是一种常见的制备方法。
在这种方法中,磷脂和胆固醇混合后,加入溶剂并加热,形成透明的溶液,然后冷却形成凝胶,最后通过加入缓冲液使凝胶水合膨胀,形成脂质体。
这种方法制备的脂质体具有较高的稳定性和载药量,适用于一些需要长期保存和高载药量的应用。
最后,脂质体膜内溶解法也是一种常用的制备方法。
在这种方法中,磷脂和胆固醇混合后,在有机溶剂中形成薄膜,然后将药物溶解在内水相中,最后将内水相缓慢注入有机相中,通过超声或搅拌等手段使两相混合,形成脂质体。
这种方法制备的脂质体可以实现药物的高效载荷,适用于一些需要高效载药的应用。
综上所述,脂质体的制备方法有多种,每种方法都有其适用的场景和特点。
在选择制备方法时,需要根据具体的应用要求和实验条件进行综合考虑,以选择最适合的制备方法。
希望本文介绍的内容能对脂质体的制备方法有所帮助。
脂质体的制备方法

脂质体的制备方法
脂质体是一种由磷脂类物质构成的微小球形结构,可以用来包封各种水溶性和不溶性的药物。
以下是制备脂质体的一般方法,不包含标题及重复文字。
1. 选择适当的脂质组分:按照需要包封的药物性质(如极性、脂溶性)选择相应的磷脂类物质,常用的有磷脂酰胆碱(PC)、磷脂酰甘油(PG)、磷脂酰丝氨酸(PS)等。
2. 选择合适的方法:制备脂质体的常用方法有薄膜法、乳化法、脂肪酸分散法等。
根据药物特性和制备要求选择合适的方法。
3. 薄膜法制备脂质体:将L-α-磷脂酰胆碱和药物以适当比例
溶解于有机溶剂中(如氯仿),用旋转蒸发器除去溶剂,形成薄膜。
加入适量水溶液,通过超声波处理或机械震荡破碎薄膜,生成脂质体悬浮液。
4. 乳化法制备脂质体:将磷脂、药物和辅助乳化剂(如表面活性剂)溶解于有机溶剂中。
将该溶液滴加到含有乳化剂的水相中,并用机械手段(如超声波)进行乳化处理,形成脂质体。
5. 脂肪酸分散法制备脂质体:将药物与脂肪酸(如硬脂酸)按一定比例共熔,然后迅速冷却。
通过乳化剂或超声波等方法将该混合物乳化成脂质体。
6. 脂质体的后处理:根据需要可以对脂质体进行一些后处理步骤,如冻干、冻融法提高脂质体稳定性等。
综上所述,脂质体的制备方法可以根据实际需求选择薄膜法、乳化法或脂肪酸分散法。
制备时要选择适当的脂质组分,并根据需要进行后处理以提高脂质体的稳定性。
脂质体的制备及其应用

脂质体的制备及其应用近年来,脂质体在制药领域里展现出了广阔的应用前景。
从初期的制备到现在的技术逐渐成熟,脂质体已经成为制药工业中最热门的制剂载体之一。
本文将介绍脂质体的制备及其应用。
一、脂质体的制备1. 胆固醇和磷脂共混法该制备法是最早的脂质体制备方法之一,实现较为简单。
只需将胆固醇和磷脂以特定比例共混,并使用水或其他溶剂进行溶解,即可制备出脂质体。
2. 薄膜法该制备法是制备脂质体的另一种常见方法。
将磷脂及其他组份按一定比例混合,并在热水浴中加热搅拌,并持续将其挤压,形成薄膜,薄膜会自行聚集形成脂质体。
3. 超声波法该制备法利用超声波的力量将水相和油相分散均匀,从而形成脂质体。
简单易行且可重复性良好,所以是制备脂质体最常用的方法之一。
二、脂质体的应用1. 药物传递脂质体是一种非常好的药物传递载体,由于其构成和细胞膜相似,因此可有效载药物,并快速进入人体细胞。
脂质体还可以用于治疗肿瘤和炎症。
2. 增强药物传递的稳定性很多药物容易被分解,但是通过使用脂质体,这些药物可以被稳定传递,并防止药物在消化过程中被分解。
对于某些对稳定性要求极高的药物,如RNA、DNA和酶,脂质体的应用显得尤为重要。
3. 疫苗传递最近几年,脂质体在疫苗传递方面展现出自己的优势。
将疫苗包裹在脂质体中,可呈现出更好的抗原肽处理,并取得良好的抗体反应。
这让脂质体成为了一种非常良好的疫苗传递载体。
4. 脂质体在饮食保健品中的应用还有一些饮食保健品在其制备过程中也可以使用脂质体。
例如,脂质体可用于保护鱼油或其他有益成分的品质和稳定性,并让它们更方便地传递到人体内。
总的来说,脂质体已成为制药工业中不可或缺的一部分,并在医药、食品及化妆品等领域发挥着重要作用。
脂质体的制备方法也在不断更新,未来必将有更多的应用领域,为人类健康和生活发挥更大的作用。
脂质体制备工艺流程

脂质体制备工艺流程脂质体是一种由磷脂和胆固醇等成分组成的小型纳米载体,具有良好的生物相容性和生物可降解性。
脂质体在药物递送和基因治疗方面具有广泛的应用前景。
下面将重点介绍脂质体的制备工艺流程。
一、磷脂选择脂质体的制备以磷脂为主要原料,常用的磷脂有卵磷脂、磷脂酰胆碱、磷脂酰丝氨酸等。
选择适合的磷脂是制备高质量脂质体的重要因素。
二、制备方法1. 薄膜分散法将磷脂溶解在有机溶剂中制备成薄膜,再加入药物或基因,利用机械或超声分散制备脂质体。
该法制备的脂质体颗粒分布比较均匀,适合制备小型脂质体。
2. 溶剂挥发法将磷脂溶解在有机溶剂中,加入药物或基因,通过挥发有机溶剂制备脂质体。
该法可以制备大量的脂质体,但颗粒大小分布不如薄膜分散法。
3. 冻干法将磷脂溶解在水相中,加入药物或基因,通过冻干、再溶解、超声或机械处理制备脂质体。
该法制备的脂质体稳定性较好,适合制备高含药量的脂质体。
三、性质调节为了满足不同的应用需求,可以通过改变脂质体的表面性质、大小、药物包载量和脂质组分来调节脂质体的性质。
常用的方法有加入表面活性剂、多肽等改变脂质体表面性质,改变磷脂组分、添加胆固醇等调节脂质体结构和稳定性。
四、质量检测在脂质体制备过程中,应注意生产环境的净化和卫生,保证脂质体的质量安全。
脂质体质量的检测方法包括颗粒大小、分布、多分散性、药物包载量、稳定性等方面的指标测定。
综上所述,脂质体的制备工艺包括磷脂选择、制备方法、性质调节和质量检测。
通过合理选择磷脂和制备方法以及进行性质调节和质量检测,可以得到性质稳定、药物包载量高的高质量脂质体,为药物递送和基因治疗等领域提供了广阔的应用前景。
脂质体制备
脂质体的制备方法
一、试剂、器材
主要试剂:
SPAN80
聚乙烯醇1750士50
天然大豆磷脂LIPoid s100
胆固醇
无水乙醚氯仿
TWEEN80
主要仪器:
AB204一N电子天平
MICROCOMPUTERPH/MV/TEMPMODEL
6171型pH计
R一201旋转蒸发仪
JY-92一H超声波细胞粉碎机(探头式超声仪)
KQ一100E型超声波清洗仪
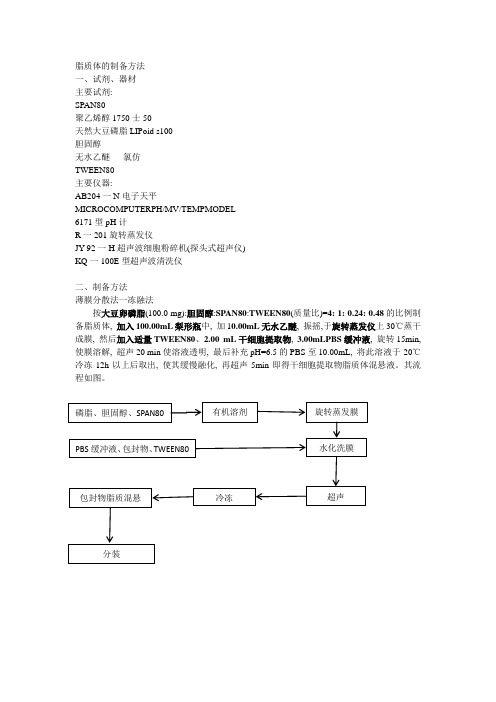
二、制备方法
薄膜分散法一冻融法
按大豆卵磷脂(100.0mg):胆固醇:SPAN80:TWEEN80(质量比)=4:1:0.24:0.48的比例制备脂质体,加入100.00mL梨形瓶中,加10.00mL无水乙醚,振摇,于旋转蒸发仪上30℃蒸干成膜,然后加入适量TWEEN80、2.00mL干细胞提取物,3.00mLPBS缓冲液,旋转15min,使膜溶解,超声20min使溶液透明,最后补充pH=6.5的PBS至10.00mL,将此溶液于-20℃冷冻12h以上后取出,使其缓慢融化,再超声5min即得干细胞提取物脂质体混悬液。
其流程如图。
脂质体制备的方法

脂质体制备的方法脂质体是一种由脂质分子组成的微细粒子,主要用于制备及输送药物、基因和化妆品成分等。
脂质体具有优异的生物相容性和生物可降解性,并且可以有效稳定和保护被包封的药物或成分。
目前,常用的脂质体制备方法包括薄膜溶解法、乳化法、胶束法、膜断裂法、气相法等。
下面将详细介绍这些方法。
薄膜溶解法是一种利用脂质和溶剂溶解及薄膜形成原理制备脂质体的方法。
首先,选择适当的脂质和溶剂。
常用的脂质有磷脂类(如磷脂酰胆碱、磷脂酰丝氨酸)、脂肪醇(如固体脂肪醇)、脂肪酸等。
常用的溶剂有乙醇、二甲酚、甲醇和酯类溶剂。
然后,将脂质和溶剂溶解在一起,通过快速旋转薄膜机或制备配制机将溶液薄膜扩散到玻璃底板上,在适当的温度和时间下形成脂质质体。
最后,通过超声处理或其他方法将脂质质体分散成脂质体悬浮液。
乳化法是一种利用乳化剂和脂质相互作用生成脂质体的方法。
乳化剂常用的有表面活性剂和共乳剂。
表面活性剂包括非离子型(如Tween系列)和阴离子型(如脂肪酸钠盐)。
共乳剂包括长链脂肪醇(如固体脂肪醇)、糖(如蔗糖、葡萄糖)和胆汁酸类。
首先,将乳化剂和脂质在适当比例下溶解在无水有机溶剂中。
然后,加入水相,通过机械剪切或超声处理将脂质和乳化剂形成乳液。
最后,通过去除有机相或冷冻干燥等方法获得脂质体。
胶束法是一种利用表面活性剂和脂质相互作用形成胶束后制备脂质体的方法。
首先,选择适当的表面活性剂,如磷脂酰胆碱、磷脂酰丝氨酸等。
然后,将表面活性剂溶解在溶剂中,通过搅拌、超声处理等方法形成胶束。
最后,将胶束与药物或成分混合,通过快速稀释或其他方法获得脂质体。
膜断裂法是一种利用高压处理使脂质质体断裂形成脂质体的方法。
首先,通过之前介绍的方法制备脂质质体悬浮液。
然后,将悬浮液经过高压处理,使脂质质体断裂成小颗粒,形成脂质体。
最后,通过超声处理或其他方法除去未断裂的脂质颗粒,获得脂质体。
气相法是一种利用空气或氮气吹淋使脂质溶液蒸发形成脂质体的方法。
脂质体制备工艺流程
脂质体制备工艺流程
脂质体是一种类似于自然界中存在的脂质体的微小粒子,在药物输送中具有广泛的应用。
脂质体制备工艺流程主要包括以下几个环节: 1. 液相制备:首先需要将所需的药物、脂质体原料和乳化剂等
组分按照一定比例加入到水相中。
然后,使用机械搅拌或超声波处理等方法,使其形成一个稳定的乳液。
2. 单步法制备:将脂质体原料和药物共同混合,然后通过乳化
和超声波处理等方式制备脂质体。
3. 反向微乳化法:将脂质体原料和乳化剂,以及反相剂等组分
混合,形成一个稳定的反向微乳液,然后通过添加外相使得脂质体形成。
4. 油水两相法:将脂质体原料和药物溶于有机溶剂中,然后将
其滴加到水相中,形成一个乳液,最终通过去除有机溶剂使得脂质体形成。
脂质体制备的工艺流程具有一定的复杂性,在实际操作中需要根据具体的要求进行选择和调整。
同时,还需要注意稳定性、纯度等方面的问题,以确保制备出的脂质体具有良好的药物输送效果。
- 1 -。
脂质体制备方法
脂质体制备方法
脂质体是一种由脂质构成的微粒,常用于药物传递和基因转染等领域。
常见的脂质体制备方法包括以下几种:
1. 脂质薄膜混悬法(Thin-film hydration method):将脂质和
药物按一定比例溶解在有机溶剂中,制备成薄膜,然后通过加入缓冲溶液或其他溶液来重悬薄膜,形成脂质体。
2. 油水乳化法(Emulsion method):将脂质和药物溶解在水
相和油相中,通过机械剪切或超声波处理使两相乳化,并形成脂质体。
3. 水介质溶解法(Ether injection method):将脂质和药物溶
解在有机溶剂中,然后使用高速搅拌或机械剪切射入水相中,并迅速挥发有机溶剂,使脂质形成粒状结构。
4. 反向脂质体法(Reverse phase evaporation method):将脂质和药物按一定比例混合,加入有机溶剂形成混合体系,然后加入水相,通过振荡或加热使有机溶剂插入水相,形成胶束,最后去除有机溶剂,得到脂质体。
5. 膜片发育法(Lipid film hydration method):将脂质溶解在
有机溶剂中形成薄膜,将溶剂挥发干燥后,加入含有药物的水相,经超声辐照或搅拌使薄膜与水相均匀悬浮,并形成脂质体。
这些方法各有优缺点,选择合适的方法取决于具体应用的要求和物质特性。
药剂学实验脂质体的制备及包封率的测定
06
实验注意事项与改进建议
实验安全注意事项
实验室安全
01
确保实验室通风良好,佩戴适当的防护装备,如实验服、手套
和护目镜。
化学品安全
02
熟悉并遵守所有化学品的安全数据表(SDS)指南,特别注意
有毒、易燃或腐蚀性物质的正确处理和存储。
设备安全
03
正确使用实验设备,遵循制造商的操作指南,确保设备维护和
其他制备方法
复乳法
将药物水溶液与磷脂等膜材制成W/O型乳剂 后,再分散到外水相中形成W/O/W型复乳 ,除去有机溶剂后可得脂质体
熔融法
将磷脂等膜材在高于相变温度条件下熔融成液晶态 ,加入药物溶液进行搅拌,然后冷却固化得到脂质 体
超声波分散法
利用超声波的空化作用将磷脂膜材分散成脂 质体
03
包封率测定原理及方法
02
直至形成稳定的W/O型乳剂,减压蒸发除去有机溶 剂
03
形成脂质体,加入缓冲液,通过凝胶色谱法或超速 离心法除去未包封的药物
注入法
1
将类脂质和脂溶性药物溶于有机溶剂中,然后把 此药液经注射器缓缓注入加热至相变温度以上的 磷酸盐或醋酸盐等缓冲液
2
类脂质排列成整齐的脂质双分子层而形成脂质体
3
该方法可制备粒径较大且粒径分布均匀的脂质体
包封率定义及意义
包封率定义
包封率是指脂质体中药物包裹量与投 药量之比,是评价脂质体制备工艺和 药物包裹效果的重要指标。
包封率意义
高包封率意味着更多的药物被有效地 包裹在脂质体内,有利于提高药物的 稳定性和生物利用度,减少用药剂量 和副作用。
测定原理
分离原理
通过物理或化学方法将脂质体中的游 离药物与包裹药物分离,然后分别测 定两者的含量,计算包封率。
制备脂质体的方法
制备脂质体的方法
脂质体的制备方法大体可以分为液相法和固相法。
(1)液相法:
此方法通常是由磷脂、脂肪酸和蛋白质或其它物质组成的混合溶液形成脂质体,具体操作步骤如下:
①将磷脂和脂肪酸加入微量水中,混合搅拌至完全溶解;
②将蛋白质或其它物质加入上述混合溶液中,再搅拌混合;
③在pH值、温度适宜条件下进行静置,使脂质体形成;
④该混合溶液中的离子性物质会对脂质体的形成产生影响,需要进行离子交换柱净化,去除杂质;
⑤当脂质体形成后,冰箱冷却一段时间,使其固化,最后将其离心收集。
(2)固相法:
此方法的基本原理是将脂质和蛋白质混合,然后用乙醇/水混合物溶解,再加入极性溶剂萃取,使脂质体形成,具体操作步骤如下:
①将磷脂、脂肪酸和蛋白质混合,并加入乙醇/水混合物溶解;
②将溶解后的混合液用真空过滤,去除乙醇;
③加入极性溶剂,使其混合物形成脂质体;
④用离心机将混合物中的脂质体收集,再利用冰箱冷却,使其固化;
⑤最后用溶剂洗脱,去除其余的极性溶剂,即可得到所需的脂质体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2 脂质体的制备方法
2.1 薄膜蒸发法该方法是将脂质及芯材(脂溶性药物)溶于有机溶剂,然后将此溶液置于大圆底烧瓶中,再旋转减压蒸干,磷脂在烧瓶内壁上会形成一层很薄的膜,然后加入一定量的缓冲溶液(生理盐水),充分振荡烧瓶使脂质膜水化脱落,即可制得脂质体。
尽管薄膜分散法是使用最广泛的方法,由于这种方法比较原始,所以尚存在较多缺点。
用该方法制备得到的脂质体的粒径较大且不均匀,为了使其粒径更小、更均匀,可通过超声波仪处理,在一定程度上降低脂质体的粒径,从而提高包封率。
如采用此法制备得到的细辛脑脂质体的包封率达54. 1%[5]。
2.2 超声波法
MLVs的混悬液经超声波处理,再通过 Sepharose 2B或4B柱色谱仪可去除较大的脂质体和
MLVs 。
常用的方法有探针型和水浴型。
小量脂质悬液(高浓度脂质或黏性水溶液)需要高能
量时用探针型。
水浴型更适于大量的稀释脂质。
郑宁等[6]采用薄膜 -超声分散法制备依托泊苷脂质体,按均匀设计的最优组合制备脂质体的平均包封率为(61.58±0.83)% ,粒径均小于2卩m,体外释药达到了长效缓释的作用,60Co灭菌后脂质体较稳定。
李维凤等⑺以薄
膜-超声法和乙醚注入法制备硝苯地平脂质体,结果表明薄膜蒸发法和超声法综合使用,所得脂质体粒径均匀,粒度小,且多为单室。
2.3复乳法(二次乳化法)这种方法是先将脂质溶于有机溶剂,加入待包封芯材的溶液,乳化得到W/O
初乳,其
次将初乳加入到 10 倍体积的水溶液中混合,进一步乳化得到 W/O/W 乳液,然后在一定温度下去除有机溶剂即可得到脂质体,其包封率变化较大,一般为20%-80% 。
通过研究发现,
在第二步乳化过程和有机溶剂的去除过程中, 对脂质体的粒径有较大影响的因素是温度, 较
低的温度有利于减小脂质体的粒径。
姚瑶等[8]采用二次乳化法制备的酪丝亮肽多囊脂质体,
不仅稳定性好,80%的粒径分布在 20-30卩m,且包封率为 92. 43%。
2.4反相蒸发法(逆相蒸发法)反相蒸发法最初由 Szoka 和 Papahadjopoulos 于 1978 年提出, 这
种方法适用于脂质成分中磷脂占有较大的比例, 且芯材中水溶性成分较多的情况。
一般的制备方法是将脂质等膜材料溶于有机溶剂中,加入芯材药物的水溶液经过短时超声振荡形成稳定的W /O 乳液后,减
压蒸发除掉有机溶剂,形成所谓“反相胶团” ,在达到胶态后,滴加缓冲液,旋转蒸发使器壁上的凝胶脱落,然后在减压下继续蒸发,制得水性混悬液, 再除去未包入的芯材,即得到
单层脂质体。
因这种方法可包裹较大的水容积, 所以一般适用于包封水溶性药物、大分子生物活性物质等的情况。
李淑梅等[9]采用逆向蒸发法制备黄芪多糖脂质体,操作简单可行,包
封率为 44. 32%。
2.5 注入法将脂质和芯材溶于水中或者不相溶的有机溶剂中, 然后用微量注射器把有机相均速注射到水相(含水溶性药物)中,搅拌挥发除去有机溶剂,再超声得到脂质体。
此法根据溶剂的不同可分为乙醇注入法和乙醚注入法。
用乙醇注入法制备时若放慢注入速度可制得具有较高包封率的脂质体, 并且乙醇注入法避免了使用有机溶剂。
乙醚注入法制备的脂质体大多为单层脂质体,粒径绝大多数在 2卩m以下,操作过程中温度比较低(40 — 50C),该方法适用于在乙醚中有较好溶解度和对热不稳定的芯材, 通过调节乙醚中不同磷脂的浓度, 可以得到不同粒径且粒径分布均匀的脂质体混悬液。
许洁等[10]采用乙醇注入法制备环孢素 A 脂质体, 包封率高达 87. 09%。
2.6冷冻干燥法
采用低温干燥技术,通过反复包封、冻干和重新融合来实现较高的包封率。
冻干法为提高脂质体储存期的稳定性提供了较好的解决方法,它改变了液态脂质体不稳定和易氧化的缺点,具有工艺稳定、适合于工业化生产、质量易于控制和产品稳定性好等特点。
冻干法存在的问题是 :制备工艺
较复杂,成本相对高。
胥传来等人[11]研究了冷冻 PST 脂质体的制备及其
物理稳定性,表明冻干后的 PST 脂质体总体物理稳定性提高,置于室温下的保质期大大延长。
2.7 冻融法
此法是首先制备包封有芯材的脂质体,然后冷冻。
在快速冷冻过程中,由于冰晶的形成,使形成的脂质体膜破裂,冰晶的片层与破碎的膜同时存在,此状态不稳定,在缓慢融化过程中,暴露出的脂膜互相融合重新形成脂质体。
通过研究发现,冻融法制备的脂质体的包封率最高,但是粒径最大。
反复冻融可以提高脂质体的包封率。
该制备方法适于较大量的生产,尤其对不稳定的药物最适合。
