碱的化学性质实验报告
有关碱的实验报告

有关碱的实验报告实验目的本实验旨在通过实践,探究碱的性质和特点,了解碱的酸碱指示剂、电离度、酸碱反应等方面的知识。
实验材料和仪器- 精密天平- 量筒- 研钵- 滴定管- 酸碱指示剂- 动物实验用品(如动物肝脏等)实验步骤1. 精确称取约5g的氢氧化钠(NaOH)固体在研钵中。
2. 使用量筒准确测量50 mL的蒸馏水并加入到研钵中,用玻璃杯搅拌均匀,使NaOH固体充分溶解。
3. 取一滴定管,滴入几滴酸碱指示剂,如酚酞溶液,用手轻轻摇晃,观察溶液的颜色变化。
4. 同时,使用滴定管将约10 mL的氢氧化钠溶液滴入盛装酸碱指示剂的滴定管中,细心地滴入,直至颜色变化为止。
记录滴定液的滴数,计算出NaOH的浓度。
5. 取少量动物实验用品(如动物肝脏),制备出它的提取液。
6. 将提取液取少量放入一滴定管中,滴入酸碱指示剂,观察溶液的颜色变化和反应。
7. 将提取液剩余部分滴入盛装NaOH溶液中,记录滴量,计算提取液的酸碱度。
实验数据记录与结果1. NaOH固体质量:5g2. NaOH溶液滴定滴数:15滴3. NaOH溶液浓度:0.5 mol/L4. 动物提取液滴定滴数:10滴5. 提取液酸碱度:0.1 mol/L结论与讨论1. 根据实验数据,可以推算出NaOH的溶液浓度为0.5 mol/L。
滴定实验结果显示,15滴NaOH溶液可以中和指示剂的酸碱度。
2. 动物提取液的酸碱度为0.1 mol/L,在酸性环境中加入少量NaOH溶液(15滴)后,可以中和酸度,使液体呈现中性状态。
3. 由于实验条件限制,实验结果可能存在一定的误差。
在实际应用中,应当注意实验环境的准确性和仪器设备的精度,避免引入不确定性因素。
实验总结通过本实验,我们对碱的性质和特点有了更加深入的了解。
通过酸碱指示剂的使用和滴定实验,我们可以准确测定NaOH的浓度,并了解动物提取液的酸碱度。
通过实验过程,加深了我们对碱的认识,提高了实验操作的技能和观察数据的分析能力。
碱的性质

是 生石灰 与水反应生成的,该反应的化学方程 式是 CaO +H2O = Ca(OH)2 。澄清的氢氧化钙水溶 液又称 石灰水 ,常用来检验 二氧化碳 气体,观 察到的现象是 澄清的石灰水变浑浊 ,此反应的化 学方程为
Ca(OH)2+CO2=CaCO3↓+H2O
。
9.完成化学方程式
1.NaOH + SO2 → 2. NaOH + FeCl3 →
3. NaOH +H2SO4 →
4.KOH+( )→ K2CO3+( )
5.HNO3+(
)→ NaNO3+(
)→ CaCl2+(
)
)
6.Ca(OH)2+(
1.盛有盐酸、水、氢氧化钠的三 瓶无色液体,请选用一种试剂 将它们区别。 2.你能否用生石灰制出烧碱?写出有关 的化学方程式。
3、为了证明长期暴露在空气中氢氧化钠溶液已经 部分变质,请分别选用三种不同物质类别的试剂 完成三种实验方案的设计,并填写实验报告。
碱的水溶液有滑腻感。 ⑥把一小撮兔毛放入盛有烧碱溶液的试 管中,加热煮沸后观察现象: 兔毛溶解
(羊毛在碱性条件下易发生水解即 不耐碱)
1、氢氧化钠的个性:
①是一种白色固体; ②易吸收空气中的水分而 潮解; ③极易溶于水,溶解时放 出大量的热; ④水溶液有涩味,有滑腻 感; 在使用氢氧化 钠时必须十分小心, 防止皮肤、衣服被 它腐蚀,更应防止 溅到眼睛里。
⑴只有可溶性碱才能满足以上四条性 质,难溶性碱只能满足一种难溶。
(1)实验室的氢氧化钠应该如何保存?为什么?
实验室氢氧化钠固体必须密封保存,因为氢氧 化钠暴露在空气中,不仅易吸收空气中的水分而 潮解,而且还易跟空气中的二氧化碳反应而变质。 (2)氢氧化钠固体具有易潮解的性质,你觉得在 这方面应有什么用途?而在使用时又应注意什么? 实验室根据氢氧化钠易潮解的性质,常用它做 干燥剂。但氢氧化钠是一种碱性干燥剂,只能干燥 碱性气体 (NH3) 和中性气体 (H2、O2、N2等),不 能干燥酸性气体(如:HCl、CO2、SO2、H2S等)
生物碱实验报告

生物碱实验报告引言:生物碱是一类具有重要生理活性的有机化合物,在医药领域有着广泛的应用价值。
为了进一步了解生物碱的性质和特点,本实验旨在通过提取和分离维生素B12中的生物碱,并通过实验分析其结构和化学性质。
实验方法:1. 提取维生素B12中的生物碱。
首先,将维生素B12溶于无水乙醇,并加入一定量的醋酸,使其充分溶解。
然后,用柱层析法将酸性溶液和正己烷进行分离,得到含有生物碱的正己烷溶液。
2. 生物碱的结构分析。
通过红外光谱仪对提取物进行红外光谱分析,鉴定其功能基团和分子结构。
同时,用质谱仪对提取物进行质谱分析,检测其分子量和分子离子峰,并与已知的生物碱进行对比。
3. 生物碱的化学性质研究。
将提取物转为溴化物,并进行溴化反应,观察其颜色变化和反应产物的性质。
此外,还进行还原反应和氧化反应,以进一步探究生物碱的化学性质和反应行为。
结果与讨论:1. 提取维生素B12中的生物碱。
通过柱层析法和正己烷分离,成功获得了含有生物碱的正己烷溶液。
2. 生物碱的结构分析。
红外光谱分析显示,提取物中存在与生物碱相关的特定吸收峰。
质谱分析结果表明,提取物的分子离子峰与已知的生物碱相吻合,进一步证实了其为生物碱。
3. 生物碱的化学性质研究。
溴化反应的结果显示,提取物在溴化物的作用下产生颜色变化,表明其具有较强的亲电性。
还原反应和氧化反应的实验结果显示,提取物在还原和氧化剂的作用下发生明显的物质转化,说明其具有还原性和氧化性。
结论:通过本实验的提取、分离和分析过程,成功获得了维生素B12中的生物碱,并进一步研究了其结构和化学性质。
实验结果显示,生物碱具有较强的亲电性、还原性和氧化性,为进一步研究生物碱的生理活性和应用奠定了基础。
实验的局限性与改进:本实验所提取的生物碱仅限于维生素B12中的生物碱,对于其他类别的生物碱尚未进行研究。
未来的研究可以进一步扩大样本范围,以获得更全面的生物碱类型和性质。
同时,实验中的确切机理和反应路径还需要进一步研究和验证,以加深对生物碱的理解。
碱金属及其化合物的性质实验报告
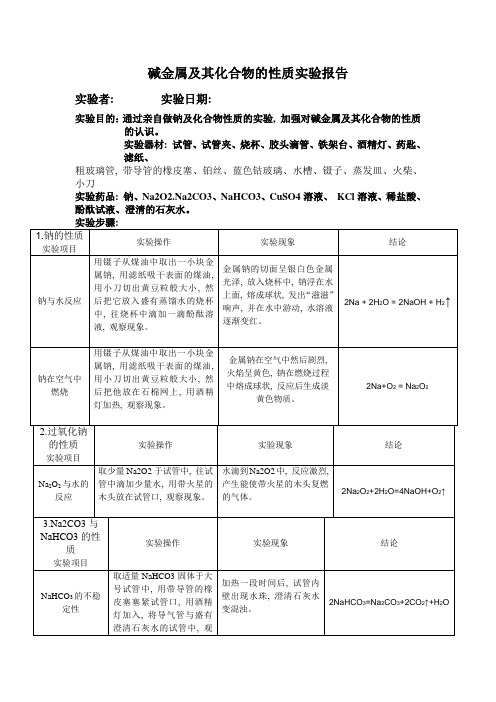
碱金属及其化合物的性质实验报告
实验者: 实验日期:
实验目的:通过亲自做钠及化合物性质的实验, 加强对碱金属及其化合物的性质的认识。
实验器材: 试管、试管夹、烧杯、胶头滴管、铁架台、酒精灯、药匙、
滤纸、
粗玻璃管, 带导管的橡皮塞、铂丝、蓝色钴玻璃、水槽、镊子、蒸发皿、火柴、小刀
实验药品: 钠、Na2O2.Na2CO3、NaHCO3、CuSO4溶液、KCl溶液、稀盐酸、酚酞试液、澄清的石灰水。
实验讨论:
1.在NaHCO3加热分解的实验时, 为什么要先将导管移出烧杯, 然后再熄灭酒精灯?
答: 这样做主要是防止倒流。
2.做好焰色反应的关键是什么?
答: 关键是将铂丝灼烧至无色。
[注意事项]:
1.不要用手直接接触金属钠
2.实验中所取钠块不得超过黄豆粒大小。
碱金属实验报告

碱金属实验报告实验目的:本实验旨在探究碱金属在水中的反应特性及其产生的氢气现象。
器材与试剂:1. 锂金属片2. 钠金属片3. 钾金属片4. 长颈瓶5. 蒸馏水6. 镊子7. 灯泡8. 瓶塞9. 实验室纸10. 夹管实验步骤:1. 将锂金属片放入长颈瓶中,加入适量的蒸馏水,观察其反应现象。
2. 用夹管夹住钠金属片,向瓶中注入适量的蒸馏水,密封瓶口。
3. 将钾金属片放入长颈瓶中,加入蒸馏水,用实验室纸盖住瓶口,迅速插入灯泡,观察灯泡亮起情况。
实验原理:碱金属与水反应产生碱性氢氧化物,并放出氢气。
碱金属越活泼,其与水反应的剧烈程度越大。
在反应中,碱金属的外层电子被水分子接受,形成氢氧化物,同时放出氢气。
实验结果:1. 锂金属与水反应产生氢气,但反应不剧烈,氢气产量较小。
2. 钠金属与水迅速反应,产生大量氢气,反应剧烈。
3. 钾金属与水反应极为激烈,产生大量氢气,使灯泡明亮。
实验结论:碱金属与水反应产生氢气,反应剧烈程度与碱金属的活泼性有关。
锂金属反应温和,钠金属反应剧烈,而钾金属反应最为激烈。
实验结果与碱金属活泼性的活动规律一致。
实验注意事项:1. 实验过程中要小心操作,避免发生意外情况。
2. 实验后要及时清洁实验器材,避免碱金属残留造成损坏。
3. 实验结束后,注意妥善处理实验废液,避免对环境造成污染。
通过本次实验,我们对碱金属在水中的反应特性有了更深入的了解,同时也加深了对反应剧烈程度与活泼性之间的关系。
希望本次实验能够帮助大家更好地理解碱金属的化学性质。
实验6_酸碱的化学性质实验报告

实验6_酸碱的化学性质实验报告一、实验目的1.了解酸碱的化学性质;2.掌握酸碱溶液的鉴别方法。
二、实验原理1.酸的化学性质:酸可以与金属反应产生氢气,与碱反应生成盐和水,与金属碱土金属的氢氧化物反应生成盐和水,与碱式盐反应生成普通盐和水。
2.碱的化学性质:碱可以与酸反应生成盐和水,与酸式盐反应生成普通盐和水。
三、实验设备和试剂1.实验设备:试管、试管架、酒精灯、玻璃棒、滴管等。
2.实验试剂:盐酸、稀硫酸、氢氧化钠、氢氧化钾、氯化钠、硝酸银溶液。
四、实验步骤1.盐酸和氢氧化钠的反应a.取一根盛满氢氧化钠溶液的试管;b.在试管中加入数滴盐酸,观察产生的现象和气体。
2.碳酸氢铵和稀硫酸的反应a.取一根盛满碳酸氢铵溶液的试管;b.在试管中加入数滴稀硫酸,产生的气体通过试管口,倾斜试管观察产生的现象。
3.酸式盐和氢氧化钠的反应a.取一根盛满氢氧化钠溶液的试管;b.在试管中加入数粒酸式盐,观察产生的现象。
4.酸和金属的反应a.取一根盛满盐酸的试管;b.将一块锌片放入试管中,观察产生的气体。
五、实验结果与分析1.盐酸和氢氧化钠的反应a.实验现象:盐酸与氢氧化钠混合后,产生大量气泡,并有气泡从试管口直接飘出。
b.化学方程式:HCl+NaOH→NaCl+H2Oc.结果分析:盐酸与氢氧化钠反应生成盐(氯化钠)和水。
2.碳酸氢铵和稀硫酸的反应a.实验现象:碳酸氢铵与稀硫酸混合后,试管内产生了大量白色气体,并发出刺激性气味。
倾斜试管时,气体滴入湿润的白纸上,使白纸颜色发生变化。
b.化学方程式:NH4HCO3+H2SO4→(NH4)2SO4+CO2+H2Oc.结果分析:碳酸氢铵与稀硫酸反应生成盐(硫酸铵)、二氧化碳和水。
3.酸式盐和氢氧化钠的反应a.实验现象:酸式盐与氢氧化钠混合后,溶液变得中性,即颜色变淡。
b.化学方程式:NaOH+HClO_4→NaClO4+H2Oc.结果分析:酸式盐与氢氧化钠反应生成盐(氯酸钠)和水。
碳酸钠和碳酸氢钠的性质实验报告
碳酸钠和碳酸氢钠的性质实验报告实验报告:碳酸钠和碳酸氢钠的性质一、实验目的:1.了解碳酸钠和碳酸氢钠的化学性质;2.学习通过实验方法鉴别碳酸钠和碳酸氢钠。
二、实验原理:碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)为碱性物质,广泛应用于化学实验和工业生产中。
碳酸钠是白色结晶粉末,易溶于水,在潮湿空气中吸湿;碳酸氢钠也为白色结晶粉末,溶于水,但不易溶于醇类。
本实验通过一系列的实验操作和分析,来鉴别这两种碱性物质。
三、实验步骤:1.鉴别外观:将碳酸钠和碳酸氢钠分别放在两个干燥的试管中,观察外观。
发现两种物质外观相似,都为白色结晶粉末。
2.鉴别溶解性:取两个试管分别加入少量蒸馏水,并用玻璃棒搅拌溶解。
发现碳酸钠完全溶解,而碳酸氢钠溶解度较差,部分悬浮在水中。
3.鉴别酸碱性:将两个试管中分别加入几滴酚酞指示剂。
观察到碳酸钠试管中液体变为橙红色,而碳酸氢钠试管中液体仍为无色。
4.鉴别热分解性:将碳酸钠和碳酸氢钠分别放在干燥的坩埚中,放入烧杯中,使用酒精灯进行加热。
观察到碳酸钠在加热过程中失去结晶水,呈现白色粉末,同时有气泡的产生;碳酸氢钠在加热过程中,产生有臭酸(二氧化碳)气体,同时有气泡的产生。
5.鉴别与酸反应性:将两种试剂单独放入两个试管中,分别加入稀盐酸。
观察到碳酸钠试管中有大量气泡产生,呈现剧烈的反应,而碳酸氢钠试管中气泡较少。
反应后,将两个试管中产生的气体分别用湿润的蓝色红石蕊试纸接触,观察到碳酸钠试管中红石蕊试纸变蓝,而碳酸氢钠试管中无明显变化。
四、实验结果和结论:通过一系列的实验操作和观察,我们得到以下结论:1.碳酸钠和碳酸氢钠在外观上相似,都为白色结晶粉末;2.碳酸钠在水中完全溶解,而碳酸氢钠溶解度较差;3.碳酸钠为碱性物质,碳酸氢钠为中性物质;4.碳酸钠和碳酸氢钠在加热过程中有不同的反应:碳酸钠失水变为白色粉末,碳酸氢钠分解产生臭酸气体;5.碳酸钠与稀盐酸有剧烈的反应,产生大量气泡,而碳酸氢钠反应较为缓慢。
酸碱化学性质实验报告
酸碱化学性质实验报告
实验名称:酸碱化学性质实验报告
实验目的:
1. 掌握常见的酸、碱的性质;
2. 熟悉酸、碱的中和反应;
3. 了解酸碱指示剂的作用。
实验器材:
1.试管、试管夹、移液管;
2.酸、碱、酚酞指示剂、石蕊酸钠、氨水。
实验步骤:
1.取三个试管,标记为试管①、试管②、试管③;
2.试管①中加入少许石蕊酸钠溶液,试管②中加入少许氨水,试管③一般不加任何试剂;
3.向试管①和试管②中滴加酚酞指示剂,直至溶液变色;
4.将试管①、试管②内的溶液互相混合;
5.观察试管③的溶液是否变化,若变化则记录变化现象。
实验结果:
试管①和试管②中加入酚酞指示剂后溶液显红色和黄色,说明
分别为酸性和碱性溶液。
将两个试管中的溶液混合后酚酞指示剂
变色消失,说明酸、碱发生了中和反应,产生了盐和水的物质。
试管③内的溶液未发生变化,说明试管③中未加入任何试剂或试
剂浓度极低。
实验分析:
本次实验展示了酸碱中和反应的基本过程,即酸、碱配合酚酞
指示剂发生颜色变化,混合后指示剂消失,证明两者已发生中和。
同时也证明了酸碱指示剂能够帮助我们判断溶液中酸碱性质的一
种方法。
实验结论:
1. 石蕊酸钠为弱酸,氨水为弱碱,酚酞指示剂分别显示出了红
色和黄色的颜色。
2. 酸、碱混合后发生中和反应,生成水和对应的盐,且酚酞指示剂消失。
3. 试管③未加入任何试剂或浓度极低,未显示出酸、碱性质。
碱的化学性质实验报告
碱的化学性质实验报告实验目的:通过实验观察不同碱的化学性质;掌握不同浓度的碱的稀释方法并测定其饱和溶解度。
实验原理:碱是指在水中能够产生氢氧根离子的化合物。
碱的化学性质表现在中和反应、生成氢氧根离子等方面,且其化学性质的强弱与浓度有关。
实验步骤:1. 实验前准备:分别称取出NaOH、KOH、Ca(OH)2三种碱,测定其质量并记录。
用滴定管加水将每种碱样品分别稀释至0.1mol/L。
2. NaOH的饱和溶解度测定:将NaOH加入100mL的三角瓶中,缓慢加入少量水并充分搅拌,直至NaOH溶解后形成一定浓度的溶液,记录溶解度。
3. 所有碱样品的中和反应:准备3支400mL 锥形瓶,每支装入NaOH、KOH、Ca(OH)2溶液,且每种碱浓度均为0.1mol/L。
加入酚酞指示剂后分别用稀盐酸溶液滴定至中性点(指示剂颜色从红变色至淡黄),记录所需的滴定体积。
4. 三种碱浓度的稀释:由于实验条件所限,只能将NaOH的浓度进行稀释。
必须将NaOH溶液浓度稀至0.01mol/L和0.001mol/L,采用简单的稀释法即可。
5. NaOH、KOH溶液的饱和度测试:将适量的NaOH、KOH加入100mL的三角瓶中并分别加入稀水进行稀释,直到出现微小的固体残留物,停止稀释。
求算其饱和度并记录。
实验结果:1. NaOH、KOH、Ca(OH)2的质量分别为30g、25g、50g。
2. NaOH饱和溶解度:1.2mol/L。
3. NaOH中和反应:20.1 mL;KOH中和反应:17.9 mL;Ca(OH)2中和反应:40.5 mL。
4. NaOH分别稀释至0.01mol/L和0.001mol/L。
5. NaOH的饱和度为0.8mol/L,KOH的饱和度为0.9mol/L。
实验分析:由于NaOH溶解度比较高,中和反应时需要耐心地加入滴定液,以免误差产生。
NaOH和KOH的饱和度相差不大,Ca(OH)2的饱和度明显较低。
稀释时应注意稀释液量的大小,以提高测量的准确性。
化学实验报告单(探究酸和碱的化学性质)
【实验过程】(实验步骤、记录、数据、分析)
实验步骤:(1)在洁净的点滴板上分别低价5~6滴稀盐酸、稀硫酸、白醋、果汁和自来水。然后向这4种液体中分别滴加1~2滴石蕊试液、观察溶液颜色变化情况。
(2)将石蕊试液换成酚酞试液,重复上述实验。观察溶液颜色变化情况。
(3)在干燥、洁净的白瓷板上放4片pH试纸,用玻璃棒分别蘸取4种待测液体,滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,读出溶液的pH值。
(4)将上述待测液换成氢氧化钠、氢氧化钙、肥皂水、蔗糖水,重复上述实验。
实验现象:
(1)(2)
(3)pH=
教师签名:
实验报告单
实验名称
实验日期
班级__________________________第____组
姓名_________________
实验概述:
【实验目的】
认识酸、碱的化学通性、学会使用酸碱值指示剂和pH试纸检验溶液得算碱性
【ห้องสมุดไป่ตู้验原理及装置
【实验环境】(实验仪器、药品等)
石蕊试液、酚酞试液、pH试纸;稀盐酸、稀硫酸、氢氧化钠、澄清石灰水;白醋、肥皂水、蔗糖水、自来水、镁条、石灰石、生锈铁钉、2%碳酸钠溶液;试管、烧杯、胶头滴管、点滴板、白瓷板、玻璃棒。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碱的化学性质实验报告
碱的化学性质实验报告
引言:
碱是化学中常见的一类物质,具有碱性溶液和一系列特殊的化学性质。
本实验旨在通过一系列实验操作,探索碱的化学性质,并深入了解其在实际应用中的重要性。
实验一:酸碱中和反应
实验目的:观察酸碱中和反应的现象,探究碱的碱性质。
实验步骤:
1. 取一小段红色石蕊试纸,将其分别蘸取于盛有盐酸和氢氧化钠溶液的两个试管中。
2. 观察试纸颜色的变化,并记录下来。
实验结果:
在盛有盐酸的试管中,红色石蕊试纸变为蓝色;而在盛有氢氧化钠溶液的试管中,红色石蕊试纸变为绿色。
实验分析:
根据实验结果,我们可以得出结论:盐酸是一种酸性物质,而氢氧化钠是一种碱性物质。
当酸和碱反应时,会产生中和反应,生成盐和水。
这一实验结果验证了碱的碱性质。
实验二:碱的酸中和能力
实验目的:比较不同碱的酸中和能力。
实验步骤:
1. 取三个试管,分别盛有盐酸溶液。
2. 向每个试管中加入少量氢氧化钠、氢氧化钙和氢氧化钾溶液。
3. 观察并记录下每个试管中溶液的颜色和现象。
实验结果:
在氢氧化钠溶液中,盐酸完全中和,溶液呈中性,无明显变化。
在氢氧化钙溶液中,盐酸中和较为缓慢,溶液呈微酸性,有少量气泡产生。
在氢氧化钾溶液中,盐酸迅速中和,溶液呈碱性,有大量气泡产生。
实验分析:
根据实验结果,我们可以得出结论:不同碱的酸中和能力存在差异。
氢氧化钠具有较强的酸中和能力,而氢氧化钙和氢氧化钾的酸中和能力相对较弱。
这一实验结果揭示了不同碱的化学性质差异。
实验三:碱与金属反应
实验目的:观察碱与金属反应的现象,了解碱的还原性质。
实验步骤:
1. 取一小块钠金属,将其放入盛有水的试管中。
2. 观察并记录下反应过程中的现象。
实验结果:
钠金属与水反应后,产生氢气,并伴有剧烈的气泡和火花。
实验分析:
根据实验结果,我们可以得出结论:碱具有还原性质,可以与金属反应生成相应的金属氢化物。
这一实验结果展示了碱的重要特性,在工业生产和实验室研究中具有广泛的应用。
结论:
通过本次实验,我们深入了解了碱的化学性质。
我们观察到了碱与酸发生中和反应的现象,并比较了不同碱的酸中和能力。
此外,我们还观察到了碱与金属反应的现象,了解了碱的还原性质。
这些实验结果揭示了碱的重要性和应用价值,对于深入了解化学领域中碱的性质具有重要意义。
