高三化学专题训练:物质的组成、性质和分类+化学用语
物质的组成、分类、性质和基本化学用语专题总结

物质的组成、性质变化、分类和基本化学用语专题总结高三 班 姓名知识点一、物质的组成:1.物质的组成关系2.分子、原子、离子的比较微粒概念 构成物质的类别及部分代表物原子化学变化中最小的微粒 1.少数非金属单质:金刚石、晶体硅2.某些非金属化合物:二氧化硅等分子保持物质化学性质的一种微粒1.非金属单质:氧气、氢气、稀有气体等2.非金属氢化物、酸酣、含氧酸、有机物等离子原子失去或得到电子得到的带电的微粒金属氧化物、强碱、大多数盐4.同素异形体与同位素、同系物、同分异构体的区别:离子基团定义 带电的原子或原子团 化学中对原子团和基的总称 区别 带有正电荷或负电荷不带电,为缺电子物质,呈电中性联系 两者通过得失电子可以互相转化实例-OH -2NO-Cl CH 3+-OH -NO 2 -Cl -CH 3知识要点:1.在宏观上,物质由元素组成,已发现组成物质的元素有110多种;在微观上,物质由微粒构成,构成物质的微粒有原子、离子、分子等。
2.分子与原子的区别:分子是保持物质化学性质的最小粒子,在化学反应中可分。
原子是化学变化中的最小粒子,在化学变化中不可分。
3.元素与核素、同位素的区别:元素是指具有相同核电荷数(或质子数)的一类原子的总称。
元素只有种类之分,无数量概念。
核素是具有一定数目的质子和一定数目的中子的一种原子 .同位素是指具有相同质子数和不同中子数的同种元素的不同原子。
元素种类仅由质子数决定,而同位素是由质子数和中子数共同决定。
4.同素异形体——同种元素形成结构不同的单质,如:O2和O3、金刚石和石墨、白磷和红磷。
5.物质的构成微粒:a由分子构成的物质:①非金属单质:如H2、X2、O2、O3、N2、P4、S、C60、稀有气体等②非金属氢化物:如HX、H2O、NH3、H2S等③酸酐:如SO2、CO2、SO3、P2O5、N2O5 等④酸类:如HClO4、HClO、H2SO4、H3PO4、H2SiO3等⑤有机物:如烃类、烃的衍生物、糖类、氨基酸等⑥其它:如NO、N2O4、AlCl3等b由原子直接构成的物质:稀有气体、金刚石、晶体硅、二氧化硅、碳化硅、石墨等;c由阴阳离子构成的物质:绝大多数盐、强碱、低价金属氧化物。
2022年高考化学主干核心知识:专项一物质的组成、性质和分类化学用语

2022年高考化学主干核心知识:专项一物质的组成、性质和分类化学用语【命题趋向】1.高考试题中常用选择题来考查考生对同素异形体、同分异构体、同位素和核素、无机反应和有机反应的分类、化合价、原子结构等差不多概念的明白得程度。
高考中常会以化学学科中的重要概念来考测考生对化学基础概念的明白得和辩折能力。
2.不管是基础型试题依旧能力型试题,问题的答案大多会要求考生用化学方程式、离子方程式、热化学方程式、化学式、结构简式等差不多化学用语来表述答案,每年的高考化学试题的答案中化学用语占有专门大的比例。
能够说,熟练把握化学用语、明白得这类化学用语的含义专门重要。
3.相对原子质量、相对分子质量、物质的量,气体摩尔体积等重要差不多概念,不管是化学概念辩折题依旧化学运算题中必须要用到这些重要概念。
【主干知识整合】一、物质的组成1.物质的组成关系原子、分子、离子差不多上保持化学性质的一种微粒2.分子、原子、离子的比较同系物结构相似,分子组成相差一个或若干个CH2原子团的有机物,互称为同系物有机化合物不同结构相似,官能团类型与数目相同物理性质不同,化学性质相似同分异构体分子式相同、结构不同的化合物互称为同分异构体有机化合物相同不同物理性质不同,化学性质不一定相同二、物质的分类无机化合物的分类1.按组成性质分类:2.按微粒间成键种类分类化合物分为共价化合物如CO2,SiO2和离子化合物如NaCl、NH4Cl3.按能否电离来分类将化合物分为电解质和非电解质,电解质又分为强电解质和弱电解质。
4.胶体的分类:分散剂是液体——液溶胶。
如Al(OH)3胶体,蛋白质胶体(1)按分散剂的状态分分散剂是气体——气溶胶。
如雾、云、烟分散剂是固体——固溶胶。
如烟水晶、有色玻璃。
粒子胶体——胶粒是许多“分子”的集合体。
如Fe(OH)3胶体。
(2)按分散质的粒子分分子胶体——胶粒是高分子。
如淀粉溶胶,蛋白质胶体等。
5.从不同角度对化学反应进行分类及相对应的表示方式三、化学用语 1.四种符号 (1)元素符号:①表示一种元素(宏观上)。
高考化学复习专题限时集训(一) [专题一 物质的组成、分类和化学用语].docx
![高考化学复习专题限时集训(一) [专题一 物质的组成、分类和化学用语].docx](https://img.taocdn.com/s3/m/a4cafd934afe04a1b171de00.png)
高中化学学习材料唐玲出品专题限时集训(一)[专题一物质的组成、分类和化学用语](时间:40分钟)1.下列有关物质组成的说法正确的是( )A.物质均是由分子构成,分子均是由原子构成的B.某物质经测定,只含有一种组成元素,则该物质一定是单质C.碱性氧化物均是金属氧化物,酸性氧化物均是非金属氧化物D.纯净的硫酸是纯净物,而纯净的盐酸是混合物2.下列有关说法错误的是( )A.“人造太阳”原理为21H+31H→42He+10n,该变化不是化学变化B.乙烯与HCl通过加成反应可得氯乙烯C.锌可与稀盐酸、稀硫酸发生置换反应,但不能与稀硝酸发生置换反应D.金刚石的能量比等质量的石墨能量高,通过吸热反应石墨有可能转化为金刚石3.下列各组物质,均是由分子直接构成的化合物的是( )A.NH3、HD、C10H8B.PCl3、CO2、H2SO4C.SO2、SiO2、P2O5D.CCl4、NaCl 、H2O24.下列说法正确的是( )A.“嫦娥”三号使用的碳纤维是一种新型的有机高分子材料B.PM 2.5亦称可入肺颗粒物,比表面积大,能吸附有毒有害物质C.从海水中提取物质都必须通过化学反应才能实现D.煤经过气化和液化等物理变化可转化为清洁燃料5.分类是科学研究的一种重要方法,下列分类中完全正确的是( )条件符合条件的物质或微粒A 混合物空气、食盐水、冰水混合物B 烃CH4、C2H4、CH3ClC 非电解质,水溶液能导电NH3、CO2、SO2D 氢元素的不同核素H、H2、D、T6.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( ) A.海水蒸发制海盐的过程只发生了化学变化B.海水中含有钾元素,只需要经过物理变化就可以得到钾单质C.利用潮汐发电是将化学能转化为电能D.从海水中提取溴单质的过程中,溴元素通常要参与三次氧化还原反应7.下列化学用语表示正确的是( )A.N2分子的电子式:B.中子数为18的氯原子的原子符号:1817ClC.CH4分子的球棍模型:D.HOCH2COOH缩聚物的结构简式:H OCH2COO OH 8.下列有关表示方式中正确的是( )A.18O2-的结构示意图:B.NH3的电子式:H·,·)N,··,H ·,·)H C.乙烯的结构式:CH2===CH2D.乙酸的结构简式:CH3COOH9.下列化学用语使用正确的是( )A.CO2的比例模型:B.乙酸分子的球棍模型:C.甲基的结构简式:CH3D.明矾晶体的化学式:KAl(SO4)210.下列变化中,酸只体现酸性的是( )A.浓硫酸与蔗糖混合B.浓硝酸与铜反应C.稀硫酸与BaCl2溶液混合D.盐酸与Na2CO3溶液混合11.下列事实能说明物质Q一定是纯净物的是 ( )①Q的组成元素只有一种②常压下Q的熔点、沸点分别只有一个确定的值③Q的组成元素有两种,且这两种元素原子个数比是确定的④构成Q的分子只有一种A.②④B.①④C.①②④ D.②③④12.下列有关变化中,一定没有电子转移的是( )A.漂白粉使石蕊试液褪色B.苯使溴水褪色C.需要吸收热量的变化D.铁被浓硫酸钝化13.分别将6滴饱和FeCl3溶液滴加到下列试剂(①5 mL 20 ℃蒸馏水中、②5 mL沸水中并加热至红褐色、③5 mL20 ℃蒸馏水)中,然后再加入适量0.1 mol·L-1的NaOH溶液,下列有关相应分散系的说法中不正确的是( )A.分散质粒子直径:①<②<③B.分散系稳定性:①>②>③C.仅凭观察法就可将①、②、③三种分散系区别开D.向三种分散系中加入酸性AgNO3溶液后只有①中会产生白色沉淀14.类比是重要的学习方法,但不能违背客观实际。
专题1 物质的组成、性质和分类 化学用语
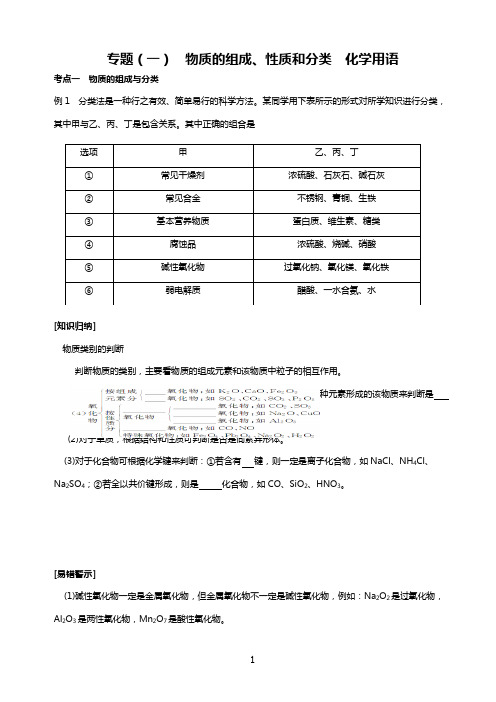
专题(一) 物质的组成、性质和分类 化学用语考点一 物质的组成与分类例1 分类法是一种行之有效、简单易行的科学方法。
某同学用下表所示的形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。
其中正确的组合是[知识归纳]物质类别的判断判断物质的类别,主要看物质的组成元素和该物质中粒子的相互作用。
(1)根据有无固定的组成可判断是 还是 ,再根据是由几种元素形成的该物质来判断是 还是 。
(2)对于单质,根据结构和性质可判断是否是同素异形体。
(3)对于化合物可根据化学键来判断:①若含有 键,则一定是离子化合物,如NaCl 、NH 4Cl 、Na 2SO 4;②若全以共价键形成,则是 化合物,如CO 、SiO 2、HNO 3。
[易错警示](1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,例如:Na 2O 2是过氧化物,Al 2O 3是两性氧化物,Mn 2O 7是酸性氧化物。
(2)酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物,例如:CO 、NO 、NO 2等不是酸性氧化物。
(3)由同种元素组成的物质不一定是单质,也可能属于混合物,如O 2和O 3的混合气体是混合物,只有由同一种元素组成的纯净物才属于单质。
(4)能电离出H +的物质不一定是酸,如NaHSO 4;能电离出OH -的物质不一定是碱,如Mg(OH)Cl ;盐的构成并不一定仅有金属阳离子和酸根阴离子,如铵盐。
(5)非金属元素可形成阳离子,如NH +4;金属元素也可形成阴离子,如AlO -2、MnO -4等。
选项甲 乙、丙、丁 ①常见干燥剂 浓硫酸、石灰石、碱石灰 ②常见合金 不锈钢、青铜、生铁 ③基本营养物质 蛋白质、维生素、糖类 ④腐蚀品 浓硫酸、烧碱、硝酸 ⑤碱性氧化物 过氧化钠、氧化镁、氧化铁 ⑥弱电解质 醋酸、一水合氨、水命题猜想1 近期出版的德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。
高考化学复习 专题一 物质的组成、性质和分类

专题二化学用语化学用语考纲内容常见高考题型(1)熟记并正确书写常见元素的名称、符号、离子符号。
常见的元素的名称、符号、离子符号的书写;特殊离子组成的判断。
(2)熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
根据化合价写分子式;根据组成物质相关元素化合价推断离子电荷;根据组成求未知元素的化合价。
(3)掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
常见物质电子式、原子结构示意图、分子式、结构式和结构简式;由分子式写电子式、结构式和结构简式。
(4)理解质量守恒定律的含义。
掌握热化学方程式的含义。
能正确书写化学方程式、热化学方程式、电离方程式、离子方程式、电极反应式。
化学计算或配平中质量守恒定律的应用;化学方程式、电离方程式、离子方程式、电极反应式的书写及正误的判断。
一、表示物质基本组成的化学式1、元素符号(1)定义用来表示元素的特有符号;通常由一个字母的大写英文字母,或一个大写个英文字母和一个小写英文组成。
如:H、N、Na、Al。
(2)意义:表示一种元素,表示这种元素的一个原子,计算时可表示这种元素的原子量。
(3)书写:书写时应注意:分清大小写,不要连写,字母在小写时要书写到位。
最易出错的符号如:Ca、Cu等。
(4)掌握:常见元素和所有主族元素的元素名称和元素符号,以及常见的离子符号。
2、原子结构示意图(离子结构示意图)(1)定义:用来表示原子核、核内质子数和核外电子排布的原子结构图。
如氖原子结构示意图:(2)意义:表示原子核核内核电荷数(质子数)和核外电子排布。
(3)掌握:常见主族元素的原子和离子结构示意图。
3、离子符号在元素符号(或原子团)右上角表示出离子所带正、负电荷数的符号。
如:H+、F-、Ca2+、OH-、SO42-等,注意离子的电荷与元素的化合价的区别。
二、表示物质组成和结构的化学用语1、电子式(1)概念在元素符号周围用“·”、“×”表示其最外层电子数的式子叫电子式。
高三二轮专题复习--- 物质的组成、性质、分类与化学用语

专题4 《物质的组成、性质、分类与化学用语》预习学案班级姓名学号命、审:王圣妮宋焕刚【考纲要求】1.了解分子、原子、离子等概念的含义。
2.理解物理变化与化学变化的区别与联系。
3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。
4.理解酸、碱、盐、氧化物的概念及其相互联系。
5.了解溶液的含义,了解胶体是一种常见的分散系。
6.熟记并正确书写常见元素的名称、符号、离子符号,熟悉常见元素的化合价。
7.了解原子结构示意图、分子式、结构简式的表示方法。
【考查形式】在选择题中主要以物质组成和分类的概念为出发点,以反映重大科技成果和人们普遍关注的社会问题为切入点,将有关物质组成、分类的概念与化学用语及物质结构融合于试题之中。
预测2013年高考题命题,试题仍应主要以选择题的形式出现,侧重概念的类比与辨析,突出对要领的准确理解与正确应用能力的考查。
【过程与方法】应关注以下考点:①酸、碱、盐、氧化物之间的联系;②化学用语的正误判断;③根据分散质粒子的大小能判断分散系的种类;④以无机物知识为载体来考查常见物质的类别判断、物质的分类与转化,并形成科学、技术、社会相互联系的基本观点。
【重点知识整合】知识点1 物质的组成和分类1.物质的组成2.物质的分类【练习1】下列关于物质分类或归类正确的是()A.混合物:盐酸、漂白粉、水玻璃、水银B.化合物:CaCl2、NaOH、HCl、HDC.同素异形体:C60、C70、金刚石、石墨D.天然高分子化合物:淀粉、纤维素、蛋白质、油脂【归纳总结】1.分类是研究物质性质的基本方法,分类的依据有多种,同一种物质可能属于多个类别,例如:Na2CO3可以是钠盐、碳酸盐、强碱弱酸盐等。
2.碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Na2O2是过氧化物,Al2O3是两性氧化物,Mn2O7是酸性氧化物。
3.酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物,如CO、NO、NO2等不是酸性氧化物。
高考化学专题分类练习专题1 物质的组成、分类、变化及化学用语
专题1 物质的组成、分类、变化及化学用语1(2015·湖南省五市十校3月模拟)右图为雾霾的主要成分示意图。
下列说法不正确的是A.重金属离子可导致蛋白质变性B.苯是最简单的芳香烃C.SO2和NOy都属于酸性氧化物D.汽车尾气的大量排放是造成雾霾天气的人为因素之一答案:C解析:氮的氧化物中NO为不成盐氧化物,C项错误。
2(2015·福建省漳州市3月质检)下列对化学知识的认识正确的是A.H2与T2互为同位素B.氯化铵、氯化银都属于强电解质C.离子化合物中一定不含共价键D.SO2、CO均属于酸性氧化物答案:B解析:H2和T2是氢气单质,二者不是同位素关系,A项错误;离子化合物如NaOH、Na2O2、Na2SO4等均含有共价键,C项错误;CO是不成盐氧化物,D项错误。
3(2015·山东省泰安市一模)下列说法正确的是A.石油的分馏、煤的干馏、电解质溶液导电均属于物理变化B.钢铁生锈主要发生吸氧腐蚀,镀锌铁皮镀层破损后对铁失去保护作用C.14C与12C互称同位素;O2与O3是氧元素的同素异形体D.SO2和CO2属于酸性氧化物,Na2O和Al2O3属于碱性氧化物答案:C解析:煤的干馏是化学变化,电解质溶液导电实质上是电解过程,A项错误;锌比铁活泼,镀锌铁片破损后,仍然对铁具有防腐作用,B项错误;Al2O3是两性氧化物,D项错误。
4.(2015湖北省荆门市元月调研)下列有关化学用语表示正确的是A.四氯化碳分子比例模型:B.COS的电子式是S C OC.次氯酸的结构式为H-Cl-O D.18 8O2-离子结构示意图:【答案】B【解析】四氯化碳分子中,Cl的半径大于C,A错误;次氯酸的结构式为H-O -Cl,C错误;188O2-离子的原子序数为8,D错误。
5.(2015湖南省株洲市一模)下列广告语对应商品中含有的物质有误的是()A.“红梅味精,领先(鲜)一步”﹣﹣蛋白质B.“衡水老白干,喝出男人味”﹣﹣乙醇C.“吃了钙中钙,腰不疼了,腿不痛了,腰杆也直了”﹣﹣碳酸钙D.“要想皮肤好,早晚用大宝”﹣﹣丙三醇【答案】A【解析】:味精的主要成分是谷氨酸钠,不是蛋白质,故A错误;衡水老白干的主要成分是乙醇,故B正确;钙中钙主要成分是碳酸钙,故C正确;大宝保湿成分是甘油﹣丙三醇,故D正确;6.(2015四川省资阳市期末)下表中关于物质分类的正确组合是类别组合酸性氧化物碱性氧化物电解质强电解质高分子物质A CO2 CuO 氨气NH3·H2O 葡萄糖B SO3 Na2O 稀硫酸NaOH 果糖C SO2 CaO 冰醋酸OH 纤维素D N2O5 Na2O2 α-丙氨酸Cu(OH)2 聚乙烯A错误;稀硫酸是混合物,果糖不是电解质,B错误;Na2O2是过氧化物,Cu(OH)2是弱电解质,D 错误。
高考化学二轮复习专题1物质的组成、性质、分类及化学用语课时作业
专题一物质的组成、性质、分类及化学用语一、选择题1.“化学是人类进步的关键”。
下列有关说法能反映正确化学观点的是() A.改变物质的性质不一定要通过化学变化B.天然物质都比人造物质好C.一种元素可有多种离子,但只有一种原子D.根据分散系是否具有丁达尔效应,分散系分为溶液、胶体和浊液2.下列情况不能用胶体知识加以解释的是() A.氯化铝溶液中加入小苏打溶液会产生白色沉淀和无色气体B.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗C.水泥厂、冶金厂常用高压电除工厂烟尘,以减少对空气的污染D.牛油与烧碱溶液共热,向反应所得溶液中加入食盐,则有固体析出3.(2010·上海,5)下列判断正确的是() A.酸酐一定是氧化物B.晶体中一定存在化学键C.碱性氧化物一定是金属氧化物D.正四面体分子中键角一定是109°28′4.下列各组物质的分类都正确的是(括号里的是类别) () A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质)C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)5.生活中遇到的某些问题,常常涉及化学知识,下列各项叙述不正确的是() A.鱼虾放置时间过久,会产生令人不愉快的腥臭味,应当用水冲洗,并在烹调时加入少量食醋B.“酸可以除锈”、“洗涤剂可以去油”都是发生了化学变化C.被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时立即涂抹稀氨水或碳酸氢钠溶液,则可以减轻疼痛D.苯酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固6.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。
【人教版】高考化学复习指导:《物质的组成、性质和分类化学用语》.docx
物质的组成、性质和分类化学用语【教法指引】复习此专题吋要做到“准确”、“系统”、“灵活”,可以从三点入手:1.以高考的热点、考点、难点为依据,合理设置复习内容和练习题,熟练掌握解题思路、•注重方法、技巧,不求血血俱到,但求在某些考点的深度和广度的挖掘上有所突破。
2.加强区别相似概念的异同,理顺不同概念间的联系,进而形成连贯的知识系统。
3.必须将化学知识总结归纳成规律,并运用规律解决实际问题。
【知识网络】一、物质的组成1.物质的组成关系定义离了带电的原了或原了团基团化学屮对原了团和基的总称2.4.离子与基团区别 带有正电荷或负电荷 不带电,为缺电子物质,呈电中性联系两者通过得失电子可以互相转化实例 OH' N0~ Cl~ CH 3+・°H-N02 -Cl -CH 34. 同素异形体与同位素、同系物、同分异构体的区别:二、物质的分类按化学键分—离子化合物——共价化合物I —金I —非金雇(含稀有气体)无机化合物的分类1.按组成性质分类:按组成成分分混合物化合物按水濬液或 濬液导电性分按有无碳元素分纯浄物按元素电解质非电解质 按电离强电解质程度分 弱电解质无机化合物 有机化合物TSARUK Zf)如 NaziL 寸画列US (S) in Ml2. 按微粒间成键种类分类3. 按能否电离来分类4. 胶体的分类:分散剂是液体——液溶胶。
如A1(OH )3胶体,蛋口质胶体Sfsta如阿CO. HDaHI 无机化合恂KltBt agRJHbd »TO> HM Q D4 还原性酸如HL liS发it如阳PQ. IfaSCJt----------- ► UB 獰发廉抑限Her 帘H4Q3T IkEttW 9U 3 haSUfe tfeFU l 不St 走性SB 迹 田* HI, US. FtSOw血性 r 可涪性・E 如KfaOH, N%・⑷----- ►[ 躍眸嫌如他0匕)2・ 心吨3aU ft EOH @3tt ir m ・ z厂正盐Hbt& Y IK 式空Xj 络fi n 如 如 如 如住SCU KHSCUCnXOHhCOa ECAXSO^h* :2%O b^3AlFrt 化合物分为共价化合物如C02, SiCh 和离了化合物如NaCX NH4CI化合物「电解质-I 非电解质电离程度厂强电解质1弱电解质如 HCOi 如HC1电團吕—元K ft HN» #-in» tfl 旧0・HQ I Q I劳廉如Hu. i^sa SSL tLFbS. CHCO3H捱sat电(1)按分散剂的状态分 分散剂是气体——气溶胶。
高考化学冲刺训练1.1物质的组成、性质和分类化学用语
江苏省2013高考化学冲刺训练物质的组成、性质和分类化学用语一、单项选择题1.(2011·镇江模拟)2011年为国际化学年,主题为“化学——咱们的生活,咱们的未来”。
下列说法错误的是( )A.化学是在原子、分子水平上研究物质的科学B.绿色化学的核心是应用化学原理对环境污染进行治理C.氮化硅、光导纤维均属于新型无机非金属材料D.明矾净水利用的是胶体的吸附作用2.下列说法正确的是( )①有化学键破坏的转变必然属于化学转变②发生了颜色转变的必然是化学转变③电解质溶液导电必然发生了化学转变④用糯米、酒曲和水酿制成甜酒,必然是化学转变⑤用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学转变A.①③⑤B.②③④C.③④⑤D.全数3.下列关于物质的分类、性质、用途说法全数正确的是( )A.水玻璃—混合物氨水—弱电解质B.油脂—天然高分子化合物有机玻璃—合成高分子化合物C.二氧化硅—半导体材料硅单质—光纤材料D.高锰酸钾溶液—氧化性碳酸钠溶液—碱性4.下列对有关物质分类的说法错误的是( )A.“面粉增白剂”中的过氧化钙(CaO2)属于氧化物B.“苏打水”中的碳酸氢钠,制作“毒豆芽”所用的亚硝酸钠都属于钠盐C.核电站泄漏的放射性物质13153I和12753I互称为同位素D.“碘片”和“加碘盐”都属于混合物,其中“碘”是单质碘5.判断下列有关化学大体概念的依据正确的是( )A.胶体:物质的微粒直径是不是在1~100 nm之间B.氧化还原反映:反映前后元素的化合价是不是转变C.共价化合物:组成物质的元素是不是全数是非金属元素D.化学转变:是不是有热效应、颜色转变、气体或沉淀生成等四种实验现象二、不定项选择题6.(2010·江苏高考)水是最宝贵的资源之一。
下列表述正确的是( )的电子式为℃时,纯水的pH=7中,质量数之和是质子数之和的两倍K、101 kPa,水分子间的平均距离d:d(气态)>d(液态)>d(固态)7.(2011·无锡模拟)下列关于胶体和溶液的说法中,不正确的是( )A.胶体和溶液都是均一、稳定的分散系,静置不易产生沉淀B.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分开C.光线通过时,胶体产生丁达尔效应,溶液无丁达尔效应D.往Fe(OH)3胶体中逐滴加入稀硫酸只产生沉淀8.(2011·徐州模拟)下列化学用语利用正确的是( )A.重氢原子可表示为:21H的结构示用意:的电子式:D.聚丙烯的结构简式:三、非选择题9.(2011·杭州模拟)实验室里常常利用的干燥剂有:①浓硫酸(98%),②无水氯化钙,③变色硅胶[硅胶的主要成份是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂,无水氯化钴呈蓝色,吸水后变成CoCl2·6H2O呈粉红色],④五氧化二磷,⑤碱石灰(主要成份是氢氧化钠、氧化钙,制法是:把生石灰加到浓的烧碱溶液中,再增强热蒸干)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题训练(一) 物质的组成、性质和分类 化学用语 一、选择题 1.(2014·江苏单科化学卷,T1)水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型如图。下列关于水的说法正确的是
A.水是弱电解质 B.可燃冰是可以燃烧的水 C.氢氧两种元素只能组成水 D.0℃时冰的密度比液态水的密度大 解析水是弱电解质,A正确;可燃冰是甲烷和水的混合物,B错误;氢氧两种元素还可以组成双氧水,C错误;0℃时冰的密度小于液体水的密度,D错误。 答案A 2.(2013·湖南联考)下列物质分类正确的是( ) ①混合物:铝热剂、福尔马林、水玻璃、漂白粉 ②化合物:氯化钙、烧碱、冰水混合物、胆矾 ③电解质:明矾、二氧化碳、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 ⑤同素异形体:C60、C70、金刚石、石墨 A.①②④ B.②③④ C.①②⑤ D.②④⑤ 解析 二氧化碳是非电解质,③错误;C2H4O2、C3H6O2、C4H8O2可能是酸,也可能是酯,④错误;①②⑤正确,答案为C。 答案 C 3. (2014·重庆理综化学卷,T3)下列叙述正确的是( ) A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 C.Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 D.25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度 解析A、浓氨水和FeCl3溶液反应产生Fe(OH)3沉淀,不会产生胶体,A错误;B、加入浓盐酸,使平衡CH3COO-+H+CH3COOH向正方向移动,减小;C、反应的化学方程式为Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2O,C错误;D、Cu(OH)2的沉淀溶解平衡的方程式为Cu(OH)2Cu2++2OH-,在Cu(NO3)2中,会使平衡向逆方向移动,导致溶解度减小,D正确。 答案D 4.(2013·大连双基测试)分类法是学习化学的重要方法,人们在认识事物时可采用多
种分类方法。下列各组归类中不合理的是( ) 选项 分类标准 归类 A FeSO4、NO2、MnO2、NaClO、Cu3P、Na2O2 H2SO3 B CH3COOH、HOOC—COOH、HClO、H2S HF C 复分解反应、电解反应、放热反应、离子反应 焰色反应 D (NH4)2SO4、NH4Cl、NH4NO3、NH3·H2O NH4HCO3 解析 本题考查物质及反应的分类,意在考查考生阅读材料及从材料中获取信息的能力。 选项A,分类标准中的物质都含有可变价态的元素,且这些元素都处于中间价态,H2SO3
中S为+4价,符合此特点,A正确;选项B,分类标准中的物质都是弱酸,HF符合此
特点,B正确;选项C,分类标准中的反应都是化学变化,而焰色反应属于物理变化,C错误;选项D,分类标准中的物质都能电离出NH+4,NH4HCO3符合此特点,D正确。 答案 C
5.(2013·南昌调研)X为短周期元素组成的单质,有下列转化关系:X――→①O2XnOm――→②碱盐,下列相关叙述正确的是( ) A.①②一定都是氧化还原反应 B.①②都不是氧化还原反应 C.XnOm一定是酸性氧化物 D.XnOm是金属氧化物或非金属氧化物 解析 X可以是金属(如铝),也可以是非金属(如碳、硅等),反应①是氧化还原反应,XnOm可以是金属氧化物(Al2O3),也可以是非金属氧化物(CO2、SiO2等),反应②不是氧化还原反应,Al2O3是两性氧化物。 答案 D 6.(2014·广东汕头市质量监控)下列说法正确的是 A.聚乙烯塑料的老化是由于发生了加成反应 B.溴乙烷与NaOH乙醇溶液共热生成乙烯 C.蛋白质、乙酸和葡萄糖均属电解质 D.煤经气化和液化两个物理变化过程,可变为清洁能源 解析聚乙烯塑料老化是由于被氧化导致的,A项错误;溴乙烷的消去反应和水解反应的区别在溶剂不同,水做溶剂发生水解反应,醇做溶剂发生消去反应,B项正确;葡萄糖不是电解质,C项错误;煤的气化和液化属于化学变化,D项错误。 答案B 7.(2013·南昌一模)下列物质可通过置换反应一步得到的是( )
①H2 ②FeCl3 ③Fe3O4 ④O2 A.只有②③ B.只有①④ C.①②③④都能得到 D.①②③④都不能得到 解析 ①Zn与稀硫酸发生置换反应可得到氢气;②氯气与FeBr3发生置换反应得到FeCl3
和单质溴;③高温条件下Fe与水蒸气发生置换反应生成Fe3O4和氢气;④单质氟与水发
生置换反应生成氧气和HF。综上所述,选项C正确。 答案 C 8.(2013·江南十校第一考)下列对有关化学用语的理解错误的是( )
A.电子式H:C···H:H可以表示甲基,但是不可以表示CH+3 B.离子结构示意图可以表示32S2-,又可以表示34S2- C.比例模型可以表示甲烷分子,也可以表示四氯化碳分子 D.分子式C3H8O既可以表示1-丙醇,也可以表示2-丙醇 解析 甲基(—CH3)是甲烷分子失去一个H原子后剩下的部分,其C原子上还有一个未成键的单电子,CH+3是整个甲基失去一个电子后形成的阳离了,A对;从离子结构示意图可看出,该元素的质子数为16,是硫元素,一种元素可以有多种核素,B对;比例模型中体现原子半径大小,因为氯原子半径大于碳原子,故不能表示四氯化碳分子,C错;1-丙醇和2-丙醇互为同分异构体,D对。 答案 C 9.(2013·苏北二调)下列有关化学用语表示不正确的是( ) A.氧的原子结构示意图:
B.Na2O2的电子式:Na+[:O···· :O····:]2-Na+ C.HClO的结构式:H—O—Cl D.中子数为16的硫离子:3216S2- 解析 氧的原子结构示意图应为,A错。 答案 A
10.(2014河南豫东豫北十所名校阶段测试二)下列物质依次按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是 A.淀粉、CuO、HClO、Cu B.水玻璃、Na2O·CaO·6SiO2、Ag2O、SO3 C.KAl(SO4)2·12H2O、KClO3、NH3·H2O、CH3CH2OH D.普通玻璃、H2O、Fe(SCN)3、葡萄糖 【解析】铜为单质,既不是电解质,又不是非电解质,A项错误;Na2O·CaO·6SiO2为硅酸盐,B项错误;KAl(SO4)2·12H2O是纯净物,KClO3是盐,C项错误;普通玻璃是Na2SiO3和CaSiO3的混合物、Fe(SCN)3为络合物难电离,D项正确。 D 二、非选择题 11. (2014·广东理综化学卷,T32)(16分)石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:
(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃) (1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_________________。 (2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,气体I中的碳氧化物主要为________________________,由气体II中某物质得到水玻璃的化学反应方程式为_________________。 (3)步骤①为:搅拌、________、所得溶液IV中的阴离子有____________。 (4)由溶液IV生成沉淀V的总反应的离子方程式为_____________,100kg初级石墨最多可获得V的质量为___________kg。 (5)石墨可用于自然水体中铜件的电化学防腐,完成图19防腐示意图,并作相应标注。 答案(16分) (1)排出空气,作为保护气,防止石墨被空气中的氧气氧化而损耗(1分)。 (2)CO(1分) , SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O(2分) (3)过滤(1分)。Cl—、AlO2—、OH—(3分)。 (4)AlO2—+CH3COOCH2CH3+2H2O CH3COO— + Al(OH)3↓+CH3CH2OH (3分),7.8Kg(2分)
(5) (3分) 解析(1)开始前反应器中存在氧气,那么在加热的条件下,石墨与氧气发生反应,所以在反应前必须排净反应器中的氧气,故通入N2的目的就是排出空气,作为保护气,防止石墨被空气中的氧气氧化而损耗; (2)只能是CO不可能是CO2,因为石墨与CO2高温下也会转化CO;根据题目中的信息“SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃”,所以气体II的主要成分就是SiCl4,SiCl4再与NaOH 反应制备水玻璃(Na2SiO3),故发生反应的化学方程式是SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O; (3)固体Ⅲ含AlCl3、FeCl3、MgCl2加过量NaOH溶液有沉淀Mg(OH)2、Fe(OH)3和溶液NaAlO2、NaCl。要分离出沉淀的操作是过滤;因为NaOH过量,所以溶液中必存在的阴离子是AlO2
—、OH—,反应由NaCl生成,则溶液中还存在阴离子Cl—,那么所得溶液IV中的阴离子
有Cl—、AlO2—、OH—; (4)溶液IV中的阴离子有Cl—、AlO2—、OH—。加入了反应物CH3COOCH2CH3,能除去溶液
