等电子体的找法
选修3,第二章第一节,共价键

2. 共价键的实质
.
.
..
电子云在两个原子核间重叠,意味着电子在两个原子核间出现的概 率增大,电子带负电,因而可以形象的说,核间电子好比在核间架 起一座带负电的桥梁,把带正电的两个原子核“黏结〞在一起。
3.共价键的类型 (1)σ键的形成
Ⅰ. s-s σ键的形成
相互靠拢
Ⅱ. s-p σ键的形成
未成对电子的 电子云相互靠拢
价键理论的要点
1.电子配对原理
两原子各自提供1 个自旋方向相反 的电子彼此配对。
2.最大重叠原理
两个原子轨道重叠局部越大,两 核间电子的概率密度越大,形成 的共价键越结实,分子越稳定。
常见的等电子体:
N2 SO2 SO3 C6H6 NO2 CO2 NH3 CH4
CO O3 NO3-
C22NO2SiO32-
C.稀有气体一般很难发生化学反响
D.硝酸易挥发,硫酸难挥发
3.由下表的数据判断,以下分子的稳定性:
1〕. Cl2、 Br2、 I2 H2O
键 Cl-Cl Br-Br
I-I O-H
键能 242.7 193.7 152.7 462.8
2〕. NH3 、
键 N=O O-O O=O N-H
键能 607 142 497.3 390.8
分子中相邻原子之间是靠什么作用而结合在一起? 什么是离子键、共价键? 通常哪些元素之间可以形成共价键? 你能用电子式表示H2、HCl、Cl2分子的形成过程吗?
为什么不可能有H3、H2Cl、Cl3分子的形成?
一、共价键
1. 共价键具有饱和性 根据共价键的共用电子对理论: 一个原子有几个未成对电子,便可和几个自旋相反 的电子配对成键,这就共价键的“饱和性〞。
11等电子体原理

高考化学新热点——等电子原理叶归归1、等电子原理1919年,美国化学家Irving Langmuir在大量实验事实的基础上总结出一条经验规律,即等电子原理:原子数相同,电子数相同的分子,结构相似,物理性质相近。
具有等电子特征的微粒互称为等电子体。
常见的等电子体如N2和CO,其性质比较如表1。
表1 CO与N2的性质对比CO N2原子个数电子总数价电子数成键特征离解能/kJ⋅mol-1熔点/K沸点/K密度/g⋅cm-3临界温度/K临界压强/MPa21410共价叁键(一个σ键和两个π键,且有一个空的π*轨道)1075832530.7931333.621410共价叁键(一个σ键和两个π键,且有一个空的π*轨道)946772520.7961273.5运用等电子原理预测分子或离子的空间构型时,不能简单的认为价电子数相等的两种微粒即为等电子体,必须注意等电子体用于成键的轨道具有相似性。
例如CO2和SiO2,若单从价电子数相等角度考虑,二者看似互为等电子体,实则不然,两者的空间结构相差甚远。
原因是,在CO2中,除了C原子以sp杂化轨道分别与2个O原子的p 轨道以σ键结合,还有2个离域的键;而SiO2中Si原子以sp3杂化轨道分别与4个O原子的p轨道以σ键结合,同时,Si原子的d轨道还与O原子的P轨道形成了离域的π键。
因此,成键轨道是否具有相似性是运用等电子原理判断分子或离子空间构型的前提。
常见的等电子体中学常见的等电子体价电子数有8、10、14、16、18、24、26、30、32、48十种,按照重原子总数的不同可以归类如下(表2)。
表2 常见的等电子体及空间构型等电子类型常见等电子体空间构型2原子10电子2原子14电子3原子16电子3原子18电子4原子24电子4原子26电子5原子8电子5原子32电子6原子30电子7原子48电子N2, CN-, C22-, C2H2, NO+F2, O22-, H2O2, N2H4, C2H6, CH3NH2, NH2OH, CH3FCO2, N2O, NCO-, N3-, NO2+, SCN-, HgCl2, BeCl2(g),O3, SO2, NO3-SO3(g), CO32-, NO3-, BO33-, BF3SO32-, ClO3-, BrO3-, IO3-, XeO3CH4, SiH4, NH4+, PH4+, BH4-CCl4, SiF4, SiO44-, SO42-, ClO4-C6H6, N3B3H6(俗称无机苯)AlF63-, SiF62-, PF6-, SF6直线型直线型直线型折线型平面三角型三角锥型正四面体型正四面体型平面六边型八面体型高考化学新热点——等电子原理刘鑫茹1、等电子原理1919年,美国化学家Irving Langmuir在大量实验事实的基础上总结出一条经验规律,即等电子原理:原子数相同,电子数相同的分子,结构相似,物理性质相近。
分子结构与性质 新高考化学专题讲解 考点详细分析深入讲解 化学高考必看 最新版

①计算杂化轨道数:n= 1 (中心原子的价电子数+与中心原子结合的原子的成
2 键电子数±电荷数)。(所带电荷为正值时取“-”,所带电荷为负值时取“+”)
②判断杂化类型:当n=2,为sp杂化;n=3,为sp2杂化;n=4,为sp3杂化。如SO2: n=(6+0)=3,是sp2杂化;NO3-:n=(5+1)=3,是sp2杂化;NH3:n=(5+3)=4,是sp3
D.氢键
必备知识通关
解析:(1)每生成1 mol氯吡苯脲,需要1 mol 2-氯-4-氨基吡啶、1 mol异 氰酸苯酯,反应过程中1个2-氯-4-氨基吡啶分子断裂1个σ键、1个异氰酸 苯酯分子断裂1个π键,生成1个氯吡苯脲分子时新形成2个σ键,所以当σ键 增加1 mol 时,π键减少的数目约为6.02×1023。(2)SCN-中存在共价 键,Fe3+与SCN-以配位键结合成配离子,K+与配离子之间以离子键的形式 结合,所以K3[Fe(SCN)6]中的化学键类型有离子键、共价键、配位键;寻找 SCN-的等电子体时,把N原子的价层电子增加1个,则与S原子的价层电子 数相等,即可写成CS2,同理可写出其他的等电子体N2O、CO2、COS等。
CH4、NH4+、SiH4、BH4-
8
空间构型
直线形
平面三角形 V形
正四面体形 三角锥形 直线形
正四面体形
必备知识通关
(2)确定等电子体的方法
方法
具体阐释
示例
把分子(或离子)中的某个原
竖换法 子换成该原子同族的其他元
CO2
CS2,
素原子
O3
SO2
必备知识通关
高中化学第2章化学键与分子间作用力第2节第2课时价电子对互斥理论等电子原理鲁科3鲁科高二3化学

12/11/2021
第十八页,共五十一页。
相关
(xiāngguā
12/11/2021
第十九页,共五十一页。
例1 利用(lìyòng)价电子对互斥理论推测下列分子或离子的空间构型。 (1)H2Se_______________;(2)OF2________________; (3)BCl3_______________;(4)PCl3________________; (5)SiCl4_______________;(6)SO2________________。
(1)CO、CN-与
[C≡N]-
12/11/2021
互为等电子体,CO的结构式为 N2 。
第十页,共五十一页。
,CN-的结构式为 C≡O
答案(dá
(2)CS2与 CO2 互为等电子(diànzǐ)体,CS2的结构式为S==C==S,C原子的杂化类型
为 sp,1 分子空间构型为
直线(zhíx。iàn)形
解题(jiě tí)反 思
12/11/2021
第二十六页,共五十一页。
二、等电子原理(yuánlǐ)及应用
1.判断方法 化学通式相同且价电子总数(zǒngshù)相等的分子或离子。 2.应用
等电子体的许多性质是相近的,空间构型是相同的。利用等电子体可以:
(1)判断一些简单分子或离子的空间构型; (2)利用等电子体在性质上的相似性制造新材料; (3)利用等电子原理针对某物质找等电子体。
价电子对数
价电子对的空间构型
2
直线形
3
三角形
4
四面体
这样已知价电子对的数目(shùmù),就可以确定它们的空间构型。
12/11/2021
2020高中化学专题四第一单元第二课时价层电子对互斥模型等电子原理讲义测试(含解析)苏教版选修3

第二课时 价层电子对互斥模型 等电子原理[学习目标] 1.理解价层电子对互斥模型,学会用价层电子对互斥模型来判断分子或离子的立体构型。
2.理解等电子原理及其应用。
自主学习区一、价层电子对互斥模型 1.价层电子对互斥模型分子中的价层电子对(包括□01成键电子对和□02孤电子对)由于□03相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的立体构型。
2.AB m 型分子的价电子对计算方法对于AB m 型分子(A 是中心原子,B 是配位原子),分子的价电子对数可以通过下式确定:n =中心原子的价电子数+每个配位原子提供的价电子数×m2其中,中心原子的价电子数等于□04中心原子的最外层电子数,配位原子中卤素原子、氢原子提供□051个价电子,氧原子和硫原子按不提供价电子计算。
二、等电子原理 1.等电子原理具有□01相同价电子数和相同原子数的分子或离子具有□02相同的结构特征。
2.等电子体满足等电子原理的分子称为等电子体。
1.价层电子对互斥模型和分子的立体构型二者相同吗?提示:不同。
①价层电子对互斥模型指的是包括σ键电子对和孤电子对在内的空间构型;分子的立体构型指的是组成分子的所有原子(只考虑分子内的σ键)所形成的空间构型。
②若分子中没有孤电子对,价层电子对互斥模型和分子立体构型一致;若分子中有孤电子对,价层电子对互斥模型和分子立体构型不一致。
2.为什么CH 4、NH 3、H 2O 的中心原子均为sp 3杂化,但键角却分别为109.5°、107.3°、104.5°?提示:因为CH 4分子的中心原子碳原子上无孤电子对,4个σ键伸向正四面体的4个顶点,键角为109.5°,NH 3分子中氮原子上有一对孤电子对,孤电子对对另外三个σ键产生排斥作用,使三个σ键的键角变小,同理,H 2O 分子中的氧原子上有2对孤电子对,对σ键排斥力更大,故键角更小。
教师点拨区对应学生用书P048一、价层电子对互斥模型与分子空间构型用价层电子对互斥(VSEPR)模型判断分子的构型的关键是确定中心原子的成键情况,然后再根据成键情况和孤对电子来确定分子的空间构型。
浅析“等电子原理”及其应用
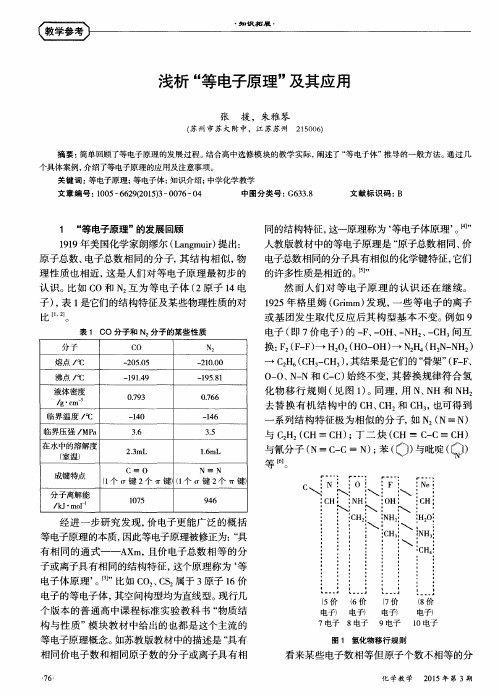
现有 的知识范 围内, 直接对 等 电子 体进行 快速 准 确的推导。 其实这并不难做 到, 只要让学生将常见 后在 明确原子 数 的基础上, 对价电子总数进行 简
的等 电子原 理就可表述为: 重原子总数相等, 价 电 和 空间构型 通常具 有相 似性。 显然 这个定 义 已经 超 出了我们对等 电子原理一般 意义上 的理解。
1 “ 等 电子原理” 的发展回顾 1 9 1 9年美国化学家 朗缪尔 ( L a n g m u i r ) 提出: 原子总数 、 电子总数相 同的分 子, 其结 构相 似, 物 理性质也 相近, 这是人们对 等 电子原 理最初步 的 认识 。 比如 C O和 N ’ 互 为等 电子 体 ( 2 原子 l 4电 子) , 表 1 是它们的结构特征及某 些物理性质的对
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
_ _ 【 教学参考 ]
’ 0 、 _ . - . - - . _ _ - _ . . . . - . . - - - _ ,
子, 在忽略 H原子存在 的情况下其构型是类似的, 总数解释为 “ 重原子” 总数 ( H等轻 原子不计在内) ,
价 电子总数 算作是重原子提 供 的价 电子与轻原子
c N 。
F Ne
成键特点 分子离解能
/ k J ・ m0 1 ~
C i 0 N i N ( 1 个 1 3 " 键2 个 耵键) ( 1 个 仃键 2个 盯键)
1 0 7 5 9 4 6
\
\
: C H : N H
: O H: i C H:
n原子杂化类型的判断
n原子杂化类型的判断
判断N原子杂化类型的方法主要有以下几种:
1. 等电子体法:将结构模糊或复杂的分子、离子转化成熟悉的等电子体,然后根据等电子体的中心原子杂化类型来判断。
例如,NO2+和CO2互为等
电子体,CO2中心原子C为sp杂化,则NO2+中心原子N也为sp杂化。
2. 价键直查法:根据杂化轨道理论,原子之间成键时,未杂化轨道形成键,杂化轨道形成键。
若未参与成键的杂化轨道上的孤对电子,则可直接用下式判断:杂化轨道数n=中心原子的键数+中心原子的孤电子对数(多重键中
只有一个键,其余均为键),从而确定中心原子的杂化类型。
3. 价层电子对数法:若n=4,则采用sp3杂化;若n=3,则采用sp2杂化;若n=2,则采用sp杂化。
如需了解更多信息,建议咨询化学领域专业人士或查阅化学相关书籍。
2.1共价键(第2课时)课件高二化学人教版选择性必修2
⑵ 通过上例子,你认为键长、键能对分子的化学 性质有什么影响?
一般地,形成的共价键的键能越大,键 长越短,共价键越稳定,含有该键的分子越稳定, 化学性质越稳定。
2
键参数 3、键角:两个共价键之间的夹角称为键角。
键角决定分子的空间构型。
键角一定,表明共价键具有方向性。键角是 描述分子立体结构的重要参数,分子的许多性 质与键角有关。
2
键参数
二、键参数---键能,键长,键角
1.键能:气态基态原子形成1mol化学键释放的最低能量。 破坏1mol化学键形成气态基态原子所需的最低能量。 键能越大,化学键越稳定。
应用:计算化学反应的反应热(焓变)。
∆H = 反应物键能总和 - 生成物键能总和
2
【思考】教材 P34 第四题
键参数
表2-1
YCLioont4ulieom、crCa&eon勿l.o)Cr将han今ge日Fill之事拖到明日。(Not matter of the today XXX drag tomorrow. )
5、学习时的苦痛是暂时的,未学到的痛苦是毕生的。(Time the study pain is temporary, has
but succeeds must arrange the position. )
8、学习并不是人生的全部。但,既然连人生的一部分——学习也无法征服,还能做什么呢?
(The study certainly is not the life complete. But, since continually life part of-studies also is unable
Ft9Ro、cEo请nEq享u受er,无w法ha躲t b避ut的als痛o c苦an。m(akPel?e)ase enjoy the pain which is unable to avoid.)
物质结构
ds 区:IB IIB;f 区:镧系和锕系。 2.元素结构与性质呈周期性变化
⑴ 原子核外电子排布的递变规律 ⑵原子半径的递变规律 ⑶金属性和非金属性的递变规律 ※金属性强弱的判断依据: ①与水或酸反应置换出氢气的难易程度 ②最高价氧化物对应的水化物(氢氧化物)碱性强弱 ③对应单质的还原性。 ※ 非金属性强弱的判断依据: ①与氢气化合的难易程度 ②气态氢化物稳定性 ③最高价氧化物对应的水化物(含氧酸)酸性越强 ④对应单质的氧化性。 ⑷元素的第一电离能的递变规律 同主族元素从上向下第一电离能逐渐减小; 同周期元素从左向右第一电离能有逐渐增大的趋势;除了 IIA 族和 VA 族元素比同周期 的后一元素具有更大的第一电离能;原因: IIA 族元素原子外围电子在同一能级上全.充.满.,原子能量较低,因此具有较大的第一电 离能;
SO3
1
三角锥形
NH3、H3O+
AB4
0
sp3
正四面体
CH4、CCl4
键的极性(不同元素形成的共价键为极性共价键),分子的极性可结合空间构型加以判断。
7.求算σ键、π键的数目
(单键必为σ键,双键和三键中均只有一个σ键,其余为π键;所以某原子所成σ键数等
于该原子所连原子数,所以解答相关问题务必看清是求某个分子中键数还是求算一定物质的
可根据书本公式。
空间构型的判断(可参考下表加以判断):
粒子 组成
孤对电子 中心原子的 粒子的空间构型
的对数 杂化方式
实例
0
判断中心原子杂化轨道类型的常见方法
SO2-
ClO4- 、
4 、
4 、
4 、
BCl4- 、
NCl4+ 等互 为 等 电 子 体,它 们 的 中 心 原 子 的 杂
化类 型 均 为 sp3 杂 化 .
找 等 电 子 体 要 遵 循 “先 同 族 代
换,后左右递变”的原则,另 外 就 是 按 要 求 写 自 己 最 熟
数为 3,杂化类型为 sp 杂化 .
的
3NH3BH3+6H2O=3NH4+ +B3O3-
B3O3-
6 +9H2 .
6
结构为
在该 反 应 中,
.
B 原子的杂化
图1
根据 2 种 离 子 (焦 磷 酸 根 离 子、三 磷 酸 根 离
子)的结构示 意 图,可 以 判 断 NH4H2PO4 中
63
难点挑战
因为 SO2-
和 CCl4 分子互为“等电子体”,所
双键,则b=2,若它与中心原子形成三 键,则b=3,进
而可求 所 研 究 中 心 原 子 的 价 层 电 子 对 数 .
如:判 断
CH3CH3 中碳原子的杂化类型,计算 1 个 碳 原 子 的 价
层电子对数 时,因 为 碳 碳 之 间 为 单 键,所 以 另 一 个 碳
原子 的 b =1,氢 原 子 的 b =1,故 孤 电 子 对 数 =
题,如果知道 了 真 实 键 角,就 可 以 判 断 中 心 原 子 的 杂
子并不需要杂化 .
而分子的真实构型才是决定杂化类
型的标准,例如吡 啶 分 子(
N )为 平 面 型 分 子,
类型为 sp3 杂化 .
石墨中的碳原子与周围的3个碳原
子成键,且为平面结构,无 孤 电 子 对,所 以 价 层 电 子 对
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C和He形成的离子理论上可能是稳定的,该离子是
甲烷的等电子体,其化学式是 CHe44+ 再写出一种阳离子的等电子体 NH4+
等电子体书写方法
等电子体定义:是指原子数目和价电子( 主族元素原子即 为最外层电子) 总数都相等的分子或离子间的互称,它 们具有相似的结构与性质.
方法1:在同主族元素中寻找替代元素 例:SO2 的等电子体:O3
变式练习:写出与CO2 具有相同空间构型的阳离子: N SO3 互为等电子体离子有 SiO32- 、 NO3-;;
与 SO2 的互为 等电子体的离子有 NO2-;
.
② OH-的等电子体有 :HS-、 HF、
NH2-的等电子体有 : H2O ③ NH3 的等电子体有 :H3O+、 CH3-、 PH3
4、与OH-互为等电子体的一种分子为 HF ( 填化学式)
5、与H2O互为等电子体的一种阳离子为
( 填化学式) H2F +
N3-再通过得失电子可以得 N2O(氧化物)
【高考真题】
1、一种由 化学式为
B、CN2O组成的.化(合B物为与氮A元C2素互,为C等为电氧子元体,素其,
A 为碳元素)
[∶O O∶]2 +
2、C22-与 O22+ 互为等电子体 O22+的电 子式为 ;
3、写出一种与YZ42-互为等电子体的 分子的化学 式: CCl4 或 SiCl4. ( Y 为硫元素, Z 为氧元素)
技巧3: 价电子数分摊( 同时改变配位原子,中心 原子)
如: CO 价电子总数 = 4 + 6 = 10,每个原子分 摊价电子数 = 10/2 =5,可得 N2,通过得失电子 还可得到 C22- 与 O22 + ;
还能再写出一种吗? CNCO2 的等电子体可以是 N3- ( 中心原子与配位原子 同时改变) ,
NH3 → PH3 AlP →AlN、 BN
变式练习:写出两个与 CO2 具有相同空间构型的分子
CO2 的等电子体可以为 CS2、 COS
方法2:在同周期相邻元素,通过得失电子替换元素 ( 离子
( 1) 中心原子不变,通过得失电子替换配位原子
变式练习:写出与CO2 具有相同空间构型的阴离子: SCN- 、CNO-
例:CO2 的等电子体中心原子 C元素不变,O元素的 左 边是 N元素,故 N 得到1个价电子数( 显-1价) 可以替 换O原子,另一O原子可以用同主族的 S 替代,CO2 的等 电子体可以为 SCN-.
( 2) 配位原子不变,通过得失电子替换中心原子 如: SO4 2 - 的等电子体: PO43- ClO4P再得到1 个价电子数就等同于S, Cl失去一个价电子就等同于 S,
