[高考]化学一轮基础知识:基础过手4铝及其化合物(铝三角转化)
高考化学一轮总复习第四单元第2讲铝及其化合物课件

断,完全正确的是(
)。
选项
陈述Ⅰ
铝制炊具最好不要盛 A 放酸性或碱性较强的
液体食物
氯气不能使干燥的有 B 色布条褪色,能使湿
润的有色布条褪色
C
二氧化硫能使KMnO4 溶液褪色
铁和铝制成的槽车可 D 以密封贮运浓硫酸或
浓硝酸
陈述Ⅱ
因为Al和Al2O3既可以 与酸反应,又可以与 碱反应
判断
Ⅰ对,Ⅱ对, 无
碱反应,Al 与产生 H2 的关系均是:2Al~3H2。
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气
的体积比为VVNHaOClHHH22=1。
第十九页,共49页。
(2)足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反 应,产生氢气的体积比为VVNHaOClHHH22=13。
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应, 若产生氢气的体积比为13<VVNHaOClHHH22<11,则必定是:铝与盐酸 反应时,铝过量而盐酸不足;铝与氢氧化钠溶液反应时,铝不 足而氢氧化钠过量。
第七页,共49页。
◎ 自主测评 ◎
1.(2014年北京卷)下列(xiàliè)金属中,表面自然形成的氧化层能
保护(bǎohù)内层金属不被空气氧化的是( )。
A.K
B.Na
C.Fe
D.Al
解析:K、Na化学性质非常活泼,在空气中极易被氧气氧
化,A、B错误;Fe在空气中易被氧气氧化生成一层疏松的Fe2O3
第十七页,共49页。
解析:18 mol·L-1 H2SO4为浓H2SO4与Mg、Al反应不产生H2; Mg、Al与稀HNO3反应生成NO而不是H2;Mg与盐酸反应产生H2,而 Mg与NaOH不反应,等质量(zhìliàng)的Al分别与足量的HCl和NaOH溶 液反应,产生H2的量相等。故A项产生H2的量最多。
铝三角及其图像

Al3+ + 3AlO2—+ 6H2O = 4Al(OH)3↓
0 1 2 3 n(AlCl3)
9.往NaAlO2溶液中通入CO2 (或过量) 或AlO2—+CO2 +2H2O =Al(OH)3↓+HCO3— n[Al(OH)3] ↓ 2AlO2— +CO2 +3H2O =2Al(OH)3↓+CO32—
铝及其重要化合 物之间的转化
Al
① ②
Al2O3
④ ⑥ ⑨ ⑧ Al3+ ③ Al(OH)3 ⑿ ⒀
⑤ ⑦
⑩ ⑾ AlO2
点燃
①4Al+3O === 2 Al O 2 2 3
② 2Al O =4Al+ 3O ↑ 2 3 2 △ ③ ④ 2Al+6H+=2Al3++3H2↑
电解
2Al(OH)3=Al2O3+3H2O
n(OH-) ≥ 4n(Al3+) 时,n[Al(OH)3)]=0,无沉淀
(2).求反应物强碱的物质的量 若碱不足:n(OH-) = 3n[Al(OH)3] 若碱过量:n(OH-) = 4n(Al3+)-n[Al(OH)3] (3).可溶性铝盐与强碱(如NaOH溶液)反应后Al元素存在形态
例3
在50 mL b mol·L-1的AlCl3溶液中加入50 mL a mol/L NaOH溶液。 (1)、当a≤3b时,生成Al(OH)3沉淀的物质的量为________。
溶液用于溶解 Al(OH) ∴ c(HCl) = n/V =3。 0.800mol/0.10L = 8.00mol/L
(2)8.00 mol· L
(1) 、由题意可知 m[Al(OH)3]=(19.4—11.6)g =7.8g , m[Mg(OH)2] =11.6g,则铝的质量分数为:
[优选]高考化学一轮复习优质PPT铝及其化合物(PPT版)共
![[优选]高考化学一轮复习优质PPT铝及其化合物(PPT版)共](https://img.taocdn.com/s3/m/eeb276d6581b6bd97e19ea3d.png)
【 (名校 师课 整堂 理】课获本奖专P题PT)-高考化学一轮 复习课优 件质:PP铝T铝及及其其化化合合物物((P PTPT版版))推共荐p共pt (优最质新说 版课本稿)( 推精荐选)
(1)铝在空气中耐腐蚀,所以铝是不活泼金属( × ) (2)冶炼铝时常用焦炭作还原剂( × ) (3)铝制餐具不能长时间存放酸性、碱性食物( √ ) (4)MgO与Al粉的混合物也可称为铝热剂( × ) (5)铝条用砂纸打磨后插入浓硝酸中产生红棕色气体( × )
【 (名校 师课 整堂 理】课获本奖专P题PT)-高考化学一轮 复习课优 件质:PP铝T铝及及其其化化合合物物((P PTPT版版))推共荐p共pt (优最质新说 版课本稿)( 推精荐选)
3.铝的制备及用途 (1)制备原理 电解熔融Al2O3:__2_A__l2_O__3(_熔__融__)=_电_=_=解_=_=_4_A_l_+__3_O_2_↑_____。 (2)用途 ①纯铝用作导线;②铝合金用于制造汽车、飞机、生活用品等。
【 (名校 师课 整堂 理】课获本奖专P题PT)-高考化学一轮 复习课优 件质:PP铝T铝及及其其化化合合物物((P PTPT版版))推共荐p共pt (优最质新说 版课本稿)( 推精荐选)
(名师整理课本专题)高考化学一轮 复习优 质PPT铝 及其化 合物( PPT版 )共ppt 优质说 课稿( 精选)
(名师整理课本专题)高考化学一轮 复习优 质PPT铝 及其化 合物( PPT版 )共ppt 优质说 课稿( 精选)
①
4Al+3O2=点==燃==2Al2O3
②__2_A__l+__3_C__l2_=_点=_=_燃=_=_2_A__lC__l3______________
第四章玩转铝及其化合物(附带答案解析)-2023年高考化学一轮复习重难点突破讲义
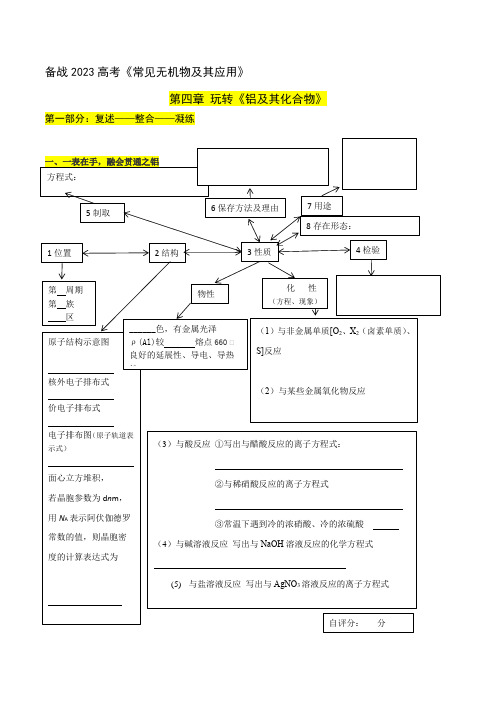
备战2023高考《常见无机物及其应用》第四章玩转《铝及其化合物》第一部分:复述——整合——凝练【核心补充1】【重要的实验】1、铝热反应①在下面方框中画出简易装置图并指出所用试剂的用途 ② 在下面方框中写出实验现象③铝热反应的用途:注:Al 和某些金属氧化物在高温下进行,反应迅速并放出大量的热,新生成的金属单质呈熔融态且易与Al 2O 3分离重要的实验】2、离子检验问题写出检验Al 3+写出检验AlO -2【核心补充2】【Al 的工业冶炼方法】从铝土矿(主要成分是Al 2O 3、含SiO 2、Fe 2O 3、MgO 等杂质)中冶炼铝的两种工艺:要求:1.补全主要微粒或添加的试剂的化学式 2.写出步骤1—5中含铝物质发生反应的离子方程式步骤1: 步骤2: 步骤3: 步骤4: 步骤5: 注:冶炼Al 时只能电解熔融Al 2O 3而不能电解熔融AlCl 3,原因是AlCl 3是共价化合物,熔融态不导电;加入冰晶石(Na 3AlF 6)的目的是降低Al 2O 3的熔化温度。
【核心补充3】【基本图像问题】1.可溶性铝盐溶液与NaOH溶液反应的图像:偏铝酸盐溶液与盐酸反应的图像:2.总结:Al3+、Al(OH)、AlO-2相互转化的比例关系二、一图在手融汇贯通之铝及其化合物连线。
用箭头表示出价类二维图中各物质之间可能存在的转化线,并标清楚反应条件。
+3 Al 2O 3 Al(OH)3 Al Cl 3NaAl O 20 Al单质氧化物氢氧化物盐三、Al 及其化合物易错点全掌控1、结合必要的化学用语解释明矾能净水的原因:2、注意反应的先后顺序当溶液中有多种离子H +、NH 4 +、Mg 2+、Al 3+存在时,向溶液中逐滴加入NaOH 溶液,与NaOH 反应的微粒的先后顺序是: 。
3、离子共存问题 画图连线,标记出微粒间不能大量共存的原因4、从分类观角度总结 既能与酸反应,又能与碱反应的物质 (1)无机物:①金属 如:Al 等 ②两性氧化物 如:Al 2O 3等 ③两性氢氧化物 如:Al(OH)3等④多元弱酸的酸式盐 如:NaHCO 3、KHS 、KHSO 3等⑤弱碱弱酸盐 如:CH 3COONH 4、(NH 4)2CO 3等。
2023届高三化学一轮复习知识点(四)——金属及其化合物

2023届高三化学一轮复习知识点(四)金属及其化合物一、钠及其化合物的性质金属钠:(自然界中无钠单质)银白色固体、有金属光泽、密度比煤油大比水小、质软、熔点低,保存于煤油中。
1.钠在空气中缓慢氧化:4Na+O2==2Na2O(白色)钠在空气中燃烧:2Na+O2Na2O2(淡黄色)2.钠与水反应:2Na+2H2O==2NaOH+H2↑实质:钠与水中的H+反应现象:①钠浮在水面上(密度小于水);②熔化为银白色小球(熔点低、放热);③在水面上四处游动;④伴有嘶嘶响声(放出气体—H2);⑤滴有酚酞的水变红色(产生碱性物质—NaOH)钠与酸反应:2Na+2HCl==2NaCl+H去油污、制玻璃、造纸发酵粉、治疗胃酸过多注意事项:Na2CO3溶液与盐酸作用时,滴加顺序不同,实验现象可能会有所不同,产生的CO2的量也可能不同(1)把Na2CO3溶液逐滴滴到盐酸中,开始时盐酸相对过量,则发生反应:Na2CO3+2HCl==2NaCl+CO2↑+H2O,即一滴加就有CO2气体产生。
(2)把盐酸逐滴滴到Na2CO3中,开始时Na2CO3相对过量,则发生反应:Na2CO3+HCl==NaHCO3+CO2↑,继续滴加盐酸时,才发生反应:NaHCO3+HCl==NaCl+CO2↑,即一开始没有CO2气体,后来才有气体放出。
二、铝及其化合物性质(一)铝的性质1.物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高。
有良好的导电、导热性和延展性。
2.化学性质:铝是较活泼的金属。
①通常与氧气易反应,生成致密的氧化物起保护作用。
4Al+3O2==2Al2O3。
同时也容易与Cl2、S等非金属单质反应。
②与酸反应:强氧化性酸,如浓硫酸和浓硝酸在常温下,使铝发生钝化现象;加热时,能反应,但无氢气放出;非强氧化性酸反应时放出氢气。
(2Al+6H+=2Al3++3H2↑)③与强碱溶液反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑(2Al+2OH−+2H2O=2AlO2−+3H2↑)④与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
高三一轮复习铝及其化合物ppt课件

4、Al的工业制法——电解熔融氧化铝
失4×3e-
2Al2O3 (熔融)
电解 4Al+ 3O冰2晶↑石
得6×2e-
由于铝的熔点很高,故在氧化铝中添加 冰晶石(Na3AlF6)降低其熔点。
金属间的置换
17
二、铝的化合物 1、氧化铝(Al2O3): (1)物理性质:白色、不溶于水的固体,熔点很
高(2054℃)常作耐火材料。 刚玉的主要成分是Al2O3 ,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和 钛元素的刚玉称为蓝宝石。
(NH4)2S等; ⑤弱酸的酸式盐:NaHCO3、KHS、NaHSO3
NH4HCO3、等 ⑥氨基酸、蛋白质等有机物
22
(3)Al(OH)3的制备: ①Al3+ 、加入氨水
必修1—P58实验
AlCl3溶液中逐滴加入NaOH? Al3+ + 3OH- = Al(OH)3 ↓ Al(OH)3 + NaOH = NaAlO2 + 2H2O
2、铝的物理性质:
银白色金属, 硬度和密度小, 具有良好的导电导热性和延展性。 在空气中具有很好的耐腐蚀性。
+13 2 8 3
4
3、铝的化学性质:
(较强还原性)
(1)与非金属反应(O2、Cl2) 4Al + 3O2 ═ 2Al2O△3
铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
2Al + 3Cl2
═
铝热反应的应用: 在生产上,如用于焊 接钢轨、冶炼金属等。
铝除了和Fe2O3反应外,还可以和FeO、 Fe3O4、 Cr2O3、V2O5、MnO2等金属氧 化物组成铝热剂发生铝热反应,冶炼Fe、V、Cr、Mn等金属。
12
Al 铝及其化合物
HCO3-的反应不属于水解相互促进的反应,而是 HCO-3 电离
出的
H
+
与
[Al
OH
4]
-
发
生
的
反
应
:
[Al
OH4]
-
+
HCO
-
3
===AlOH3↓+CO32-+H2O。
目录
即时应用 1. (2013·济南质检)某溶液中可能含有 OH-、[Al(OH)4]-、CO23-、 SiO23-、SO24-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液 中加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量 随盐酸溶液的体积变化的图像如图所示,下列说法正确的是
目录
特别提醒:1当溶液中有多种离子时,要考虑离子之间的反
应顺序,如向含有 H+、NH+4 、Mg2+、Al3+的混合溶液中逐 滴加入 NaOH 溶液,NaOH 先与 H+反应,再与 Mg2+、Al3
+反应生成沉淀,再与 NH+4 反应,最后才溶解 AlOH3 沉淀。
一般是按生成水、沉淀、气体的顺序反应。,2[AlOH4]-与
目录
跟踪训练
1.下列图像正确的是( )
目录
2.如图所示,横坐标为某溶液中加入溶质的物质的量,纵坐 标为沉淀量。
从 A~D 中选择符合要求的选项填入下表的相应位置:
编号 ① ②
③ ④ ⑤
溶液
饱和石灰水 含少量NaOH的 Na[Al(OH)4]溶液 含少量NaOH的 Na[Al(OH)4]溶液 MgCl2、AlCl3混合溶液
(2)注意溶液中生成沉淀不只是 Al(OH)3 一种的反应情况,如: 明矾溶液中加入 Ba(OH)2(aq)至过量或向含 Mg2+、Al3+的溶液 加入强碱时的反应。
铝及铝的化合物一轮复习
(2)当 n[KAl(SO4)2]∶n[Ba(OH)2]=1∶2 时,铝元素的 存在形式是什么?
提示 铝元素的存在形式是AlO-2:KAl(SO4)2
+2Ba(OH)2===KAlO2+2BaSO4↓+2H2O。
考点精讲
考点一 铝与强酸、强碱的反应 1.等质量的两份铝分别与足量的盐酸、 氢氧化钠溶液反应,所得 H2 的体积之比是多 少?为什么?
4.8,2.7 8mol/L
应用Ⅱ
铝元素在溶液中的存在形式的判断
观察方程式可知:找到恰好完全反应的两个点
①Al3++3OH-=Al(OH)3 ②Al3++4OH-= AlO2-+2H2O
a mol b mol
Al(OH)3 AlO2-
Al(OH)3 和Al3+ ○
Al(OH)3 和AlO2
○
AlO2-
铝及其化合物
思考 4
学案部分
向明矾溶液中逐滴加入 Ba(OH)2 溶液,
(1)当 n[KAl(SO4)2]:n[Ba(OH)2]=2∶3 时,铝元 素的存在形式是什么? 提示 铝元素的存在形式是Al(OH)3:
2KAl(SO4)2+3Ba(OH)2===2Al(OH)3↓+ 3BaSO4↓+K2SO4。
⑵铝的特性——与碱的反应
化学方程式: 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 离子方程式: 2Al+2OH-+2H2O===2AlO2-+3H2↑
反应的实质分析: 该反应的氧化剂是什么?
2Al +6H2O=== 2Al(OH)3+3H2 ↑ Al(OH)3+OH-===AlO2-+2H2O
4Al+3O2
2Al2O3
问题:铝是活泼金属,为什 么铝制品却有非常广泛的用途?
高考化学一轮复习课件第七单元铝及其化合物PPTppt文档
受热分解:__________ ______________
(续表)
物质 属性
用途
Al2O3 __两__性____氧化物
Al(OH)3 ___两__性___氢氧化物
常刚灯用玉管作球等高磨级机耐、火高材压料钠、灯制的可剂用、作阻脱燃色材剂料、胃酸中和
三、铝盐
1.复盐
由两种或两种以上阳离子和一种阴离子构成的盐。如明矾,
化学性质
化学方程式或离子方程式
与 O2 反应
常温下铝能与 O2 反应生成致密的氧化膜,点 燃条件下铝能与 O2 反应生成氧化铝:
______________________________
与非氧化性酸(如 盐酸)反应
与碱(如 NaOH 溶 液)反应
____2_A_l_+__6_H_+__=_=_=_2_A_l_3_+_+__3_H_2_↑____ ______________________________
C.反应Ⅱ中的离子方程式为 CO2+AlO- 2 +2H2O=== Al(OH)3↓+HCO- 3
D.工业上还可采用 Fe 还原 Al2O3 的方法制 Al,成本更低
解析:A 项,试剂 X 应为强碱溶液,使 Al2O3 溶解;B 项, 若用强酸代替 CO2,强酸过量时,Al(OH)3 会溶解,不能保证生 成 Al(OH)3 沉淀;D 项,因 Al 比 Fe 活泼,不能用 Fe 置换 Al。
(续表)
化学性质 与某些盐溶液(如 CuCl2 溶液)反应 与某些金属氧化 物(如 Fe2O3)反应
钝化
化学方程式或离子方程式 ___2_A_l_+__3_C_u_2_+_=_=_=__2_A_l_3+__+__3_C_u____
______________________________ 常温下浓硫酸、浓硝酸能使铝表面形成一层
2024年新人教版高考化学一轮复习讲义(新高考版) 第4章 第17讲 铝、镁及其化合物
2024年新人教版高考化学一轮复习讲义(新高考版)第17讲铝、镁及其化合物复习目标1.了解镁、铝及其重要化合物的存在、性质和用途。
2.掌握工业提取铝、镁的一般方法。
内容索引考点一 铝及其化合物考点二 镁 海水提镁真题演练 明确考向课时精练><铝及其化合物1.铝单质必备知识写出图中有关反应的化学方程式或离子方程式:①②______________________;钝化③2Al+6H+===2Al3++3H2↑④_________________________________;⑤__________________________(铝热反应)。
2.氧化铝、氢氧化铝的两性按要求完成下列化学反应的离子方程式。
(1)氧化铝分别溶于盐酸、NaOH 溶液:______________________________、_____________________________。
(2)氢氧化铝分别溶于盐酸、NaOH 溶液:____________________________、______________________________。
Al 2O 3+6H +===2Al 3++3H 2O Al 2O 3+Al(OH)3+3H +===Al 3++3H 2O Al(OH)33.Al(OH)3的制备写出下列反应的离子方程式。
(1)Al3+与氨水反应(不用强碱):____________________________________。
______________________________________。
________________________________。
4.工业炼铝的流程方案一:碱溶法方案二:酸溶法1.MgO 与Al 粉的混合物也可称为铝热剂( )2.实验室可用氧化铝坩埚熔化NaOH 、Na 2CO 3固体等()3.铝和酸反应时,氧化剂是酸,铝和碱反应时,氧化剂是碱( )4.明矾可作净水剂,起到杀菌消毒的作用( )××××1.下列关于铝的化合物的说法错误的是A.氧化铝俗名为刚玉,是高温耐火材料B.KAl(SO 4)2·12H 2O 溶于水可形成Al(OH)3胶体,可以净水一、铝及其化合物的性质关键能力√将AlCl 3溶液滴入浓氨水中,生成氢氧化铝沉淀,D 错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学基础过手4 铝及其化合物2 班级 姓名 一、重要反应过手 ①铝与氧化性酸(稀硝酸)反应,产生的气体不是 ,而是 ②铝与冷的氧化性酸( 、 )会钝化,但加热时可反应。 ③铝热反应 ④工业上冶炼铝 ⑤铝盐和偏铝酸盐的转化:Al3+ Al(OH)3 AlO2-
向AlCl3溶液中逐滴加入NaOH溶液,有什么现象?
向NaAlO2溶液中逐滴加入HCl溶液,有什么现象?
⑥Al(OH)3呈两性的原因 酸式电离Al(OH)3碱式电离 制备氢氧化铝的三个反应: 向AlCl3溶液中加入过量氨水 向NaAlO2溶液中通入过量CO2气体 利用双水解:将NaAlO2溶液与AlCl3溶液混合 二、 填空 ①Al3+ 与哪些离子能发生双水解 ②将NaAlO2溶液与NaHCO3溶液混合是双水解吗? ③铝粉与Fe2O3粉末反应,有什么现象?________________________________ 铝热反应引发的操作是:加少许 ,用 引燃 反应特点:属于 反应,放出 用途: 、 三、熟记以下重要关系式 1. 2Al ~ 6H+ ~ 2Al3+ ~ H2 ~ 6e – 2. 2Al ~ 2OH- ~ 2 AlO2-~ 3H2 ~ 6e - 3. Al3+ ~ OH -~ Al(OH)3↓ 4. Al3+ ~ OH- ~ AlO2-
5. AlO2- ~ H+ ~ Al(OH)3↓ 6. AlO2- ~ H+ ~ Al3+
化学基础过手4 铝及其化合物2 班级 姓名 一、重要反应过手 ①铝与氧化性酸(稀硝酸)反应,产生的气体不是 ,而是 ②铝与冷的氧化性酸( 、 )会钝化,但加热时可反应。 ③铝热反应 ④工业上冶炼铝 ⑤铝盐和偏铝酸盐的转化:Al3+ Al(OH)3 AlO2-
向AlCl3溶液中逐滴加入NaOH溶液,有什么现象?
向NaAlO2溶液中逐滴加入HCl溶液,有什么现象?
⑥Al(OH)3呈两性的原因 酸式电离Al(OH)3碱式电离 制备氢氧化铝的三个反应: 向AlCl3溶液中加入过量氨水 向NaAlO2溶液中通入过量CO2气体 利用双水解:将NaAlO2溶液与AlCl3溶液混合 二、填空 ①Al3+ 与哪些离子能发生双水解 ②将NaAlO2溶液与NaHCO3溶液混合是双水解吗? ③铝粉与Fe2O3粉末反应,有什么现象?________________________________ 铝热反应引发的操作是:加少许 ,用 引燃 反应特点:属于 反应,放出 用途: 、 三、熟记以下重要关系式 1. 2Al ~ 6H+ ~ 2Al3+ ~ H2 ~ 6e – 2. 2Al ~ 2OH- ~ 2 AlO2-~ 3H2 ~ 6e -
3. Al3+ ~ OH -~ Al(OH)3↓ 4. Al3+ ~ OH- ~ AlO2-
5. AlO2- ~ H+ ~ Al(OH)3↓ 6. AlO2- ~ H+ ~ Al3+ 答案:①2Al+2OH-+2H2O===2AlO-2+3H2↑ ②2Al+6H+===2Al3++3H2↑ ③Al2O3+2OH-===2AlO-2+H2O ④Al2O3+6H+===2Al3++3H2O ⑤Al(OH)3+OH-===AlO-2+2H2O ⑥Al(OH)3+3H+===Al3++3H2O
4Al+3O2=====点燃2Al2O3 8Al+3Fe3O4=====高温9Fe+4Al2O3 AlO-2+2H2O+CO2===Al(OH)3↓+HCO-3 AlO-2+4H+===Al3++2H2O ⑪AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3
⑫3AlO-2+Al3++6H2O===4Al(OH)3↓
Al3++3NH3·H2O===Al(OH)3↓+3NH+4 Al3++4OH-===AlO-2+2H2O ⑮Al3++3HCO-3===Al(OH)3↓+3CO2
↑
⑯2Al3++3CO2-3+3H2O===2Al(OH)3↓+3CO2
↑
⑰2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑
⑱2Al2O3=====电解Na3AlF64Al+3O2
↑
答案:①有白色沉淀生成,当NaOH过量时白色沉淀消失 ②立即有白色沉淀生成,且有大量气泡冒出 ③有大量气泡和白色沉淀生成,当Na2O2过量时,白色沉淀溶解 ④剧烈反应,火星四射,有黑色熔融物生成 答案:①碱 Al2O3被碱液溶解后,铝和碱液反应生成H2,原理为2Al+2OH-+2H2O===2AlO-2+3H2↑ ②把混合均匀的氧化铁粉末和铝粉放在纸漏斗中,上面加少量氯酸钾,并在混合物中间插一根镁条,点燃镁条,观察发生的现象 ③Al(OH)3呈两性,但它只溶于强酸强碱而不溶于弱碱(氨水),使用氨水容易控制产物 ④把Al粉分为四等份,其中一份与适量盐酸反应,生成AlCl3,三份与适量NaOH溶液反应,生成NaAlO2,将AlCl3与NaAlO2溶液混合,即可得到Al(OH)3。本途径耗费HCl与NaOH的量最少
⑤AlO-2+H++H2O酸式电离Al(OH)3碱式电离Al3++3OH-
每周记背(第21) 铝及其重要化合物 寇介芳 一、铝的存在 铝以化合态存在于自然界中,在地壳中的含量居三位,是地壳中含量最多的金属元素。 二、 铝的性质 1. 物理性质:银白色固体,硬度较小,密度较小,熔点较低,有很好的延展性和导电性,导电性仅次于银、铜和金。
2. 化学性质:较活泼金属,具有还原性 (1)与非金属反应 ① 与O2反应: a.常温下,铝被氧气氧化,表面生成一层致密的氧化物薄膜,失去金属光泽。 b.点燃时,铝可以在氧气中燃烧,放出大量热和耀眼的白光,4Al+3O2点燃2Al2O3。 ② 与氯气、硫等非金属反应: 2Al+3Cl2点燃2AlCl3,2Al+3S Al2S3 (2)与酸的反应 ①与非氧化酸(盐酸、稀硫酸)反应, 2Al+6H+=2Al3++3H2↑ ②与氧化性酸(硝酸、浓硫酸)反应,不产生氢气(生成氮的氧化物和SO2)。 【注意】Al遇冷的浓硫酸、浓硝酸会钝化,但加热时可反应。 (3)与碱溶液的反应 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ (4)与金属氧化物的反应(铝热反应): ①方程式:2Al+Fe2O3高温2Fe+Al2O3。 ②引发方法:加少许KClO3,用镁条引燃。 ③反应特点:置换反应,放出大量的热。 ④用途:焊接钢轨,冶炼难熔金属。 三、铝的工业制法(电解熔融的Al2O3)*2Al2O3(熔融)通电4Al+3O2↑; 四、铝的用途 铝可以制炊具、电线、电缆、包装材料、防锈油漆、信号弹、燃烧弹,铝合金可用于制汽车、飞机等的构件。
五、氧化铝 1. 物理性质:白色固体,不溶于水,熔点高。由于Al2O3熔点高,难分解,因而可做良好的耐火材料。 2. 化学性质:两性氧化物 ①与酸反应:Al2O3+6H+=2Al3++3H2O ②与碱反应: Al2O3+2OH-+3H2O=2[Al(OH)4]- 六、氢氧化铝 1. 物理性质:不溶于水的白色胶状固体,具有吸附性。 2. 化学性质:两性氢氧化物 (1)与酸反应:Al(OH)3+3H+=Al3++3H2O (2)与碱反应:Al(OH)3+OH-=[Al(OH)4]- (3)受热易分解:大部分难溶性的氢氧化物在受热时可以分解生成相应的氧化物和水:2Al(OH)3 Al2O3+3H2O。
3. Al(OH)3的制法: (1)用铝盐与氨水反应制取 Al3++3NH3·H2O=Al(OH)3↓+3NH4+。 一般不用强碱溶液,因为 Al3++3OH-(少量)= Al(OH)3↓,Al3++4OH-(过量)=[Al(OH)4]-。 (2)四羟基合铝盐溶液中通入CO2制取 ①2[Al(OH)4]-+CO2(少量)=2Al(OH)3↓+CO32-+H2O; [Al(OH)4]-+CO2(过量)=Al(OH)3↓+HCO3-。 一般不用强酸溶液,因为 [Al(OH)4]+H+(少量)=Al(OH)3↓, [Al(OH)4]+4H+(过量)=Al3++4H2O。 4. Al(OH)3的用途:可作净水剂和色素吸附剂,还可用作治疗胃酸过多的药剂。 七、熟记以下重要关系式 1.2Al ~ 6H+ ~ 2Al3+ ~ 3H2 ~ 6e -; 2. 2Al ~ 2OH- ~ 2[Al(OH)4]- ~ 3H2 ~ 6e -; 3. Al3+ ~ 3OH -~ Al(OH)3↓; 4. Al3+ ~ 4OH- ~ [Al(OH)4]-; 5. [Al(OH)4]- ~ H+ ~ Al(OH)3↓; 6. [Al(OH)4]- ~ 4H+ ~ Al3+。
绳锯木断,水滴石穿。 每周记背(第22期) 铝 铜 金属材料 寇介芳 八、规律方法总结 1.既能与强酸溶液反应又能与强碱溶液反应的物质 ⑴单质:Al等;⑵两性氧化物:Al2O3等; ⑶两性氢氧化物:Al(OH)3等; ⑷弱酸的铵盐:如CH3COONH4、(NH4)2CO3、(NH4)2S等; ⑸多元弱酸的酸式盐:如NaHCO3、NaHSO3 NaHS等。 【注意】SiO2可以与NaOH溶液反应也可以与HF反应,但HF是弱酸。 2.不用其它试剂,用互滴法就可以鉴别的溶液有: ⑴CO32-与H+,如Na2CO3溶液与盐酸; ⑵Al3+与OH-,如AlCl3溶液与NaOH溶液; ⑶[Al(OH)4]- 与H+,Na[Al(OH)4]溶液与稀盐酸。 3. Mg2+和Al3+的检验方法: (1)加入过量的NaOH溶液,若产生白色沉淀则含有Mg2+ ; (2)加入过量的NaOH溶液,若先产生白色沉淀,后白色沉淀溶解,则含有Al3+。(限于中学化学学习范围) 4. 比较金属与酸的反应产生H2的量的多少的方法 (1)先看是否产生H2 ,淘汰浓硫酸、硝酸等不产生氢气的选项; (2)看过量情况,用少量物质计算; (3)注意过量Na与水反应的情况。 5.典型的不能一步转化的物质 (1)SiO2→H2SiO3 ; (2)CuO→Cu(OH)2;Fe2O3→Fe(OH)3;
