高考化学大一轮复习 第7讲 新情境下化学方程式、离子方程式书写的解题策略考题集萃实战演练
【高三化学复习】新情境下氧化还原型离子方程式的书写

③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转 化为单质溴,再用有机溶剂提取溴后,还可得到副产品
Na2SO4。这一过程可用化学方程式表示为__________ _____________________________________________。
【解析】(1)①湿法制备高铁酸钾时,Fe(OH)3失电子被 氧化生成K2FeO4,则ClO-作氧化剂被还原生成Cl-,氢氧 化铁必须在碱性条件下存在,所以该反应是在碱性条件
下进行,该反应的离子方程式为2Fe(OH)3+ 3ClO-+ 4OH- FeO24 ====2 +3Cl-+ 5H2O。 ②由反应的离子方程式知每生成1 mol K2FeO4转移电 子的物质的量为3 mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高 铁酸钾,说明相同条件下高铁酸钾的溶解度比高铁酸钠 的溶解度小。
____________________________________________。
【解析】(1)①根据信息,KMnO4在H2SO4作用下,把KCl氧
化成Cl2,本身被还原成Mn2+。②注意NaBiO3不能拆写成
离子形式。NaBiO3作为氧化剂,把Mn2+氧化成
MnO
4
,本
身被还原成Bi3+。
5.整体元素配平:通过观察法确定所有物质的化学计量 数。 6.三查检验验证:检查物质拆分是否正确,电荷、质量 是否守恒。
【高考模拟预测】 1.(1)(2016·北京高考改编)以废旧铅酸电池中的含铅 废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料, 制备高纯PbO,实现铅的再生利用。其工作流程如下:
高考化学大一轮复习 第七章 化学反应速率与平衡 第二节 化学平衡状态 新人教版

答案:A
课件ppt
2.一定条件下,对于可逆反应 X(g)+3Y(g) 2Z(g),若 X、Y、Z 的起始浓度 分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z 的浓度分别为 0.1 mol·L-1、 0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A.c1∶c2=3∶1 B.平衡时,Y 和 Z 的生成速率之比为 2∶3 C.X、Y 的转化率相等 D.c1 的取值范围为 0<c1<0.14 mol·L-1
角度一:极值思想在化学平衡状态中的应用
1.在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知 X2、Y2、Z 的起始浓 度分别为 0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平
衡时,各物质的浓度可能是( )
A.Z 为 0.3 mol·L-1 C.X2 为 0.2 mol·L-1
答案:< > < <
课件ppt
3.对一定条件下进行的可逆反应 N2+3H2 2NH3,若某一时刻: (1)n(N2)、n(H2)、n(NH3)不再随时间改变而改变,反应是否达到平 衡状态? (2)v(N2)∶v(H2)∶v(NH3)=1∶3∶2,反应是否达平衡状态? (3)v 正(N2)=v 逆(NH3)。此时反应是否达到平衡状态?
答案:②⑥⑨
课件ppt
4.在一个不传热的固定容积的密闭容器中,发生可逆反应 mA(g)+
nB(g) pC(g)+qD(g),当 m、n、p、q 为任意整数时,反应达到平衡的标
志是( )
①体系的压强不再改变
②体系的温度不再改变
③各组分的浓度不再改变
④各组分质量分数不再改变
2023年高考化学一轮复习考点过关检测卷07 离子共存(讲解版)

检测卷七 离子共存1.常温下,下列各组离子在指定溶液中能大量共存的是 A .pH=13的溶液:K +、Na +、Cl -、2-3SiOB .0.1mol·L -1HCl 溶液:Na +、Ca 2+、NO 3-、-3HCOC .()()+-c H c OH =1×10-14的溶液:Na +、+4NH 、Cl -、2-4SOD .0.1mol·L -1Na 2CO 3溶液:K +、Ba 2+、Cl -、OH - 【答案】 A【解析】A .常温下,pH=13的溶液中存在大量OH -,OH -、K +、Na +、Cl -、2-3SiO 之间不会发生反应,因此能够大量共存,故A 选;B .0.1mol·L -1HCl 溶液中存在大量H +、Cl -,H +与-3HCO 之间能够发生复分解反应生成CO 2、H 2O 或3HCO -,不能大量共存,故B 不选; C .溶液中()()+-c H c OH =1×10-14<1,说明溶液呈碱性,溶液中存在大量OH -,OH -与+4NH 之间能够发生复分解反应生成弱电解质NH 3·H 2O ,不能大量共存,故C 不选;D .0.1mol·L -1Na 2CO 3溶液中完全电离出Na +、23CO -,23CO -与Ba 2+之间能够发生复分解反应生成难溶物BaCO 3,不能大量共存,故D 不选; 综上所述,答案为A 。
2.下列各组离子一定能大量共存的是A .在含大量3+Fe 的溶液中: +4NH 、+Na 、-Cl 、-SCNB .在强碱溶液中: +Na 、+K 、-2AlO 、2-3COC .在+-13-1(H )=10mol L c ⋅的溶液中: +4NH 、3+Al 、2-4SO 、-3HCOD .在pH =1的溶液中: +K 、2+Fe 、-Cl 、-3NO 【答案】B【解析】A .Fe 3+、SCN -之间发生络合反应生成硫氰化铁,在溶液中不能大量共存,故A 不选;B .Na +、K +、-2AlO 、2-3CO 之间不反应,且都不与氢氧根离子反应,在碱性溶液中能够大量共存,故B 选;C .常温下c (H +)=10-13mol•L -1的溶液呈碱性,+4NH 、Al 3+能够与氢氧根离子反应,在碱性溶液中不能大量共存,故C 不选;D .常温下pH=1的溶液呈酸性,Fe 2+、-3NO 在酸性条件下能够发生氧化还原反应,在溶液中不能大量共存,故D 不选; 故选B 。
高考化学一轮总复习配套文档 第七章 第三节
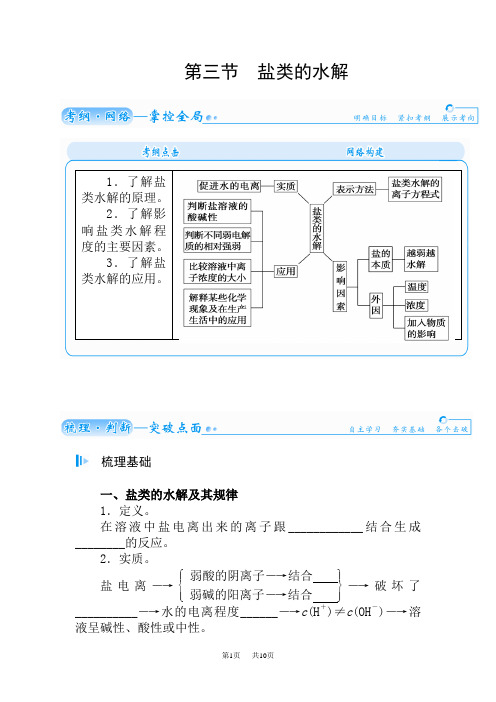
第三节 盐类的水解梳理基础一、盐类的水解及其规律 1.定义。
在溶液中盐电离出来的离子跟____________结合生成________的反应。
2.实质。
盐电离―→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫ 弱酸的阴离子―→结合 弱碱的阳离子―→结合 ―→破坏了__________―→水的电离程度______―→c (H +)≠c (OH -)―→溶液呈碱性、酸性或中性。
1.了解盐类水解的原理。
2.了解影响盐类水解程度的主要因素。
3.了解盐类水解的应用。
3.特点。
→水解反应是________反应→水解反应是________反应的逆反应→水解反应程度很________4.水解的规律。
有弱才水解,越弱越水解;谁强显谁性,同强显中性。
(1)书写形式。
在书写盐类水解方程式时一般要用“________”号连接,产物不标“↑”或“↓”,其一般形式为:盐+水酸+碱,用离子方程式表示为:盐中的弱离子+水_________。
(2)书写规律。
①一般盐类水解程度很小,水解产物很少,如果产物易分解(如NH 3·H 2O 、H 2CO 3)也不写成其分解产物的形式,如NH 4Cl 的水解离子方程式:_________________。
②多元弱酸盐的水解分步进行,以第一步为主,一般只写第一步水解的离子方程式,如Na 2CO 3的水解离子方程式:____________________________。
③多元弱碱阳离子的水解方程式一步写完,如FeCl 3的水解离子方程式:_________________________。
④能完全水解的离子组,由于水解程度较大,书写时要用“===”、“↑”、“↓”等,如NaHCO3与AlCl3混合溶液的反应离子方程式:_______________________________________。
二、盐类水解的影响因素及应用1.内因——盐本身的性质。
(1)弱碱越弱,其阳离子的水解程度就________,溶液酸性________。
高考化学(鲁科版)大一轮复习第7章化学反应的方向、限度与速率-第2节-高考真题重组

1.(2013·高考四川卷) 在一定温度下,将气体X 和气体Y 各0.16 mol 充入10 L 恒容密闭容器中,发生反应X(g)+Y(g)2Z(g) ΔH <0,一段时间后达到平衡。
反应过程中测定的数据如下表:下列说法正确的是( )A .反应前2 min 的平均速率v (Z)=2.0×10-3 mol/(L·min)B .其他条件不变,降低温度,反应达到新平衡前v (逆)>v (正)C .该温度下此反应的平衡常数K =1.44D .其他条件不变,再充入0.2 mol Z ,平衡时X 的体积分数增大解析:A.根据表中的数据可求得在前 2 min 内生成Z 为0.08 mol ,故v (Z)=0.08 mol10 L ×2 min=4×10-3mol/(L·min)。
B.由于该反应的正反应是放热反应,降低温度,平衡正向移动,v (逆)<v (正)。
C.根据平衡常数的表达式K =c 2(Z )c (X )·c (Y )=0.01220.01×0.01=1.44。
D.因该反应前后气体化学计量数和相等,其他条件不变时,再充入0.2 mol Z ,达到平衡时,其作用效果相当于保持Z 的物质的量不变,缩小容器的体积,X 的体积分数不变。
答案:C2.(2014·高考北京卷)一定温度下,10 mL 0.40 mol/L H 2O 2溶液发生催化分解。
不同时刻测得生成O 2的体积(已折算为标准状况)如下表。
A .0~6 min 的平均反应速率:v (H 2O 2)≈3.3×10-2mol/(L·min)B .6~10 min 的平均反应速率:v (H 2O 2)<3.3×10-2mol/(L·min)C .反应至6 min 时,c (H 2O 2)=0.30 mol/LD .反应至6 min 时,H 2O 2分解了50% 解析:2H 2O 2=====催化剂2H 2O +O 2↑ A .6 min 时,生成O 2的物质的量n (O 2)=22.4 mL ×10-3 L/mL22.4 L/mol=1×10-3mol ,依据反应方程式,消耗n (H 2O 2)=2×10-3mol , 所以0~6 min 时,v (H 2O 2)=2×10-3mol 0.01 L ×6 min≈3.3×10-2mol/(L·min),A 正确。
高考第一轮复习-离子反应相关题型解题思路

高考第一轮复习-离子反应相关题型解题思路----900f185e-7166-
11ec-894a-7cb59b590d7d
离子反应也是高考必考点,而且是得分点,每年至少有6分是考察的离子反应,这个
考点都是基础考题,因此是万万不能失分的考点。
相关知识点已在前一篇文章中描述。
高中第三方可以看看。
今天,我们主要讨论常见
的解决问题的想法。
离子共存问题,四步走,一看颜色,二看酸碱性,三看特殊反应,四看其他反应。
离子方程的书写有很多常规练习,但我们应该注意这个问题。
如果涉及到过多的问题、量化,以及放弃和被放弃之间的关系,我们必须清楚地看到和写清楚。
一定要相信问
题stem中给出的信息是为了测试你的观点。
一定要复习这个问题。
离子方程式的正确错误的判断,上图已经给出了要考察的内容,还要记住一个原则,
一定要选择排除法,将最明显的错误排除,实在有剩下模棱两可的,就将自己看着眼熟的,最为合理的选择上。
微专题2 与量有关的离子方程式及新情境下氧化还原反应方程式的书写
12
2.(1)KMnO4能与热的经硫酸酸化的Na2C2O4溶液反应,生成Mn2+和CO2,该反应的离子方
程式是
。
(2)生产硫化钠大多采用无水芒硝(Na2SO4)——炭粉还原法,若煅烧后所得气体为等物质
的量的CO和CO2,写出煅烧时发生反应的化学方程
式:
3Na2SO4+8C
3Na2S+4CO↑+4CO2↑
3Na2S2O3+CO2
。
微专题2 与量有关的离子方程式及新情境下氧化还原反应方程式的书写
9
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO
在强碱性条件下反应可制取K2FeO4,其反应的离子方程式
为
。
(5)KMnO4的氧化性随pH的减小而增强,在酸性介质中还原产物是Mn2+,在中性或碱性介
2021届
高考第一轮复习
化学物质及其变化
2
微专题2 与量有关的离子方程式及新情境下 氧化还原反应方程式的书写
变化观念与模型认知:建立变化观念,能够根据题目信息结合有关变化规律判断反应物 和生成物。并能够结合氧化还原反应配平原理形成思维模型,根据模型快速解题。
一、与量有关的离子方程式的书写 1.连续型 (1)向多元弱酸的盐溶液中滴加强酸溶液,一般先生成弱酸的酸式盐,强酸过量则生成弱 酸,如向Na2CO3溶液中滴加盐酸,首先生成NaHCO3,盐酸过量时生成CO2。
1.按要求写出下列离子方程式。 (1)NaHCO3溶液与Ca(OH)2溶液混合 Ca(OH)2少量: Ca(OH)2足量: (2)Ca(HCO3)2溶液与NaOH溶液混合 Ca(HCO3)2少量: Ca(HCO3)2足量:
新情境下方程式的书写
新情境方程式的书写1.已知:25℃时,K sp[Mg(OH)2]=1.8×10—11,K sp [Cu(OH)2]=2.2×10−20。
在25℃下,向浓度均为0.1 mol·L—1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为。
2.将足量二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。
请写出二氧化氯溶液和硫化氢溶液反应的离子方程式。
3.含CN−的污水危害很大,处理污水时,可在催化剂TiO2作用下用NaClO将CN− (C为+2价)氧化成CNO− (C为+4价),CNO−在酸性条件下继续被NaClO氧化生成N2和CO2。
试写出上述两步反应的离子方程式,___________________________________________________________________ 。
4.MnO2粗品中含有少量的Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2。
写出Mn3O4和稀硫酸反应的化学方程式。
5.加适量稀硫酸酸化,H2O2与KMnO4反应的离子方程式如下:2MnO4—+5H2O2+6H+==2Mn2++5O2↑+8H2O;若不加稀硫酸酸化,MnO4−被还原为MnO2,其离子方程式为。
6.在CuSO4酸性溶液中加入一定量的Na2SO3和NaCl溶液,加热后生成CuCl沉淀,写出该过程的离子方程式。
7.辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,MnO2能将金属硫化物中的硫氧化为单质硫,将辉铜矿软锰矿共同用硫酸酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等。
写出该反应的化学方程________________________________________________________________________________________8.根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 第7讲
类型1
(1)(2017·全国卷Ⅲ)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,
生成H3AsO4和单质硫。写出发生反应的化学方程式:__2As2S3+5O2+6H2O===4H3AsO4+6S__。
(2)(2016·浙江卷)已知Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标
况下的密度为1.518 g·L-1),写出该反应的离子方程式:__Fe3S4+6H+===3Fe2++3H2S↑+
S__。
(3)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
__4H++5ClO-2===Cl-+4ClO2↑+2H2O__。
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是
无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:__4KClO3=====
400 ℃
KCl+3KClO4__。
解析 (2)根据题意Fe3S4与稀硫酸反应,生成的淡黄色不溶物为S,气体的摩尔质量为
1.518 g·L-1×22.4 L·mol-1=34 g·mol-1,故应为H2S,硫元素化合价升高,故产物还有
Fe2+,反应的离子方程式为Fe3S4+6H+===3Fe2++3H2S↑+S。(4)由原子守恒知无氧酸盐为氯
化钾,氯酸钾中+5价氯降低到-1价,反应为氧化还原反应,另一种盐中氯的化合价得升
高,得到高氯酸钾,利用氧化还原反应中得失电子守恒配平即可。
类型2
(1)NaAlH4是一种重要的还原剂。写出NaAlH4与水发生氧化还原反应的化学方程式:
__NaAlH4+2H2O===NaAlO2+4H2↑__。
(2)PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:__PF5+4H2O===H3PO
4
+5HF__。
解析 (1)NaAlH4与H2O发生氧化还原反应时,NaAlH4是还原剂,H2O是氧化剂,H2既是氧
化产物又是还原产物,最后由得失电子相等和质量守恒配平得NaAlH4+2H2O===NaAlO2+
4H2↑。(2)PF5中,磷元素为+5价,则水解产物为H3PO4和HF。
类型3
(1)将黑色的Fe2S3固体加入足量盐酸中,溶液中有淡黄色固体生成,该反应的化学方程
式为__Fe2S3+4HCl===S↓+2FeCl2+2H2S↑__。
(2)铁的一种含氧酸根FeO2-4具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,
并有无色气体产生,该反应的离子方程式是__4FeO2-4+20H+===4Fe3++3O2↑+10H2O__。
类型4
(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
电解时发生反应的化学方程式为__NH4Cl+2HCl=====电解3H2↑+NCl3__。
(2)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各
组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为__2H2S=====高温2H2+S2__。
解析 (1)酸性条件下不能生成NH3,根据产物NCl3和H2,写出电解方程式为NH4Cl+
2HCl=====电解3H2↑+NCl3。(2)设H2S分解的方程式为nH2nH2+Sn,观察图像,1 100 ℃时
生成的两种组分的体积分数之比为20%∶10%=2∶1,所以n=2,H2S分解的方程式为
2H2S=====高温2H2+S2。
