醋酸纤维素薄膜电泳指导
醋酸纤维素薄膜电泳
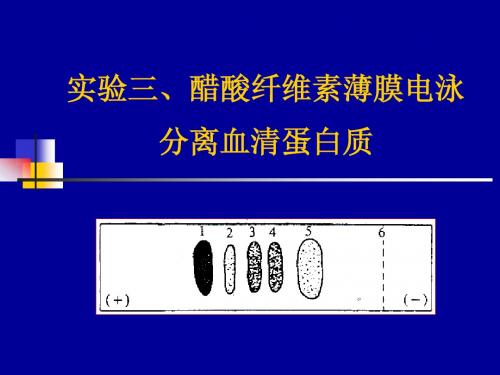
各种蛋白质由于氨基酸组成、分子量、等电点 及形状不同,在电场中的迁移速度不同。 以醋酸纤维素薄膜为支持物,正常人血清在 pH8.6的缓冲体系中电泳,染色后可显示5条主 要区带。其中清蛋白的泳动速度最快,其余依 次为α1-、α2-、β-及γ-球蛋白。
三、实验材料
醋酸纤维薄膜(2×8 cm) 镊子
5. 放薄膜的时候毛面朝下,要注意放平,与 滤网充分接触,但不要接触点样端。 6. 电泳时应选择合适的电流强度,一般电流 强度为0.4~0.6mA/cm膜宽度。电流强度高, 则热效应高;电流过低,则样品泳动速度慢 且易扩散。
7. 操作过程为防止指纹污染,应戴手套。
采用醋酸纤维薄膜作为支持物的电泳方法称为 醋酸纤维素薄膜电泳。
醋酸纤维素薄膜具有均一的泡沫状的结构,厚 度约为120 μm,有很强的通透性,对分子移动 阻力很小,该法具有微量、快速、简便、分辨 力高,对样品无拖尾和吸附现象等优点。
本实验以醋酸纤维素为电泳支持物,分离各种 血清蛋白。
血清中各主要蛋白质的等电点均低于pH8.6, 在该缓冲液中均带负电荷,在电场中向正极移 动。血清中含有清蛋白、α-球蛋白、β-球蛋白、 γ-球蛋白和各种脂蛋白等。
2. 点样时,应将薄膜表面多余的缓冲液用滤纸 吸去,以免引起样品扩散。但不宜太干,否则 样品不易进入膜内,造成点样起始点参差不起, 影响分离效果。
3. 点样时,点样不要过多,恰到好处,动作 要轻、稳,用力不能太大,以免损坏膜片或 印出凹陷影响电泳区带分离效果。 4. 醋酸纤维素薄膜电泳常选用pH8.6巴比妥- 巴比妥钠缓冲液,其浓度为0.05~0.09 mol/L。 (选择何种浓度与样品和薄膜的厚薄有关。缓 冲液浓度过低,则区带泳动速度快区带扩散 变宽;缓冲液浓度过高,则区带泳动速度慢, 区带分布过于集中,不易分辨。)
电泳分析常用方法

电泳分析常用方法(一)醋酸纤维素薄膜电泳醋酸纤维素是提纤维素的羟基乙酰化形成的纤维素醋酸酯。
由该物质制成的薄膜称为醋酸纤维素薄膜。
这种薄膜对蛋白质样品吸附性小,几乎能完全消除纸电泳中出现的“拖尾”现象,又因为膜的亲水性比较小,它所容纳的缓冲液也少,电泳时电流的大部分由样品传导,所以分离速度快,电泳时间短,样品用量少,5靏的蛋白质可得到满意的分离效果。
因此特别适合于病理情况下微量异常蛋白的检测。
醋酸纤维素膜经过冰醋酸乙醇溶液或其它透明液处理后可使膜透明化有利于对电泳图谱的光吸收扫描测定和膜的长期保存。
⒈材料与试剂醋酸纤维素膜一般使用市售商品,常用的电泳缓冲液为pH8.6的巴比妥缓冲液,浓度在0.05-0.09mol/L。
⒉操作要点⑴膜的预处理:必须于电泳前将膜片浸泡于缓冲液,浸透后,取出膜片并用滤纸吸去多余的缓冲液,不可吸得过干。
⑵加样:样品用量依样品浓度、本身性质、染色方法及检测方法等因素决定。
对血清蛋白质的常规电泳分析,每cm加样线不超过1靗,相当于60-80靏的蛋白质。
⑶电泳:可在室温下进行。
电压为25V/cm,电流为0.4-0.6mA/cm宽。
⑷染色:一般蛋白质染色常使用氨基黑和丽春红,糖蛋白用甲苯胺蓝或过碘酸-Schiff试剂,脂蛋白则用苏丹黑或品红亚硫酸染色。
⑸脱色与透明:对水溶性染料最普遍应用的脱色剂是5%醋酸水溶液。
为了长期保存或进行光吸收扫描测定,可浸入冰醋酸:无水乙醇=30:70(V/V)的透明液中。
(二)凝胶电泳以淀粉胶、琼脂或琼脂糖凝胶、聚丙烯酰胺凝胶等作为支持介质的区带电泳法称为凝胶电泳。
其中聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)普遍用于分离蛋白质及较小分子的核酸。
琼脂糖凝胶孔径较大,对一般蛋白质不起分子筛作用,但适用于分离同工酶及其亚型,大分子核酸等应用较广,介绍如下:⒈琼脂糖凝胶电泳的原理概述琼脂糖是由琼脂分离制备的链状多糖。
醋酸纤维薄膜电泳实验总结

二 ︑ 实 验 原 理
电泳是指带电质点在电场中向本身所带电荷相反的电极移 动的现象。在一定pH条件下,不同的质点由于具有不同的等 电点而带不同性质的电荷,因而在一定的电场中它们的移动 方向和移动速度也不同,即它们的电泳迁移率不同,因此, 可使它们分离 影响电泳迁移率的外界因素:电场强度、溶液的pH值、溶 液的离子强度和电渗现象 影响电泳迁移率的内在因素:质点所带净电荷的量、质点 的大小和形状 采用醋酸纤维薄膜作为支持物的电泳方法称为醋酸纤维素 薄膜电泳。醋酸纤维素薄膜电泳具有微量、快速、简便、分 辨力高,对样品无拖尾和吸附现象等优点 醋酸纤维素是纤维素的羟基乙酰化所形成的纤维素醋酸酯 ,将它溶于有机溶剂(如:丙酮、氯仿、氯乙烯、乙酸乙酯 等)后,涂抹成均匀的薄膜则成为醋酸纤维素薄膜。该膜具 有均一的泡沫状的结构,厚度约为120 μm,有很强的通透 性,对分子移动阻力很小
04
七 ︑ 实 验 结 果
从左至右分别为血清蛋白、α 1-球蛋白、α 2-球 蛋白、β-球蛋白、γ -球蛋白、点样处
06
07
09
实验结果既有清晰的图谱,也有模糊不清的图谱
拖尾状:点样量过多,被分离的血清蛋白不能分离成5条 区带或产生拖尾。 有斑点:点样不均匀,不整齐,导致被分离的区带出现 斑点。 边流现象:点样板蘸取血清一边多一边少,导致区带分 离不清,出现边流现象。 区带模糊:薄膜过湿,样品扩散Байду номын сангаас速,导致样品分离不 成区带。 锯齿状:薄膜用滤纸吸水过度(薄膜上出现白斑)或点 样过慢,又未及时大桥,导致薄膜过于干燥,使区带成锯 齿状。 区带倾斜:薄膜搭载滤纸上的位置歪斜,弯曲,与电流 方向不平行,或点样一边多一边少,区带容易泳斜。 显色过浅:点样太少,区带显色不明显。 区带重叠:染色时,醋酸纤维薄膜不是一张一张放入染 色液的,在染色固定前,薄膜与薄膜之间重叠,造成薄膜 上还未固定的血清蛋白彼此粘连。 区带过密:电泳时电压,电流或电泳过小或时间不够, 造成区带未分离。
血清蛋白的醋酸纤维薄膜电泳课件

血清蛋白的醋酸纤维薄膜电泳
5
五、实验操作
➢浸泡:将2×8 cm醋酸纤维薄膜迎着光辨别光泽面和无光泽面。在无光 泽面距短边一端1.5 cm处用铅笔轻轻画一条点样线,将之置于盛有缓冲液 的平皿中,浸泡30 min方可用于点样
➢点样:用镊子取出浸透的薄膜,夹在两层粗滤纸内吸干多余的缓冲液, 然后平铺在玻璃板上(无光泽面朝上)。在另一 载玻片上滴一滴血清, 点样器(用盖玻片的一边)在血清上蘸一下(可来回移动一次),再将点 样器轻印在加样线上,使血清渗透到薄膜内,形成均匀的直线
一、实验目的
✓了解电泳技术的一般原理 ✓学习醋酸纤维薄膜电泳的操作
血清蛋白的醋酸纤维薄膜电泳
1
二、实验原理
➢ 电泳是指带电质点在电场中向本身所带电荷相反的电极移动的现象。在 一定pH条件下,不同的质点由于具有不同的等电点而带不同性质的电 荷,因而在一定的电场中它们的移动方向和移动速度也不同,即它们的 电泳迁移率不同,因此可使它们分离
则成为醋酸纤维素薄膜。该膜具有均一的泡沫状的结构,厚度约为 120μm,有很强的通透性,对分子移动阻力很小
醋酸纤维素薄膜电泳是近年来推广的一种新技术,它具有微量、快速、 简便、分辨力高,对样品无拖尾和吸附现象等优点
本实验以醋酸纤维素为电泳支持物,分离各种血清蛋白。血清中含有清 蛋白、α-球蛋白、β-球蛋白、γ-球蛋白和各种脂蛋白等。各种蛋白质由于 氨基酸组成、分子量、等电点及形状不同,在电场中的迁移速度不同。 以醋酸纤维素薄膜为支持物,正常人血清在pH8.6的缓冲体系中电泳,染 色后可显示5条区带。其中清蛋白的泳动速度最快,其余依次为α1-、α2-、 β-及γ-球蛋白
➢电泳:将点样端的薄膜平贴在阴极电泳槽支架的滤纸桥上(点样面朝 下),另一端平贴在阳极端支架上。盖上电泳槽盖,使薄膜平衡10 min。 通电,调节电压至160 V,电流强度为0.4~0.6 mA/cm膜宽度,电泳时间约 25 min
醋酸纤维素薄膜电泳实验讨论

醋酸纤维素薄膜电泳实验讨论醋酸纤维素薄膜电泳实验讨论引言:醋酸纤维素薄膜电泳是一种常用的分离和分析技术,广泛应用于生物医学、环境监测和食品安全等领域。
本实验旨在探究醋酸纤维素薄膜电泳在分离和分析中的应用,并进一步研究其影响因素以及优化条件。
实验方法:1. 准备醋酸纤维素薄膜:将质量浓度为4%的醋酸纤维素溶液在玻璃片上匀开,然后在60℃恒温槽中干燥30分钟;2. 准备电泳缓冲液:将100mM的特定缓冲液配制好,保持pH稳定;3. 准备样品:将待测样品进行处理,如酶解、过滤等;4. 实施电泳实验:将醋酸纤维素薄膜与玻璃片固定在电泳板上,注入电泳缓冲液至电极孔上方,然后将样品涂抹在薄膜上,按照特定电压和时间进行电泳。
实验结果:经过实验,我们发现醋酸纤维素薄膜电泳可以有效地分离待测样品中的目标成分。
通过调节电压和时间,我们发现改变这两个参数可以影响分离效果。
在本实验中,我们进行了一系列实验,对不同电压和时间条件下的分离效果进行了分析。
首先,当电压在80V~120V范围内逐渐增加时,电泳分离的效果呈现出明显的改善。
这是因为较高的电压可以提高电泳速度,使目标成分在薄膜上移动的距离更短,从而加快分离过程。
然而,当电压过高时,可能会发生样品电泳坍塌和电解液温升,导致分离效果下降。
其次,我们发现时间对分离效果的影响也很明显。
在时间较短的情况下,目标成分无法完全分离,而在时间较长的情况下,目标成分已经移出薄膜,导致无法检测到。
因此,我们需要根据待测样品的特点和所需分离程度来选择合适的时间。
讨论:本实验结果表明醋酸纤维素薄膜电泳可以作为一种有效的分离和分析技术,同时也揭示了影响分离效果的关键因素。
在进行实际应用时,我们需要根据待测样品的特点和所需分离程度来选择合适的电压和时间条件。
此外,在实验过程中应注意控制电解液的pH值和温度,以保证实验结果的准确性和重复性。
总结:醋酸纤维素薄膜电泳是一种有效的分离和分析技术,可以应用于生物医学、环境监测和食品安全等领域。
【精选】醋酸纤维素薄膜电泳

正极
负极
- - - - - - - -- - - - - - - - + + + + + + + ++ + + + + + + +
表面带负电荷 带正电荷的水层携带粒子向负极移动
如果样品应移向负极,则泳动速度加快;
如果样品应移向正极,则泳动速度减慢。
显微电泳
分类
自由电泳
等电聚焦电泳
(无支持体) 等速电泳
阻力: F’ = 6πrηυ
当电泳达到平衡时,带电颗粒匀速运动: F = F’
QE = 6πrην
ν
Q
=
E 6πrη
• 迁移率: 即ν/E,表示单位电场强度时粒子运动的速度。 该值在 一定条件下决定于粒子本身的性质,即其所带电荷、大小和形状.
影响电泳速度的因素
• 样品本身:带电量、分子大小、形状 • 电场强度:电压 • 缓冲液:成分、pH、离子强度(0.02-0.2 M) • 支持介质:电渗作用、吸附作用 • 温度
电泳
密度梯度电泳
垂直板电泳槽
滤纸电泳(常压及高压)
区带电泳 薄层电泳(薄膜及薄板) (有支持体)
凝胶电泳(琼脂、琼脂糖、淀粉胶、聚丙烯酰胺)
圆盘电泳槽
水平电泳槽
双向电泳
醋酸纤维薄膜电泳
• 醋酸纤维素薄膜电泳以醋酸纤维素薄膜为支持物。 • 醋酸纤维素是纤维素的醋酸酯,将其溶于丙酮等有机
溶液中,可涂布成均一细密的微孔薄膜。待有机溶剂 挥发后,即为白色不透明的醋酸纤维薄膜。该膜具有 均一的泡沫状的结构,厚度约为120μm,有很强的通 透性,对分子移动阻力很小。
血清蛋白质的醋酸纤维素薄 膜电泳
实验目的
1.掌握电泳的基本原理,了解电泳仪和电泳 槽的功能。
实验四血清蛋白的醋酸纤维薄膜电泳
• 4. 染色
取出纤维薄膜——放于培养皿染色液中染 色10min.
• 5. 漂洗
取出纤维薄膜——放在漂洗液中漂洗数 次——漂洗到可见色带清晰的电泳图谱。
• 6. 定量测定
• 2 点样:
• 取出2块载玻片——分别滴一滴血清蛋 白A和血清蛋白B——然后用盖玻片的平边 取样(注意均匀)——然后轻轻的在纤维 薄膜的铅笔横线上点样(注意要轻)
• 3 电泳:
• 在电泳槽中搭建好滤纸桥——倒入缓冲 液(注意两边液面高度一致)——将纤维 薄膜架于桥上(点样端靠近负极,点样面 朝下)——接好导线——调节电泳仪参 数——电泳30min
• 醋酸纤维薄膜电泳是用醋酸纤维薄 膜作为支持物的电泳方法。
• 醋酸纤维薄膜由二乙酸纤维素制成,ቤተ መጻሕፍቲ ባይዱ它具有均一的泡沫样的结构,有强渗透 性,对分子移动无阻力,作为区带电泳 的支持物进行蛋白电泳有简便、快速、 样品用量少,应用范围广,分离清晰, 没有吸附现象等优点。
二 实验步骤
• 1. 浸泡
用镊子取醋酸纤维薄膜1张——分别 光泽面和粗糙面——然后在粗糙面离 边缘2cm处用铅笔轻轻的画一条与边 缘平行的直线(为了点样方便)—— 然后将薄膜放在巴比妥缓冲液中浸泡 20min——用镊子取出纤维薄膜——y 用滤纸吸干——平置于载玻片上(粗 糙面朝上)
实验四 醋酸纤维薄膜电泳2008
实验结果
醋酸纤维素薄膜电泳的实验结果 1.全血清电泳图谱 2.血清清蛋白电泳图谱 3.γ-球蛋白电泳图谱
注意事项
1、薄膜内不含杂质和膜条厚度要均匀。 2、点样时醋酸纤维薄膜以不干不湿为 宜;掌握好点样的力度;要控制好点样 的量;血清离膜条两侧要空1 - 2 m m ; 3、点样的膜条要马上搭在滤纸桥上, 而且,膜条要紧贴滤纸桥。 4、在染色固定前要谨防薄膜之间重叠, 杜绝血清蛋白彼此粘连的现象。
实验步骤
• 六、透明 透明 • 用滤纸吸干薄膜,浸入透明液的甲液中,2min 后立即取出,再浸入透明液的乙液中,1min后迅 速取出,紧贴在载物片上,赶出气泡。约2-3min 内薄膜完全透明,放置10-15min后,用吹风机将 膜吹干。在水笼头下将玻璃板上透明的薄膜润湿 后,用单面刀片从膜的一角撬起,并划开一端, 再用手捏住撬起的膜轻轻撕下,可以顺利地从玻 璃板上取下透明的薄膜。用滤纸吸干,浸入液体 石腊中,约3min后取出。再用干净的滤纸吸干, 压平,则成为色泽鲜艳而又透明的血清蛋白醋酸 纤维薄膜电泳图谱,可以长期保存不褪色。
实验原理
6.目前已广泛用于分析检测血浆蛋白、脂蛋白、 . 糖蛋白、核酸及其他生物大分子,为心血管疾病、 肝硬化及某些癌症鉴别诊断提供了可靠的依据, 因而已成为医学和临床检验的常规技术。 7.本实验以醋酸纤维素为电泳支持物,分离各种血 7. 清蛋白。血清中含有清蛋白、α-球蛋白、β球蛋白、γ-球蛋白和各种脂蛋白等。各种蛋白 质由于氨基酸组成、分子量、等电点及形状不 同,在电场中的迁移速度不同。以醋酸纤维素 薄膜为支持物,正常小牛血清在pH8.6的缓冲体 系中电泳,染色后可显示4条区带。其中清蛋白 的泳动速度最快,其余依次为α-、β-及γ-球 蛋白。
实验步骤
醋酸纤维薄膜电泳实验总结
3、根据人血清中蛋白各组分的等电点,估计它们在 pH8.6的巴比妥电极缓冲液中电泳移动的相对位置。
九 ︑ 实 验 思 考
答:
蛋白名称
等电点
血清蛋白
α1-球蛋白 α2-球蛋白 β-球蛋白 γ-球蛋白
4.88
5.06 5.06 5.12 6.85-7.50
巴比妥电极缓冲液的pH为8.6,蛋白的等电点均低于 它,因此蛋白带负电荷,向正极移动。速度为血清蛋 白>α 1-球蛋白>α 2-球蛋白>β-球蛋白>γ -球蛋白 。因此,在电泳图谱上位置由左向右依次为血清蛋白 、α 1-球蛋白、α 2-球蛋白、β-球蛋白、γ -球蛋白。
八 ︑ 失 败 图 谱 分 析
九 ︑ 实 验 思 考
1、为什么要将点样一端放在电泳槽的负极?
答:带电质点在电场中向本身所带电荷相反的电极移动 。因为血清样品带负电荷,在电场中将向正极泳动,所 以点样端要置于负极。 2、电泳时电压表显示的电压是否等于加在膜条两端的 实际电压,为什么?
答:不相等。因为在实际中缓冲液两边离子不平衡。
五 ︑ 实 验 过 程
浸泡:将2×8 cm醋酸纤维薄膜迎着光辨别光泽面和无光 泽面。将粗糙面朝上置于盛有缓冲液的平皿中,浸泡 20min方可用于点样
点样:用镊子取出浸透的薄膜,夹在两层粗滤纸内吸干 多余的缓冲液,然后平铺在玻璃板上(无光泽面朝上)。 在另一载玻片上滴一滴血清,点样器(用盖玻片的一边) 在血清上蘸一下(可来回移动一次),再将点样器轻印在 加样线上,使血清渗透到薄膜内,形成均匀的直线
五 ︑ 实 验 过 程
电泳槽的准备:根据电泳槽膜支架的宽度,裁剪尺寸合 适的滤纸条。在两个电极槽中,各倒入等体积的电泳缓冲 液,在电泳槽的两个膜支架,各放两层滤纸条,使滤纸一 端的长边与支架前沿对齐,另一端浸入电泳缓冲液中。当 滤纸全部润湿后,用玻璃棒轻轻挤压在膜支架上的滤纸以 驱赶气泡,使滤纸的一端能紧贴在膜支架上,即为滤纸桥
实验四 血清蛋白的醋酸纤维薄膜电泳 ppt课件
实验四 血清蛋白的醋酸纤维薄膜电泳
分子越小,泳动速度越快 带电量越多,泳动速度越快
γ
β α2 α1 清蛋白
15
实验四 血清蛋白的醋酸纤维薄膜电泳
2.定性,定量
• 膜条经过氨基黑10B染色后显出清晰色带。 • 各色带蛋白质含量与染料结合量基本成正比。 • 可将各色带剪开,分别溶于碱性溶液中。 • 用分光光度法计算各种蛋白质的百分数。
(三)电泳 点样端薄膜平贴阴极电泳槽支架滤纸桥 (点样面朝下) 另一端平贴在阳极端支架 要求:薄膜紧贴滤纸桥并绷直,薄膜之间相隔几毫米 盖电泳槽盖,平衡10min 打开电源开关,调节电流强度为0.3mA/片,通电10min 调节电流强度为0.5mA/片,电泳60~90min 电泳后调节旋钮电流为O,关闭电泳仪切断电源
电泳速度:带电粒子在电场中运动时,单位电 场强度内粒子运动的速度,以u表示,即
u= V = Q X 6πrη
V—粒子运动的速度 X—电场强度 Q—粒子所带电荷 r—粒子的半径 η—介质的粘度
5
实验四 血清蛋白的醋酸纤维薄膜电泳
影响电泳速度的因素
1.样品本身:
u= V = Q X 6πrη
Q越多,u越大;
38
实验四 血清蛋白的醋酸纤维薄膜电泳
5.区带拖尾:缓冲液离子强度小于0.05 6. 染色后清蛋白中间色浅:染色时间不足,或清蛋白量过高
减少样品用量或延长染色时间
39
α2球蛋白4%~9%,β球蛋白6.5%~12% γ球蛋白12%—20%
31
实验四 血清蛋白的醋酸纤维薄膜电泳
可能相关疾病 骨髓瘤 肾病综合症 肾炎 肝硬化 急性肝坏死 传染性肝炎 急性感染初期 慢性炎症/感染后期 低球蛋白血症
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
醋酸纤维素薄膜电泳指导
醋酸纤维素薄膜电泳是一种常用的分离和纯化生物大分子的方法。
本文将对醋酸纤维素薄膜电泳的操作步骤进行详细介绍,并提供实验指导。
一、实验材料准备
1. 醋酸纤维素薄膜:可准备自制醋酸纤维素薄膜或购买商用的醋酸纤维素薄膜。
2. 缓冲液:根据需要选择适当的缓冲液,常用的有Tris缓冲液、磷酸盐缓冲液等。
3. 模版DNA:准备需要分离和纯化的DNA样品。
4. 电泳仪和电源:确保电泳仪和电源的正常工作。
二、膜制备
1. 制备醋酸纤维素溶液:将适量醋酸纤维素加入足够的乙醇中,并充分搅拌溶解。
2. 漏斗滴膜:将制备好的醋酸纤维素溶液倒入装有膜模的漏斗中,边转动漏斗边滴膜于预处理过的载玻片上,使其均匀涂布在玻片上。
3. 干燥膜:将滴膜后的载玻片在通风处自然干燥,确保膜完全干燥后再进行下一步操作。
三、电泳条件设定
1. 调节电泳仪:按照电泳仪的设备说明书正确设置电泳仪的参数,如电压、时间等。
2. 准备缓冲液:根据实验需要选择合适的缓冲液,并按照比例配置好缓冲液。
3. 进行预电泳:将准备好的醋酸纤维素薄膜浸入缓冲液中,进行预电泳处理。
四、样品处理和装载
1. DNA片段制备:将目标DNA打断成合适的片段大小,并使用聚丙烯酰胺凝胶电泳分析确认打断效果。
2. 样品加载:将制备好的DNA样品加载到醋酸纤维素薄膜上,可采用直接加载或间接加载的方式。
五、电泳操作
1. 启动电泳:将装有DNA样品的醋酸纤维素薄膜浸入缓冲液中,确保电泳液覆盖薄膜,并启动电源。
2. 电泳过程:根据需求设定合适的电源参数,进行电泳分离。
注意观察电泳过程,确保电泳效果和样品分离。
3. 停止电泳:根据实验需要设定合适的电泳时间,完成电泳后断开电源。
六、薄膜处理和分析
1. 取出薄膜:将电泳结束的薄膜小心取出,避免扭曲或损坏。
2. 染色处理:可根据需要选择合适的染色方法染色薄膜上的DNA 样品,如乙锐亮绿、溴化乙锭等染料。
3. 分析结果:使用合适的分析工具,如UV-Vis分光光度计、荧光成像仪等,对薄膜上的DNA样品进行定量或定性分析。
七、结果解读
根据分析结果,结合实验目的和先前的研究,对分析结果进行解读和分析。
可以参考相关文献和实验室组内讨论,以得出准确的结论和进一步的研究方向。
总结:
醋酸纤维素薄膜电泳是一种广泛应用于生物大分子分离和纯化的技术。
本文提供了详细的实验操作指导,从材料准备到电泳条件设定,再到样品处理和分析,全面介绍了醋酸纤维素薄膜电泳的操作步骤。
通过正确的实验操作和结果解读,可以有效地利用醋酸纤维素薄膜电泳方法进行生物大分子的分离和纯化。
