醋酸纤维素薄膜电泳
醋酸纤维素薄膜电泳

实验步骤
注意事项
1. 点样面为不光滑面,勿用手触摸; 2. 点样量适中,垂直居中点样; 3. 点样端靠近电泳仪负极; 4. 膜条背面朝上放置,需与滤纸贴紧,拉直。
思考题
• 分析影响电泳的各个因素。
• 分析自己的实验结果,针对本实验的各项操作提出改进意见。
阻力: F’ = 6πrηυ QE = 6πrην
当电泳达到平衡时,带电颗粒匀速运动: F = F’
ν Q = E 6πrη
• 迁移率: 即ν/E,表示单位电场强度时粒子运动的速度。 该值在
一定条件下决定于粒子本身的性质,即其所带电荷、大小和形状.
影响电泳速度的因素
• 样品本身:带电量、分子大小、形状
• 电场强度:电压
• 缓冲液:成分、pH、离子强度(0.02-0.2 M) • 支持介质:电渗作用、吸附作用 • 温度
正极
- - - - - - - -- - - - - - - - + + + + + + + ++ + + + + + + +
负极
表面带负电荷 带正电荷的水层携带粒子向负极移动
如果样品应移向负极,则泳动速度加快; 如果样品应移向正极,则泳动速度减慢。
分类
电泳
显微电泳 自由电泳 等电聚焦电泳 (无支持体) 等速电泳 密度梯度电泳 滤纸电泳(常压及高压) 区带电泳 薄层电泳(薄膜及薄板) (有支持体) 凝胶电泳(琼脂、琼脂糖、淀粉胶、聚丙烯酰胺)
垂直板电泳槽
圆盘电泳槽
水平电泳槽
双向电泳
醋酸纤维薄膜电泳
• 醋酸纤维素薄膜电泳以醋酸纤维素薄膜为支持物。 • 醋酸纤维素是纤维素的醋酸酯,将其溶于丙酮等有机
血清蛋白质的醋酸纤维素薄
膜电泳
血清醋酸纤维素薄膜电泳

取出膜,用滤纸吸干即可。
17
医学ppt
操作步骤
血浆蛋白醋酸纤维素薄膜电泳图谱
电泳方向
-
+
γ
β
α2 α1
A
纤维蛋白原
18
医学ppt
操作步骤
7、透明 薄膜完全干燥后,浸入透明液中20min后,
取出平贴在玻璃板上(不要留有气泡),完全 干燥后即成透明的薄膜图谱,要作扫描或照相 用。可长期保存。
醋酸纤维素是纤维素的羟基乙酰化所形成
的纤维素醋酸酯,将它溶于有机溶剂(如丙酮 、
氯仿、氯乙烯、乙酸乙酯等)后,涂抹成均匀
的薄膜,干燥后就成为醋酸纤维素薄膜。该膜
具有均一的泡沫状结构,厚度约为120μm,通
透性好,对分子移动阻力少,是一种良好的电
泳支持物。
3
医学ppt
醋酸纤维素薄膜电泳的优点及应用
具有微量、快速、简便、区带清晰、灵敏度高、 便于摄影和保存等优点。
28
医学ppt
注意事项
1、最好选用同一批号、厚薄均匀、质量良好 的醋纤膜。
2、样品要新鲜。 3、点样要细窄、均匀、集中。 4、盐桥要平整。 5、电泳槽盖要密封。 6、室温不宜过高。
29
医学ppt
注意事项
7、选择合适的缓冲液离子强度。 8、两电泳槽内缓冲液面应在同一水平面。 9、要控制好电压、电流和电泳时间。 10、电泳槽内两极溶液要交替使用,操作时应
6、镊子
7、试管、试管架、吸量管 8、分光光度计
(定量用)
9
医学ppt
操作步骤
1、薄膜准备 ①将醋酸纤维素薄膜切成2×8cm的小条。 ②在薄膜粗面一端1.5cm处用铅笔轻轻画一横线。 ③在薄膜角上用铅笔作一标记。 ④将醋酸纤维素薄膜浸泡于缓冲液中20min。
醋酸纤维素薄膜电泳原理

醋酸纤维素薄膜电泳原理醋酸纤维素薄膜电泳是一种常见的电泳技术,它利用醋酸纤维素薄膜作为分离介质,将带电粒子在电场作用下进行分离。
其原理如下:1. 醋酸纤维素薄膜制备首先需要制备醋酸纤维素薄膜。
通常采用将醋酸纤维素溶解于有机溶剂中,然后涂布在玻璃板或硅片上,通过挥发有机溶剂使得溶液中的醋酸纤维素形成均匀的薄膜。
2. 薄膜上形成静电场接着,在制备好的醋酸纤维素薄膜上形成一个静电场。
通常使用高压直流电源将两个金属极板连接到两端,然后将极板放置在离玻璃板或硅片一定距离的位置上。
这样就可以在玻璃板或硅片表面形成一个强大的静电场。
3. 样品准备样品需要经过处理才能进行分离。
通常需要将样品溶解在缓冲液中,并加入适量的表面活性剂以保持样品的稳定性。
此外,还需要将样品进行染色以便于观察。
4. 样品注入将处理好的样品注入到醋酸纤维素薄膜上,让其在静电场作用下进行分离。
通常使用注射器或微量泵进行样品注入。
5. 分离过程在静电场作用下,带电粒子会受到电场力的作用,向着极板移动。
不同大小、不同电荷的粒子会受到不同的力,从而发生分离。
这个过程需要一定时间,通常需要几十分钟到几小时才能完成。
6. 结果分析通过观察醋酸纤维素薄膜上的色带可以得到分离结果。
不同大小、不同电荷的粒子会形成不同位置和形状的色带。
通过比对标准样品可以确定待测物质的种类和浓度。
总之,醋酸纤维素薄膜电泳是一种基于静电场作用下带电粒子分离原理的技术。
它具有高效、高灵敏度、高分辨率等优点,被广泛应用于生物学、化学、环境科学等领域。
醋酸纤维素薄膜电泳
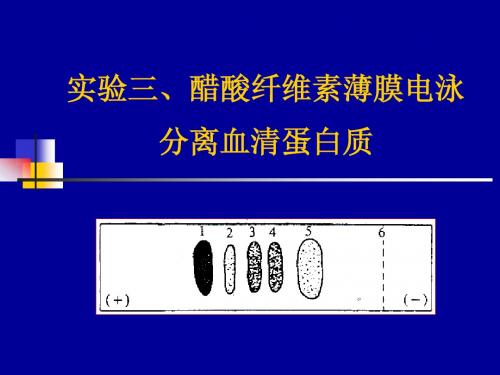
各种蛋白质由于氨基酸组成、分子量、等电点 及形状不同,在电场中的迁移速度不同。 以醋酸纤维素薄膜为支持物,正常人血清在 pH8.6的缓冲体系中电泳,染色后可显示5条主 要区带。其中清蛋白的泳动速度最快,其余依 次为α1-、α2-、β-及γ-球蛋白。
三、实验材料
醋酸纤维薄膜(2×8 cm) 镊子
5. 放薄膜的时候毛面朝下,要注意放平,与 滤网充分接触,但不要接触点样端。 6. 电泳时应选择合适的电流强度,一般电流 强度为0.4~0.6mA/cm膜宽度。电流强度高, 则热效应高;电流过低,则样品泳动速度慢 且易扩散。
7. 操作过程为防止指纹污染,应戴手套。
采用醋酸纤维薄膜作为支持物的电泳方法称为 醋酸纤维素薄膜电泳。
醋酸纤维素薄膜具有均一的泡沫状的结构,厚 度约为120 μm,有很强的通透性,对分子移动 阻力很小,该法具有微量、快速、简便、分辨 力高,对样品无拖尾和吸附现象等优点。
本实验以醋酸纤维素为电泳支持物,分离各种 血清蛋白。
血清中各主要蛋白质的等电点均低于pH8.6, 在该缓冲液中均带负电荷,在电场中向正极移 动。血清中含有清蛋白、α-球蛋白、β-球蛋白、 γ-球蛋白和各种脂蛋白等。
2. 点样时,应将薄膜表面多余的缓冲液用滤纸 吸去,以免引起样品扩散。但不宜太干,否则 样品不易进入膜内,造成点样起始点参差不起, 影响分离效果。
3. 点样时,点样不要过多,恰到好处,动作 要轻、稳,用力不能太大,以免损坏膜片或 印出凹陷影响电泳区带分离效果。 4. 醋酸纤维素薄膜电泳常选用pH8.6巴比妥- 巴比妥钠缓冲液,其浓度为0.05~0.09 mol/L。 (选择何种浓度与样品和薄膜的厚薄有关。缓 冲液浓度过低,则区带泳动速度快区带扩散 变宽;缓冲液浓度过高,则区带泳动速度慢, 区带分布过于集中,不易分辨。)
醋酸纤维素薄膜电泳

醋酸纤维素薄膜电泳
醋酸纤维素薄膜电泳是一种高效、快速和准确的分离和鉴定分子的技术。
这种技术被广泛应用于生物化学、医学、环境科学等领域。
醋酸纤维素薄膜电泳是一种基于毛细管电泳和聚丙烯酰胺凝胶电泳的分离技术。
该技术将醋酸纤维素质地的薄膜作为分离介质,样品通过电泳移动分离在薄膜的表面。
这种技术具有高分辨率、高灵敏度、高通量和半制备规模的优点。
醋酸纤维素薄膜电泳技术的应用范围广泛,包括但不限于以下方面:
1、蛋白质分离和鉴定。
醋酸纤维素薄膜电泳技术可以对蛋白质进行高分辨率的分离和鉴定,对于寻找新的蛋白质、筛选生物标志物和新药物的作用非常重要。
2、核酸分离和鉴定。
醋酸纤维素薄膜电泳技术还可以高效地分离和纯化核酸,对于对基因筛选和遗传学研究非常重要。
3、药物分析和质量控制。
对于药物制剂的分析和质量控制,醋酸纤维素薄膜电泳技术可以快速准确地检测出药物中的有效成分和有害成分。
4、环境分析。
醋酸纤维素薄膜电泳技术也可以用于环境分析,例如分析水体中的有机物和无机物质。
在应用这种技术时,需要注意以下几点:
1、选择合适的样品前处理方法,以保证样品的纯度和完整性。
2、选择合适的运行条件,如电场强度、分离介质pH值、电泳时间等,以获得最佳的分离效果。
3、选择合适的检测方法,如荧光检测、吸收光谱检测等,以达到最优的检测灵敏度和选择性。
总之,醋酸纤维素薄膜电泳技术在生物化学、医学、环境科学等领域中具有广泛的应用前景。
我们需要不断地探索和创新,以推动这种技术的发展和应用。
醋酸纤维素薄膜电泳

清蛋白 前清蛋白
制备。
临床意义:
白蛋白:主要在肝脏合成,所以与肝脏疾患密切相关。
α球蛋白的增加与发热有关,与炎症有关。 β球蛋白增加常伴随血中脂质的增加。
γ球蛋白含有抗体成分,在许多慢性感染、免疫性疾病中有异常。
例如:多发性骨髓瘤病人在β球蛋白与γ球蛋白之间出现一个尖峰:M蛋白
肝硬化病人γ球蛋白增加,白蛋白降低。
红蛋白、球蛋白、脂蛋白、糖蛋白、甲胎 蛋白、类固醇及同工酶等。它具有简单快
-球蛋白
-球蛋白
速、对蛋白质样品吸附极少,无“拖尾”
现象,染色后蛋白质区带更清晰等优点, 电渗作用虽然较高但很均一 ,不影响样
品的分离效果。不足之处是分辨率比聚丙
烯酰胺凝胶电泳低,由于薄膜厚度小(约 10~100μm),样品用量很少,不适于
思考题
P2:1、2、3
预习:实验五、六
• 凝胶层析分离蛋白质混合物的原理?何谓分子筛
效应? DNS—氨基酸的双向聚酰胺薄膜层析中,各种氨 基酸是怎样得到分离?
•
血清蛋白醋酸纤维素薄膜电泳
——根据迁移率分离
操作步骤
标记 用铅笔在薄膜无光泽面(毛面)一端2cm处
轻画一细线 ,并在右上角做好标记。
浸泡 将醋酸纤维素薄膜毛面向下,在缓冲溶液中浸泡,使其充分浸透。 点样
用镊子将薄膜置于滤纸上,吸收多余的液体(不要太干),利用载玻片 一侧蘸取样品,45度角于毛面细线处点样。
(有效长度)
设:混合物中有A、B两物质:
• 物质A在电场中移动的距离为: dA= AVt/l
物质B的移动距离为:dB= BVt/l 则两物质移动距离之差为: Δd=(dA-dB)=(A-B)Vt/l 即:物质A、B能否分离取决于两者的迁移率
醋酸纤维素薄膜电泳分离及定量测定血清蛋白成分
醋酸纤维素薄膜电泳分离及定量测定血清蛋白成分一、实验目的1(掌握醋酸薄膜电泳的原理及操作。
2(定量测定人血清中各种蛋白质的相对百分含量。
3(掌握分光光度计的原理及操作二、实验原理采用醋酸纤维薄膜为支持物的电泳方法,叫做醋酸纤维素薄膜电泳。
醋酸纤维素,是纤维素的羟基乙酰化所形成的纤维素醋酸酯。
将它溶于有机溶剂(如:丙酮、氯仿、氯乙烯、乙酸乙酯等)后,涂抹成均匀的薄膜则成为醋酸纤维素薄膜。
该膜具有均一的泡沫状的结构,有强渗透性,厚度约为120μm。
醋酸纤维素薄膜电泳是近年来推广的一种新技术。
它具有微量、快速、简便、分辨力高、对样品无拖尾和吸附现象等优点。
该技术已广泛应用于血清蛋白、糖蛋白、脂蛋白、结合球蛋白、同功酶的分离和测定等方面。
目前,醋酸纤维薄膜电泳趋向于代替纸电泳。
四、试剂和器材(一)试剂(1)新鲜血清——无溶血现象。
(2)巴比妥——巴比妥钠缓冲液(pH8.6,0.07M,离子强度0.06):称取巴比妥1.66g和巴比妥钠12.76g,溶于少量蒸馏水后定容1 000ml。
?(3)染色液:称取氨基黑10B 0.5g,加入蒸馏水40ml,甲醇50ml和冰乙酸10ml,混匀,在具塞试剂瓶内贮存。
?(4)漂洗液:取95,乙醇45ml,冰乙酸,ml和蒸馏水50ml。
混匀,在具塞试剂瓶内贮存。
[易挥发、密封]?(5)透明液[易挥发、密封]甲液—取冰乙酸15ml和无水乙醇85ml,混匀,装入试剂瓶内,塞紧瓶塞,备用。
乙液—取冰乙酸25ml和无水乙醇75ml,混匀,装入试剂瓶内,塞紧瓶塞,备用。
(6)液体石腊。
(7)0.4mol氢氧化钠溶液:称取16g氢氧化钠(分析纯)用少量蒸馏水溶解后定容到1000ml。
(二)器材(1)醋酸纤维素薄膜—2?×8?(浙江黄岩曙光化工厂等处生产)(2)培养皿(直径9,10?) (3)血色素吸管或点样器(4)直尺和铅笔 (5)镊子(6)电泳仪和电泳槽 (7)万用电表(8)玻璃板(8?×12?) (9)普通滤纸(10)试管和试管架 (11)吹风机(12)单面刀片 (13)擦镜纸(14)吸量管(2ml、5ml)和吸量管架 (15)722型分光光度计五、实验仪器介绍(1)722型分光光度计?测量原理分光光度法测量的理论依据是伯郎—比耳定律:当容液中的物质在光的照射和激发下,产生了对光吸收的效应。
醋酸纤维薄膜电泳 原理 步骤 详细
蛋白组分 Alb 1 2
g/L 35~52 1.0~4.0 4.0~8.0 5.0~10.0 6.0~13.0
占蛋白百分数 (%) 57~68
1.0~5.7
4.9~11.2
7.0~13
9.8~18.2
Schematic representation of a protein electrophoresis
电泳40~~4cm时即可断电 (1)加样后,将薄膜条架于支架两端,无光泽面朝下(点样面),点样侧置于阴极端,膜两侧分别塔上纱布,纱布一端垂入缓冲液中。
Schematic representation of a protein electrophoresis
6r
3 影响电泳结果的因素 6 r
是纤维素醋酸酯(acetate ester of cellulose ),由纤维素的羟基进行乙酰化后制得,将它溶于有机溶剂涂抹成均匀的薄膜,待有机溶剂 挥发后,即为白色不透明的醋酸纤维薄膜
2. 电泳图谱分离不清
①标本加量过多 ②电流过低 ③薄膜结构过分致密,透水性差 ④薄膜表面干燥
3. 电泳速度慢
血清蛋白醋酸纤维素薄膜电泳 由于血清中各蛋白组分等电点不同而致表面净电荷量不等,加之分子大小和形状各异,因而电泳迁移率不同,彼此得以分离。 由于血清中各蛋白组分等电点不同而致表面净电荷量不等,加之分子大小和形状各异,因而电泳迁移率不同,彼此得以分离。
6r ①点样时血清点加不均匀 丽春红S染色扫描法结果 (1)加样后,将薄膜条架于支架两端,无光泽面朝下(点样面),点样侧置于阴极端,膜两侧分别塔上纱布,纱布一端垂入缓冲液中。 Amido black 10B
4. 白蛋白(Albumin)区带中间部分不着色,染色不足
醋酸纤维素薄膜电泳法
醋酸纤维素薄膜电泳法
试剂(1)巴比妥缓冲液(pH8.6) 称取巴比妥2.76g、巴比妥钠15.45g,加水溶解使成1000ml。
(2)氨基黑染色液称取氨基黑10B 0.5g,溶于甲醇50ml、冰醋酸10ml及水40ml的混合液中。
(3)漂洗液量取乙醇45ml、冰醋酸5ml及水50ml,混匀。
(4)透明液量取冰醋酸25ml、无水乙醇75ml,混匀。
测定法取醋酸纤维素薄膜,裁成2cm×8cm膜条,将无光泽面向下,浸入巴比妥缓冲液(pH8.6)中,待完全浸透,取出夹于滤纸中,轻轻吸去多余的缓冲液后,将膜条无光泽面向上,置含巴比妥缓冲液(pH8.6)的电泳槽架上,通过滤纸桥浸入巴比妥缓冲液(pH8.6)中。
于膜条上距负极端2cm处,条状滴加蛋白含量约5%的供试品溶液2~3μl,在0.4~0.6mA/cm[总电流量=电流量(mA/cm)×每条膜的宽度(cm)×膜条数]电流条件下电泳;同时取新鲜人血清作对照,电泳时间以白蛋白与丙种球蛋白之间的电泳展开距离约2cm为宜。
电泳完毕,将膜条取下浸于氨基黑或丽春红染色液中,2~3分钟后,用漂洗液浸洗数次,直至脱去底色为止。
将洗净并完全干燥的膜条浸于透明液中,待全部浸透后,取出平铺于洁净的玻板上,干燥后即成透明薄膜,可供测定纯度和作标本长期保存。
将干燥的醋酸纤维素薄膜用色谱扫描仪采用反射(未透明薄膜)或透射(已透明薄膜)方式在记录器上自动绘出各蛋白组分曲线图,以人血清作对照,按峰面积计算各蛋白组分的含量(%)。
附注:采用全自动电泳仪操作时,参考仪器使用说明书进行。
简述醋酸纤维素薄膜电泳原理及优点
简述醋酸纤维素薄膜电泳原理及优点
醋酸纤维素薄膜电泳是一种电泳分离技术,它是利用醋酸纤维素薄膜作为固定相,将荷电样品在电场作用下在薄膜表面进行分离和富集。
这种电泳技术广泛应用于生物学、化学等领域,在分离、纯化和表征化合物方面具有独特的优点。
醋酸纤维素薄膜电泳的原理是基于涂覆在玻璃或石英片表面的醋酸纤维素薄膜,通过电场使荷电物质在薄膜表面上移动,实现荷电物质的分离。
这种技术与传统的凝胶电泳相比,具有以下优点:
1.高分辨率
醋酸纤维素薄膜电泳是一种高分辨率的电泳技术,由于该技术的固定相为薄膜,因此可以提供一个大的有效表面积,以提高分离效率和分辨率。
与其他电泳技术相比,它可以实现更明显的分离和更清晰的图谱。
2.灵敏度高
醋酸纤维素薄膜电泳技术可以分离和检测非常低浓度的样品,对于物质的分离和检测具有高度的灵敏度。
这使得它成为生物学和化学研究中极为重要的技术。
3.简便易行
醋酸纤维素薄膜电泳技术具有简单易于操作的优点,使用起来非常方便,减少了许多样品前处理的步骤,提高了分析效率和速度。
4.适用广泛
醋酸纤维素薄膜电泳技术在生物学和化学领域有着广泛的应用,可以分离细胞质、蛋白质、核酸和药物化合物等不同的生化分子,成为分离、纯化和分析化合物的重要工具。
总之,醋酸纤维素薄膜电泳技术是一种独特的电泳分离技术,具有高分辨率、高灵敏度、简便易行和适用广泛等优点,在生物学和化学研究中有着广泛的应用前景。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
12~29
缓冲液pH=8.6
pI<pH
血清蛋白均带负电荷,在电场中向正极移动
在醋酸纤维素薄膜分为五条带。电泳迁移率最大的是白蛋 白,其后为α1球蛋白,α2球蛋白,β球蛋白和γ球蛋白
+
白蛋 α α β
γ
白(A) 1
2
实验器材
电泳仪,电泳槽,滤纸,醋酸纤维素薄膜 脱色摇床,染缸,点样器
血清中几种主要蛋白组分:
血清蛋白质 等电点
分子量
白蛋白 α1球蛋白 α2球蛋白 β球蛋白
4.8白 6.85~7. 50
69,000
200,000
300,000
90,000~ 150,000 156,000~ 950,000
占总蛋白的 %
57~72 2~5 4~9
步骤
4、平衡 将膜条无光泽向下置于电泳槽支架上
,点样端靠近负极。薄膜两端要紧贴滤纸,(点
样线不要压在滤纸上)中间平直悬空,加盖密封
,平衡5min。
5 、电泳
将点样端的薄膜平贴在阴极电泳槽支架的滤纸桥上 (点样面朝下),另一端平贴在阳极端支架上(见下图)。 要求薄膜紧贴滤纸桥并绷直,中间不能下垂。连接好电泳 仪。在室温下电泳,打开电源开关,调节电流强度 0.5mA/cm膜宽度,通电50min后,调节旋钮使电流为零,关 闭电泳仪切断电源。
试剂
4x电极缓冲液:1.5mol/L Tris-HCl(pH 8.6)
(Tris三羟甲基氨基甲烷)
染色液:称取0.5g氨基黑,甲醇50ml,冰醋
酸10ml,蒸馏水加至100ml。
漂洗液:取甲醇45ml,冰乙酸5ml和蒸馏水
50ml,混匀置塞试剂瓶内贮存。
实验操作
1、准备 将电极缓冲液加入电泳槽的电极室内, 使正,负极室的液面等高,调节电泳支架宽度正好 适合醋酸纤维素薄膜的长度。用4层纱布或滤纸做 盐桥,一端浸入缓冲液中,一端搭在支架上。
意义
肝炎:白蛋白,a1-球蛋白,a2-球蛋白,β-
球蛋白下降,γ-球蛋白升高
肝硬化:白蛋白,a1-球蛋白,a2-球蛋白
下降明显, γ-球蛋白极度升高
肾病综合症:白蛋白降低,α2和β球蛋白
升高
人有了知识,就会具备各种分析能力, 明辨是非的能力。 所以我们要勤恳读书,广泛阅读, 古人说“书中自有黄金屋。 ”通过阅读科技书籍,我们能丰富知识, 培养逻辑思维能力; 通过阅读文学作品,我们能提高文学鉴赏水平, 培养文学情趣; 通过阅读报刊,我们能增长见识,扩大自己的知识面。 有许多书籍还能培养我们的道德情操, 给我们巨大的精神力量, 鼓舞我们前进。
带正电荷的水层携带粒子向 负极移动
如果样品原本是移向负极的,则泳动的速度加快; 如果样品原本是移向正极的,则泳动的速度减慢。
电泳技术:指利用电泳现象对混合物进行分离分析的技术。 电泳技术的优点:快速,准确,重复性好。 电泳分类: 按装置的差异有:薄膜电泳,垂直板电泳,平板电泳,垂直圆
等)
血清蛋白电泳结果的临床意义
可能相关疾病
白蛋白
α 1球蛋 α 2 球 蛋 β 球 蛋 γ 球 蛋
白
白
白
白
骨髓瘤
↑
肾病综合症
↓
↑
↑
肾炎
↑
↑
肝硬化
↓(显著)
↑
急性肝坏死
↓
↑
↑
↑
↑
传染性肝炎
↓
↑
↑
急性感染初期
↑
↑
↑
慢性炎症/感染
↑
后期
低球蛋白血症
↓
临床意义: 血清蛋白质醋酸纤维薄膜电泳在临床上 常用于分析血、尿等样品中的蛋白质,供临床上 诊断肝、肾等疾病参考。
有不同的等电点而带不同性质的电荷,因而在一 定的电场中它们的移动方向和移动速度也不同, 即它们的电泳迁移率不同,因此,可对它们进行
分离。 电泳的应用:分离各种有机物;分析某种物质的
纯度及分子量。
影响电泳迁移率的因素:
1、内在因素:蛋白所带净电荷的性质和所带电 荷的多少、蛋白的大小和形状
2、外界因素:电场强度、溶液的pH值、溶液的 离 子强度和电渗现象
注意事项
1、薄膜的浸润与选膜是电泳成败的关键之一。 2、点样时,应将薄膜表面多余的缓冲液用滤纸吸去。 3、点样时,动作要轻、稳,用力不能太大,以免损坏薄膜
影响分离效果。
4、点样应点在薄膜的毛面上,点样量要适量,不宜过多或
过少。
5、电泳时应将薄膜的点样端置于电泳槽的负极端。 6、应控制染色时间。时间长,薄膜底色不易脱去;时间太
可以减少产热。所以,实验中我们要选择合适的电压,同时要冷
分
却降温。
离 3缓冲液的性质
效 缓冲液的pH决定了生物的解离程度。对于蛋白质和氨基酸来说,我们知
果 道溶液的pH离等电点越远,,所带的净电荷越多,迁移速度越快。因此选 择一个合适的pH,使各种蛋白质所带的净电荷数量差异越大,以利于分
的 离。缓冲液要求性能稳定,不易电解。 因 同时,缓冲液的离子强度会对自身缓冲能力有影响。过高,缓冲能力差,
短,着色不易区分,或造成条带染色不均匀,必要时可进行 复染。
7、每次电泳时应交换电极,使两侧电泳槽内缓冲液的正负
离子相互交换,使缓冲液的pH维持在一定水平。
电泳失败的原因
①电泳图不整齐(点样不均匀,温度过高等) ②各组分分离效果不佳(点样过多,电流过低
等) ③染色后蛋白区带中间着色浅(染色试剂不足
1 实验目的 2 实验原理 3 实验步骤 4 注意事项
实验目的
掌握电泳的基本原理,了解电泳仪, 电泳槽的基本结构和功能。 熟悉电泳的基本过程与定量方法。 熟悉血清电泳在临床诊断中的作用。
实验原理
1. 醋酸纤维薄膜电泳是用醋酸纤维素薄膜作为支 持物的电泳方法。
2. 血清中各种蛋白质的等电点在pH4.88~7.50之 间,在pH8.6的缓冲溶液中均带负电荷,在电场 中向正极泳动。血清中各种蛋白质的等电点不 同,所以带电荷量也不同。此外各种蛋白质的 分子大小各有差异,因此在同一电场中泳动的 速度不同。分子小而带电荷多者,泳动较快; 反之,则较慢。
盘电泳和毛细管电泳 按支持介质有: 1 醋酸纤维素薄膜电泳:分辨率高,成本低,灵敏度高,应用 广泛。 2 琼脂糖凝胶电泳:操作简单,分辨率高,重复性好,结果可 定量分析,电泳后易洗脱。 3 聚丙烯酰胺凝胶电泳;灵敏度高,对pH和温度变化较温度, 应用广。 4 SDS-聚丙烯酰胺凝胶电泳具有聚丙烯酰胺凝胶电泳的所有 优点。 5 等电聚焦电泳。 6 双向电泳:具有极高的灵敏度和分辨率。
素 过高则会阻碍分子的迁移,使样品速度减慢。
4支持介质
理想的介质:具有网状结构,不带电荷,对分离物质无 吸附作用的惰性材料。
网状结构:提高电泳分辨率 电渗:降低分辨率。导致电渗的原因是支持介质表面存
在带电基团。 吸附:降低电泳分辨率。(常用支持介质中,高纯度的
琼脂糖和聚丙烯酰胺凝胶的吸附最小,醋酸纤维素薄膜 次之,滤纸最大
2、浸膜
在膜条无光泽面距一端1.5cm处用铅笔轻划点样线,浸入电
极缓冲液中,至完全浸透为止(≧20min)。用镊子取出薄膜, 点样线向上平放于干净滤纸上,用滤纸轻轻地按压,吸去薄膜上 多余的液体。
3、点样
取少量待测血清均匀涂布在玻璃片上,用宽1cm的平整的塑
料软片末端取少许样品,垂直轻印到薄膜点样线上,形成一条 细窄而均匀的直线。(注:点样量不宜过多)此步是实验的关 键。以印章法加样时,点样量不宜过多,动作应轻,稳,用力 不能太重。
血清蛋白质醋酸纤维素薄膜电泳
——第三组 陈艳 李秀清 张伟 孙金山
定义:带电粒子在电场中向着与其电性相反的电极移动 的现象。
负
正
极
极
-
那 么 什 么 是 电 泳?
电泳为何能分离混合物?
原理
迁移率(mobility):表示单位电场强度粒子的 速度。
又叫泳动度,用 μ表示。 μ=v/E=Q/(6πrη) 可知,在一定pH条件下,不同的蛋白质由于具
。
步骤
6、染色 取下薄膜直接浸于氨基黑10B染色
液中,染色5~10min。然后在漂洗液中漂去剩余染
料,直至背景无色为止。回收漂洗液。。
7、定量 将干燥的薄膜电泳图谱入自动扫描光密度
仪内,记录仪上自动绘出蛋白质组分曲线图。每一个 峰代表一种蛋白质组分。若使用具有电子计算机附件 的自动扫描光密度仪,可通过相关软件的分析,直接 获得每。 条区带蛋白质的百分含量。
5温度
。
热不利于电泳
热蒸发缓冲液,影响缓冲液的离子强度,甚至导致样品
变质。
热会增加样品的扩散
为了减少热对实验的影响,可控制电泳或电流,也可安
装冷却完散热装置。
: 电渗作用
电渗:在电场作用下液体对固体支持物相对移动的现象。
以纸电泳为例:
正极
-------- ++++++++
负极 表面带负电荷
等电点(pI)
以生物大分子为例
COO-
H+
Pr
OH- Pr
NH2
COO-
H+
Pr
OH-
NH3+
pH>pI
pH=pI
COOH
NH3+
pH<pI
1样品性质
影 响
迁移率与电荷量成正比,与相对分子质量成反比。
2电场强度
电 泳
电压越高,速度越快。但高电压 介质温度升高 样品扩散
和对流速度增加
分辨率降低。低电压会延长电压时间,但
蛋白质的染色方法
蛋白 质
1. 氨基黑10B :蓝色酸性染料,可与蛋白质结合 形成青色结合物。灵敏度为考马斯亮蓝R-250 的20%。
