初中化学物质间的相互转化关系总结
初中化学知识点总结人教版

初中化学知识点总结人教版初中化学知识点总结(人教版)一、基本概念与原理1. 物质的组成- 物质由原子、分子或离子组成。
- 原子是物质的基本单位,由原子核和电子构成。
2. 元素与化合物- 元素是由相同类型的原子组成的纯物质。
- 化合物是由两种或两种以上不同元素的原子以固定比例结合而成的纯物质。
3. 化学式与化学方程式- 化学式用元素符号和数字表示物质的组成。
- 化学方程式表示化学反应中物质的转化关系。
4. 化学反应类型- 合成反应:多种物质反应生成一种物质。
- 分解反应:一种物质分解生成多种物质。
- 置换反应:单质与化合物反应生成新单质与新化合物。
- 复分解反应:两种化合物相互交换成分生成两种新的化合物。
5. 氧化还原反应- 氧化:物质失去电子的过程。
- 还原:物质获得电子的过程。
- 氧化剂:使其他物质氧化的物质。
- 还原剂:使其他物质还原的物质。
二、常见物质的性质与变化1. 物质的分类- 混合物:由两种或多种物质混合而成,各组成部分保持原有性质。
- 纯净物:由单一物质组成,具有固定性质。
2. 物质的状态变化- 固态、液态、气态之间的相互转化称为物态变化。
3. 酸碱盐- 酸:在水溶液中电离出的阳离子全部是氢离子的化合物。
- 碱:在水溶液中电离出的阴离子全部是氢氧根离子的化合物。
- 盐:由金属离子和酸根离子构成的化合物。
4. 氧化还原反应的应用- 金属的腐蚀与防护。
- 燃烧与爆炸。
- 生物体内的呼吸作用。
三、实验基本操作与安全1. 实验器材的使用- 熟悉常见实验器材的名称、用途和正确使用方法。
2. 实验操作规程- 严格按照实验步骤进行操作,确保实验的准确性和安全性。
3. 实验安全- 了解化学品的安全标识和危险性质。
- 掌握基本的实验室急救措施。
四、化学与生活1. 化学与健康- 营养素的化学性质及其在人体中的作用。
- 常见药物的化学成分和作用机理。
2. 化学与环境- 了解常见的环境污染问题及其化学原因。
初中中考化学推断题(整理)
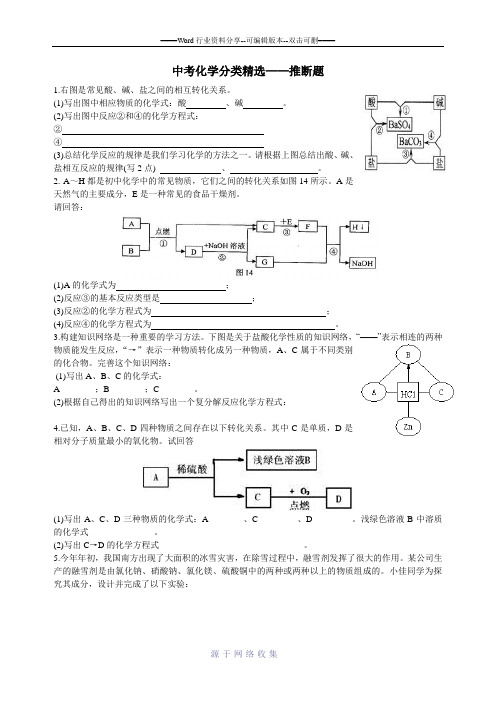
中考化学分类精选——推断题1.右图是常见酸、碱、盐之间的相互转化关系。
(1)写出图中相应物质的化学式:酸、碱。
(2)写出图中反应②和④的化学方程式:②④(3)总结化学反应的规律是我们学习化学的方法之一。
请根据上图总结出酸、碱、盐相互反应的规律(写2点) 、。
2. A~H都是初中化学中的常见物质,它们之间的转化关系如图14所示。
A是天然气的主要成分,E是一种常见的食品干燥剂。
请回答:(1)A的化学式为;(2)反应③的基本反应类型是;(3)反应②的化学方程式为;(4)反应④的化学方程式为。
3.构建知识网络是一种重要的学习方法。
下图是关于盐酸化学性质的知识网络,“——”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,A、C属于不同类别的化合物。
完善这个知识网络:(1)写出A、B、C的化学式:A________;B________;C________。
(2)根据自己得出的知识网络写出一个复分解反应化学方程式:____________________________________________4.已知,A、B、C、D四种物质之间存在以下转化关系。
其中C是单质,D是相对分子质量最小的氧化物。
试回答(1)写出A、C、D三种物质的化学式:A________、C_________、D_________。
浅绿色溶液B中溶质的化学式_______________。
(2)写出C→D的化学方程式_________________________________。
5.今年年初,我国南方出现了大面积的冰雪灾害,在除雪过程中,融雪剂发挥了很大的作用。
某公司生产的融雪剂是由氯化钠、硝酸钠、氯化镁、硫酸铜中的两种或两种以上的物质组成的。
小佳同学为探究其成分,设计并完成了以下实验:请你根据以上设计过程,完成下列空白:(1)该融雪剂中一定含有(写化学式,下同),一定不含有,可能含有;(2)加入硝酸银溶液发生反应的化学方程式是。
初三化学-物质的转化

【物质的转化】一.经典回顾:1(2015武汉).有关物质之间的部分转化关系如右图所示。
其中“—”表示物质之间能发生化学反应,“→”表示物质之间的转化关系。
下列说法中正确的是( )A .物质X 是一种常见的有机化合物B .反应②是一定有盐参加反应C .向Ca(OH)2溶液中加入CaO ,所得溶液的溶质质量分数一定增大D .图中的所有反应均不属于置换反应2. (2016武汉)甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示,关于该转化关系图,下列说法正确的是( )A .如果丙是碳酸钠,乙是氢氧化钠,则甲是硝酸钠B .若甲、乙、丁都是氧化物,则丙一定是碳酸钙C .甲、乙、丙、丁之间的转化可以全部通过复分解反应实现D .若甲、乙、丙、丁均含有同一种元素,且乙可用来灭火,则丙一定是单质碳二.提高训练1 .(荆州)小明设计了下列四组物质,要求在一定条件下都能一步转化,其中错误的是( )A .Na 2CO 3→NaCl→NaNO 3→NaOHB .C→CO→CO 2→Na 2CO 3C .Cu→CuO→CuSO 4→Cu(OH) 2D .CaCO 3→CaO→Ca(OH) 2→NaOH2. 下列各组变化中,每一转化在一定条件下均能一步实现的是( )A .①和②B .②和③C .①和③D .①②③3.甲、乙、丙、丁四种物质的相互反应关系如图所示(“—”表示相连的物质间能发生反应)下列符合对应反应关系的选项是选项A B C D 物质 甲Ca(OH)2 CO 2 H 2 Fe 乙 Na 2CO 3 NaOH O 2 HCl 丙H 2SO 4 CaCl 2 CuO CuSO 4 丁 BaCl 2 AgNO 3 HCl NaOH4.甲乙丙丁四种物质的转化关系如图所示。
下列说法正确的是A.若丙为沉淀,则甲、乙中一定有一种物质是碱B.若丙为气体,则甲、乙中一定有单质C.若丁为水,则该反应一定是复分解反应D.若甲、丁为单质,则该反应一定是置换反应5(双选题).现有铁、氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液五种物质.存在如图所示的相互反应和转化关系。
初中化学总复习专题四物质共存与相互转化

专题三、物质共存、溶液中离子大量共存与相互转化在初中阶段,如果溶液中的物质或离子能发生复分解反应,即符合复分解反应发生的条件就不能共存:生成气体:2H+ +CO32-=H2O+CO2 ↑H++HCO3-=H2O+CO2↑NH4+ + OH-= H2O + NH3生成水:H+ +OH-=H2O生成沉淀:常见的沉淀 Fe3+ + OH-= Fe(OH)3 Cu2++ OH-=Cu(OH)2 Mg2+ + OH-=Mg(OH)Ag+ +Cl-= AgCl Ba2+ + SO42-= BaSO4 Ca+ + CO32-= CaCO3 Ba2++ CO32-= BaCO3 Ag+ + CO32-= Ag2CO31. 向某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该白色沉淀是()A 一定是AgCl和BaSO4的混合物B 一定是AgClC 一定是BaSO4D 可能是AgCl也可能是BaSO4还可能是它们的混合物2. 在无色溶液中能大量共存的离子组是()A Ag+,Cu2+,Cl-,K+B Mg2+,SO42-,NO3-,NH4+C OH-,CO32-,H+,K+D Na+,OH-,Ba2+,NH4+3. 有Mg,CO,CuO,KOH溶液,Ba(OH)2溶液,Na2CO3溶液,稀H2SO4等七种物质在常温下两种物质能发生的化学反应最多有()A 8个B 7个C 6个D 5个4. 用Mg,MgO,Mg(OH)2,稀H2SO4,CuSO4溶液五种物质两两进行反应,能得到MgSO4的方法有( )A 2种B 4种C 5种D 无法确定5. 有A,B,C三种物质,分别是酸碱盐中的一种。
在溶液中,三者之间可发生如下反应:<1>A+B → 钠盐+ 水+ 二氧化碳,<2>A+C → 盐↓ + 碱,<3>B+C → 盐↓ + 水反应<2>生成的盐溶于稀硝酸,反应<3>生成的盐不溶于稀硝酸,则A,B,C三种盐的名称分别是______________,__________________,_________________6. A,B为可溶性盐,C为可溶性碱。
初中化学物质的性质和变化知识点总结

初中化学物质的性质和变化知识点总结
本文总结了初中化学中涉及的物质的性质和变化的知识点。
以下是该文档的结构和内容概述:
一、物质的性质
1. 物质的分类:
- 纯净物质和混合物
- 无机物和有机物
- 固体、液体和气体
2. 物质的性质:
- 色、臭、味、密度等感官性质
- 熔点、沸点、溶解度等物理性质
- 酸碱性、氧化性等化学性质
3. 物质的分离和纯化:
- 过滤、蒸发、结晶等分离方法
- 蒸馏、萃取、电解等纯化方法
二、物质的变化
1. 物质的变化方式:
- 物理变化:改变物质的形状、大小或相态,但不改变其组成- 化学变化:改变物质的组成和性质
2. 物质的化学变化:
- 酸和碱的中和反应
- 金属与非金属的反应
- 燃烧反应及其特点
- 氧化还原反应及其特点
3. 物质的能量变化:
- 吸热反应和放热反应
- 光化学反应和电化学反应
4. 变化速率和条件的影响:
- 反应速率的影响因素
- 浓度、温度、催化剂等条件对反应速率的影响
三、化学方程式
1. 化学方程式的基本组成:
- 反应物和生成物的化学式
- 反应物和生成物的摩尔比例
2. 化学方程式的平衡:
- 平衡态和平衡常数
- 影响平衡的因素
以上是初中化学物质的性质和变化知识点的总结。
这些知识将帮助学生理解物质的特性和变化过程,并为进一步学习化学打下基础。
初中化学酸碱盐知识点总结分解

初中化学酸碱盐知识点总结分解(总8页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--2 初中化学酸碱盐知识点总结一、物质的分类:二、各类物质的主要化学性质:(见下图。
短线表示相互间能反应,箭号表示相互间能转化)1.单质:1)金属: 2)非金属 + 氧气 → 氧化物2.氧化物: 1)酸性氧化物: 2)碱性氧化物:3)水: 3.酸:4.碱:5.盐:+2Fe → Fe 氧气→氧化物 金属+ 酸→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸) 盐→盐+金属(①排在前面的金属;②可溶性盐)酸性氧化物+ 水→酸 碱→盐+水(可溶性碱) 碱性氧化物+ 水→碱(可溶性碱)酸→盐+水 酸性氧化物→酸 水+ 碱性氧化物→碱(可溶性碱) CuSO 4→CuSO 4·5H 2O 石蕊变红;酚酞不变色金属→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸)酸+ 碱性氧化物→盐+水碱→盐+水盐→酸+盐(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O )石蕊变蓝;酚酞变红(可溶性碱)酸性氧化物→盐+水(可溶性碱) 酸→盐+水盐→盐+碱(反应物必须可溶且生成物之一必须是不溶物)碱+ 金属→盐+金属(①排在前面的金属;②可溶性盐)酸→盐+酸(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O ) 碱→盐+碱(反应物必须可溶且生成物之一必须是不溶物) 盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物) 盐+ 金 属:Fe 、Cu 、Mg 、Al 单 质 稀有气体:He 、Ne 、Ar非金属纯净物 酸性氧化物:CO 2、SO 2、SO 3氧化物 碱性氧化物其它氧化物:H 2O 、CO 、Fe 3O 4 化合物 酸 物质 碱 盐 混合物:空气、水煤气、煤、石油、天然气、石灰石可溶盐:K +、Na +、NH 4+、NO 3-、SO 42-(除BaSO 4)、Cl - (除AgCl) 难溶盐:AgCl 、BaSO 4、CaCO 3、BaCO 3、Ag 2CO 3 可溶碱:NaOH 、KOH 、Ba(OH)2、Ca(OH)2 难溶碱:Cu(OH)2、Fe(OH)3、Mg(OH)2 无氧酸:HCl 、H 2S 含氧酸:H 2SO 4、HNO 3、H 2CO 3、H 3PO 4 可溶:K 2O 、Na 2O 、BaO 、CaO 难溶:CuO 、Fe 2O 3、MgO 固态非金属:C 、S 、P 气态非金属:H 2、O 2、Cl 2、N 2三、化学反应的基本类型:1)化合反应:(有单质时化合价改变)⑴单质+单质→化合物 Mg + O2—— P + O2——⑵单质+化合物→化合物 C + CO2——⑶化合物+化合物→化合物 CaO + H2O —— CuSO4 + H2O ——2)分解反应:(有单质时化合价改变)⑴氧化物分解 H2O —— HgO ——⑵酸分解 H2CO3——⑶盐分解 KMnO4—— KClO3——CaCO3—— CuSO4·5H2O ——Cu2(OH)2CO3——3)置换反应:(化合价一定改变)⑴金属+酸→盐+氢气(①H前面的金属;②不能是浓硫酸和硝酸)Fe + HCl — Al + H2SO4—⑵金属+盐→盐+金属(①排在前面的金属;②可溶性盐)Fe + CuSO4— Cu + AgNO3—⑶金属氧化物+H2(或C)→金属+水(或CO2)CuO + H2— C + Fe2O3——4)复分解反应:(化合价一定不变)⑴碱性氧化物+酸→盐+水Fe2O3 + HCl — CuO + H2SO4—⑵酸+碱→盐+水NaOH + H2SO4— Fe(OH)3 + HCl —⑶酸+盐→盐+酸(可溶反应物能生成↓、↑、H2O;难溶反应物能生成↑、H2O)H2SO4 + BaCl2— HCl + CaCO3—⑷碱+盐→碱+盐(反应物必须可溶且生成物之一必须是不溶物)Ca(OH)2 + Na2CO3— NaOH + FeCl3—⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)CaCl2 + K2CO3— Ba(NO3)2 + Na2SO4—※不属于四种基本类型的反应:⑴金属氧化物+CO→金属+CO2 Fe2O3 + CO ——⑵碱+酸性氧化物→盐+水(可溶性碱) NaOH + CO2—⑶有机物+O2→H2O+CO2 C2H5OH + O2——☆氧化还原反应:得到氧的物质被氧化,发生氧化反应,是还原剂;失去氧的物质被还原,发生还原反应,是氧化剂。
初中化学跨学科知识点归纳总结
中级教育学校化学跨学科知识点归纳总结化学作为一门自然科学学科,探究的是物质的组成、结构、性质、变化规律以及与能量的互相干系等。
与其他学科相比,化学涉及到多种学科的知识,是一门较为综合的学科。
下面,本文将对中级教育学校化学涉及的跨学科知识点进行归纳总结,以援助同砚更好地理解和精通化学知识。
一、物理学与化学的干系1. 物质的相态变化:物质的相态变化是物理学和化学学科的交叉点。
物理学主要探究物质在不同温度、压力下的相变规律,而化学则探究相变所涉及的物质内部结构和化学反应。
例如,水的沸腾,物理学探究其温度和压力条件,而化学则探究其中涉及的水分子的组成和结构。
2. 热力学:热力学是物理学和化学的交叉领域,它探究物质与能量之间的干系。
化学反应中的能量变化和热力学参数(如焓、熵、自由能变化等)屡屡被用来描述化学反应的性质和驱动力。
而物理学则通过探究能量的守恒和转化规律,给出了热力学原理的基础。
二、生物学与化学的干系1. 有机化学:生物学的基本单位是细胞,而细胞的主要成分是有机物。
有机化学探究碳元素和其他元素的化合物,其中包括生物大分子(如蛋白质、核酸、多糖等)的结构和性质。
通过有机化学的探究,可以更好地理解生物分子的结构和功能。
2. 生物化学反应:生物学中许多反应都是以化学反应为基础的。
例如,光合作用是一系列复杂的化学反应,通过它植物能够将光能转化为化学能。
此外,生物学还探究细胞中的代谢过程,其中包括蛋白质合成、无氧呼吸等化学反应。
三、地学与化学的干系1. 地球化学:地球化学是地学和化学的联合学科,探究地球上物质的成分、分布和变化规律。
地球上的岩石、土壤、水体等中含有大量的化学成分,通过对地球化学的探究可以了解到地球上化学元素的循环和分布。
2. 环境化学:环境化学是地学和化学的交叉学科,探究环境中的化学物质及其影响。
例如,大气中的污染物、地下水中的重金属等都是环境化学探究的对象。
同时,化学反应也是地球上环境变化的重要原因之一,例如酸雨的形成。
《物质的转化》 说课稿
《物质的转化》说课稿尊敬的各位评委、老师:大家好!今天我说课的题目是《物质的转化》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程、板书设计这几个方面来展开我的说课。
一、教材分析《物质的转化》是中学化学中的重要内容,它不仅是对之前所学元素化合物知识的整合与深化,也为后续化学平衡、化学反应速率等知识的学习奠定基础。
本节课主要包括物质的分类以及不同类别物质之间的相互转化关系。
通过学习物质的转化,学生能够建立起物质世界的系统性和规律性的认识,培养学生的化学思维能力和解决实际问题的能力。
教材在内容编排上注重从生活实际出发,引入了许多常见的物质和化学反应,使学生能够感受到化学与生活的紧密联系,激发学生的学习兴趣。
二、学情分析学生在之前的学习中已经掌握了一些常见物质的性质和化学反应,对物质的分类也有了初步的了解。
但是,对于不同类别物质之间的转化关系,学生还缺乏系统的认识和深入的理解。
在思维能力方面,学生已经具备了一定的逻辑思维能力,但对于抽象的化学概念和原理的理解还存在一定的困难。
因此,在教学过程中,需要通过具体的实例和实验,引导学生进行思考和分析,帮助学生构建知识体系。
三、教学目标1、知识与技能目标(1)掌握常见物质的分类方法。
(2)理解不同类别物质之间的相互转化关系,并能写出相应的化学方程式。
(3)学会运用物质的转化关系解决实际问题。
2、过程与方法目标(1)通过对物质分类和转化的学习,培养学生的归纳总结能力和逻辑思维能力。
(2)通过实验探究和化学方程式的书写,提高学生的实验操作能力和化学用语的表达能力。
3、情感态度与价值观目标(1)让学生感受到化学知识的实用性和趣味性,激发学生学习化学的兴趣。
(2)培养学生严谨的科学态度和合作精神。
四、教学重难点1、教学重点(1)不同类别物质之间的相互转化关系。
(2)化学方程式的书写。
2、教学难点(1)物质转化规律的理解和应用。
(2)通过物质的转化培养学生的化学思维能力。
2023年中考化学二轮专题复习---物质的转化与推断
题眼五 特征反应现象
1.能使澄清石灰水变浑浊的无色无味气体:CO2 。 2.与碱液反应产生的能使湿润的酚酞试纸变红的气体:NH3。 3.能使带火星的木条复燃的气体:O2 。 4.能使燃着的木条熄灭的常见气体:CO2或N2。 5.能与氧气反应生成CO2和H2O的物质:一般为有机物,如CH4 、C2H5OH。 6.在O2中燃烧火星四射的物质:Fe。 7.能使黑色CuO变紫红(或红棕色Fe2O3变黑)的气体:H2或CO; 固体:C。 8.能使无水CuSO4粉末变蓝的气体:水蒸气。
(5)某固体中加入稀盐酸,有气泡产生,该固体一定是某种活泼 金属。( × )
(6)氢氧化钠、氧化钙和浓硫酸都能作干燥剂。( √ ) (7)氢氧化钠用于改良酸性土壤。( × ) (8)氢氧化钙易潮解,故应密封保存。( × ) (9)盐中一定含有金属元素。( × ) (10)所有的盐溶液 pH 都等于 7。( × )
A.C→CO2→CO B.Mg→MgO→MgSO4 C.KCl→KNO3→K2SO4 D.NaOH→Na2CO3→NaCl
1.(2022·东营模拟)整理、归纳、转化是研究物质的方法之一。下
D 列转化关系中,有误的一组是( )
A.
B.
C.
D.
2.(2022·岳阳)甲、乙、丙是初中化学中常见的物质,它们的转 化关系如图所示(“→”表示反应一步实现,部分物质和反应条件已
三种物质符合图示转化关系的是( A )
选项 甲
乙
丙
A CuCl2 Cu
CuO
B CO2 Na2CO3 CaCO3
C CaO Ca(OH)2 CaCl2
D Fe Fe2(SO4)3 Fe(OH)3
4.(2022·昆明)甲、乙、丙、丁是初中常见的物质,转化关系如图(所涉及
专题16 物质的相互反应与转化-2022年中考化学真题分项汇编(全国通用)(第01期)(原卷版)
专题16 物质的相互反应与转化1.(2022年重庆市中考)一定条件下物质间可以转化。
结合如下转化过程和初中知识,下列说法不正确的是()C→CO-→CO2→H2CO3→CaCO3→CaOA.CO是有毒气体B.CO2不是空气污染物C.H2CO3受热易分解D.CaCO3可直接转化为Ca(OH)22.(2022年重庆市中考)工业炼铁原理为3CO+Fe2O3高温2Fe+3CO2,其中CO体现还原性。
下列化学反应中有物质体现还原性的是()A.SO3+H2O=H2SO4B.H2+CuO ΔCu+H2OC.CuSO4+BaCl2=BaSO4↓+CuCl2D.H2SO4+2NaOH=Na2SO4+2H2O 3.(2022年山东省泰安市中考)如图是自然界中碳、氧循环简图(X为H2CO3,Y为C6H12O6)。
下列说法错误的是()A.图一中X溶液显酸性,是形成酸雨的主要原因B.图二转化1实现了无机化合物到有机化合物的转化C.图一、图二对比说明,反应物相同,反应条件不同,产物不同D.碳循环和氧循环有利于维持大气中二氧化碳和氧气含量的相对稳定4.(2022年云南省中考)甲、乙、丙、丁是初中化学常见的物质,在一定条件下它们之间的转化关系如图所示。
下列推断中正确的个数有()①甲、乙、丙、丁可能含有同一种元素①若甲为单质,则此反应一定是置换反应①若丙为氯化钠,则甲、乙中一定有碱①若丙为Cu(NO3)2,则甲可能为单质、氧化物、酸、碱或盐A.1个B.2个C.3个D.4个5.(2022年云南省昆明市中考)甲、乙、丙、丁是初中常见的物质,转化关系知图(所涉及反应均为初中常见化学反应,部分反应物、生成物及反应条件已略去,“→”表示某种物质经一步反应可转化为另一种物质)。
下列说法错误的是()A.若甲为H2,则丁可以是Fe或H2OB.若甲为NaOH,则丙可以是H2O或Fe(NO3)3C.若甲为CuO,则乙、丙、丁可以是含有相同金属元素的化合物D.若甲为A12(SO4)3,则如图所示转化关系均可以通过复分解反应实现6.(2022年山东省泰安市中考)有一包固体粉末X,可能含有碳酸钙、硫酸铜、硫酸亚铁、镁粉中的两种或多种。
