014芳环的烃化和酰化反应
芳烃化学反应方程式反应路径
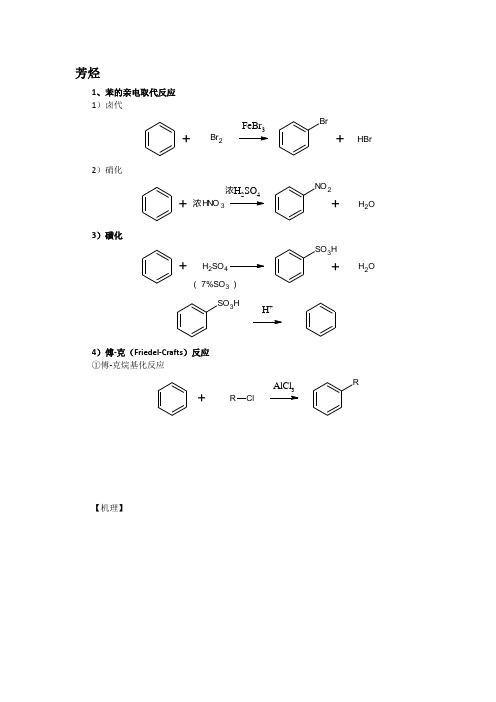
芳烃1、苯的亲电取代反应 1)卤代+FeBr 3Br+BrH Br 22)硝化+NO 2+H 2OHNO 3浓H 2SO 4浓3)磺化+SO 3H+H 2OH 2SO 4( 7%SO 3 )SO 3HH +4)傅-克(Friedel-Crafts )反应①傅-克烷基化反应+RClAlCl 3R【机理】R Cl+AlCl 3AlCl 4++R CH 2+RCH 2++HR++HR+++AlCl 4+R++HClAlCl 3【注】碳正离子的重排,苯环上带有第二类定位基不能进行傅-克反应。
【例】+CH 3ClAlCl 3CH 3CH3+CH 3ClCH 3CH 3AlCl 3CH 3CH 3CH3CH 2Cl 2+2AlCl3CH 1Cl 3+3AlCl3②傅-克酰基化反应+RO Cl AlCl 3OR+OO O RRAlCl 3OR+RCOOH【例】CH 3CH 2COClAlCl 3CH 3OZn -HgHCl浓CH3+O OOAlCl 3COOHO2、苯环上取代反应的定位效应1)第一类定位基,邻对位定位基,常见的有:NR 2NHRNH 2OHHNC ROORCRO OR ArX(F,Cl,Br,I)2)第二类定位基,间位定位基, 常见的有:NR 3NO 2CF 3Cl 3COOHCOROCNSO 3HCHOCOR【注】第一类定位基除卤素外,均使苯环活化。
第二类定位基使苯环钝化。
卤素比较特殊,为弱钝化的第一类定位基。
3、苯的侧链卤代CH3FehCH 3ClCH 3Cl+CH 2ClCH 3NBSCH 2Br【机理】自由基机理 4、苯的侧链氧化1)用高锰酸钾氧化时,产物为酸。
【描述】苯环不易被氧化,当其烷基侧链上有α氢的时候,则该链可被高锰酸钾等强氧化剂氧化,不论烷基侧链多长。
结果都是被氧化成苯甲酸。
CHKMnO H COOH【例】C CH3CH 3CH 3CH 3KMnO H C CH 3CH 3CH 3COOH2)用CrO 3+Ac 2O 为氧化剂时,产物为醛。
高等化学之构成碳链的反应(形成碳碳单键)

二、活泼亚甲基上的烷基化反应
1、定义P102
致活亚甲基的活性基和活性顺序:
NO2>COR>SO2R>COOR>CN>C CH>C6H5>CH=CH2
活性基是CN以前的基团有二个取代的亚甲基,酸性 比醇大,很易与碱反应,而生成负离子,这种负离子 与卤代烃亲核取代反应,就产生烷基化反应。
2、活泼亚甲基生成负离子过程
O +RCCl AlCl3 O C R
酰化剂:酰卤、酸酐、羧酸酯、羧酸
(1)反应机理:亲电取代
O O
R
C
Cl
R
C
(2)影响反应的主要因素
a、酰化剂的活性:
酰卤>酸酐>酯>羧酸 • 酰卤:
O RC O I >RC O Br > RC O Cl > RC F
• 酰卤的烃基影响:叔丁基易脱羰基生成叔丁基苯 • α ,β不饱和酰卤易成环
O O O
C2H5OC
CH2
C2H5ONa RX
C2H5OC
CH R
OH-/H2O H+
HOC
CH R
-CO2
C2H5OC
O
C2H5OC
O
HOC
O
△
RCH2COOH
β二酮可与二分子碱反应生成双负离子,往往在酸性较小的甲基上引入基团
O O O O
CH3CCH2CCH3
2molNaNH2,液氨 RX
CH3CCH2CCH2R
4、影响活泼亚甲基烷基化因素
• • • • • • • 碱和溶剂的影响
叔丁醇钾>异丙醇钠>乙醇钠>甲醇钠
采用醇钠则采用相应的醇为溶剂 对于一些在醇中难于烃化的活泼亚甲基化合物,可在苯、甲苯、
第二章:烃化反应(3节)

镇痛药美沙酮(methadone) 中间体 镇痛药美沙酮( 苯 乙
CH CN Cl
CH 3 CH CH 2 N(CH 3 ) 2 , N aN H 2
CN C
月青
烃 化 反 应
回流,
3h
CH CH3
C H 2 N(C H 3 ) 2
37%
镇静催眠药格鲁米特中间体
CN H2 C CN
C2H5Br, NaNH2 回流, 4h
CH C CH3 H2
95%
药
H 3C O
米中间体
H 3C O CN
H 3C O
H2 C
(C H 3 ) 2 C H B r , Na O H CN r.t. , 8h
H 3C O
CH C H (C H 3 ) 2
80%
2. 烯胺的C-烃化 烯胺的C
H O R1 R3 OH CH R2 R4 N R4 R3 C CH R2 R3 H N C C R2
O C H C Bu-n
O C OEt + Br
n-Bu
O CH3CCH2COOEt + n-BuBr NaOEt 69~72% Cl
O CH3CCH2CHOOEt Bu-n
CH2(CO2Et)2 +
NaOEt 61%
CH(CO2Et)2
CH3COCH2 COCH3 + CH3 I
K2 CO3 75~77%
3. 烃基的异构化
碳正离子重排
CH3 H3C C H
+ CH2CH2 CH2Cl
AlCl3
+
HCl
H3C CH2 CH2CH2Cl + AlCl3 CH3CH2CH2 AlCl4 H 3C
药物合成反应— 酰化反应

1. 羧酸为酰化剂
应用
DCC为催化剂的酰化反应 DCC:增强羧酸的酰化能力
2. 羧酸酯为酰化剂(酯的氨解反应)
应用 1)羧酸甲酯、乙酯的应用
2)活性酯的应用
3)在实际药物合成中的应用
3. 酸酐为酰化剂 机理
4. 酰氯为酰化剂 机理
应用 缚酸剂:(1)有机碱
三乙胺、吡啶等有机碱可中和反应中产生的HCl; 以吡啶、N,N-二甲氨基吡啶类为缚酸剂时,在中和产生的酸的同 时,还可以与酰氯生成络合物,起催化作用。
酰化反应
Acylation Reaction
第一节 概述
案例——神秘的阿司匹林(Aspirin)
➢ 镇痛 ➢ 解热 ➢ 消炎 ➢ 抗风湿 ➢ 对血小板聚集有抑制作用
O
COOH
CH3C
H+
+
O
OH
CH3C
O
被酰化物
酰化试剂
COOH
+
O CCH3 O
O CH3C OH
酰化反应:在有机物分子结构中的C、N、O或S等原子
(有机酸)对甲苯磺酸、萘磺酸
作用形式:与羧酸的羰基形成烊盐,增强羰基碳原子的正电性
Lewis酸 BF3、AlCl3、FeCl3、TiCl4 作用形式:与羧酸的羰基O形成络合物,增强羰基碳原子的正电性
副反应少\收率高\条件温和
DCC (P54)——良好的酯化缩合剂
作用形式:增强羧酸的活性 特点:条件温和、收率高、立体选择性强、价格贵
上导入酰基的反应。
1. 酰基是某些药物重要的药效基团; 2. 也是药物合成中官能团转换的重要合成手段; 3. 在涉及-OH、氨基等基团的保护时,将其酰化也是一种常见 的保护方法。
精细化学品化学烃化与酰化

23
卤烷的反应活性顺序是: RI > RBr > RCl 同系物的反应活性随碳链增长而减弱。硫
酸二甲酯的毒性较大,使用时须注意安全。
(一) 用卤烷或酯类进行胺类烷化
1、卤化物作烷化剂
用卤烷为烷化剂时,反应中要放出卤化
氢,为使反应顺利进行,常常要加缚酸剂,如
氢氧化钠(钙)、碳酸钠和氧化镁等。例:
2020/7/26
时间:4h
N(CH3)2 NHCH3
(+
)
96% (含量0.5%)
2020/7/26
21
➢N-乙基苯胺
NH2
+ C2H5OH
摩尔比 : 1
3.33
高压液相烷化法 H2SO4
NHC2H5
0.01
温度:210oC 压力:2.4-2.6MPa 时间:11h
N-乙基苯胺60%; N,N-二乙基苯胺21~25%;
1
RNH2
RNHR'
RNR'R''
RNHCOR'
RN+R'R''R'''X-
ROH
ROR'
ROCOR'
涉及的反应是取代连接在带有孤对电子的
氮、氧、硫原子上的氢的反应。
对于这些基团来说是亲电取代,反应活性与
孤对电子的活性成正比,所以脂肪族的氨基和羟
基都比芳香族的氨基和羟基的反应活性高。
2020/7/26
C6H5N(CH3)2 + Na2SO4 + 2CH3OH
水解得到的N,N-二甲基苯胺与水层分离后,
与上述甲基化过程中得到的粗产品合并,进行蒸
化学竞赛PPT-第八章 芳烃-第82
CH3 NO2 +
CH3
NO2
§8.4 取代苯的亲电取代反应——定位效应
大量实验证明,一取代苯发生亲电取代反应时, 苯环上原有取代基的性质对发生亲电取代反应的速度 和亲电试剂(第二个取代基)进入苯环位置都有影响。 也影响反应的难易程度。
这种原有取代基对新引入取代基进入苯环位置的 决定作用称为取代基的定位效应。
(1) 含有未共用电子对的原子与芳环成键,形成大键 ; (2) 含有电子的基团,例如: C C C6H5(3) 可通过诱导效应或超共轭效应产生给电子效应的烷基等。
2. 第二类定位基——间位定位基
使新引入的取代基主要进入原基团间位(间位产物大于 50%),且钝化苯环,使取代反应比苯难进行。此类定位基 为吸电子基,钝化基。
XY
有 些 容 易 混 淆 的 基 团 , 譬 如 —COOCH3 和 — OCOCH3 、 —CONHCH3 和 —NHCOCH3 , 按 此 方 法 均 可以正确判断:
—COOCH3 和 —CONHCH3 为 吸 电 子 基 , 而 — OCOCH3和—NHCOCH3为给电子基。
对于—CH2Cl、—CH2OH、—CH2OCH3、—CH2CN 则属例外,它们仍是给电子基。这些基团可以看成—CH3 上的1个H被取代,但其余C—H还可以通过σ-p超共轭作用 发挥给电子作用。
:OCH3
C 第三类定位基(卤素)定位效应的解释
第三类定位基卤素的电负性X > C, 具有 -I 效应;但X 的电子对与苯形成 p-π 共轭,具有 + C 效应。由于卤素 的+C < -I,因而苯环上的电荷密度总体降低,反应速度 减慢,但+C效应使邻、对位电荷密度较大,因而为邻对
第六章 酰化
OH
Zn Hg / HCl
OH
104~110℃
OH CO(CH2)4CH3
OH CH2(CH2)4CH3
பைடு நூலகம்
生产工艺: 想一想:
可以用间苯 二酚与1- 氯己烷进行 C-烃化反 应来制备 2,4-二羟基 己苯吗?
间苯二酚与过量的己酸 (同时用作溶剂) 在 氯化锌催化下,于120℃反应3h得缩合物,该缩
O + 2 CCl
AlCl3
CO + 2 HCl CO
首页
前页
后页
精细有机单元反应
第六章
酰 化
(3) 用羧酸的Friedel-Crafts酰基化 例如:邻苯甲酰基苯甲酸在浓硫酸中130~140℃ 脱水闭环得蒽醌。
O C COOH
98%H2SO4 130~140℃
O
O
想一想:
若要制备 还原染料 的中间体 2-甲基蒽 醌、2-氯 蒽醌,应选 用什么原 料?
例如:苯与丁二酸酐反应,经锌汞齐-盐酸还原 可得长链羧酸,接着进行分子内酰化可得萘满酮。
O + O O
AlCl3
O C CH2 CH2COOH
Zn Hg / HCl
CH2 CH2 CH2COOH
HF
O
羧酸作酰化剂,不宜用A1Cl3作催化剂,一般 用硫酸、磷酸,最好是氟化氢。
首页 前页 后页
精细有机单元反应
NH2 回流 + (CH3CO)2O COOH NHCOCH3 + CH3COOH COOH
本章重点介绍: 原理、方法和实例。 C-酰化、N-酰化和O-酰化的
首页 前页 后页
精细有机单元反应
第十一章 酰化
11.2 N-酰化
一、N-酰化的目的 二、反应历程 三、胺类结构对反应的影响 四、用不同酰化试剂的N-酰化反应
一、N-酰化的目的
永久性酰化 改变化合物的性质: 如药物性质(磺胺嘧啶)、 染料色光和牢度(色酚AS) 过渡性酰化
NH2
酰化 乙酐
NHCOCH3
硝化 混酸
NHCOCH3 NO2 水解
羧酸-磷酸混合酸酐、
羧酸-多取代苯甲酸混合酸酐等。 混合酸酐的应用 羧酸-三氟乙酸混合酸酐 (适用于立体位组较大的羧酸的酯化)
(CF3CO)2O H2N CH2OH
+ CH3CH2COOH
H2N
CH2OCOCH2CH3
73%
COOH CH3
+
H3C C CH3
OH
(CF3CO)2O
COOBu-t
当脂链上或芳环上有吸电子基时酰化剂的活性 增强,而有给电子基时则活性减弱。 由弱酸构成的酯也可以作为酰化剂,但是它的活性 比羧酸还弱。一些特殊的酯有较强的酰化能力。 由强酸构成的酯,例如硫酸二甲酯和苯磺酸甲酯, 则是烷化剂,而不是酰化剂,因为酯分子中烷基碳原 子上的正电荷较多。 一些特殊的酰胺及某些具有强吸电子基团的酮类 也可用作酰化剂
O R-C
δ3
+
Cl
δ1 +
<
δ2 +
<
δ3 +
因为酰氯酰基碳原子与电负性相当高的氯原子相 连,所以1+最大。酸酐与酸相比,前者的酰基碳原 子所连接的氧原子上又连接了一个吸电子的碳酰基, 因此,2+ > 3+,酸酐比羧酸活泼。 在脂族酰化剂中,其反应活性随烷基碳链的增长 而减弱。 因此,只有在向氨基氮原子或羟基氧原子上引入 低碳酰基时才能用羧酸作酰化剂。例如,甲酸、乙酸、 草酸(乙二酸)等。在引入长碳链的酰基时,需要使用 活泼的羧酸酰氯作酰化剂,或加入活化剂或缩水剂等。 当R为芳环时,由于芳环的共轭效应,活性降低。 因此,在引入芳羧酰基时也要用活泼的芳羧酰氯 作酰化剂或加入活化剂或缩水剂等。
第五章芳烃
R+ + AlCl4-
亲电试剂
AlCl 3
稳C定H3性-2C+。大HC-+于CH13。C+
R
+H
AlCl4-
R + HCl + AlCl3
+
RCOCl + AlCl3
+ + R-C=O
R-C=O + AlCl4-
H
- H+
COR
COR
AlCl3
C=O...AlCl3
R
18
(3) 加成反应
(甲) 加氢
丙酰氯
Clemmenson还原
O C-CH2CH3 Zn-Hg/HCl
CH2-CH2CH3
丙酰苯
正丙苯
13
(戊) 氯甲基化
3
+ (HCHO)3 + 3HCl
ZnCl2
。
60 C
3
CH2Cl + 3H2O
氯甲基化反应在有机合成上很重要,-CH2Cl(氯甲基)很容 易转化为:
例:
-CH2OH 羟甲基
CH2Cl
+E
E
E
H
H
+
H
+
① 该反应分为两步进行,第一步先生成中间体σ-络 合物。(一般常把 p 络合物这一步略去不写)σ-络合物 所带的一个正电荷分布在5个碳上;
② 失去质子,重新恢复苯环的稳定结构,最后形成能
量较低的取代产物。
15
(甲) 硝化反应机理
• 硝化反应中进攻试剂是NO2+,浓硫酸的作用是促进NO2+ 的生成:
第二章 烃化反应-3碳原子上的烃化反应
12
3. 应用特点
(1)烃基的异构化:制备稳定的烷基芳烃 氯代正丙烷在AlCl3存在下,生成丙基正离子,该正离 子可转变成更稳定的异丙基碳正离子,然后进攻苯环
Withdrawing Group) ,如- NO2 、- SO3H 、- CN 、 和与环直接相连的羰基 (包括醛、酮、羧酸和酯)的 芳环底物、使芳环活性降低, Friedel-Crafts 烷化反 应不易发生。
8
随堂练习题
相同条件下,下列化合物进行傅-克(Friedel-Crafts) 烷基化反应的活性顺序是( )。
得定位:烷基芳烃的位置选择性 一般符合定位规律,高温下易得不正常的间位产物
15
(3) 氯甲基化反应(Blanc反应)(掌握) 在无水ZnCl2存在下,芳烃与甲醛及氯化氢作用, 芳环上的氢原子被氯甲基 (-CH2Cl)取代,称氯甲基化 反应 (chloromethylation reaction) (Blanc反应)。
36
③ 应用实例4-维拉帕米中间体的合成
维拉帕米,抗心律失常药,为一种钙离
子内流的抑制剂,在心脏,钙离子内流 受抑制使窦房结和房室结的自律性降低。
37
自学内容
2. 醛、酮、羧酸衍生物的α位C-烃化(自学) 3. 烯胺的C-烃化(自学) 4. 相转移催化反应(自学)
38
小结
芳烃的Friedel-Crafts烷基化反应(重点)
炔烃的C-烃化反应 格氏试剂的C-烃化反应
