花色素苷含量表达方式
ph示差法花青素 计算问题

ph示差法花青素计算问题
Ph示差法是一种测定花青素含量的方法,这种方法利用花青素在不同pH
值下的颜色变化来计算花青素的浓度。
首先,你需要准备一些实验材料,包括含有花青素的样品、缓冲液(通常为pH 和pH 的磷酸盐缓冲液)、以及标准的花青素溶液。
实验步骤如下:
1. 将样品与pH 的缓冲液混合,用分光光度计在595nm处测定吸光度A1。
2. 将样品与pH 的缓冲液混合,再次测定吸光度A2。
3. 将标准花青素溶液与pH 的缓冲液混合,测定吸光度A3。
4. 将标准花青素溶液与pH 的缓冲液混合,测定吸光度A4。
通过以下公式计算花青素的浓度:
花青素浓度(mg/L)= [(A3×V3) - (A4×V3)] / [(A1×V1) - (A2×V1)] × [(V2/V1) - 1] / V3
其中,A1、A2、A3和A4分别是样品在pH 和pH 缓冲液中以及标准花青素溶液在pH 和pH 缓冲液中的吸光度。
V1和V2分别是样品和标准花青素溶液的体积,V3是缓冲液的体积。
请注意,这只是一个基本的计算方法,实际操作中可能需要根据具体情况进行适当的调整。
另外,为了保证实验结果的准确性,建议进行多次测量并取平均值。
花青素含量的测定

花青素含量的测定花青素是一种常见的植物色素,广泛存在于植物中,特别是在花朵和水果中。
花青素不仅赋予植物丰富多彩的颜色,还具有多种生理活性和保健功能。
因此,准确测定花青素含量对于研究植物生长发育以及开发植物资源具有重要意义。
测定花青素含量的常用方法有分光光度法、高效液相色谱法、电化学法等。
其中,分光光度法是一种简单、快速、经济的测定方法,被广泛应用于花青素含量的测定。
分光光度法是基于花青素本身在紫外-可见光区域具有特定的吸收光谱特性。
通常情况下,花青素在紫外区域(200-400nm)和可见光区域(400-700nm)都有吸收峰,峰值波长和吸光度的大小与花青素的结构和浓度有关。
因此,通过测定样品在特定波长下的吸光度,可以间接推算出花青素的含量。
具体的测定步骤如下:1. 样品的制备:将待测样品(如花朵、水果等)剪碎或研磨成细粉,加入适量的提取液(如乙醇、甲醇等),充分摇匀,静置一段时间,使花青素充分溶解在提取液中。
2. 提取:将提取液和样品混合物进行离心或过滤,得到澄清的提取液。
3. 分光光度法测定:取适量的提取液,利用紫外-可见光分光光度计,在特定波长下(通常为紫外区域的吸光峰)测定样品的吸光度。
根据吸光度和标准曲线的关系,可以计算出样品中花青素的含量。
需要注意的是,为了保证测定结果的准确性和可靠性,实验中应该设置空白对照组和标准曲线。
空白对照组是不含花青素的提取液,用于消除其他物质的干扰。
而标准曲线则是利用已知浓度的花青素标准品,根据吸光度和浓度的线性关系建立的,用于计算样品中花青素的含量。
为了提高测定的精确度,还可以对样品进行预处理,如去除杂质、调整pH值等。
同时,在测定过程中要注意操作规范,控制好实验条件,避免误差的产生。
测定花青素含量是研究植物色素和植物生理活性的重要手段。
分光光度法是一种常用而有效的测定方法,通过测定样品在特定波长下的吸光度,可以准确推算出花青素的含量。
通过合理的实验设计和操作,可以获得准确可靠的测定结果,为植物资源的开发和利用提供科学依据。
食品中花青素的含量测定与分析

食品中花青素的含量测定与分析食品中的花青素,作为一类天然色素,不仅能为食品增添色彩,提升观赏性,还具有多种对人体健康有益的功效。
而如何准确测定食品中花青素的含量,对于产品质量控制和营养价值评估具有重要意义。
一、花青素的简介花青素是一类存在于植物中的天然色素,在生命界中分布广泛,具有深浅不一的紫红色。
它们是由芳香稠环结构苯丙基酮环和醌环的结构单元通过茄乙酸途径合成的。
花青素具有很强的抗氧化作用,对预防心血管疾病、癌症以及抗衰老等方面具有积极作用。
二、花青素含量测定方法介绍测定食品中的花青素含量可以利用多种分析方法,常用的包括高效液相色谱法(HPLC)、紫外光谱法、比色法等。
这些方法各有优缺点,需要根据实际需要和样品特性选择适合的方法。
1. 高效液相色谱法(HPLC)HPLC是目前应用较广的分析方法之一,其原理是利用色谱柱对样品进行分离和纯化,并通过检测器检测某一波长下的吸光度或荧光强度。
这种方法具有分离效果好、灵敏度高、准确性高等特点,但需要较专业的设备和技术来操作。
2. 紫外光谱法紫外光谱法是利用不同波长下的吸收光谱来测定花青素含量的方法。
通过对设置不同波长下的吸光度进行测定,可以得到样品中花青素的含量。
这种方法简单易行,但对于含量较低的样品灵敏度较低,且无法区分不同种类的花青素。
3. 比色法比色法是利用花青素与一定试剂发生反应后形成有色产物,通过测定其吸光度来测定花青素的含量。
这种方法操作简便,成本较低,适用范围广,但受样品干扰较大,精确度相对较低。
三、花青素含量测定实验步骤为了更好地测定食品样品中花青素的含量,下面简要介绍一下实验步骤。
1. 样品制备:将待测样品进行制备和处理,如搅拌、研磨、加热等操作,以获得均匀的样品溶液或提取物。
2. 适当稀释:根据样品的浓度和分析方法的需求,适当稀释样品,并留取适量的样品溶液。
3. 实验操作:根据选择的分析方法,进行相应的实验操作,如HPLC的进样、流动相选择和梯度 elution,紫外光谱法和比色法的试剂添加和颜色反应等。
葡萄籽提取物中原花青素含量的最佳测定方法
葡萄籽提取物中原花青素含量的最佳测定方法葡萄籽提取物-原花青素被誉为“最强效的自由基清除剂”,其抗氧化能力是VC的20倍,VE的50倍。
也是唯一能透过血脑屏障的抗氧化剂,因此在促进皮肤新陈代谢,分解黑色素,以及提高机体免疫力,延缓衰老方面的应用极为广泛。
葡萄籽提取物由原花青素、儿茶素、表儿茶素、没食子酸等多酚类物质组成的,由于原花青素的成分极其复杂,目前的研究实验中还无法提供原花青素的标准品,因此Bate-Smith 和Porter法只能测定葡萄籽提取物中原花青素的相对含量。
一、Bate-Smith法、Porter法测定葡萄籽原花青素含量西安源森生物实验室对Bate-Smith法和Porter法测定原花青素相对含量实验进行了研究:(一)Bate-Smith法测定葡萄籽原花青素含量【实验目的】由于目前没有原花青素的标准品,因此此方法测定的只是葡萄籽提取物中原花青素的相对值,其含量用原花青素指数(procyanidolic index)来表示。
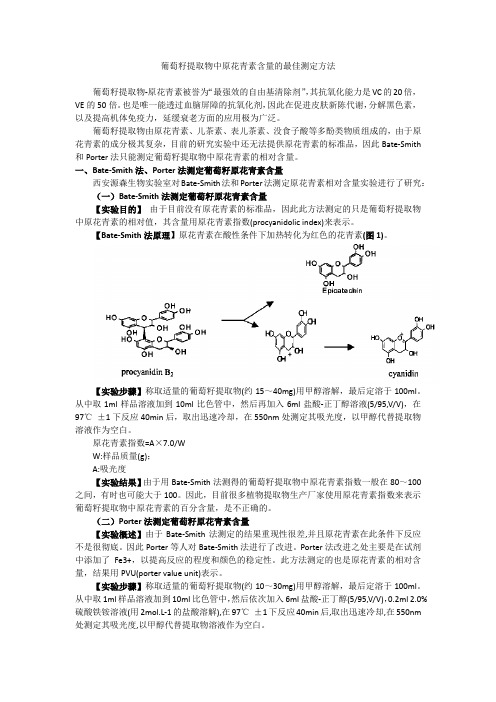
【Bate-Smith法原理】原花青素在酸性条件下加热转化为红色的花青素(图1)。
【实验步骤】称取适量的葡萄籽提取物(约15~40mg)用甲醇溶解,最后定溶于100ml。
从中取1ml样品溶液加到10ml比色管中,然后再加入6ml盐酸-正丁醇溶液(5/95,V/V),在97℃±1下反应40min后,取出迅速冷却,在550nm处测定其吸光度,以甲醇代替提取物溶液作为空白。
原花青素指数=A×7.0/WW:样品质量(g);A:吸光度【实验结果】由于用Bate-Smith法测得的葡萄籽提取物中原花青素指数一般在80~100之间,有时也可能大于100。
因此,目前很多植物提取物生产厂家使用原花青素指数来表示葡萄籽提取物中原花青素的百分含量,是不正确的。
(二)Porter法测定葡萄籽原花青素含量【实验概述】由于Bate-Smith法测定的结果重现性很差,并且原花青素在此条件下反应不是很彻底。
花青素单位u

花青素单位u花青素(Anthocyanin)是一种天然的水溶性色素,属于黄酮类化合物。
它们广泛存在于植物中,尤其是水果、蔬菜和花朵等部位。
花青素具有抗氧化、抗炎、抗肿瘤等多种生物活性,对人体健康具有重要价值。
花青素的单位通常用“μg/g”或“mg/kg”表示,其中“μg”表示微克,“mg”表示毫克,“g”表示克,“kg”表示千克。
这些单位用于表示花青素在食物或其他物质中的含量。
例如,某种水果的花青素含量为100 mg/kg,意味着每千克这种水果中含有100毫克的花青素。
花青素的颜色来源于其分子结构中的共轭双键系统。
当共轭双键系统中的电子在不同的能级之间跃迁时,会吸收或发射特定波长的光,从而产生不同的颜色。
因此,花青素的颜色与其分子结构密切相关。
不同种类的花青素具有不同的颜色,如天蓝色、红色、紫色等。
花青素的生物活性主要与其抗氧化作用有关。
研究表明,花青素具有很强的自由基清除能力,可以有效抵抗氧化应激对细胞的损伤。
此外,花青素还具有抗炎、抗肿瘤、保护心血管等多种生物活性。
例如,花青素可以抑制炎症因子的产生,减轻炎症反应;可以抑制肿瘤细胞的生长和扩散,促进肿瘤细胞凋亡;可以降低血脂、抑制动脉粥样硬化等。
花青素的摄入对人体健康具有重要意义。
许多研究表明,富含花青素的食物如蓝莓、黑莓、红葡萄酒等,可以降低心血管疾病的风险,预防癌症的发生,延缓衰老过程等。
因此,适量摄入富含花青素的食物,对维护人体健康具有积极作用。
然而,花青素的摄入也需要注意适量。
过量摄入某些花青素可能会引起过敏反应、肠胃不适等问题。
此外,花青素的生物利用率受到多种因素的影响,如食物中的其他成分、人体的消化吸收能力等。
因此,在选择富含花青素的食物时,应综合考虑其营养价值和安全性。
总之,花青素是一种具有多种生物活性的天然色素,对人体健康具有重要意义。
适量摄入富含花青素的食物,有助于维护人体健康。
然而,摄入花青素也需要注意适量和安全性。
玫瑰茄转录组测序及花青素合成相关基因表达分析

玫瑰茄转录组测序及花青素合成相关基因表达分析玫瑰茄(Solanum lycopersicum)是一种重要的蔬菜作物,也是研究植物进化和基因调控的模式植物之一。
近年来,随着高通量测序技术的发展,转录组测序成为研究玫瑰茄基因表达的重要方法。
在这篇文章中,我将介绍转录组测序及花青素合成相关基因表达分析的基本原理和方法。
转录组测序是利用高通量测序技术对细胞或组织中的RNA进行测序,从而获得所有基因的表达信息。
在玫瑰茄中,我们可以通过转录组测序来探究其在不同生长阶段,不同组织和不同环境条件下的基因表达差异。
我们需要提取玫瑰茄组织中的总RNA,并经过质量控制和纯化处理,获得高质量的RNA样本。
然后,我们将RNA样本转录成cDNA,并对cDNA 进行文库构建。
我们使用高通量测序技术对cDNA文库进行测序,并获得大量的短序列数据。
得到转录组测序数据后,我们就可以进行基因表达分析了。
我们需要对测序数据进行质量控制和预处理,去除低质量的序列和适配体序列。
然后,我们使用生物信息学工具将清洗后的测序数据比对到玫瑰茄的参考基因组上,得到每个基因的表达水平。
接下来,我们可以使用不同的统计方法来筛选出差异表达基因。
可以使用DESeq、edgeR等工具来计算每个基因的表达差异,并进行假设检验。
通过比较不同样本之间的基因表达差异,我们可以找到一些与玫瑰茄花青素合成相关的基因。
花青素是一类重要的天然色素,在植物的花朵、果实和叶子中广泛存在。
在玫瑰茄中,花青素的合成是一个复杂的过程,涉及多个基因的调控。
通过转录组测序和基因表达分析,我们可以鉴定出参与花青素合成的关键基因,并了解它们在不同生长阶段和组织中的表达模式。
进一步的功能研究可以揭示这些基因在花青素合成途径中的具体作用。
玫瑰茄转录组测序及花青素合成相关基因表达分析是一种强大的研究工具,可以帮助我们深入了解玫瑰茄基因调控网络和花青素合成途径。
通过这种方法,我们可以挖掘出更多与玫瑰茄发育和品质形成相关的基因,并为玫瑰茄的育种和种植提供有力的理论支持。
pH示差法测总花青素含量

pH示差法测总花青素含量
pH示差法测总花青素含量
实验试剂氯化钾、醋酸钠、浓盐酸、蒸馏水
实验器材容量瓶、烧杯、离心机、电子天平、pH计、紫外可见分光光度计
实验操作
取两个100 mL 容量瓶,各加入一定量离心待测液,分别用pH1.0 缓冲液和pH4.5 缓冲液定容后混匀,4℃静置2 h,然后将两种样品各在510 nm和700 nm波长下测定吸光度。
总花青素含量按公式2.3 计算,结果以矢车菊-3-葡萄糖苷(C3G)表示
公式2.3 中:A 由公式2.4 计算所得,Mw 为分子量(以C3G 计算,449.2g/mol),
Df 为稀释倍数(参考文献依据A取值在0.2-0.7),ε 为C3G 的消光系数(26900 L/mol·cm),l 为光程(1.0 cm)。
缓冲液的配制
①pH1.0 缓冲液配置
准确称取1.86 g KCl,与980 mL 蒸馏水混合,用浓HCl 校正pH 至1.0,移至1 L 的容量瓶中,用蒸馏水定容
②pH4.5 缓冲液配置
准确称取32.82 g 醋酸钠,与960 mL 蒸馏水混合,用浓HCl 校正pH 至4.5,移至1 L 的容量瓶中,用蒸馏水定容。
实验报告—实验五、果蔬抗氧化物质含量及抗氧化能力测定

实验五、果蔬抗氧化物质含量及抗氧化能力测定一、实验目的了解果蔬中主要活性物质,掌握其测定方法。
二、方法步骤2.1 果蔬汇总活性物质测定2.1.1花青素含量测定1.称取苹果果皮4g,加入适量石英砂,分次加入10ml1%HCl溶液研磨成匀浆,将匀浆液全部转移至100ml三角瓶,再加50-60ml1%HCl溶液抽提40min至样品无色,将抽提液过滤转移至100ml容量瓶,并用1%HCl溶液定容。
2.分别取上清液和1%HCl溶液各1ml,分别加入pH4.5DE 0.4M醋酸钠溶液各4ml;同时取上清液和1%HCl溶液各1ml,分别加入pH1.0的0.25M氯化钾溶液各4ml,摇匀混合平衡40min之后,转入光径1cm的比色皿,于520nm和700nm下测定其吸光度。
提取液的花青素浓度(mg/L)=A/ԑL×103×MW×稀释倍数式中:最终吸光度A=(A520nm,pH1.0-A70nm,pH1.0)-(A520nm,pH4.5-A700nm,pH4.5)苹果主要花青素是1-矢车菊素-3半乳糖苷,以其为标准,MW 为摩尔质量502.5,ԑ为摩尔吸光系数30200,L为比色皿光路长(1cm),最终以1g试样含有花青素的量(mg)来表示。
2.1.2类黄酮含量测定1.芦丁标准曲线精确称取芦丁标准样品(105°C干燥至恒重)0.0592g,加入60%乙醇,加热使其样品溶解,定量转移至200ml容量瓶中,配置成0.296g/L的标准溶液。
分别取上述芦丁标准溶液0、1、2、3、4、5ml,用30%乙醇补充至10ml,分别加入1ml5%NaNO2,摇匀后放置5min,加入1ml10%Al (NO3)3,6min后在加入5ml1MNaOH,混匀,用30%乙醇定容至100ml,10min 后于波长510nm下测定吸光值,绘出芦丁标准曲线。
2.称取4g番茄样品,加少量石英砂和5-10ml30%乙醇研磨成匀浆,用30%乙醇定容至100ml,过滤至三角瓶中后,取绿野和30%乙醇各2ml,分别加蒸馏水3ml、5% NaNO2 0.3ml,摇匀静置5min,加入10%Al(NO3)3 0.3ml,放置6min,再加1MNaOH 2ml摇匀,5min后于510nm波长下测定吸光值,以芦丁曲线作标准曲线计算类黄酮含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
花色素苷含量表达方式
花色素苷是一类常见的天然化合物,可在许多植物中发现。
它们通常负责给植物提供色彩,并在医药和保健品行业中使用。
花色素苷含量通常是评估植物中功能活性成分含量的指标之一。
在研究或生产中,正确地表达花色素苷含量通常是非常重要的。
以下是几种常见的表达方式:
1. % 花色素苷含量:这种方式是将花色素苷的含量与样品总重量进行比较。
例如,如果样品中含有2克花色素苷,且总重量为100克,则含量为2%。
2. mg/g:这种方式是将花色素苷的含量与样品干重进行比较。
例如,如果样品中含有10毫克花色素苷,且干重为5克,则含量为
2 mg/g。
3. μg/mL:这种方式是将花色素苷的含量与样品提取溶液的体积进行比较。
例如,如果样品提取溶液中含有100微克花色素苷,且体积为10毫升,则含量为10 μg/mL。
需要注意的是,不同植物中花色素苷的含量可能千差万别,因此在比较不同样品之间的花色素苷含量时应该格外小心。
同时,在进行含量测定时应该使用适当的方法和技术,以确保结果的准确性和可重复性。
- 1 -。
