用于基因治疗的慢病毒载体(一)
慢病毒简介PPT课件(模板)

7
Reagents for calcium phosphate transfection.
Polybrene, 800 μg/mL stock solution in PBS. tat编码的蛋白参与RNA转录的控制。 慢病毒载体系统的另一个特征是携带病毒微粒的表面蛋白,包含HIV受体和共受体,从而改变或扩大的细胞类型的范围,使得该载体可 以结合并且进入。
重组病毒载体已被用于研究各种发育神经生物学 中的基础问题,以及各种神经退行性疾病的发病机 理和治疗。慢病毒载体能转导分裂的细胞,如神经 元,并介导中枢神经系统(CNS)细胞在体内和体 外基因治疗或报道基因而作为神经生物学研究的有 价值的工具。
11
1.1. Lentiviral Gene Delivery to
的基 pol基因编码病毒复制所需的酶,如反转录酶、整合酶、
本结 蛋白酶。
构 env基因编码病毒的包膜糖蛋白,决定病毒感染宿主的 靶向性。
调节 rev编码的蛋白调节gag、pol、env的表达水平。
基因 tat编码的蛋白参与RNA转录的控制。
4个辅助基因vif、vpr、vpu、nef编码的蛋白则作为毒力
CNS Cells
Lentivirus preintegration complexes interact with the nuclear pore and undergo active transport into the nucleus of nondividing cells, where the proviral DNA is integrated into the genomic DNA of the host cell. This feature is the primary reason why lentiviruses are being developed as gene-transfer vectors for postmitotic cells in the CNS.
慢病毒载体构建原理

慢病毒载体构建原理
慢病毒(lentivirus)是一类病毒,属于反转录病毒的一种。
慢病毒可以作为基因转移的工具,被广泛应用于基因治疗、基因编辑、干细胞研究等领域。
慢病毒载体构建是利用慢病毒作为基因传递的载体,将外源基因导入慢病毒基因组中,并通过慢病毒的复制和转录机制,将外源基因稳定地表达在宿主细胞中的过程。
慢病毒载体构建的原理主要包括以下几个步骤:
1. 选择适当的慢病毒载体,慢病毒载体通常由慢病毒的基因组和外源基因组成。
在构建慢病毒载体时,需要选择适当的慢病毒载体,通常选择已经经过改造的慢病毒载体作为基础,然后将需要表达的外源基因插入到载体中。
2. 插入外源基因,将需要表达的外源基因插入到慢病毒载体的适当位置。
通常采用限制性内切酶切割和连接酶连接的方法,将外源基因与慢病毒载体连接起来,形成重组的慢病毒载体。
3. 构建重组慢病毒载体,将插入了外源基因的慢病毒载体导入到适当的宿主细胞中,利用宿主细胞的复制和转录机制,使重组慢
病毒载体在宿主细胞中稳定复制和表达外源基因。
4. 验证慢病毒载体的稳定性和表达效果,对构建的重组慢病毒
载体进行验证,包括验证慢病毒载体在宿主细胞中的稳定性和外源
基因的表达效果。
通常采用PCR、Western blot等方法对慢病毒载
体进行验证。
总之,慢病毒载体构建是利用慢病毒作为基因传递的载体,将
外源基因导入慢病毒基因组中,并通过慢病毒的复制和转录机制,
使外源基因稳定地表达在宿主细胞中的过程。
这一技术在基因治疗、基因编辑、干细胞研究等领域具有重要的应用前景,对于疾病治疗
和生命科学研究具有重要意义。
慢病毒载体构建原理

慢病毒载体构建原理
慢病毒载体是一种常用于基因转染和基因治疗研究的工具,其构建原理主要包括载体选择、基因插入、包装和转染等几个关键步骤。
下面将分别对这些步骤进行详细介绍。
首先,载体选择是慢病毒构建的第一步。
常用的慢病毒载体包括pLenti、pSico、pRetro等,这些载体通常具有较高的转染效率和稳定性。
在选择载体时,需要考虑载体的大小、复制能力、转染效率以及转染细胞类型等因素,以确保最终构建的慢病毒载体能够满足实验需求。
其次,基因插入是慢病毒构建的关键步骤之一。
一般来说,可以利用限制性内切酶切割载体,然后将待插入的基因片段与载体连接,形成重组载体。
在进行基因插入时,需要注意选择合适的限制性内切酶,控制酶切的时间和温度,以确保基因能够正确插入到载体中。
接下来是包装步骤。
包装是指将重组载体导入到包装细胞中,通过包装细胞的辅助,使其产生慢病毒颗粒。
常用的包装细胞包括293T细胞、HEK293细胞等。
在包装过程中,需要利用辅助载体,如
pMD2.G和psPAX2等,通过三质体共转染的方式,使包装细胞产生
慢病毒颗粒。
最后是转染步骤。
转染是将包装好的慢病毒颗粒导入到目标细
胞中,实现基因的转染。
在进行转染时,需要根据目标细胞的特性
选择合适的转染方法,如离体转染、体内转染等,以确保慢病毒能
够有效地转染目标细胞,并表达目标基因。
总的来说,慢病毒载体构建的原理涉及到载体选择、基因插入、包装和转染等关键步骤。
通过合理的实验设计和操作,可以构建出
稳定、高效的慢病毒载体,为基因转染和基因治疗研究提供有力的
工具支持。
病毒载体在基因工程中的优势与应用案例

病毒载体在基因工程中的优势与应用案例基因工程是一门通过DNA分子的重组技术来改变或者改造生物体基因结构的科学技术。
它不仅可以用于基础研究,还可以应用于医学、农业和工业领域。
在基因工程中,病毒载体作为一种重要的工具,具有许多独特的优势和广泛的应用。
本文将介绍病毒载体在基因工程中的优势,并举几个应用案例进行讨论。
病毒载体在基因工程中的优势之一是其高度选择性,可以将外源基因有效地嵌入到宿主细胞的基因组中。
病毒载体的基因组通常很小,可以携带和传递较长的DNA序列。
此外,病毒载体经过长时间的进化,已经具备了高度有效的侵染宿主细胞的能力。
利用这些特性,科学家可以使用病毒载体来将目标基因传递到特定类型的细胞中,从而实现基因工程的目的。
其次,病毒载体在插入目标基因时具有高效性。
病毒载体可以很容易地与外源基因重组,使得目标基因在宿主细胞中高效表达。
病毒侵染细胞的过程中,目标基因会被病毒载体运输并插入宿主细胞的基因组中,从而可以在细胞内产生目标蛋白。
这种高效的表达方式使得病毒载体在基因工程中得到了广泛应用。
病毒载体还具有广泛的宿主范围,可以感染多种类型的细胞。
这一特性使得病毒载体在基因工程中的应用更加灵活多样。
不同的病毒载体适用于不同类型的细胞,科学家可以根据需求选择合适的病毒载体进行基因传递。
例如,腺病毒载体可以感染多种哺乳动物细胞,而慢病毒载体则可以感染较广泛范围的细胞类型。
下面,我们将介绍两个病毒载体在基因工程中的应用案例。
第一个应用案例是利用腺病毒载体进行基因治疗。
腺病毒载体具有高度感染人体细胞的能力,被广泛应用于基因治疗领域。
基因治疗是一种将正常基因导入病人体内,以纠正遗传性基因缺陷或者改善疾病症状的方法。
例如,在严重联免疫缺陷病患者中,科学家使用腺病毒载体将正常的免疫系统基因导入患者的造血干细胞中,以恢复其免疫功能。
第二个应用案例是利用慢病毒载体进行基因敲除。
慢病毒载体具有稳定的遗传物质传递能力,被广泛应用于基因组编辑和基因敲除中。
基因治疗的三大类基因传递载体与基因传递效率评估

基因治疗的三大类基因传递载体与基因传递效率评估基因治疗是利用基因传递载体将修复或替代基因传递到患者的细胞中,以治疗遗传性疾病、癌症等难治性疾病的一种方法。
在基因治疗过程中,选择合适的基因传递载体和评估基因传递效率是非常重要的一步。
本文将介绍基因治疗中的三大类基因传递载体以及基因传递效率的评估方法。
第一类基因传递载体是病毒型载体。
病毒型载体可以将基因传递到目标细胞内,并整合到宿主基因组中,实现长期稳定的基因传递效果。
常用的病毒型载体包括腺病毒(Adenovirus)、逆转录病毒(Retrovirus)和腺相关病毒(Adeno-associated virus,AAV)等。
这些病毒型载体具有高效率的基因传递能力,但也存在一些问题,比如免疫反应、随机插入等。
然而,病毒型载体在基因治疗中仍然是最常用的载体,因为它们可以针对不同类型的细胞和组织进行基因传递。
第二类基因传递载体是非病毒型载体。
非病毒型载体是指没有感染细胞的能力,通常可以通过物理或化学手段将基因传递到细胞中。
常见的非病毒型载体有质粒DNA、利用电穿孔或超声波破裂、脂质体等。
相比病毒型载体,非病毒型载体有许多优点,如安全性高、简易制备、规模化生产等。
然而,非病毒型载体的缺点是传递效率相对较低,对于某些细胞类型的基因传递效果较差。
第三类基因传递载体是基因编辑工具。
基因编辑工具一般用于精确修改基因,包括锌指核酸酶(Zinc Finger Nucleases,ZFNs)、类转录因子效应子(Transcription activator-like effector nucleases,TALENs)和CRISPR/Cas9等。
这些工具可以通过靶向特定的DNA序列来实现基因的精确修饰,比如基因敲除、插入和突变等。
基因编辑工具具有高效的基因传递能力和精确性,但也面临着安全性和伦理问题的挑战。
为了评估基因传递效率,科研人员通常会采用多种方法来确定基因传递的效果。
金拓思慢病毒产品说明书

金拓思慢病毒产品说明书一、产品简介慢病毒载体是一类重组逆转录病毒载体,由于其结构和功能的特点,慢病毒载体作为一种重要的基因转移工具应用于基因治疗和细胞分子生物学研究领域。
区别于一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。
该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型细胞,达到良好的基因治疗效果。
我公司生产的重组慢病毒均以国际通用的第三代载体四质粒体系生产,通过重组改造后将含有目的基因的慢病毒骨架及其相应的作用元件组合为新质粒,并通过辅助质粒将病毒包装的元件组成重组病毒。
通过自我灭活的方式,阻止病毒自我复制。
保证了慢病毒使用过程中的良好生物安全性。
二、重要说明2.1安全操作说明1.应在Ⅱ级及以上级别生物安全柜中使用慢病毒产品。
2.虽经过改造后病毒安全性极大提高,操作中仍需佩戴口罩、手套等安全防护措施以免产生潜在危害。
3.操作中所有接触慢病毒试剂的样品、耗材、器皿等均需通过84消毒液(1:20)浸泡后,高温121℃灭活15min以上。
4.实验过程中有病毒液洒落的情况时,应用纸巾将病毒液吸干后喷洒70乙醇,并将擦干的纸巾一并高温处理以免造成其它伤害、污染环境。
2.2使用注意事项所有慢病毒产品均通过干冰低温运输,请收到产品后立即转入-80℃冰箱保存。
每次使用时提前取出病毒液放置在4℃冰箱待融化,并保存于4℃冰箱。
每次融化后请尽快使用,病毒液应尽量避免反复冻融降低病毒滴度。
三、慢病毒制备与使用3.1实验材料细胞:人贴壁细胞293T培养基:高糖DMEM培养基血清:胎牛血清抗生素:青链霉素转染试剂:Transfection-mate增强剂:Polybrene3.2病毒制备方法3.2.1细胞准备细胞复苏:1.将液氮保存细胞取出后,迅速放入37℃水浴锅内,应及时轻柔摇动加快解冻速度。
2.将完全溶解的细胞离心,1500rpm,3min。
慢病毒载体在基因治疗关节软骨损伤中的实验应用

【 关键词 】 基 因工程 ; 关节软骨 ; 慢病毒载体
在关节软骨损伤 的治疗 中研究 者尝试 用多种 载体 支架
结合骨髓 间充质干细胞来修复软骨缺损 , 如脱细胞 骨软骨支 架、 聚 乳 酸 一聚 乙 醇 酸共 聚物 ( p o l y l a c t i c — C O . g l y c o l i c a c i d , P L G A) 双层支架 等 , 但 由于 因素单一 缺乏环 境 因子的刺 激 , 研究者将 目光投入到基 因工程 , 利用 能介 导相关基 因并 结合
・
7 6・
中华关 节外科 杂志 ( 电子版 ) 2 0 1 3年 4月 第 7 卷第 2 期
C h i n J J o i n t S u r g ( E l e c t r o n i c E d i t i o n ) , A p i r l 2 0 1 3 , V o 1 . 7 , N o . 2
・
综 述
・
慢病 毒 载体 在 基 因治 疗关 节 软 骨 损 伤 中 的实 验 应 用
杨 自权 梁大川
【 摘要 】 基因治疗关 节软骨损伤是传送 目的基因至预定靶 细胞 , 并且 直接表达该基 因的性质 ,
达到修复治疗软骨损伤 的 目的。基 因载体是传递 目的基 因进入 靶细胞 的介导工 具。但 大部分基 因 载体 由于转 染效率低 、 表达 时间短、 免疫反应大 等诸 多问题而运用新型 的慢病毒载体使其介导 目的 基 因获得持续表达 , 从而使关节软骨损伤修 复顺利进行。慢病 毒载体在多用性和安全性上展示 了令 人满意 的特点 , 在基因工程中的运用更 加安全 , 因此慢病毒 载体 成了最有潜力 的基因工程工具 。它 不仅能应用于实验室操作 , 还能应 用于疾病 的诊断 和治疗方面 。本文按慢 病毒载体 的发 展简介 、 慢 病毒载体的生物安全性 、 在基 因治疗软骨损伤中的应用 以及展望四个方面对其予以综述 。
GenePharma 慢病毒载体 140512
6
LV6 穿梭质粒
Amp CMV HIV-1 5 LTR HIV-1 psi pack RRE HIV-1 3 LTR
LV6
8527 bp
WPRE EF-1a Puromycin CMV
Sph I (3798) Not I (3932) Nsi I (3964) Avr II (3969) Bam HI (3978)
Amp
CMV HIV-1 5 LTR HIV-1 psi pack
HIV-1 3 LTR
LV12
8087 bp
RRE
WPRE Puromycin T2A Luciferase05 CMV
U6
Hpa I (2936) Xho I (2951 )
Amp
CMV HIV-1 5 LTR HIV-1 psi pack
8
LV8 穿梭质粒
Amp CMV HIV-1 5 LTR HIV-1 psi pack HIV-1 3 LTR RRE
LV8
9262 bp
WPRE EF-1a Puromycin T2A RFP CMV
Sph I (3798) Not I (3932) Nsi I (3964) Avr II (3969) Bam HI (3978)
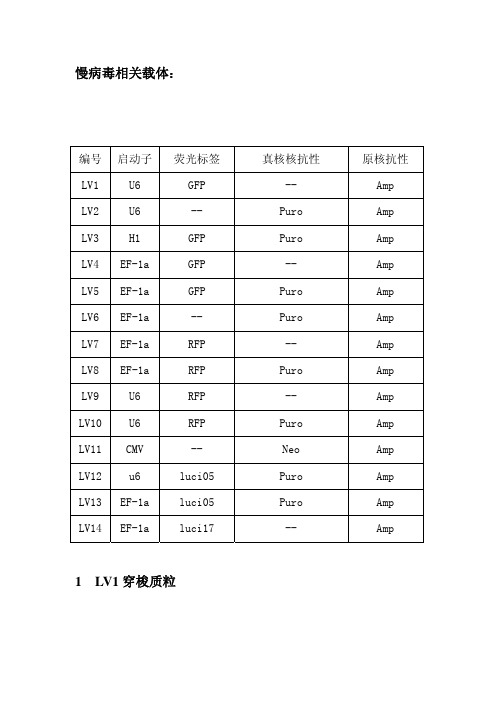
慢病毒相关载体:
编号 LV1 LV2 LV3 LV4 LV5 LV6 LV7 LV8 LV9 LV10 LV11 LV12 LV13 LV14
启动子 U6 U6 H1 EF-1a EF-1a EF-1a EF-1a EF-1a U6 U6 CMV u6 EF-1a EF-1a
荧光标签 GFP -GFP GFP GFP -RFP RFP RFP RFP -luci05 luci05 luci17
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
用于基因治疗的慢病毒载体(一)
基因治疗有望成为治疗遗传病、肿瘤、病毒感染及其它难治性疾病的有效手段,但目前基因转移方法的局限性成为实现这一希望的最大障碍。
非病毒学的基因转移方法效率较低;已用于人体试验的基因治疗方案绝大多数是以病毒学方法进行基因转移的,其中以逆转录病毒载体和腺病毒载体最为成熟。
常用的逆转录病毒载体从小鼠白血病病毒(MLV)改造而来,虽可使目的基因整合至靶细胞基因组、实现稳定表达,但只能转导分裂细胞,目前主要用于基因治疗的离体方案;腺病毒载体既能转导分裂细胞,亦可转导静止细胞,转导效率也较高,但目的基因不整合至靶细胞基因组,仅能短暂表达,而且腺病毒本身某些抗原的表达可引起人体免疫反应,阻止其重复转导;其它一些病毒载体如腺相关病毒(AAV)载体、单纯疱疹病毒(HSV)载体亦因各种原因不能令人满意。
理想的病毒载体能同时提供高效的基因转移、长期稳定的基因表达及生物安全性。
近来,一些研究者把目光投向了以Ⅰ型为人免疫缺损病毒(HIV-1)为代表的慢病毒。
研究表明〔1-5〕,以HIV-1为基础构建的这类慢病毒载体具有可感染非分裂细胞、目的基因整合至靶细胞基因组长期表达、免疫反应小等优点,适于体内基因治疗,因此有望成为理想的基因转移载体。
本文即对该类载体的研究进展做一简介。
1HIV-1基因组的基本结构〔6〕
HIV-1DNA前病毒的主要结构基因及其排列形式与其它逆转录病毒相同,均为5'LTR-gag-pro-pol-env-3'LTR。
其中gag基因编码病毒的核心蛋白,pol基因编码病毒复制所需的酶类,env基因编码病毒的包膜糖蛋白,pro基因则编码切割蛋白前体所需的蛋白酶。
与其它逆转录病毒不同的是,HIV-1基因组尚有较多调节基因,其中属于HIV-1基因复制所必需的tat基因和rev基因,分别编码两个反式激活因子Tat蛋白和Rev蛋白,前者在HIV-1基因组复制和转录延伸过程中发挥重要作用,后者则可促使HIV-1基因的表达由早期向晚期转化。
非HIV-1复制所必需的调节基因有nef、vif、vpr和vpu。
这些基因的编码产物都有各自的功能,有些尚未完全阐明,在此不一一赘述。
2构建HIV-1载体系统的基本原理〔7〕
HIV-1载体系统由两部分组成,即包装成分和载体成分。
包装成分由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白;载体成分则与包装成分互补,即含有包装、逆转录和整合所需的HIV顺式作用序列,同时具有异源启动子控制下的多克隆位点及在此位点插入的目的基因。
为降低两种成分同源重组恢复成野生型病毒的可能,需尽量减少二者的同源性,如将包装成分上5'LTR换成巨细胞病毒(CMV)立即早期启动子、3'LTR换成SV40polyA等。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能。
图1所示为Trono等建立的HIV-1载体系统中的一种〔1〕。
将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。
3HIV-1载体系统的改进
近年来,已有多个实验室建立了复制缺陷的HIV-1载体系统,用于不同目的的研究,如分析病毒的感染力〔8〕、筛选抗病毒药物〔9〕、评价Env糖蛋白的不同区域在介导病毒进入细胞中的作用〔10〕等。
而目前对于以基因治疗为目的的HIV-1载体系统,研究的焦点集中在如何扩大其嗜性范围、确保其安全性及提供其滴度和转导能力上。
1996年以来,Trono领导的课题组发表了一系列令人鼓舞的研究结果〔1~3〕,主要包括以下几方面的改进。
3.1包膜蛋白
最初的HIV-1载体颗粒,均由其本身的包膜蛋白Env所包裹,仅对CD4+的细胞具有亲嗜性。
1996年,Trono课题组的Naldini等〔1〕设计的HIV-1载体系统(见图1)采用表达水疱性口炎
病毒(VSV)糖蛋白G的质粒和双嗜性小鼠白血病病毒(MLV)包膜蛋白Env的质粒,分别取代表达HIV本身包膜蛋白Env的质粒,使HIV-1载体颗粒包上了VSV或双嗜性MLV的包膜。
这样做的结果至少具有三个方面的积极意义:①包膜的更换进一步降低了HIV-1载体恢复成野生型病毒的可能;②使HIV载体感染宿主的范围不再仅限于CD4+细胞,而扩大到几乎能感染所有组织来源的细胞;③VSV的包膜赋予HIV载体颗粒高度的稳定性,使其能够通过超速离心而浓缩,达到高滴度。
Naldini等已使HIV-1载体滴度由105转录单位(TU)/ml达到108TU/ml。
这样的改进无疑是HIV载体系统走向应用而迈出的一大步。
3.2包装成分
包装成分的构建应在不影响重组病毒的装配和感染力的前提下,尽可能地减少无关的HIV-1蛋白的表达,为野生型病毒的恢复设置障碍。
Naldini等〔1,2〕在构建包装质粒pCMVΔR9和pCMVΔR8.2时,分别在env基因阅读框架前插入了多个终止密码子或删除了env基因中1.4kp的序列,代之以终止密码子,以阻止env基因的表达。
在此基础上,Zufferey等〔3〕将包装包装质粒上表达调节蛋白Nef、Vif、Vpr和Vpu的4个基因分别删除或联合删除,结果发现它们对于产生HIV-1载体颗粒是非必需的,即使完全删除,得到的载体颗粒仍具备转导非分裂细胞的能力。
这4个调节蛋白或已被证实、或被高度怀疑是构成HIV毒性的因素〔11,12〕,将其删除、加上包膜蛋白的替换,可使制备HIV载体过程中产生野生型病毒的可能必微乎其微。
3.3载体质粒
载体质粒上HIV-1的顺式序列通常包括两端的LTR、剪切位点及包装信号Ψ等。
此外,研究表明〔7〕,gag基因5'端的序列可提高载体RNA的包装效率;Rev蛋白需要与Rev反应元件(RRE)相作用,将未剪切的载体转录产物从细胞核转运到胞浆。
因此,Naldini等〔1~3〕在载体上保留了gag基因5'端350bp的序列及位于env序列中的RRE,提高了产生载体颗粒的能力。
对于载体上需含有多少顺式作用序列为最佳,目前尚不完全靖楚。
4HIV-1载体介导基因转移的体内外实验
迄今,Trono课题组构建的HIV-1载体系统已在体外转导过人子宫颈癌细胞(HeLa)、鼠成纤维细胞(208F)、原代培养的人巨噬细胞、人呼吸道上皮细胞等,结果表明〔1-5〕,HIV-1载体无论对分裂细胞还是非分裂细胞均能转导,但对非分裂细胞的转导效率与细胞所停止的周期有关。
HIV-1载体对G0期细胞的转导效率不如对静止于G1/S或G2期的效率高,停止于G0期的时间越长,这种差别越大。
这可能是由于某些G0期细胞内脱氧核苷酸浓度低、影响了反转录步骤,造成报告基因未表达所致的表观现象。
实际上,HIV-1载体有的已进入到G0期的靶细胞内,建立了转录中间体。
一旦这类细胞进入细胞周期,载体所携带的基因就会表达。
在动物体内实验中,Naldini等〔1〕将HIV载体注射成年大鼠脑组织,30天后取脑组织,未观察到病理变化,免疫组化显示报告基因能够在终末分化的神经元中表达,证明HIV载体对体内基因转移是有效的。
此后,他们将重组病毒在转导前用dNTP和多胺处理,以增加病毒内逆转录反应,可使对大鼠神经元的转录数率提高2倍,报告基因可表达3个月以上〔2〕。
Miyoshi等〔4〕将携带绿色荧光蛋白(GFP)基因的HIV载体注射大鼠眼球,GFP能在感光细胞和视网膜色素细胞中表达,如果以视紫质启动子控制GFP,则可在感光细胞中特异地高表达。
对于HIV-1载体进入非分裂细胞后的表达是否全部由整合形式产生,目前尚有不同意见。
Naldini等〔2〕将包装质粒中的整合酶基因突变,如此而产生的HIV载体不能在非分裂细胞中表达,因此认为HIV载体的表达全部由整合形式产生;而Goldman等〔5〕却在转导细胞中测到了HIV载体前病毒的非整合形式,认为不能排除两种形式同时存在的可能。
在用HIV-1载体已经进行的所有体内外实验中〔1~5〕,未出现过有复制力的HIV,说明其安全性是有保证的。
