第十一章酚与醌
合集下载
第十一章酚和醌

(1)NaOH (2) HCl
O CH2COOH Cl Cl
2,4-二氯苯氧乙酸(2,4-D) 酚醚化学性质比酚稳定,不易氧化,而且与HI作 用,分解为酚,此反应可用来保护酚羟基。
OCH3 OH
+
2015/11/28
HI
+
习题13
CH3I
23
克莱森重排
定义:烯丙基芳基醚在高温下可以重排为邻烯 丙基酚或对烯丙基酚,这称为克莱森重排。
X
X
亲核性比醇弱
O O CH3
成酯:
OH + CH3COOH + CH3COCl + (CH3CO)2O
OH + CH3COOH
O
98%H2SO4 4h/55%
O C CH3
乙酸苯酯
2015/11/28
25
在酸催化下,酚与羧酸作用也能生成酯,但比醇 难。通常采用酰氯或酸酐与酚反应。例如:
O C Cl + HO
14
OCH2CH=CH2
OH
200oC
14
OH
CH2CH=CH2
200oC
14
O
CH2CH CH2
190-220C 6h
OH CH2CH CH2
CH2CH=CH2
O H3C
CH2CH CH2 CH3 H3C
OH CH3
CH2CH CH2
2015/11/28
24
(3)酯的生成
难
OH + HX
对 10.00 10.26 10.21 9.81 9.38 9.26 9.20 7.15
O CH2COOH Cl Cl
2,4-二氯苯氧乙酸(2,4-D) 酚醚化学性质比酚稳定,不易氧化,而且与HI作 用,分解为酚,此反应可用来保护酚羟基。
OCH3 OH
+
2015/11/28
HI
+
习题13
CH3I
23
克莱森重排
定义:烯丙基芳基醚在高温下可以重排为邻烯 丙基酚或对烯丙基酚,这称为克莱森重排。
X
X
亲核性比醇弱
O O CH3
成酯:
OH + CH3COOH + CH3COCl + (CH3CO)2O
OH + CH3COOH
O
98%H2SO4 4h/55%
O C CH3
乙酸苯酯
2015/11/28
25
在酸催化下,酚与羧酸作用也能生成酯,但比醇 难。通常采用酰氯或酸酐与酚反应。例如:
O C Cl + HO
14
OCH2CH=CH2
OH
200oC
14
OH
CH2CH=CH2
200oC
14
O
CH2CH CH2
190-220C 6h
OH CH2CH CH2
CH2CH=CH2
O H3C
CH2CH CH2 CH3 H3C
OH CH3
CH2CH CH2
2015/11/28
24
(3)酯的生成
难
OH + HX
对 10.00 10.26 10.21 9.81 9.38 9.26 9.20 7.15
《有机化学》第11章酚和醌

基团视为取代基。 但当苯环上连有比酚羟基优先的基团时(按照
优先次序判断),要以最优先的基团作为主官能团, 由主官能团决定母体的名称,此时将羟基作取代基 处理。
羟基连在稠环上的化合物,其命名与苯酚类似, 但须遵循稠环芳烃的编号原则。
3
CH3
OH
HOOC
OH
2-甲基苯酚 邻甲苯酚
4-羟基苯甲酸 对羟基苯甲酸
苯酚的卤代非常容易,不需要L酸的催化。
OH
Br2 / H2O Br
Br
OH (白色) 过量 Br2 / H2O Br Br
Br
Br O (黄色)
Br
——用于酚的定性、定量分析
Br
OH Br2 / HBr
30℃
Br
酸性溶剂
OH
Br2 / CCl4 10℃
Br
OH
非极性溶剂
17
(2)硝化反应 室温下用稀硝酸就可将苯酚硝化,生成邻位、
O CH3
OH
+ HI
+ CH3I ——保护酚羟基
14
(3)酚酯的生成 酚与羧酸直接酯化比较困难,需要用反应活性
更强的酸酐或酰氯反应。
O
OH + Cl C
苯甲酰氯
10% NaOH 40~45℃
O OC
苯甲酸苯酯
O
CH3 C
OH +
O
H3C C O
乙酸酐
15% NaOH 30~40℃
O O C CH3
HO
OH
均苯三酚
OH
偏苯三酚
1,3,5-苯三酚 1,2,4-苯三酚 39
无溶剂条件下
40~150℃
Cl
OH
优先次序判断),要以最优先的基团作为主官能团, 由主官能团决定母体的名称,此时将羟基作取代基 处理。
羟基连在稠环上的化合物,其命名与苯酚类似, 但须遵循稠环芳烃的编号原则。
3
CH3
OH
HOOC
OH
2-甲基苯酚 邻甲苯酚
4-羟基苯甲酸 对羟基苯甲酸
苯酚的卤代非常容易,不需要L酸的催化。
OH
Br2 / H2O Br
Br
OH (白色) 过量 Br2 / H2O Br Br
Br
Br O (黄色)
Br
——用于酚的定性、定量分析
Br
OH Br2 / HBr
30℃
Br
酸性溶剂
OH
Br2 / CCl4 10℃
Br
OH
非极性溶剂
17
(2)硝化反应 室温下用稀硝酸就可将苯酚硝化,生成邻位、
O CH3
OH
+ HI
+ CH3I ——保护酚羟基
14
(3)酚酯的生成 酚与羧酸直接酯化比较困难,需要用反应活性
更强的酸酐或酰氯反应。
O
OH + Cl C
苯甲酰氯
10% NaOH 40~45℃
O OC
苯甲酸苯酯
O
CH3 C
OH +
O
H3C C O
乙酸酐
15% NaOH 30~40℃
O O C CH3
HO
OH
均苯三酚
OH
偏苯三酚
1,3,5-苯三酚 1,2,4-苯三酚 39
无溶剂条件下
40~150℃
Cl
OH
第11章 酚和醌(食品2)

5
2、氯苯水解 、
Cl
+
NaOH
Cu ,20MPa 350~370℃
ONa
HCl
OH
优点: 操作简便,副产物易分离; 优点: 操作简便,副产物易分离; 缺点: 需要高温、 高压反应, 缺点 : 需要高温 、 高压反应 , 且碱对设备的腐蚀严 重,反应困难。 反应困难。 若苯环上连有强吸电子基,水解较易。 若苯环上连有强吸电子基,水解较易。 强吸电子基
OH
H3C CH3 C CH2
OH
+
CH3
浓 H2SO4
(CH3)3C
C(CH3)3
4-甲基 甲基-2,6-二 甲基 二 叔丁基苯酚
20
CH3
酚也较容易发生酰基化反应, 酚也较容易发生酰基化反应,但酚羟基上易发生酯 容易发生酰基化反应 化反应,而使酚的酰基化反应产率较低。 化反应,而使酚的酰基化反应产率较低。
二、酚的制法 1、异丙苯氧化法
O OH
OH
O2 / 过过酸过 110~120℃
稀 H2SO4 75~80℃
O
+
氢过氧化异丙苯 聚合橡胶的引发剂
此法是目前工业生产苯酚最主要 最好的方法 最主要和 的方法, 此法是目前工业生产苯酚最主要和最好的方法, 原料廉价易得,可连续化生产, 原料廉价易得,可连续化生产,副产品丙酮也是常用 的有机试剂、有机溶剂之一。 的有机试剂、有机溶剂之一。
酚过量: 酚过量:
OH
HCHO
2
H or OH
+
-
HO
CH2
OH CH2 或
OH
OH
23
以上中间产物与甲醛、苯酚继续作用, 以上中间产物与甲醛、苯酚继续作用,就可得到 线型酚醛树脂: 线型酚醛树脂:
2、氯苯水解 、
Cl
+
NaOH
Cu ,20MPa 350~370℃
ONa
HCl
OH
优点: 操作简便,副产物易分离; 优点: 操作简便,副产物易分离; 缺点: 需要高温、 高压反应, 缺点 : 需要高温 、 高压反应 , 且碱对设备的腐蚀严 重,反应困难。 反应困难。 若苯环上连有强吸电子基,水解较易。 若苯环上连有强吸电子基,水解较易。 强吸电子基
OH
H3C CH3 C CH2
OH
+
CH3
浓 H2SO4
(CH3)3C
C(CH3)3
4-甲基 甲基-2,6-二 甲基 二 叔丁基苯酚
20
CH3
酚也较容易发生酰基化反应, 酚也较容易发生酰基化反应,但酚羟基上易发生酯 容易发生酰基化反应 化反应,而使酚的酰基化反应产率较低。 化反应,而使酚的酰基化反应产率较低。
二、酚的制法 1、异丙苯氧化法
O OH
OH
O2 / 过过酸过 110~120℃
稀 H2SO4 75~80℃
O
+
氢过氧化异丙苯 聚合橡胶的引发剂
此法是目前工业生产苯酚最主要 最好的方法 最主要和 的方法, 此法是目前工业生产苯酚最主要和最好的方法, 原料廉价易得,可连续化生产, 原料廉价易得,可连续化生产,副产品丙酮也是常用 的有机试剂、有机溶剂之一。 的有机试剂、有机溶剂之一。
酚过量: 酚过量:
OH
HCHO
2
H or OH
+
-
HO
CH2
OH CH2 或
OH
OH
23
以上中间产物与甲醛、苯酚继续作用, 以上中间产物与甲醛、苯酚继续作用,就可得到 线型酚醛树脂: 线型酚醛树脂:
有机化学课后习题答案11第十一章酚醌
2)
SO3H 浓H2SO4 NaOH ONa H+ OH
OH 浓H2SO4 Cl2 Cl
OH Cl H+ Cl
OH Cl
SO3H
SO3H
OCH3 浓 H2SO4 SO3H 浓HNO3 O2N OCH3 NO2
3.
1)
OH CH3I OCH3
SO3H
NO2
2)
OH
+
OH CH3COOH BF3 CH3COCl
OC2H5 H
+
OC2H5
CH2CH2MgBr
CH2CH2OH
123
习题 C 一. 1. 4. 7. 蒽醌 4-硝基萘酚 4-羟基-2-溴苯乙酮 2. 5. 8. 2-萘酚 4-溴萘酚 对羟基苯乙酮 3. 6. 9. 4-羟基-3-甲氧基苯甲醛 3-甲基-4-羟基苯甲酸 对苯醌
二. 1. A 2. C 3. C 4. A 5. C 6. D 7. C 三.完成下列反应式
5.
O 1,4-环己二肟
6.
COCH3
7.
4-甲基-2,6-二羟基-α-苯乙醇
OH
8.
9.
1,4-环己二酮
10. H2N 二.
OH
1.
CH2CH2CH2Br,
OCH2CH=CHCH3 OH
O
2. ,
O
CHCH=CH2 CH3
3.
O
,
三. 1. C>A>B
2. A>C>B
四. (1) 1.溴水处理,有白色沉淀生成为苯酚;2.加入金属钠,有气体生成为丁醇;3.剩余两种化 合物中,溶于浓硫酸的是丁醚,不溶的则为己烷。 (2) 用氢氧化钠水溶液处理,苯酚溶于氢氧化钠水溶液,苯甲醇不溶。 (3) 用氢氧化钠水溶液处理,对甲苯酚溶于氢氧化钠水溶液,苯甲醚不溶。 (4) 与溴水处理,生成白色沉淀为含酚的水溶液,无沉淀则为纯水。 五. 1.
第11章 酚和醌
OH H 3C O CH2CH CH3 CHCH3 200 。 C CH2CH CHCH3 H 3C CH3
克莱森重排本质上是乙烯基烯丙基的重排
CH2 CH O CH2CH CH2 CH2 CH CH2 CH CH OH 互变
CH2 CH CH2 CH2 CHO
4、与三氯化铁显色 凡具有烯醇式结构的化合物遇FeCl 烯醇式结构的化合物遇 凡具有烯醇式结构的化合物遇FeCl3溶液都有显色反应
NO2
NO2
NO2
苦味酸
Pka = 7.22
4.00
0.71
吸电子基团越多,酸性越强。 吸电子基团越多,酸性越强。
OH
OH < <
OH OCH3 <
OH
吸电子诱导 给电子共轭
OCH3
OCH3
Pka =
10.21
10.0
9.98
9.65
另外,酚的邻位上如有体积很大的取代基,由于苯氧负离 另外,酚的邻位上如有体积很大的取代基, 子的溶剂化受到阻碍,其酸性特别弱。 子的溶剂化受到阻碍,其酸性特别弱。如2,4,6-三新戊 基苯酚中液氨中与金属钠不起反应。 基苯酚中液氨中与金属钠不起反应。
OH (CH3)3C H2C CH2 C(CH3)3 CH2 C(CH3)3
2、酚酯的生成及傅瑞斯(Fries)重排 酚酯的生成及傅瑞斯(Fries)重排 (Fries) 由于酚中存在P 由于酚中存在P-π共轭,降低了氧周围的电子云密度,使其 共轭,降低了氧周围的电子云密度, 亲核性比醇弱。所以酚类不能直接与酸成酯, 亲核性比醇弱。所以酚类不能直接与酸成酯,而要与酸酐或 酰氯作用才能成酯。 酰氯作用才能成酯。
醇钠在水中几 乎全部水解
绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液, 绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液,又 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。
克莱森重排本质上是乙烯基烯丙基的重排
CH2 CH O CH2CH CH2 CH2 CH CH2 CH CH OH 互变
CH2 CH CH2 CH2 CHO
4、与三氯化铁显色 凡具有烯醇式结构的化合物遇FeCl 烯醇式结构的化合物遇 凡具有烯醇式结构的化合物遇FeCl3溶液都有显色反应
NO2
NO2
NO2
苦味酸
Pka = 7.22
4.00
0.71
吸电子基团越多,酸性越强。 吸电子基团越多,酸性越强。
OH
OH < <
OH OCH3 <
OH
吸电子诱导 给电子共轭
OCH3
OCH3
Pka =
10.21
10.0
9.98
9.65
另外,酚的邻位上如有体积很大的取代基,由于苯氧负离 另外,酚的邻位上如有体积很大的取代基, 子的溶剂化受到阻碍,其酸性特别弱。 子的溶剂化受到阻碍,其酸性特别弱。如2,4,6-三新戊 基苯酚中液氨中与金属钠不起反应。 基苯酚中液氨中与金属钠不起反应。
OH (CH3)3C H2C CH2 C(CH3)3 CH2 C(CH3)3
2、酚酯的生成及傅瑞斯(Fries)重排 酚酯的生成及傅瑞斯(Fries)重排 (Fries) 由于酚中存在P 由于酚中存在P-π共轭,降低了氧周围的电子云密度,使其 共轭,降低了氧周围的电子云密度, 亲核性比醇弱。所以酚类不能直接与酸成酯, 亲核性比醇弱。所以酚类不能直接与酸成酯,而要与酸酐或 酰氯作用才能成酯。 酰氯作用才能成酯。
醇钠在水中几 乎全部水解
绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液, 绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液,又 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。
大学有机化学第十一章酚醌详解演示文稿
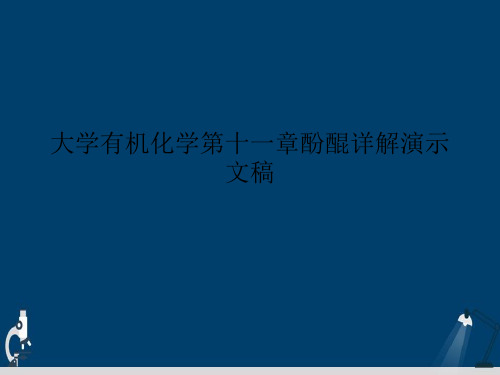
11.2.3 从芳磺酸制备
+ 浓H2SO4
NaOH(固体)
320。C
SO3H NaOH(溶液)
ONa H+
OH
SO3Na
+ 浓H2SO4 160。C
NaOH(固体) 熔融
ONa H+
SO3H NaOH(溶液) OH
SO3Na
11.2.4 从芳胺制备
芳胺经重氮化反应后,重氮基被羟基取代,得到酚。
NH2 Br
苯酚的卤代反应是亲电的离子型反应,在有利于X-X 键异裂的极性介质中或催化剂存在下更容易进行。
若想得到一元溴代产物,反应须在低温和非极性 溶剂下进行:
OH
+ Br2 CS02-o5r。CCCl4
OH
+ Br
67%
OH Br + HBr
33%
(2) 硝化
一元硝化:
OH
OH
Hale Waihona Puke OH稀H。NO325 C
NO2
先出现的为主官能团,其余为取代基,依次列出,尽
量使取代基位次和最小。
OH
OH
OH
OH
苯酚
CH3
NO2
间甲苯酚 对硝基苯酚
m-甲苯酚 p-硝基苯酚
萘酚 萘酚
OH
OH
OCH3
萘酚 邻甲氧基苯酚 萘酚 o-甲氧基苯酚
OH COOH
邻羟基苯甲酸
CHO
OH 对羟基苯甲醛
芳醇的命名与脂肪醇相似,将苯环作为取代代基。例如:
不溶
说明酚的酸性比碳酸弱!
OH + NaOH(5%) OH + NaOH(5%)
溶 不溶
多酚形成醌

多酚形成醌
多酚是一类具有多个酚羟基的化合物,其在生物体内具有重要的
生理功能。
多酚可以通过氧化反应形成酌物,这一过程被称为“多酚
形成醌”。
多酚形成醌是多酚生物活性的重要途径,而醌物则因其具
有良好的抗氧化性被广泛运用于药物、食品和护肤品等领域。
多酚形成醌的过程可以分为四步:
第一步,多酚在受到适当的诱导剂或氧化剂作用后失去一个或多
个电子,形成具有自由基性质的多酚单元。
这个步骤通常称为“引发”步骤。
第二步,由于多酚单元的极性特征,它容易发生互相作用,发生
交联、缩合等化学反应,生成高分子量的多酚聚合物。
在这个阶段中,还可能出现多酚与蛋白质的复合物形成,这样的反应会改变蛋白质的
构象和活性。
第三步,多酚聚合物进一步发生氧化反应,使其中的醚键、芳香
环等化学键结构发生断裂,而成为酌物。
酌物的一个特征就是存在碳
醌和氧醌两种结构,其中碳醌比氧醌更稳定。
第四步,酌物能够进一步反应,发生还原还原成多酚。
这个过程
被称为“消解”步骤,它使多酚生物活性得以再次体现。
多酚形成醌是多酚生物活性的最终表现形式之一。
以茶多酚为例,多酚形成醌后,具有更强的抗氧化、抗衰老、抗炎症等多种生理功能,这些功能也是茶多酚被广泛应用于食品、化妆品等领域的原因之一。
总之,多酚形成醌是一种复杂的生化反应过程,这个过程不仅能
够改变多酚的生物活性,而且还能够制备出具有强抗氧化性能的高分
子化合物。
随着对多酚形成醌和多酚生物活性的研究不断深入,相信
未来还会有更多的应用领域得到开拓。
有机化学第十一章酚与醌

氧化反应
酚易被氧化,如苯酚在空气中放置会逐渐氧 化成粉红色。
缩合反应
酚可与醛或酮发生缩合反应,生成酚醛树脂 或酚酮树脂。
醌的反应及应用
加成反应
醌可与亲核试剂发生加成反应,如与氢氰酸加成生成α-羟基腈。
还原反应
醌可被还原成酚,常用的还原剂有金属氢化物、硫化物等。
取代反应
醌环上的氢原子可被卤素、硝基等取代,生成相应的卤代醌或硝基醌。
实验安全注意事项
实验过程中需佩戴防护眼镜和 手套,避免试剂飞溅或接触皮
肤。
1
使用浓硫酸时应特别小心,避 免溅到皮肤或衣物上。若不慎 接触,应立即用大量清水冲洗
并就医。
加热回流过程中应注意控制温 度,避免温度过高引发危险。
实验结束后应妥善处理废液和 废弃物,保护环境。
06
知识拓展与前沿动态
酚和醌在自然界中的存在和作用
实验操作步骤详解
01
在圆底烧瓶中加入适量苯酚和乙醇,加热回流。
02
通过滴液漏斗缓慢滴加浓硫酸,同时观察反应现象。
03
反应完成后,将反应液冷却并用氢氧化钠溶液中和,析
出醌。
实验操作步骤详解
4. 醌的性质实验
将醌溶于少量有机溶剂 (如乙醇)中,观察其溶 解性。
取少量醌晶体,观察其颜 色、状态。
向醌溶液中滴加溴水或氯 化铁溶液,观察颜色变化。
有机化学第十一章 酚与醌
contents
目录
• 酚的概述与性质 • 醌的概述与性质 • 酚与醌的合成方法 • 酚与醌的反应及应用 • 实验操作与注意事项 • 知识拓展与前沿动态
01
酚的概述与性质
酚的定义与分类
定义
羟基直接连在芳香环上的化合物称为 酚。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+ SO2 + H2O
ONa
固体NaOH 碱熔 320-350℃
+ Na2SO3 OH
SO2 + H2O
+ Na2SO3
特点:产率较高,操作工序多,不易连续化,耗用大量硫酸和 烧碱。目前主要用于用异丙苯氧化法不易制得的酚,如对苯二 酚、间苯二酚、α -萘酚、β -萘酚等制备。
11.4 酚的化学性质
+H2SO4(98%)
OH
OH SO3H
100℃ SO3H
90%
SO3H
由于磺酸基为强吸电子基,再引入时需用发烟硫酸。
苦味酸的制备
上述二苯磺酸如果再与浓硝酸作用,则磺酸基被置 换,生成苦味酸。这是制备苦味酸的基本方法,因 为苦味酸不能用苯酚直接硝化制得。
OH
OH
SO3H浓HNO3O2N NO2
第十一章 酚和醌
(2学时 本科使用)
一、掌握酚的结构与命名 二、重点掌握酚的制法 三、一般了解酚的物理性质 四、重点掌握酚的化学性质 五、了解常见的几种酚 六、了解醌的命名、制备与化学性质
11.1 酚的结构与命名
1、酚的结构 酚是羟基直接与芳环相连的化合物, 羟基氧为SP2杂化。
跃 迁
S P 2 杂 化
1、卤代 苯酚与溴水在室温下就很容易反应,并且难以停留在一取代,一
般立即反应生成2,4,6-三溴苯酚。
O H + B r2(H 2O )
O H B r B r +3H B r
B r
三溴苯酚为白色沉淀,反应很灵敏,很稀的苯酚溶液(10ppm) 就能与溴水生成沉淀。故,此反应可用作苯酚的定性鉴别和定量 测定。
H + O H+ C H 3C O O H
O H+(C H 3C O )2O
O C O C H 3
酚酯的应用
一个应用实例就是医药阿司匹林的合成。
C O O O H H +(C H 3C O )2O6 H 5 2 -S 8 O 0 ℃ 4 C O O O H C O C H 3+C H 3C O O H
C l
O N a
3 7 0 ℃ , 2 0 0 atm +N a O H
H
O H
C u 催 化 剂
但如果在卤素的邻、对位连有吸电子基,亲核取代反应就容易
进行了。Cl Na2CO3
ONa H
OH Cl
OCH3
CH3ONa
130℃
NO2
NO2
NO2 NO2
NO2
硝 基 处 于 邻 位 能 发 生 同 样 的 反 应
CH2=CHCH2Br
OCH2CH=CH2+NaBr
苯基烯丙基醚
酚醚的应用
生成的醚性质比较稳定,对碱、氧化剂、还原剂都不反应,但对
酸不稳定,可与强酸(如HI)作用,发生醚键断裂,分解出原
来的酚。
O C H 3 + H I
O N a + C H 3 I
因此,在有机合成上常利用生成酚醚的方法来保护酚羟基。如:
NO2
0.71
0
二、酚醚的生成
酚不能分子间脱水成醚,因为C-O键之间存在着P一π 超共轭, 使C-O键比较牢固,不易发生C-O键断裂。酚醚一般是由酚在碱
性溶液中与烃基化剂(硫酸二甲酯、卤代烃等)作用生成。
RI OR + NaI
OH
ONa
NaOH
(CH3)2SO4
OCH3 + NaBr
苯甲醚(茴香醚)
水 杨 酸
乙 酰 水 杨 酸 ( 阿 司 匹 林 )
OCH3 OH+ (CH3CO)2O
H2SO4 65-80℃
OCH3 OCOCH3+CH3COOH
OCH3 OCOCH3
HNO3
OCH3
OCH3
OCOCH3 (1)OH
OH
CH3COOH
(2)H
NO2
NO2
四、芳环上的亲电取代反应
羟基是强的邻、对位定位基,由于羟基与苯环的P-π 共轭,使苯 环上的电子云密度增加,亲电反应比苯更容易进行。
官能团优先顺序只与选母体和从谁开始编号有 关;
而取代基优先顺序是用于判断立体化合物空间 构型和处理取代基的先后顺序。
11.2 酚的制备
酚可直接从煤焦油中提炼出来,但产量有限,远满足不了需求。
1)异丙苯氧化法
CH2CHCH3 H2SO4
CH3 CH
O2(空 气 )过 氧 化 物
CH3
11.3 酚的物理性质 (自学)
11.4 酚的化学性质
H
Hale Waihona Puke OOH 在结构中已经介绍过,酚羟基与芳环存在着P-π 超共轭,共轭 的结果:(1)使氧上部分电子分散到芳环上,从而使O-H键上 的电子云密度有所降低,极性增加,使氢的活性增加,呈现出 一定的酸性。此外酚羟基失去质子后,氧上的负电荷也可通过 共轭而分散到芳环上,使氧负离子比较稳定。(2)共轭的结果 又使芳环上电子云密度增加,尤其是其邻、对位,所以苯酚比 较容易进行亲电取代反应,其活性比苯、甲苯、甲氧基苯都强。
C l
C l +3H C l
C l
但三氯苯酚不是白色沉淀,不能用于定性鉴别。
芳环氯代
如果在三氯化铁催化下,2,4,6-三氯苯酚还能进一 步氯化生成五氯苯酚。
O H C l C l+C l2 F eC l3
C l
O H
C l C l +H C l C l C lC l
五氯苯酚是一种常用的杀菌剂,常用在橡胶制品、 木材的杀菌和水中灭丁螺防止血吸虫病的药物。
SO3H
NO2
4、烷基化与酰基化
由于酚比芳烃活性高,往往得到多取代产物。所以,很多烷基化 反应没制备意义,但下面的反应有制备意义。
O H
O H
2(C H 3 )2 CC H 2(H 3 C )3 C C (C H 3 )简 称 : 二 六 四 抗 氧 剂 H 2 S O 4
O N a+ H 2 O
这个性质可用于酚与不溶于水的醇或卤代烃的区别, 因为后两者都不溶于NaOH溶液。
酚的酸性
但是,酚的酸性又比碳酸弱,所以它不溶于Na2CO3、 NaHCO3溶液;反过来,通CO2到酚钠水溶液中,碳酸 能把酚钠从水溶液中游离出来。
CO 2+H 2O O N a
H Cl
O H+ N aH CO 3 O H
基 态
激 发 态
S P 2 杂 化 轨 道2 P z
O H
酚的结构
OH
两个单电子轨道分别芳环碳和氢形成σ 键,带有一对电子的 杂化轨道不成键;此外,未杂化的P轨道上也带有一对未成键 的电子,当它与芳环的大π 键平行时,就发生P-π 超共轭。
由于氧原子的电负性大于碳,诱导效应又使芳环上电子云密 度降低。
一、酚的酸性
酚的酸性有多大,可从其Pka的大小看出来。
H 2 C O 3
O H H 2 O C H 3 C H 2 O H
P k a 6 .3 8 9 .9 8 1 5 .7
1 7
可以看出来,酚的酸性比醇和水强,所以酚能与强碱 NaOH、KOH反应而溶于其水溶液。
O H + N a O H
110- 120℃
CH3 COOH CH3
稀 H2SO4 75-85℃
OC CH O 3H稀 H2SO4 CH3 75-85℃
OH
O
+CH3CCH3
这是目前生产苯酚最主要和最好的方法。得到的丙酮也是重要 的化工原料。异丙苯可来源于石油化工产品丙烯和苯,因而经 济合理。
2)卤苯碱性水解法
由于卤代苯是乙烯型卤代烃,一般条件下不易进行亲核取代反 应,如果要取代,必须在高温高压下用Cu作催化剂才能实现。
OH
OH
CH3 (1)NaOH (2)CH3I
OCH3 O
CH3
OCH3 COOH HI
COOH
三、酚酯的生成
酚钠与溴苯反应较难,由于溴苯是乙烯型卤代烃,非常 不活泼,所以反应条件要苛刻,还要用铜作催化剂。
O N a + B r 2 1 C 0 u ℃O+ N a B r
三、酚酯的生成
醇易与有机酸形成酯,但由于酚羟基中氧的亲核性较弱, 酚不易与酸直接形成酯,一般要用酰基化试剂。
序,优先的放后边。
O H O CH 3
N O 2 SO 3H
CO O H
O H
4- 羟 基 - 3- 甲 氧 基 苯 甲 酸 8- 硝 基 - 5- 羟 基 - 2- 萘 磺 酸
官能团优先顺序和取代基优先顺序
这里应该注意,官能团优先顺序与前面学的次 序规则(即取代基优先顺序)是两个完全不同 的概念,切不可将两者混淆。
吸电子基对酚酸性的影响
如果为吸电子基,当它处于羟基的邻、对位时,能使
羟基所连C上电子云密度降低,使其酸性增加,同样
间位影响较小。 OH OH
OH
OH
NO2
NO2
NO2 PKa 7.15
7.23
8.40
9.98
如果邻、对位的硝基个数增加,则酸性更强。
OH
OH
OH
NO2O2N NO2 HCl
NO2 NO2 PKa7.15 4.00
+N aCl
利用这个性质,可用于酚的纯化。
供电子基对酚酸性的影响
芳环上的取代基对酚的酸性有一定的影响,如果为供电 子基,当它处于羟基的邻、对位时,能使羟基所连的C 上电子云密度增加,故使酚的酸性降低,但间位影响较
