第九章 醛酮
9第九章 醛酮

NO2 Y H2N Y C=NY OH NH2 NHPh NH NO2 NHCONH2
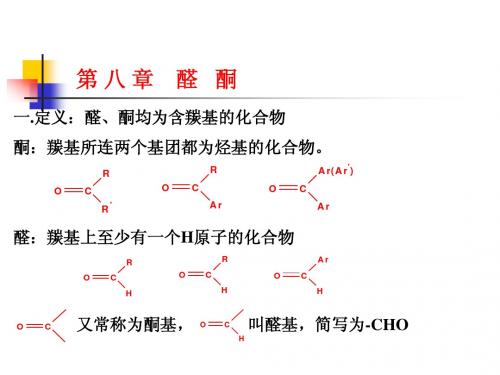
羟氨 肟
白色结晶
肼 腙
结晶
苯肼 苯腙
结晶
2,4-二硝基苯肼 二硝基苯肼 2,4-二硝基苯腙 二硝基苯腙
桔红色结晶
氨基脲 缩氨脲
结晶
21
酮和一级胺(NH2R)的加成物叫亚胺,又叫希夫碱 的加成物叫亚胺, 醛、酮和一级胺 的加成物叫亚胺 (Schiff‘s base)。一般芳香族亚胺比较稳定,而脂肪族 。一般芳香族亚胺比较稳定, 亚胺不稳定。 亚胺不稳定。
23
(4)与醇的加成 )
醛酮可以在干HCl气或无水强酸催化下与醇反应形成半缩醛酮 气或无水强酸催化下与醇反应形成半缩醛酮 醛酮可以在干
R C (R')H O + HOR"
H
+
R C (R') H
OH OR"
半缩醛(不稳定) 半缩醛(不稳定)
OR'' R C OH + H OR"
H
+
OR'' R C OR'' + H2O
由于羰基的偶极矩,增加了分子间的吸引力,因此, 由于羰基的偶极矩,增加了分子间的吸引力,因此, 醛酮的沸 比相应相对分子质量的烷烃高,但比醇低。 醛酮的沸点比相应相对分子质量的烷烃高,但比醇低。 醛酮的氧原子可以与水形成氢键, 醛酮的氧原子可以与水形成氢键,因此低级醛酮能与水 氢键 混溶。 混溶。 脂肪族醛酮相对密度小于1,芳香族醛酮相对密度大于 。 脂肪族醛酮相对密度小于 ,芳香族醛酮相对密度大于1。
合成上进一步应用: 合成上进一步应用:
1增加碳链(一个碳). 增加碳链(一个碳).
有机化学 第9章 醛、酮、醌

O CH3-C-CH3
酮式
OH CH3-C=CH2
烯醇式
碱和酸都可以促使烯醇化,原因如下: 碱促进烯醇化的理由:碱可以夺取α-H,而产生碳负离子
O B: + H-CH2-C-CH3
O 碳负离子 -CH2-C-CH3
3、氧化
醛和酮最主要的区别是对氧化剂的敏感性。因为醛中羰 基的碳上连有氢,所以醛很容易被氧化为相应的羧酸。而酮 则不易被氧化。因此用此性质可区别醛酮,常用弱的氧化剂 如托伦试剂(硝酸银的氨溶液),Ag+即可将醛氧化为羧酸, 本身被还原为金属银Ag。P:164页
OH-
RCHO + Ag+ 托伦试剂
Ag + RCOO- 银镜反应
由于生成复杂的氧化产物,酮氧化一般没有合成意义。 但环己酮氧化是工业上生产己二酸的方法。
O KCrO4 + H2SO4 HOOCCH2CH2CH2CH2COOH
环己酮
己二酸
4、烃基上的反应
(1)α-H的活性 与羰基相邻的碳(α-C)上的氢叫α-H,由于羰基中氧
原子的电负性较强,使得α-C上电子密度有所降低,从而 使α-H与分子中其它碳原子上的氢相比,酸性有所增强, 即具有一定的活性。
6、酮还有一种命名法:根据羰基所连的两个烃基而命名, 简单在前,复杂在后,最后加一酮字。如:
O C-CH3
苯乙酮 甲基苯基酮
O CH3-C-CH2CH3
丁酮 甲基乙基酮
物理性质
醛、酮分子间不能形成氢键,没有缔 合作用,但由于极性较强, 因此沸点比相 应(或分子量相近的)醇低,比相应的烷 烃和醚高。
有机化学第09章醛酮
羰基比醛羰基的活性小。当分子中有吸电子基时,羰基电子密度减小,反应加快。
羰基的活性顺序
H O C H
H
H
CH3
>
O
C R
>
O
C Ar
>
O
C CH3
O
O
O C CH3
O C
>
R
C
CH3
>
>
按与HCN反应活性的大小排列
(1) CH3CHO (2) ClCH2CHO (3) Cl3CCHO (4) CH3CH2COCH3
2 反应机理
R R
' -
C=O
CN
R R
'
C
C N H 2O O
-
R R
'
CN C OH
3 反应条件 反应必须在弱碱性条件下进行。 4 烃基结构 a.空间结构 :R,R’ 越大,空间阻碍不利于亲核试剂进攻。反应时,羰基C由 sp2→sp3 杂化,键角由120°→109.5° b.电子效应 :羰基上连烷基越多,电子密度越高,越不利于亲核加成,所以酮
+ C =O H
+ ] C- O H
Nu
-
Nu C OH
(2)醛、酮的反应活性
R H
C =O
>
R R'
Ar
C =O
>
C =O
R'
(1)与HCN的加成
醛,酮与HCN作用,得到α-羟基腈
OH R CH O
+
H ----C N
+
R C H OH CN
R
C R'
第九章 醛和酮

2 卤化-水解 4 加特曼-科赫反应
烯烃
炔烃
芳烃
醇
1 氧化 2 频哪醇重排
醛 酮
氧化
羧酸
取代
羧酸衍生物
还原
乙醛和丙酮的工业制备
一、羰基的亲核加成反应
1. 与氢氰酸加成(碱催化下)
R C (CH3)H O + H CN
OH-
R C (CH3)H
OH
H+
R C
OH COOH
CN
(CH3)H
α-羟基腈(氰醇)
RCH2OH
甲醛 伯醇
R
CH OH R1
R1
醛 仲醇
R1 RMgX +
H2O H
+
R
C OH 酮
叔醇
R2
该反应在有机合成中是增长碳链的方法。
5.与氨的衍生物加成—缩合反应
上式也可直接写成:
C O + H2 N Y C N Y + H2O
反应一般控制在弱酸性溶液(醋酸)中进行
Y: OH NH2 NH NH NO2 NO2
1、还原成醇
O H __ __ R C H( R ) OH R CH H( R )
__ __
(1)用金属氢化物还原 金属氢化物(NaBH4、 LiAlH4等)还原剂,具有选 择性,只还原羰基,不还原 C=C双键
CH3CH CHCHO
NaBH4
CH3CH CHCH2OH
(2)催化加氢 常用的催化剂是镍、钯、铂 产率高,选择性不强,不饱和基团同时被还原, 此法常用来制备饱和醇。
O O __ __ H R C__ H Ar C__ H
单酮 酮 混酮
酮分子中的羰基称为酮基。醛分子中的 称为醛基,醛基可以简写为—CHO。
有机化学第九章醛和酮
2-甲基丁醛
05
含羰基的最长碳链
06
使羰基的位次最小
07
复杂的醛酮用系统命名法
08
a
09
甲基丁醛
10
(2)脂肪酮按分子中碳原子数称某酮
1
2
3
4
5
4-甲基-2-戊酮
(3)不饱和醛酮要标出不饱和键位置
1
2
3
4
2-丁烯醛
1
3
4
3-戊烯-2-酮
2
5
2
1
苯乙醛
3-甲基环己酮
苯乙酮
环酮根据碳原子总数及所含羰基数 称为环某几酮
d+
d-
第三节 醛酮的化学性质
结构特点及反应类型
(一)亲核加成反应
-
+
亲核试剂Nu-
亲核加成反应
亲核试剂:
带负电荷或孤对电子
如:HCN,ROH 及氨的衍生物等
一些常见的亲核试剂
(一) 亲核加成反应
历程:
+
-
Nu-
慢
A+
快
动画模拟:亲核加成反应的机制
影响亲核加成反应的因素
(1)电子效应
▽酮羰基碳所带的正电性程度低 ▽连有两个烃基,空间位阻较大
烃基的斥电子效应和空间位阻增大
>
>
>
>
>
>
2
提高溶液的pH值
3
CNˉ浓度决定反应速度
1
如何提高此反应速度
4
羟基丙腈
1、加氢氰酸
加氢氰酸反应的用途
H2O H2O 增长碳链(多一个C)
醛、脂肪族甲基酮和8个碳以下的环酮
思考:芳香酮为什么不能反应?
chap09醛酮

第九章主要内容 主要内容: 醛酮与亲核试剂的反应 醛酮α-H的反应 醛酮的氧化还原反应 醛酮的制备醛和酮一、醛酮的类型、结构和命名羰基 carbonyl 醛和酮O R C H RO C R'醛(aldehyde)酮(Ketone) 醛、酮的分类O R C O R C R' Ar H Ar O C O C R Hβ αO C C C H(R)脂肪族醛 酮 脂肪族醛、酮芳香族醛 酮 芳香族醛、酮α, β-不饱和醛、酮 不饱和醛 酮 醛、酮的命名 普通命名法醛跟醇的命名类似,酮跟醚的命名类似 CH3CH2CHO 丙醛 CH2=CHCHO 丙烯醛O CH3CCH2CH3甲基乙基甲酮 (甲乙酮) 系统命名法O CH3CCH2CH2CHOO O CH3CCHCCH3 CH2CH=CH24 氧代戊醛 4-3 烯丙基-2,432 4 戊二酮OO CHO环己酮2-氧代环己基甲醛二、醛酮的化学性质羰基氧有弱碱性,可与酸结合 羰基氧有弱碱性, 可与酸结合 性质分析R1 R2α碳有吸电子基 α氢有弱酸性Oδ+δ−碳与氧相连 氢易被氧化C HαCH(R)羰基碳有亲电性 可与亲核试剂结合• α氢与碱的反应R2R1 α C HO C H(R)R1 C R2 CO H(R)B烯醇负离子1. 醛酮羰基上的亲核加成反应一些常见的与羰基加成的亲核试剂 一些常见的与羰基加成的 亲核试剂亲核试剂R相应试剂RMgBr RLi RMgBr,亲核能力负离子型R C HCR CCMgBr , R CCNa强LiAlH4, NaBH N BH4 NaCN NaHSO3NuCN HO3S H2NR, NR HNR2较强分子型NuHHOR H2O不强1.1 醛酮的亲核加成——醛酮与分子型亲核试剂的加成分析:分子型亲核试剂 分析: 分子型亲核试剂的特点及与醛酮的加成 的特点及与醛酮的加成 羰基亲电 性较弱O Cδ δ−H H Nu H H HOH OR NHR NR2可逆O C NuHδ+9有活泼 H 9亲核性不强NuH较易离去H+ O C OH C易加成OH C NuH-H HOH C Nu羰基亲 电性增 强HNu① 醛酮与 H2O 加成O C + H2O H+机理?OH C OH偕二醇例HO C O HH2OH2C(OH)2100%H3CC OHH2O CH3CH(OH)2 H2O~ 58%H3CCCH3(CH3)2C(OH)20%•给电子基 •位阻•不能分离 •含量与羰基亲电性有关¾ 一些稳定的偕二醇(水合羰基化合物)举例Cl Cl C Cl O C H + H2O Cl Cl C Cl OH C OH H吸 电 子 基R水合三氯乙醛O C O C H + H2O R O C OH C OH H¾ 水合醛的脱水OH W C OH H H2SO4 - H2O O W C H吸电子基 子基② 醛酮与 醛酮与醇 醇的加成 —— 缩醛(酮) 缩醛(酮)的形成 的形成O C ROH / 干HCl OH C OR ROH / 干HCl OR C OR +不断 除去H2O半缩醛(酮) 一般不稳定缩醛(酮) 碱性和中性中稳定OHO R OH例:环状半缩醛(酮)R O R'环状半缩醛酮R'•环状半缩醛(酮) 环状半缩醛(酮)较稳定 环状半缩醛(酮)较稳定,易生成 较稳定 易生成 较稳定,易生成 •环状半缩醛仍有醛的特性 缩醛(酮)的形成机理O C H OH C HOR OH C OR -H OH2 C OR亲电性增 亲电性增强OH C RO H HOR - H2O C OR H -HH半缩醛(酮)H OR C OR H OR C OR-H•提示:逆向为缩醛(酮)的水解机理 缩醛(酮) 请 请写一遍 遍例1:生成缩醛(酮)CHO 2 CH3OH HClOCH3 OCH3 + H2OOHOOHO O+H2OT OH TsOH环状缩醛(酮) 较易生成•交换酮原甲酸三甲酯•交换醇EtO C R R' OEt HO OH H+ O C R R' O蒸馏除去2 HOEt缩醛(酮)在合成上的应用(i) 用于保护羰基H3C O C (CH2)2 Br H3C O C (CH2)2 OH C CH3 CH3O H3C C (CH2)2 Br OH H+ OH O C H3C O O C H3C (CH2)2 MgBr O C H3C (CH2)2 (2) H2O OH C CH3 CH3 + OH OH O (1) H3C C CH3 O C R O (CH2)2 O (CH2)2 BrM Mg 无水乙醚OH C CH3 CH3H2O H+(ii) 用于保护邻二醇 例:合成多元醇单酯O R HO OH OH C Cl直接酯化难控制 • 酯化位置 • 酯化数量O HO O OH C R?O保护邻 CH3CCH3 二醇HCl OH2OH+去保护OO OOHRCClO OOCREt3N(碱)¾ 缩硫酮的制备及应用O R C R + HS SH R 干HCl S C R S + H2O缩硫酮应用 应用:• 保护羰基(缩硫酮较易制备,但较难除去, 保护羰基(缩硫酮较易制备,但较难除去,应用受到限制 应用受到限制)。
第九章 醛和酮
C
CH3 C O
CH3 + Br2
H+
CH3 C O
CH2Br + HBr C
α -溴丙酮
将次卤酸钠的碱性溶液与醛或酮作用生成卤仿的反 应称为卤仿反应。其通式表示如下:
C R C O CH3 + 3NaOX (X2 + NaOH)
NaOI NaOI
CH3 C O
ONa + CHX3 + 2H2O C
O C CH2CH3
Zn Hg , HCl
CH2CH2CH3 C
由于反应是在酸性介质中进行的,因此,羰基化合 物中含有对酸敏感的基团(如醇羟基、碳碳双键等)时, 不能用此法还原。
(4)沃尔夫—凯惜纳—黄鸣龙还原
先让醛或酮与氢氧化钠、肼(H2N―NH2)的水 溶液和高沸点的醇(例如二甘醇)一起加热,醛 和酮首先生成腙,再蒸出水和过量的腙,继续 升温回流,使腙分解放出氮气,此时羰基转变 成了亚甲基。例如:
H2 Pt
CH3CH2CH2OH CH3 CH OH CH3 C
H2 Pt
选择性不强
C CH3CH CHCHO
H2 Ni
CH3CH2CH2CH2OH
C
(2)金属氢化物还原
金属氢化物如氢化铝锂(LiAlH4)、硼氢化 钠(NaBH4)是还原羰基常用的试剂。
CH3CH CHCHO
NaBH4
异丙醇铝
CH3CH CHCH2OH
2 HCHO
浓NaOH
HCOONa + CH3OH
第九章 醛和酮
第一节 醛和酮的结构、分类及 命名
第二节 醛和酮的物理性质 第三节 醛和酮的化学性质 第四节 重要的醛和酮
第九章 醛、酮
9.3.3 羰基的氧化
弱氧化剂:Tollens试剂 [Ag(NH3)2+ OH–]; Fehling试剂 (A+B), A:硫酸铜溶液, B:酒石酸钾钠-碱溶液; 强氧化剂:KMnO4、H2CrO4、HNO3等。
脂肪醛
鉴别醛与酮:
Tollens试剂 芳醛 Fehling试剂
鉴别脂肪醛与芳醛:
Fehling试剂
乙醛
β-羟基丁醛
2-丁烯醛 (α,β-不饱和醛)
4-甲基-3-戊烯-2-酮
(5) 两分子结构不同的醛/酮缩合产物复杂,无利用价值;
乙醛自缩合产物 + 丙醛自缩合产物 无利用价值! + 丙醛羰基被进攻的缩合产物 + 乙醛羰基被进攻的缩合产物
(6) 一分子无α-H原子的醛/酮与另一分子有α-H原子 的醛 / 酮,采用合适的实验方法,进行交叉羟醛缩合, 则有较好的利用价值。
9.3.1.3 与HCN的加成 (含C亲核试剂)
试剂:HCN——一种弱亲核试剂; 促进剂:弱碱 (pH~8); 反应底物:醛、甲基酮、C6以下脂环酮; 反应特点:可逆反应;
产物反应机理:
* 亲核试剂 氧负离子 中间体 α-羟基腈
若R≠R’,则反应引入了一个手性中心。
苯甲醛
3-苯基丙烯醛 (肉桂醛)
9.3.5 歧化反应
在浓碱作用下,无 α-H 的醛 ( 如甲醛、苯甲醛等 ) 能发生自氧化-还原作用,生成一分子酸和一分子醇, 称为歧化反应,也叫康尼查罗 (Cannizzaro) 反应。
羧酸盐
伯醇
作业: 9.3 (b, m, n, o 除外),9.4,9.5,9.12
(1) 催化氢化法 ——反应无选择性
(2) 金属氢化物还原法 ——选择性还原反应
第九章 醛、酮
CH3CH2OH
Cu
CH3CHO
CH3CHO
2 C2H5OH 干 HCl
例 2:
例3:同一种醇可由不同的格利雅试剂和不同的羰基化 合物生成:
合成上的应用举例: 由不超过五个碳的醇合成
OH
2-庚醇
CH3CHCH2CH2CH2CH2CH3
CH3CH2OH
Cu
CH3CHO
PBr3 吡啶 Mg 干醚
CH3CH2CH2CH2CH2OH
CH3CH2CH2CH2CH2 MgBr
① CH3CHO + ② H3O
+ Cl C (CH2)16CH3 O
无水AlCl3
C (CH2)16CH3 O
C (CH2)16CH3 O
(CH2)17CH3
Wolff-Kishner -黄鸣龙法
1946年黄鸣龙改进了沃尔夫(Wolf.德1912) 凯西纳(Kisbner.俄罗斯1911) 的还原
方法:使用液态肼替代气态肼,使条件更为温和。
• 缩醛对碱和氧化剂都相当稳定。由于在酸催化下生成缩醛的 反应是可逆反应,故缩醛可以水解成原来的醛和醇:
• 在有机合成中常利用缩醛的生成和水解来保护醛基。
• 醛与二元醇反应生成环状缩醛:
• 酮也能与醇生成半缩酮或缩酮,但反应较为困难。 而酮和1,2-或1,3-二元醇比较容易生成环状缩酮:
• 常用1,2-或1,3-二元醇与生成环状缩醛以保护羰基。
• 羟基腈是一类很有用的有机合成中间体。氰基-CN能 水解成羧基,能还原成氨基。 例如: 有机玻璃 —聚-甲基丙烯酸甲酯的单体的合成:
丙酮氰醇 (78%)
-甲基丙烯酸甲酯(90%) • 第二步包含:水解、酯化和脱水等反应。
医学生物化学第九章 醛(aldehyde)和酮(ketone)
醛(aldehyde)和酮(ketone)
醛(aldehyde)和酮(ketone)是分子中含有羰基 (carbonyl group)官能团的有机物。羰基至少和一个 氢原子结合的为醛(-CHO又叫醛基), 羰基和两个烃 基结合的为酮。 羰 基
O O H C H R C H
O - C- Carbonyl group
快 (R')H
反应活性取决于:
亲核试剂性质;羰基碳正电性大小;空间位阻大小。 亲核反应活性:(p.154问题9-2) HCHO> CH3CHO> C6H5CHO> CH3COC6H5> C6H5COC6H5
9
1. 加HCN ( 醛、脂肪族甲基酮、八碳以内的环酮 )
O R C H + HCN
+
OH R C H CN
1-苯基-2-丁酮
1-phenylbutanone
2-甲基-1,3-环戊二酮
3-丁烯酮
2-methyl –1,3 –cyclopentanedione 3–butenone
3. 俗名
第二节
一、结构
醛、酮的结构及其物理性质
O
121.7o
C
121pm
H
116.6o
H
平面分子
羰基碳为sp2杂化,碳原子的3个sp2杂化轨道分别与氧及其 它2个原子形成 3个σ 键,这 3个σ 键处于一个平面,羰基碳余 下的1个未杂化的 p 轨道与氧的 2p 轨道彼此平行重叠,形成π 键。
O CH3CH2CH2CH2CH
稀酸
Ni CH3(CH2)3CH(OCH3)2
13
(2)水与醛、酮的羰基加成:
偕二醇,不稳定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OH R–CH=CH-CH2-C-H CN O
R–CH-CH-CH2-C-H Cl H
4 、 与有机金属化合物反应
R-MgX – + + – R-MgX H2 O C=O R–C–OMgX H+ RC≡CNa K
R–C–OH 伯醇 仲醇 叔醇
+ + H – C = O + R–MgX H2.5 3.5 H R-C-OMgX H HCl
O
O > CH3CH2–C–CH2CH3 >
提问: 比较 CH3 强弱。
CHO <
O2 N
CHO 的反应活性
CH3 O ClCH2CHO > CH3CHO > CH3–C—C–H CH3
比较反应活性强弱。
2 、加亚硫酸氢钠
SO3Na O H+(OH-) R–C–OH R–C–H + HSO3Na H (CH3) 过量饱 (CH3) 和溶液 醛亚硫酸钠 常用这个反应分离或精制 醛 O Ar–C–CH3 + NaHSO3
120
羰
sp
+ – C=O
甲醛的结构
羰基与烯烃结构的比较
极性共价 键
非极性共价 键
醛、酮分子中含有活泼的羰基,可以发生多 种化学反应。
氧化反应 还原反应
亲核加成
O
C C+
R (H)
H
α-C及α-H的反应
人民卫生电子音像出版社 9
一、羰基加成反应属于 亲核加成
加成 亲电加成 (C=C,C≡C) O 亲核加成 ( ) C δ- δ+ δ -
1 、加氢氰酸
O R–C—H + HCN (CH3) 经过大量的实验证明 加OH–,速度 加H+ 速度 HCN
OH H2O R—C—H HCl CN
OH R—C—COOH H (CH3)
甚至不反应
H+ + CN– 加碱 HCN + OH– H2O + CN– 酸使CN–浓度 反应速度 OH H2O CH3–C–H + OH– CN
邓健 制作 陆阳 审校
O- H — C
Nu
24
二、α–活泼氢反应
O R-CH-C •• H(R) H
1 、醇醛缩合(指生成物是带有羟基的醛)
O
H
O
OH -/H 2O
OH
H 3C — C — H + CH 2— C — H 5℃, 4~5h CH 3CHCH 2CHO β-羟基丁醛
O R-C-C-H •• H H +
OH
CHI3
+ RCOONa
CH3–C–R(H)
H
+ I2
NaOH
CHI3
I2 + 2NaOH OH
NaOI + NaI + H2O
CH3–C–R(H)
H
+
NaOI
O CH3–C–R(H)
+ NaI + H2O
NaOI CH I + RCOONa 3 (H) 请用简便化学方法把它们鉴别出来。 O O O O C-CH3 CH3–CH2–C–H CH3–C–CH2CH3 CH3–C–H
在内的最长碳链为主链)
O
CH3CH2C-CH(CH3)CH2CH3
4-甲基-3-己酮
芳香族醛、酮的命名时,将苯环作为取代基;
CH3 CH2CHO CH3 CH-CHCHO CH3 O C-CH3 苯乙酮
对-甲基苯乙醛
O CH3-C-CH2-C-CH3 2,4-戊二酮 O CH2-C-CH2CH3 1-苯基-2-丁酮 O
NO2 O
2.4-二硝基苯肼
O2N
O
H2–N–NH–C–NH2
R–C=N–NH–C–NH2 H(R)
亲核加成反应通式:
O R–C + H (CH3) + – A–B
OA
R–C B H (CH3)
+
O
C
H : CN H : SO3Na (-) :Nu H :H + OR (E +) H : OH H : NH-G XMg: R
HO
O O 2 C6H5–C–CH3 A1[OCH(CH3)2]3 C6H5–C=CH–C–C6H5 100℃ 二甲苯 CH
3
77% O H O C6H5–C–CH3 + H2C –C–C6H5 A1[OCH(CH3)2]3 100℃ 二甲苯
O OH H O C6H5–C – CH– C–C6H5 A1[OCH(CH3)2]3 C6H5–C=CH–C–C6H5 CH3 100℃ 二甲苯 CH3 77%
主讲:林连波
学习目的与要求 掌握醛酮结构、分类、命名及共同性质—亲核加成、 α-H反应、氧化与还原反应;醛酮的区别。
醛
O CH3–C–H
O R-C-H
O -C羰基 O R-C-R O H–C–H 甲醛
O CH3–C–CH3 酮
第一节醛、酮分类和命名
分类
O 脂肪族醛.酮 CH –C–H 3
O CH3–C–CH2CH3
加成 OH CH3CH2–C–CH3
CH3 难反应
1、烷基或芳环使C+
加成 加成 加成
影响 酮活泼性 2、烷基空间位阻大 3、芳环位阻更大
O C–H >
醛酮发生亲核加成反应活性强弱一般有以下顺序: HCHO > CH3CHO > O CH3–C–CH2CH2CH3 >
O C–CH3 O CH3–C–CH3 >
2-甲基-3-苯基丁醛
O CH 3CH 2CCH 2CHCH 2CH 3 HO-CHCH 3
O
3-甲基环己酮 CH3
5-乙基-6-羟基- 3-庚酮
CH3-CH=CHCHO
O CH3-CH2CH=CH-C-CH3
3-己烯-2-酮
2-丁烯醛
CH3O
CHO 茴香醛
CH=CHCHO
肉桂醛
提问:
CH3 O CH3-CH-C-CH2CH3 5 4 3
CH3 → CH=CH2 + H X
CH3—CH=CH2 + H+
+ • •- • C • O• • • • 正电 负电 中心 中心
δ+
CH3CH—CH3
X
CH3CHCH3
+
+
CH3CH2CH2
R-C H (R´) O
第一 + Nu– 步慢
Nu – C-O
A+
负氧中间体
R Nu C-O A H (R´)
O R–C–CH3 、八个C以下的环酮。
3 、加醇
O R–C–H + R´ OH OR´ 干燥HCl
OH 半缩醛羟基
R–C–H + OR´ 半缩醛不稳定 HO R´OH
干燥HCl
R–C–H + H2O
OR´ 缩醛稳定 OR´
CH2OH O OH CHOH
R–C–H
OR´ OR´ H+ H 2O
氧化剂 + 还原剂
CH3-CH-CH-CHO OH OH
+ 2CH3CH2OH
O 干燥HCl 难反应 R–C–R + ROH O R–C–R + R R HO–CH2 干燥HCl HO–CH2 O–CH2 O–CH2 R R OH OHCH 2 O–CH2 干HCl -H2O
C
C
+ H2 O
SO3H C6H5 CH2
O O NaOH –C–H + CH3-C-H
–CH=CHCHO +H2O
2 、卤代反应
H O O NaOH R–C–C + HCl R–CH2–C H + Cl2 H Cl Cl O R–C–C H O O CC–CI3 + NaOH 三元碘代醛(酮)
+
MgX2
试设计用 Grignaro (试剂)制取 2-苯基-2-丁醇
CH3CH2MgX + O C-CH3 无水乙醚 OMgX C CH3
CH3CH2
H+ H2O
CH3CH2
OH C CH3
MgX
O + CH3CH2-C-CH3 OH C CH3
无水乙醚
H+ H2O
CH3CH2
5 、加氨衍生物 ..
C=O + H-NHG
OH C–N–G H -H2O
-H2O
C=N-G
R–C=O + H2–NG H H2–NR (R) H2 – NOH
C=NG + H2O
R–C=N–R H(R´) R–C=N–OH H(R) R–C=N–NH2 H(R) R–C=N–NH– H(R) O N
2
H2 – N – NH2 H2–N–NH– NO2
Tollens Ag(银镜) + RCOOH RCHO + Fehling Cu2O(红色) + RCOOH
ARCHO + 芳香族醛
Tollens Ag(银镜) + ARCOOH Fehling
提问: O 如下氧化物:CH3CHO、CH3–C–CH3、
CHO
、
O CH2OH CH3CH2C-CH2CH3 、 CH2OH 请用简便化学方法把 它们鉴别出来。
OH–
O R-C-C-H
H
+ H2O
– H O 稀NaOH + O R-CH2-C-H + R-C-C-H -
