【武大】混合溶液中磷酸二氢钠与磷酸氢二钠浓度的测定
设计实验:磷酸二氢钠与磷酸氢二钠混合液中各组分含量的测定模板

设计实验:磷酸二氢钠与磷酸氢二钠混合液中各组分含量的测定模板精心整理设计实验:磷酸二氢钠(NaH2PO4)与磷酸氢二钠(Na2HPO4)混合液中各组分含量的测定实验者:XXX[1]指导老师:XXX[2]([1]武汉大学化学与分子科学学院20XX级XXX班学号:XXXX[2]武汉大学化学与分子科学学院分析实验指导老师)摘要:以酚酞为指示剂,氢氧化钠(NaOH)滴定磷酸二氢钠(NaH2PO4)至磷酸氢二钠(Na2HPO4);以溴酚蓝或溴甲酚绿为指示剂,盐酸(HCl)滴定磷酸氢二钠(Na2HPO4)至磷酸二氢钠(NaH2PO4),分别确定其含量。
关键词:酸碱滴定混合液含量测定一、实验目的实验测定混合液中NaH2PO4与Na2HPO4的含量。
二、实验基本原理磷酸(H3PO4)的解离常数Ka1=7.6*10-3Ka2=6.3*10-8Ka3=4.4*10-13NaH2PO4中[H+]=(Ka1*Ka2)1/2=2.19*10-5,pH=4.66Na2HPO4中[H+]=(Ka2*Ka3)1/2=1.66*10-10,PH=9.78PH变色范围,酚酞8.2~10.0,溴酚蓝3.0~4.6,溴甲酚绿3.0~5.2所以可以以酚酞为指示剂,氢氧化钠(NaOH)滴定磷酸二氢钠(NaH2PO4)至磷酸氢二钠(Na2HPO4);以溴酚蓝为指示剂,盐酸(HCl)滴定磷酸氢二钠(Na2HPO4)至磷酸二氢钠(NaH2PO4)。
三.主要实验试剂和仪器1.浓HCl溶液2.固体NaOH3.甲基橙溶液(1g*L-1)4.酚酞溶液(2g*L-1,乙醇溶液)5.两用滴定管(50ml)6.锥形瓶(250ml)7.移液管(25ml)8.百里酚酞9.溴酚蓝10.烧杯(100ml)四、实验操作步骤1.NaOH,HCl溶液的配置称取约2gNaOH于洁净的烧杯中,加水溶解,转移至塑料瓶中,稀释至约500mL,待标定。
另取约5mLHCl于洁净的烧杯中,加水溶解,转移至玻璃瓶中,稀释至约500mL,待标定。
分析化学设计实验:Na2HPO4-NaH2PO4混合溶液中各组分含量的测定

Na2HPO4-NaH2PO4混合溶液中各组分含量的测定(武汉大学化学与分子科学学院化基二班湖北武汉430072)摘要:分别用邻苯二甲酸氢钾标定过的氢氧化钠溶液和无水碳酸钠标定过的盐酸来滴定混合溶液,并分别以百里酚酞和甲基红为指示剂,对Na2HPO4和NaH2PO4混合溶液中各组分含量进行测定。
关键词:酸碱滴定0引言运用所学知识及有关参考资料进行实验设计,培养分析问题和解决问题的能力,通过实验进一步掌握酸碱滴定的原理及基本操作。
在本实验中,由于Na2HPO4-NaH2PO4混合溶液的Ka2=6.3×10-8,Ka3=4.4×10-13,Ka2/Ka3>10,故可分别滴定。
用标定过的NaOH溶液准确滴定H2PO4-,以百里酚酞为指示剂,滴定终点时溶液由无色变成微蓝色。
因为Ka3很小,不能直接连续滴定,所以另取溶液,用盐酸滴定HPO42-,以甲基红为指示剂,终点时溶液由橙色变为红色。
1实验部分1.10.1mol/L NaOH溶液的配制及标定称取约2g固体氢氧化钠于小烧杯中,加蒸馏水溶解后,置于500ml 的试剂瓶中并稀释到刻度,摇匀/ 在分析天平上准确称取0.4-0.6g 邻苯二甲酸氢钾试样3份,记录称取的质量,将其分别置于250ml锥形瓶中,加入40-50ml蒸馏水,溶解后加入2-3滴酚酞指示剂。
用配制的浓度约为0.10mol/L的NaOH溶液滴定溶液至微红色且保持半分钟不褪色,平行测定三次并记录数据。
1.20.1mol/L HCl 溶液的配制及标定用量筒量取4.5ml浓盐酸,倒入500ml试剂瓶中,加蒸馏水稀释到刻度,摇匀。
在分析天平上准确称取0.15-0.20g无水碳酸钠试样3份, 记录称取质量,将其分别置于250ml锥形瓶中,加入20-30ml蒸馏水,溶解后加入1-2滴甲基橙指示剂。
用配制的浓度约为0.10mol/L的盐酸滴定溶液至其刚好由黄色变为橙色且保持半分钟不褪色,平行测定三次并记录数据。
磷酸氢二钠检验
编号:ZL-SOP-QC-014-00目的:建立磷酸氢二钠检验操作规程范围:本规程适用于磷酸氢二钠的检验责任人:质检科原辅料检定人员内容:1.器具:分析天平、PH计、量筒、烧杯、玻璃棒、刻度吸管、纳氏比色管、移液管、电热恒温干燥箱、电位滴定仪、电炉、4号垂熔坩埚、水浴箱、砷盐检查反应装置2.试剂:15%碳酸钾溶液、焦锑酸钾试液、氯化铵镁试液、硼砂标准缓冲液、磷酸盐标准缓冲液、硝酸、稀硝酸、标准氯化钠溶液、硝酸银试液、盐酸、标准硫酸钾溶液、25%氯化钡溶液、稀硫酸、高锰酸钾滴定液(0.02mol/L)、标准铁溶液、盐酸溶液、10%磺基水杨酸溶液、氨试液、醋酸盐缓冲液(PH3.5)、标准铅溶液、硫代乙酰铵试液、标准砷溶液、盐酸、碘化钾试液、酸性氯化亚锡试液、锌粒、醋酸铅棉花、溴化汞试纸、硫酸滴定液(0.5mol/L)Na2HPPO4·12H2O 358.14[10039-32-4] 本品按干燥品计算,含Na2HPPO4不得少于99.0%。
3.性状:本品为无色或白色结晶或块状物,无臭;常温置空气中易风化。
本品在水中易溶,在乙醇中几乎不溶。
4.鉴别(1)钠盐:取供试品约100mg,置10ml试管中,加水2ml溶解,加15%碳酸钾溶液2ml,加热至沸;应不得有沉淀生成;加焦锑酸钾试液4ml,加热沸腾;置冰水中冷却,必要时,用玻棒摩擦试管内壁,应有致密的沉淀生成。
(2)磷酸盐:取供试品溶液,加氯化铵镁试液,即生成白色结晶性沉淀。
4.检查4.1碱度4.1.1操作步骤4.1.1.1称取样品1.0g,置于烧杯中。
4.1.1.2量取20ml水,倒入烧杯中,用玻璃棒搅拌,使完全溶解。
4.1.1.3以硼砂标准缓冲液校正仪器,以磷酸盐标准缓冲液核对,按《PH 计使用SOP》测定样品的pH值,读取并记录测定结果。
4.1.2.结果判定pH值为9.1-9.4 ,判为符合规定。
4.2溶液的澄清度与颜色4.2.1操作步骤4.2.1.1称取样品1.0g,置于烧杯中。
设计实验磷酸二氢钠与磷酸氢二钠混合液中各组分含量的测定

设计实验磷酸二氢钠与磷酸氢二钠混合液中各组分含量的测定SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#设计实验:磷酸二氢钠(NaH2PO4)与磷酸氢二钠(Na2HPO4)混合液中各组分含量的测定实验者:XXX[1]指导老师:XXX[2]([1]武汉大学化学与分子科学学院20XX级XXX班学号:XXXX[2]武汉大学化学与分子科学学院分析实验指导老师)摘要:以酚酞为指示剂,氢氧化钠(NaOH)滴定磷酸二氢钠(NaH2PO4)至磷酸氢二钠(Na2HPO4);以溴酚蓝或溴甲酚绿为指示剂,盐酸(HCl)滴定磷酸氢二钠(Na2HPO4)至磷酸二氢钠(NaH2PO4),分别确定其含量。
关键词:酸碱滴定混合液含量测定一、实验目的实验测定混合液中NaH2PO4与Na2HPO4的含量。
二、实验基本原理磷酸(H3PO4)的解离常数Ka1=*10-3 Ka2=*10-8 Ka3=*10-13NaH2PO4中[H+]=(Ka1*Ka2)1/2=*10-5,pH=Na2HPO4中[H+]=(Ka2*Ka3)1/2=*10-10,PH=PH变色范围,酚酞~,溴酚蓝~,溴甲酚绿~所以可以以酚酞为指示剂,氢氧化钠(NaOH)滴定磷酸二氢钠(NaH2PO4)至磷酸氢二钠(Na2HPO4);以溴酚蓝为指示剂,盐酸(HCl)滴定磷酸氢二钠(Na2HPO4)至磷酸二氢钠(NaH2PO4)。
三.主要实验试剂和仪器1.浓HCl溶液2.固体NaOH3.甲基橙溶液(1g*L-1)4.酚酞溶液(2g*L-1,乙醇溶液)5.两用滴定管(50ml)6.锥形瓶(250ml)7.移液管(25ml)8.百里酚酞9.溴酚蓝10.烧杯(100ml)四、实验操作步骤1.NaOH,HCl溶液的配置称取约2gNaOH于洁净的烧杯中,加水溶解,转移至塑料瓶中,稀释至约500mL,待标定。
另取约5mLHCl于洁净的烧杯中,加水溶解,转移至玻璃瓶中,稀释至约500mL,待标定。
磷酸一氢钠 磷酸二氢钠
磷酸一氢钠(Na2HPO4)与磷酸二氢钠(NaH2PO4)混合溶液中各组分浓度的测定武汉大学化学与分子科学学院 2014级化学基地五班张馨蕊 20摘要:现有一瓶未知浓度的磷酸一氢钠和磷酸二氢钠的混合溶液,为了得知混合溶液中各组分的浓度,对溶液进行分步滴定。
本文展现了本次实验的目的、原理、过程、数据以及对数据的分析。
关键词:混合溶液滴定磷酸一氢钠磷酸二氢钠正文:1、实验原理H3PO4是三元酸,其PKa1=, PKa2=, PKa3=. 磷酸一氢钠和磷酸二氢钠都可以视为两性物质,由两性物质的pH计算公式,pH=(PKa1+PKa2)可知,磷酸一氢钠(Na2HPO4)溶液的pH值等于(PKa2+PKa3)/2=(+)/2=。
同理可知,磷酸二氢钠(NaH2PO4)溶液的pH值等于(PKa1+PKa2)/2=(+)/2= 当确保Et(终点误差)≤%,化学计量点与滴定终点差值为±时,弱酸能够被准确滴定的条件是PKaCa≤8。
一般来说当PKa ≤7时,弱酸能够被准确滴定。
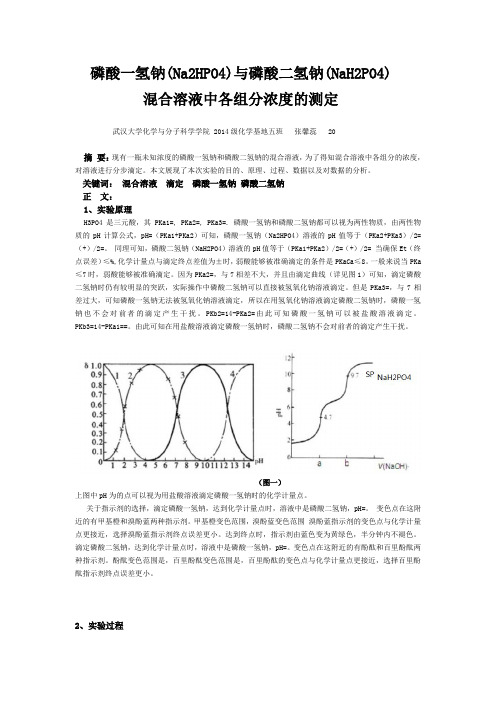
因为PKa2=,与7相差不大,并且由滴定曲线(详见图1)可知,滴定磷酸二氢钠时仍有较明显的突跃,实际操作中磷酸二氢钠可以直接被氢氧化钠溶液滴定。
但是PKa3=,与7相差过大,可知磷酸一氢钠无法被氢氧化钠溶液滴定,所以在用氢氧化钠溶液滴定磷酸二氢钠时,磷酸一氢钠也不会对前者的滴定产生干扰。
PKb2=14-PKa2=由此可知磷酸一氢钠可以被盐酸溶液滴定。
PKb3=14-PKa1==。
由此可知在用盐酸溶液滴定磷酸一氢钠时,磷酸二氢钠不会对前者的滴定产生干扰。
(图一)上图中pH为的点可以视为用盐酸溶液滴定磷酸一氢钠时的化学计量点。
关于指示剂的选择,滴定磷酸一氢钠,达到化学计量点时,溶液中是磷酸二氢钠,pH=。
变色点在这附近的有甲基橙和溴酚蓝两种指示剂。
甲基橙变色范围,溴酚蓝变色范围溴酚蓝指示剂的变色点与化学计量点更接近,选择溴酚蓝指示剂终点误差更小。
测定磷酸二氢钠和磷酸氢二钠混合液各组分的浓度

测定磷酸二氢钠和磷酸氢二钠混合液各组分的浓度姓名:曾剑仑学号:2014301040176学院:化学与分子科学学院专业:化学基地班班级:六班日期:2015/5/10摘要:本实验意在通过多次滴定掌握酸碱滴定原理和方法,了解准确分别滴定的条件。
本实验中通过先用邻苯二甲酸氢钾来滴定标定配置的氢氧化钠溶液,酚酞用做指示剂,再用已经标定的氢氧化钠溶液来滴定磷酸二氢根。
再用碳酸钠标准溶液标定配制的盐酸溶液,用甲基橙做指示剂。
最后用标定好的氢氧化钠溶液滴定磷酸二氢根,百里酚蓝做指示剂。
用标定好的盐酸滴定磷酸一氢根,甲基红做指示剂。
两者分别滴定。
引言样品来源及其分布:作为食品大国,我国的磷酸盐用量位于世界前列。
我国的磷酸盐储量丰富,沿海主要分布在东海等海滨区域,内陆主要分布在云贵高原及新疆一带。
磷酸盐自1910年首次在德国勇于食品加工以来,已成为世界各国应用广泛的食品添加剂,对于食品品质的提高和改善起着重要作用。
我国添加剂使用卫生标准GB2760-1996及其增幅本,对部分食品中允许使用的磷酸盐的种类和限量做出了明确规定,允许使用的主要为十种磷酸盐,作为磷酸盐的代表,磷酸二氢钠和磷酸氢二钠是常用的食品添加剂。
我们从实验室制取一磷酸二氢钠与磷酸氢二钠的混合液,模拟食品添加剂,对各组分的浓度进行测定。
测定的意义:帮助我们掌握酸碱滴定原理和方法,了解准确分别滴定的条件;掌握化学分析法的基本操作技能和初步运用的能力;掌握滴定分析法的基本原理,方法和数据处理;掌握分析化学实验的基本知识和基本操作技能,提高观察,分析和解决问题的能力。
结果:混合磷酸盐样品中,磷酸一氢根的浓度的浓度为0.0818摩尔每升,磷酸二氢根的浓度为0.0912摩尔每升。
1 实验部分1.1仪器与试剂仪器:酸式滴定管、碱式滴定管、分析天平、称量瓶、烧杯等。
试剂:混合液、氢氧化钠固体、浓盐酸。
邻苯二甲酸氢钾、碳酸钠。
1.2实验过程(1)0.1mol/LNaOH溶液的配制及标定在电子天平上称取2gNaOH于小烧杯中,溶解后,置于500mL的试剂瓶中稀释到刻度均匀。
各种PH值的磷酸盐缓冲液配制

各种PH值的磷酸盐缓冲液配制磷酸盐缓冲液取磷酸二氢钠38.0g,与磷酸氢二钠5.04g,加水使成1000ml,即得。
磷酸盐缓冲液(pH2.0)甲液:取磷酸16.6ml,加水至1000ml,摇匀。
乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。
取上述甲液72.5ml与乙液27.5ml混合,摇匀,即得。
磷酸盐缓冲液(pH2.5)取磷酸二氢钾100g,加水800ml,用盐酸调节pH至2.5,用水稀释至1000ml。
磷酸盐缓冲液(pH5.0)取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。
磷酸盐缓冲液(pH5.8)取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000ml,即得。
磷酸盐缓冲液(pH6.5)取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml,用水稀释至100ml,即得。
磷酸盐缓冲液(pH6.6)取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g,加水使溶解成400ml,即得。
磷酸盐缓冲液(含胰酶)(pH6.8)取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。
磷酸盐缓冲液(pH6.8)取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
磷酸盐缓冲液(pH7.0)取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液29.1ml,用水稀释至100ml,即得。
磷酸盐缓冲液(pH7.2)取0.2mol/L磷酸二氢钾溶液50ml与0.2mol/L氢氧化钠溶液35ml,加新沸过的冷水稀释至200ml,摇匀,即得。
磷酸盐缓冲液(pH7.3)取磷酸氢二钠1.9734g与磷酸二氢钾0.2245g,加水使溶解成1000ml,调节pH值至7.3,即得。
设计实验磷酸二氢钠与磷酸氢二钠混合液中各组分含量的测定

设计实验磷酸二氢钠与磷酸氢二钠混合液中各组分含量的测定Revised by BLUE on the afternoon of December 12,2020.设计实验:磷酸二氢钠(NaH2PO4)与磷酸氢二钠(Na2HPO4)混合液中各组分含量的测定实验者:XXX[1]指导老师:XXX[2]([1]武汉大学化学与分子科学学院20XX级XXX班学号:XXXX[2]武汉大学化学与分子科学学院分析实验指导老师)摘要:以酚酞为指示剂,氢氧化钠(NaOH)滴定磷酸二氢钠(NaH2PO4)至磷酸氢二钠(Na2HPO4);以溴酚蓝或溴甲酚绿为指示剂,盐酸(HCl)滴定磷酸氢二钠(Na2HPO4)至磷酸二氢钠(NaH2PO4),分别确定其含量。
关键词:酸碱滴定混合液含量测定一、实验目的实验测定混合液中NaH2PO4与Na2HPO4的含量。
二、实验基本原理磷酸(H3PO4)的解离常数Ka1=*10-3 Ka2=*10-8 Ka3=*10-13NaH2PO4中[H+]=(Ka1*Ka2)1/2=*10-5,pH=Na2HPO4中[H+]=(Ka2*Ka3)1/2=*10-10,PH=PH变色范围,酚酞~,溴酚蓝~,溴甲酚绿~所以可以以酚酞为指示剂,氢氧化钠(NaOH)滴定磷酸二氢钠(NaH2PO4)至磷酸氢二钠(Na2HPO4);以溴酚蓝为指示剂,盐酸(HCl)滴定磷酸氢二钠(Na2HPO4)至磷酸二氢钠(NaH2PO4)。
三.主要实验试剂和仪器1.浓HCl溶液2.固体NaOH3.甲基橙溶液(1g*L-1)4.酚酞溶液(2g*L-1,乙醇溶液)5.两用滴定管(50ml)6.锥形瓶(250ml)7.移液管(25ml)8.百里酚酞9.溴酚蓝10.烧杯(100ml)四、实验操作步骤1.NaOH,HCl溶液的配置称取约2gNaOH于洁净的烧杯中,加水溶解,转移至塑料瓶中,稀释至约500mL,待标定。
另取约5mLHCl于洁净的烧杯中,加水溶解,转移至玻璃瓶中,稀释至约500mL,待标定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
混合溶液中磷酸二氢钠与磷酸氢二钠
浓度的测定
孙阳勇
武汉大学化学与分子科学学院
摘要:酸碱滴定法是容量滴定分析法中最重要的方法之一,也是其它三种滴定分析的基础。
酸碱滴定法是以质子传递反应为基础的滴定分析方法。
这种方法的特征是:滴定过程中溶液的酸度呈现规律性变化。
关键词:磷酸二氢钠磷酸氢二钠差减法指示剂
引言:酸碱指示剂可以指示溶液中H+浓度的变化,是一种有机弱酸或有机弱碱,其酸性和碱性具有不同的颜色。
指示剂酸HIn在溶液中的离解常数Ka=[H+][In-]/[HIn],即溶液的颜色决定于[In-]/[HIn],而[In-]/[HIn]又决定于[H+]。
以甲基橙(Ka=10-3.4)为例,溶液的pH<3.1时,呈酸性,具红色;pH>4.4时,呈碱性,具黄色;而在pH=3.1~4.4,则出现红黄的混合色橙色,称之为指示剂的变色范围。
不同的酸碱指示剂有不同的变色范围。
试剂及仪器:NaOH固体,浓HCl溶液,甲基橙溶液(1g/L),酚酞溶液(2g/L,乙醇溶液),邻苯二甲酸氢钾基准试剂,无水碳酸钠固体,溴甲酚绿溶液,待测混合液,蒸馏水量筒,烧杯,称量瓶,烧杯,锥形瓶,50mL酸式滴定管,50mL碱式滴定管,25mL移液管,分析天平,洗耳球,玻璃棒,试剂瓶
,
实验原理:上图表示H3PO4
的分布分数图,在pH 为2.16-7.21间以磷酸二氢根为主,在pH 为7.21-12.32间,以磷酸一氢根为主。
对于浓度约为0.1mol/L 的磷酸氢二钠和磷酸二氢钠的混合液,起始,有pH=pKa+lg[HPO 42-]/[H 2PO 4-
]=7.2,用氢氧化钠将磷酸二氢钠滴定成磷酸氢二钠,当完全变成磷酸氢二钠时,此时混合溶液中c (Na 2HPO 4)=0.1mol/L,那么在此时,溶液中氢离子浓度
,此时的pH=9.74,选用酚酞作指示剂。
之后用盐酸将混合液中磷酸氢二钠滴定成磷酸二氢钠,此时混合液中c (NaH 2PO 4)=0.1 mol/L ,那么溶液中氢离子浓度:[H+]= ,此时的pH=4.68,选用溴甲酚绿作指示剂,其中溴甲酚绿在pH=3.8时显黄色,在pH=5.4是呈蓝绿色,在pH=4.5时开始有颜色明显变化。
实验操作过程:
(1)配制NaOH 溶液:称取约2.0g 固体NaOH 于烧杯中,加入100mL 水使之全部溶解,并转入试剂瓶中,配制成500mL 溶液,摇匀。
(2)配制HCl 溶液:用量筒量取约4.2mL 浓盐酸于试剂瓶中,加水约至500mL ,摇匀。
(3)标定NaOH 溶液:准确称取基准邻苯二甲酸氢钾0.4~0.5g 于锥形瓶中,溶于50mL 水后,加2~3滴酚酞指示剂。
用NaOH 溶液滴定至微红色,半分钟不褪色即为终点。
平行测定2~3次,计算NaOH 溶液的准确浓度。
编号 1 2 3 m(KHC 8H 4O 4)/g 0.4899 0.6640 0.4711 V (NaOH )/ mL 26.45 35.81 25.68 c (NaOH )/ mol/L 0.09079
0.09089 0.08993
c (NaOH )平均值
0.09054
(4)标定HCl 溶液:准确称取0.1~0.16基准无水碳酸钠 ,溶于30mL 蒸馏水中,加甲基橙1滴,用HCl 溶液滴定至溶液由黄色变为橙色,即为终点。
计算HCl 溶液的准确浓度。
编号 1 2 3 m(Na 2CO 3)/g 0.1069 0.1273 0.1293 V(HCl)/mL 21.00 25.05 25.50 C(HCl)/ mol/L 0.09605
0.09588 0.09567
C(HCl) 平均值
0.09587
(5)将磷酸二氢钠滴定成磷酸氢二钠:准确移取25.00mL 混合溶液3份于3个锥形瓶中,各
c
K )
K (cK K ][H 2
32a w a a ++=
+1
21a w a a K c )
K (cK K ++
滴加1~2滴酚酞指示剂,用NaOH 标准溶液滴定至溶液由无色变为微红且半分钟不褪色,即为滴定终点。
据此计算混合溶液中NaH 2PO 4的浓度。
编号 1 2 3 V (NaOH )/ mL 26.41 26.23 26.25 c (NaH 2PO 4)/ mol/L 0.1014
0.1007 0.1008
c (NaH 2PO 4)平均值
0.1009
(6)将磷酸氢二钠滴定成磷酸二氢钠:
准确移取25.00mL 混合液3份于3个250mL 锥形瓶中,加入40mL 水稀释。
滴加1~2滴溴甲酚绿指示剂,用上述盐酸溶液滴定使之从蓝色突变为黄色且半分钟不变色,即达到滴定终点,记下滴定消耗体积为 V (mL )。
可算出NaH 2PO 4的准确浓度。
编号 1 2
3 V(HCl)/mL 26.39 26.35 26.45 c (Na 2HPO 4)/ mol/L 0.1013
0.1012 0.1016
c (Na 2HPO 4)平均值
0.1014
实验结论:实验测得磷酸氢二钠的浓度约为0.1014mol/L ,磷酸二氢钠的浓度约为
0.1009mol/L
实验讨论:
(1)用氢氧化钠将磷酸二氢钠滴定成磷酸氢二钠,滴定终点时pHep=9.1,化学计量点时有pHsp=9.74,那么有
由电荷守恒,有[H +]+[Na +]=[OH -]+[ H 2PO 4-]+2[HPO 42-]+3[PO 43-
],那么有,终点时:[Na +]-[ H 2PO 4-]= [OH -]+2[HPO 42-]+ 3[PO 43-]- [H -
],同时由分布分数,有
因此可得终点误差约为-1%,,同理用百里酚酞作指示剂,则可算得终点误差只有-0.3%,但
[][][]
a3
a2a1a2a1
2a1
3
a3
a2a1PO K K K H K K
H K H K K K δ34+++=
+++-[]
[][][]a3
a2a1
a2
a1
2a1
3
a2a1HPO K K K
H K K
H K H H K K δ24+++=
+
+++
-
实验时考虑灵敏度,综合考虑应用酚酞。
实验中可将酚酞滴入0.1 mol/L的磷酸氢二钠中观察颜色,在实验时以此为基准。
(2)用盐酸将磷酸氢二钠滴定成磷酸二氢钠,滴定终点pHep=4.69,化学计量点时有pHsp=4.90,那么有终点误差约为-0.29%。
(3)用盐酸将磷酸氢二钠滴定成磷酸二氢钠,由于1mol Na2HPO4~1molHCl,计算磷酸氢
二钠的浓度时,有,同时标定盐酸时,有
,称取碳酸钠时用分析天平称取,天平读数标准偏差为S1=0.10mg,由于计算碳酸钠质量时用了一次减法,故S m2=S12+S12,将盐酸装入酸式滴定管中滴碳酸钠,那么滴定管体积V的标准偏差为S V2=S22+S22,其中S2=0.01mL,量取混合液时体积标准偏差为Sv=0.02mL,则根据上述两式,有
根据随机误差的传递公式,有,根据上述数据,取m=0.1069g,V2=26.39mL,V=25.00mL,V1=21.00mL,那么可以算的磷酸氢二钠的浓度范围为(0.1014-9.85*10-5)mol/L~(0.1014+9.85*10-5)mol/L
参考文献:
[1]武汉大学主编《分析化学》(第五版上册)46~47,147~151。
