脂蛋白磷脂酶A2(Lp-PLA2)测定试剂
脂蛋白相关磷脂酶A2(Lp—PLA2)测定试剂盒(连续监测法) 产品技术要求性能指标sky
脂蛋白相关磷脂酶A2(Lp-PLA2)测定试剂盒(连续监测法)2.性能指标2.1试剂性能指标2.1.1外观2.1.1.1试剂盒应包装完整,各组分齐全,无内容物溢出。
2.1.1.2说明书、标签内容应清晰、完整。
2.1.1.3试剂各组分外观应符合表1规定。
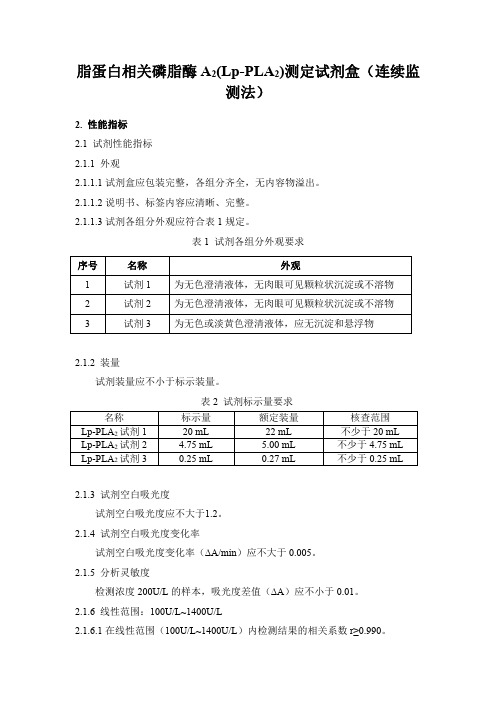
表1试剂各组分外观要求序号名称外观1试剂1为无色澄清液体,无肉眼可见颗粒状沉淀或不溶物2试剂2为无色澄清液体,无肉眼可见颗粒状沉淀或不溶物3试剂3为无色或淡黄色澄清液体,应无沉淀和悬浮物2.1.2装量试剂装量应不小于标示装量。
表2试剂标示量要求名称标示量额定装量核查范围Lp-PLA2试剂120mL22mL不少于20mLLp-PLA2试剂2 4.75mL 5.00mL不少于4.75mL Lp-PLA2试剂30.25mL0.27mL不少于0.25mL 2.1.3试剂空白吸光度试剂空白吸光度应不大于1.2。
2.1.4试剂空白吸光度变化率试剂空白吸光度变化率(∆A/min)应不大于0.005。
2.1.5分析灵敏度检测浓度200U/L的样本,吸光度差值(∆A)应不小于0.01。
2.1.6线性范围:100U/L~1400U/L2.1.6.1在线性范围(100U/L~1400U/L)内检测结果的相关系数r≥0.990。
2.1.6.2(100U/L~200U/L )范围内,线性绝对偏差不大于±20U/L ;(200U/L~1400U/L)范围内,线性相对偏差不大于±10%。
2.1.7精密度2.1.7.1重复性变异系数应不大于5%。
2.1.7.2批间精密度试剂批间相对极差应不大于6%。
2.1.8准确度相对偏差应不超过±10%范围。
2.2校准品、质控品性能指标2.2.1外观2.2.1.1标签应清晰、完整。
2.2.1.2校准品、质控品外观应符合表3规定。
表3校准品、质控品外观要求2.2.2校准品赋值准确度检测值与赋值的相对偏差应不超过±8%。
脂蛋白相关磷脂酶A2测定试剂盒(免疫比浊法)产品技术要求baiding

脂蛋白相关磷脂酶A2测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清中脂蛋白相关磷脂酶A2的含量。
1.1 包装规格校准品(选配):5×0.5mL;质控品(选配):水平1:1×0.5mL,水平2:1×0.5mL。
1.2 主要组成成分注:校准品靶值、质控品质控范围详见包装标签。
2.1 外观2.1.1试剂1:无色到淡黄色液体,无可见不溶物。
2.1.2试剂2:无色到白色液体。
2.1.3校准品:无色至淡黄色液体,无可见不溶物。
2.1.4质控品:无色至淡黄色液体,无可见不溶物。
2.1.5包装外观:外观整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 空白吸光度空白吸光度≤1.8。
2.4 分析灵敏度样本浓度为165μg/L时,吸光度差值应≥0.008。
2.5 线性在[10,800] μg/L的范围内,线性相关系数r≥0.990。
测试浓度在[10,200] μg/L时;绝对偏差应不超过±20μg/L;测试浓度在(200,800] μg/L 时,相对偏差应不超过±10%。
2.6 精密度2.6.1 重复性用高、低2个浓度的样本进行测试,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2 批间差用3个不同批次的试剂盒分别测试样本,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度回收率应在85%-115%范围内。
2.8 校准品/质控品瓶内重复性校准品/质控品瓶内重复性(CV)应不大于10%。
2.9 溯源性根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准品溯源至柏定公司内部工作校准品,并与已上市产品比对赋值。
2.10 质控品赋值有效性测试结果在质控范围内。
2.11 稳定性2.11.1 效期稳定性试剂盒在2℃~8℃密封避光保存条件下有效期为12个月。
有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1、2.7、2.8和2.10的要求。
SEA867Hu 96T 脂蛋白关联磷脂酶 A2(LpPLA2)检测试剂盒 使用说明书
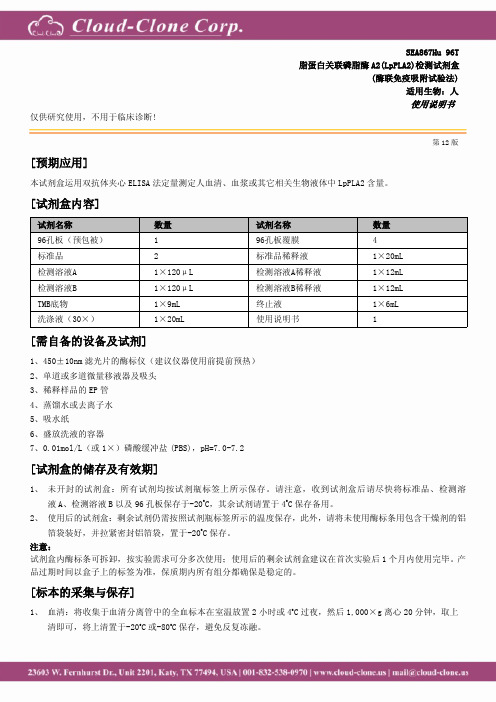
SEA867Hu96T脂蛋白关联磷脂酶A2(LpPLA2)检测试剂盒(酶联免疫吸附试验法)适用生物:人使用说明书仅供研究使用,不用于临床诊断!第12版[预期应用]本试剂盒运用双抗体夹心ELISA法定量测定人血清、血浆或其它相关生物液体中LpPLA2含量。
[试剂盒内容]试剂名称数量试剂名称数量96孔板(预包被)196孔板覆膜4标准品2标准品稀释液1×20mL检测溶液A1×120μL检测溶液A稀释液1×12mL检测溶液B1×120μL检测溶液B稀释液1×12mLTMB底物1×9mL终止液1×6mL洗涤液(30×)1×20mL使用说明书1[需自备的设备及试剂]1、450±10nm滤光片的酶标仪(建议仪器使用前提前预热)2、单道或多道微量移液器及吸头3、稀释样品的EP管4、蒸馏水或去离子水5、吸水纸6、盛放洗液的容器7、0.01mol/L(或1×)磷酸缓冲盐(PBS),pH=7.0-7.2[试剂盒的储存及有效期]1、未开封的试剂盒:所有试剂均按试剂瓶标签上所示保存。
请注意,收到试剂盒后请尽快将标准品、检测溶液A、检测溶液B以及96孔板保存于-20o C,其余试剂请置于4o C保存备用。
2、使用后的试剂盒:剩余试剂仍需按照试剂瓶标签所示的温度保存,此外,请将未使用酶标条用包含干燥剂的铝箔袋装好,并拉紧密封铝箔袋,置于-20o C保存。
注意:试剂盒内酶标条可拆卸,按实验需求可分多次使用;使用后的剩余试剂盒建议在首次实验后1个月内使用完毕。
产品过期时间以盒子上的标签为准,保质期内所有组分都确保是稳定的。
[标本的采集与保存]1、血清:将收集于血清分离管中的全血标本在室温放置2小时或4o C过夜,然后1,000×g离心20分钟,取上清即可,将上清置于-20o C或-80o C保存,避免反复冻融。
脂蛋白相关磷脂酶A2(Lp-PLA2)测定试剂盒(胶乳免疫比浊法)产品技术要求北奥泰康

脂蛋白相关磷脂酶A2(Lp-PLA2)测定试剂盒(胶乳免疫比浊法)适用范围:该产品用于体外定量测定人血清或血浆中脂蛋白相关磷脂酶A2的浓度。
1.1 产品规格1.2 组成成分1.2.1 试剂组成试剂1:磷酸盐缓冲液(pH=6.5)50mmol/L 试剂2:磷酸盐缓冲液(pH=8.0)50mmol/L 包被鼠抗人Lp-PLA2单克隆抗体的胶乳悬浊液<0.5%1.2.2校准品的组成校准品为液体,校准品组成是在磷酸盐缓冲液中加入含一定浓度的脂蛋白相关磷脂酶A2纯品。
1个水平校准品目标浓度为800ng/mL,浓度有批特异性,具体定值详见瓶签。
1.2.3质控品的组成两水平液体质控品,在磷酸盐缓冲液中加入脂蛋白相关磷脂酶A2纯品。
靶值范围分别为:(90~200) ng/mL、(200~500)ng/mL。
2.1 外观试剂R1为无色至淡黄色澄清液体;试剂R2为乳白色悬浊液;校准品为无色至淡黄色澄清液体;质控品为无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度试剂空白吸光度应在0.2~2.0之间。
2.4 空白限试剂空白限应不大于10ng/mL。
2.5 分析灵敏度测定分析灵敏度:浓度为160ng/mL时,吸光度变化应≥0.01。
2.6 线性测试血清样本,试剂线性在(0,800] ng/mL范围内,线性相关系数(r)应不小于0.99;测定结果在(0,200] ng/mL时绝对偏差不超过±20ng/mL;在(200,800] ng/mL范围内的相对偏差不超过±10%。
2.7 重复性试剂盒测试项目重复性CV≤10%。
2.8 批间差不同批号之间测定结果的相对极差应≤15%。
2.9 准确度回收实验:回收率在90%~110%。
2.10质控品赋值有效性测定值在质控靶值范围内。
2.11校准品溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至脂蛋白相关磷脂酶A2纯品(来源:Sigma;纯度≥95%)。
脂蛋白磷脂酶A2测定试剂盒(胶体金免疫层析法)产品技术要求乐普

脂蛋白磷脂酶A2测定试剂盒(胶体金免疫层析法)适用范围:该产品用于体外测定全血/血清/血浆中人脂蛋白磷脂酶A2的含量。
1.1规格卡型1人份、10人份/盒、20人份/盒、50人份/盒。
1.2组成每盒含1/10/20/50人份试纸条、1 份批号卡和1/10/20/50份样品缓冲液。
其中:每人份试纸条包括1份脂蛋白磷脂酶A2检测卡、1支滴管和1包干燥剂。
脂蛋白磷脂酶A2测定卡由样品垫、硝酸纤维素膜(T线包被鼠抗人Lp-PLA2单克隆抗体;C线包被兔抗鼠抗抗体)、金标垫(胶体金标记的鼠抗人Lp-PLA2单克隆抗体)、吸水纸、塑料载板组成。
样品缓冲液每支装定量为3mL/瓶,由0.1%的表面活性剂和0.1mol/L的Tris (pH7.0)溶液组成。
2.1物理性状2.1.1 外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
2.1.2 膜条宽度检测卡的膜条宽度≥2.5mm。
2.1.3 液体移行速度液体移行速度应不低于10 mm/min。
2.1.4样品缓冲液样品缓冲液体积应不少于标示值,pH值6.5~8.0。
2.2 空白限空白限应不高于25 ng/mL。
2.3 精密度批内精密度(CV%)应不高于15.0%。
2.4批间差批间差(CV%)应不高于15.0%。
2.5 线性在(0,500]ng/ml的范围内,用线性拟合公式拟合,剂量-反应曲线相关系数应不低于0.990。
2.6 准确度样本回收率应在85%~115%范围内。
2.7分析特异性检测浓度为25ng/mL的游离血红蛋白、25ng/mL的甘油三酯,检测结果应小于25ng/mL。
2.8稳定性将检测卡在4℃~30℃的环境中放置18个月后,取样分别检测2.1、2.2、2.3、2.5、2.6、2.7项,结果应符合各项目的要求。
2.9 溯源性应根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》提供所有校准品的来源、赋值过程以及测量不确定度等内容,校准信息可溯源至本公司工作校准品,工作校准品与已上市试剂盒比对赋值。
磷脂酶 A2 ( phospholipase A2 ,PLA2 )试剂盒说明书
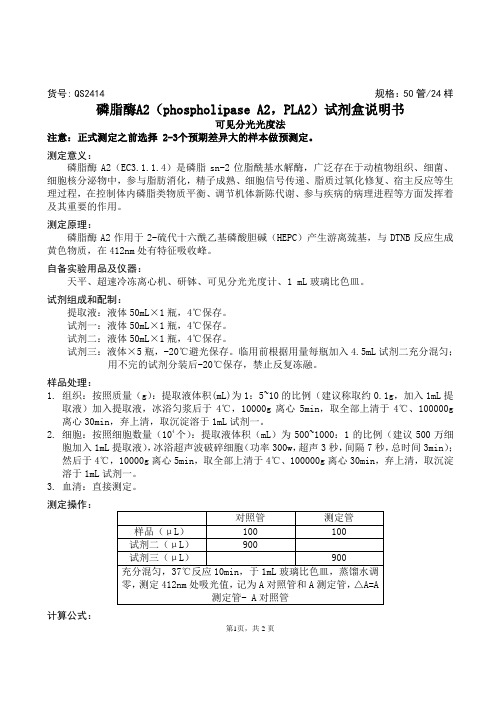
货号: QS2414 规格:50管/24样磷脂酶A2(phospholipase A2,PLA2)试剂盒说明书可见分光光度法注意:正式测定之前选择 2-3个预期差异大的样本做预测定。
测定意义:磷脂酶A2(EC3.1.1.4)是磷脂sn-2位脂酰基水解酶,广泛存在于动植物组织、细菌、细胞核分泌物中,参与脂肪消化,精子成熟、细胞信号传递、脂质过氧化修复、宿主反应等生理过程,在控制体内磷脂类物质平衡、调节机体新陈代谢、参与疾病的病理进程等方面发挥着及其重要的作用。
测定原理:磷脂酶A2作用于2-硫代十六酰乙基磷酸胆碱(HEPC)产生游离巯基,与DTNB反应生成黄色物质,在412nm处有特征吸收峰。
自备实验用品及仪器:天平、超速冷冻离心机、研钵、可见分光光度计、1 mL玻璃比色皿。
试剂组成和配制:提取液:液体50mL×1瓶,4℃保存。
试剂一:液体50mL×1瓶,4℃保存。
试剂二:液体50mL×1瓶,4℃保存。
试剂三:液体×5瓶,-20℃避光保存。
临用前根据用量每瓶加入4.5mL试剂二充分混匀;用不完的试剂分装后-20℃保存,禁止反复冻融。
样品处理:1.组织:按照质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g,加入1mL提取液)加入提取液,冰浴匀浆后于4℃,10000g离心5min,取全部上清于4℃、100000g 离心30min,弃上清,取沉淀溶于1mL试剂一。
2.细胞:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后于4℃,10000g离心5min,取全部上清于4℃、100000g离心30min,弃上清,取沉淀溶于1mL试剂一。
3.血清:直接测定。
测定操作:计算公式:第1页,共2页1.按照蛋白浓度计算酶活性定义:每毫克蛋白每分钟水解HEPC产生1nmol游离巯基所需的酶量为一个酶活力单位。
脂蛋白相关磷脂酶A2(Lp-PLA2)测定试剂盒(酶联免疫吸附法)产品技术要求xieheluoke
脂蛋白相关磷脂酶A2(Lp-PLA2)测定试剂盒(酶联免疫吸附法)
适用范围:用于体外定量测定人血浆中脂蛋白相关磷脂酶A2(Lp-PLA2)的浓度。
1.1 包装规格
24人份/盒、48人份/盒、96人份/盒
1.2主要组成成分
注:校准品靶值具有批特异性,详见瓶签;质控品质控范围及靶值具有批特异性,详见瓶签。
不同批号试剂盒中各组分不可以互换使用。
2.1外观
试剂盒各组分齐全、完整,液体组分无渗漏,标识清晰易识别。
2.2空白限
不大于20ng/ml。
2.3准确度
回收率为85%~115%。
2.4线性
试剂盒的线性范围为(20,450)ng/ml,相关系数r不小于0.9900。
2.5重复性
用高低两个浓度水平的样本各重复检测10次,其变异系数(CV)不大于15%。
2.6特异性
与白蛋白(ALB )50g/L、髓过氧化物酶(MPO)800ng/ml做交叉反应,Lp-PLA2检测浓度应不大于20ng/ml。
2.7校准品溯源性
根据GB/T21415-2008及有关规定提供所用校准品的来源、赋值过程以及不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.8质控品赋值有效性
分别取高、低两个浓度质控品,检测其浓度值,每个测试值均应在所示的质控范围内。
2.9批间差
用3个批号试剂盒检测同一份样本,变异系数(CV)不大于15%。
2.10稳定性
2℃~8℃储存,有效期为12个月,取到效期后产品进行检测,检测结果应符合2.1~2.6、2.8项要求。
脂蛋白相关磷脂酶A2测定试剂盒 (酶法)产品技术要求haomai

脂蛋白相关磷脂酶A2测定试剂盒(酶法)适用范围:本试剂用于体外定量测定人血清中脂蛋白磷脂酶A2[Lp-PLA2]的浓度。
1.1包装规格1.2主要组成成分本试剂由试剂1(R1)、试剂2(R2)和试剂3(R3)组成试剂1(R1):Tris缓冲液PH7.6 100mmol/L乙二胺四乙酸二钠(EDTA) 20mmol/LProclin300防腐剂 0.1%试剂2(R2):柠檬酸 PH2.7 100mmol/ LProclin300防腐剂 0.1%试剂3(R3):乙醇90%1-肉豆蔻-2-(4-硝基苯基琥珀酰基) 100mmol/L-sn-并三基-3-磷酸胆碱2.1 外观试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰;R1试剂应为无色澄清液体,R2试剂应为无色澄清液体,R3试剂应为无色或淡黄色澄清液体。
液体试剂不得有沉淀和絮状物。
2.2 净含量用通用量具测量,液体试剂的净含量应不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在404nm处测定试剂空白吸光度,应≤1.8A。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.02A。
2.4 分析灵敏度测试500U/L的被测物时,吸光度变化(ΔA)应不低于0.01A。
2.5 准确性参照EP9-A2的方法,用比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.990;每个浓度点在[50,160)U/L范围内绝对偏差不超过±16U/L;[160,1600] U/L范围内相对偏差不超过±10%。
2.6 重复性用三个水平的样本检测,检测结果批内变异系数(CV)应不超过7%。
2.7 线性2.7.1在[50,1600] U/L范围内,线性相关系数r应不低于0.990;2.7.2 在[50,160) U/L范围内绝对偏差不超过±16U/L;[160,1600] U/L范围内相对偏差不超过±10%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
脂蛋白磷脂酶A2(Lp-PLA2)测定试剂
•产品名称
通用名称:脂蛋白磷脂酶A2(LP-PLA2)测定试剂盒(免疫增强比浊法)
•包装规格
50人份/盒100人份/盒
•预期用途
用于体外定量测定人血清、血浆或全血中LP-PLA2的含量。
LP-PLA2是磷脂酶A2 超家族的成员。
循环中的LP-PLA2是一种主要由巨噬细胞产生的反映血管炎症的特异性标记物,在低密度脂蛋白的氧化、促进动脉粥样硬化以及冠心病和卒中的形成等方面发挥重要作用。
LP-PLA2水平升高是预测冠心病和卒中风险的一种独立危险因子。
•检验原理
样本中的LP-PLA2在磷酸盐缓冲系统中与试剂中鼠抗人LP-PLA2 单克隆抗体的致敏乳胶颗粒发生抗原抗体反应,在促聚剂聚乙二醇作用下产生凝集以使浊度上升,在546 nm 波长检测反应液吸光度的变化,其变化程度与样本中的LP-PLA2含量成正比。
•临床应用
1、独立,准确预测中风和心血管事件
2、独立,准确反应血管的炎症情况
3、独立,准确反应动脉粥样硬化斑块的破裂危险性
4、冠心病,心血管疾病以及卒中的危险评估
•临床价值
对心脑血管疾病的评估,检测和治疗的需求越来越大。
LP-PLA2检测将成为未来针对心脑血管疾病预测,诊断,治疗以及疗效评估的新指标。
LP-PLA2为反映动脉粥样硬化斑块破裂及血栓形成事件的高度一致性、精确性的独立风险因子,是急性动脉粥样硬化血栓复发事件高风险患者的准确风险评估标志物。
LP-PLA2研制成功,完全解决了酶联免疫法耗时长、操作繁琐、实验室需凑足一定标本量才能开始检测的缺陷,填补了行业内空白。
其成功实现了“准确、稳定、一分钟出报告”的POCT需求,成为迄今为止世界范围内唯一能够用比浊法快速检测的POCT产品。
•临床指南
LP-PLA2已成功进入美国临床内分泌协会(AACE)血脂异常管理和动脉粥样硬化预防指南(2012)和欧洲心脏病学学会(ESC)心脏病预防指南(2012)。
临床随访显示:保持最低LP-PLA2水平的心脑血管疾病患者的存活率最高,然而,伴随着LP-PLA2水平的升高,患者存活率持续下降。
因此,LP-PLA2水平能够反应患者的心血管健康状况。
美国临床内分泌学家协会指南指出LP-PLA2是心脑血管事件风险分层管控的最佳指标。
明确指出:正常人血液中LP-PLA2水平低于200ng/mL, 而LP-PLA2水平高于223ng/mL的患者具备高度的心脑血管事件或卒中发病的风险。
与其他的心脑血管临床检测方法,如:血管造影,血液生化检测,心肌酶检测,高灵敏C反应蛋白以及白细胞计数相比,LP-PLA2检测更加方便,迅速,具备更好的灵敏度和特异性反映动脉粥样硬化的严重程度和动态变化。
因此,快速定量Lp-PLA2检测不仅能够进行早期心脑血管疾病的临床诊断,更可以对疾病的治疗和预后起到指导评价的作用。
