高考化学复习学案——铝及其化合物
高考化学 铝及其化合物考点复习学案

高考化学铝及其化合物考点复习学案1、了解铝及其重要化合物的主要物理性质2、了解Al的化学性质3、了解Al2O3、Al(OH)3的两性4、了解Al(OH)3的制备方法及其受热分解知识梳理一、铝的制取1、铝元素位于周期表、族,是较活泼的金属元素,在自然界中以态存在,在地壳中的含量占金属中的第位,铝元素在地壳中主要存在的物质是。
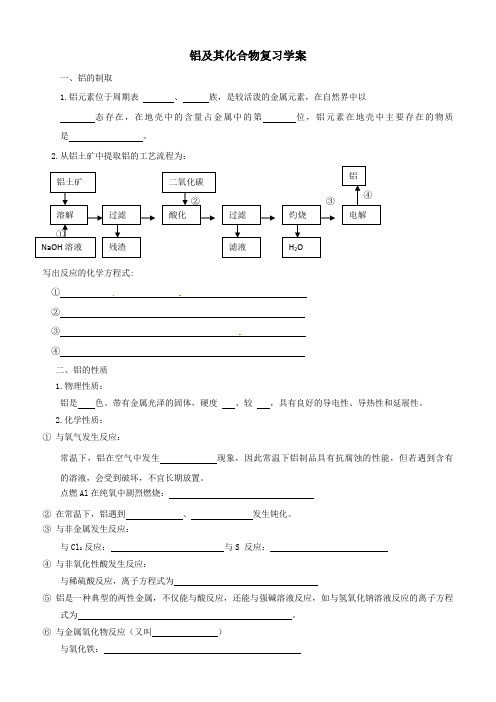
2、从铝土矿中提取铝的工艺流程为:④②①③铝土矿溶解NaOH溶液过滤残渣酸化二氧化碳过滤滤液灼烧H2O电解铝写出反应的化学方程式:① ② ③ ④二、铝的性质1、物理性质:铝是色、带有金属光泽的固体,硬度、较,具有良好的导电性、导热性和延展性。
2、化学性质:① 与氧气发生反应:常温下,铝在空气中发生现象,因此常温下铝制品具有抗腐蚀的性能,但若遇到含有的溶液,会受到破坏,不宜长期放置。
点燃Al在纯氧中剧烈燃烧:② 在常温下,铝遇到、发生钝化。
③ 与非金属发生反应:与Cl2 反应:与S 反应:④ 与非氧化性酸发生反应:与稀硫酸反应,离子方程式为⑤ 铝是一种典型的两性金属,不仅能与酸反应,还能与强碱溶液反应,如与氢氧化钠溶液反应的离子方程式为。
⑥ 与盐溶液发生反应与不活泼金属的盐溶液(如硝酸汞):与强氧化性盐溶液(如氯化铁):⑦与金属氧化物反应(又叫)与氧化铁:三、铝的化合物1、氧化铝①)物理性质Al2O3是固体,其天然晶体叫,硬度大,熔点高(为2072℃),是很好的耐火材料②化学性质(典型的氧化物)与强酸反应,其离子方程式为与强碱溶液反应,其离子方程式为思考:铝与强碱溶液反应的实质是什么?标出其电子转移方向和数目。
③用途作材料,如制、等;作冶炼铝的原料;红、蓝宝石。
2、氢氧化铝①)物理性质Al(OH)3是固体,溶于水,若溶液中生成,Al(OH)3为物,且有吸附水中悬浮物和色素的能力②化学性质(典型的氢氧化物)H++AlO2-+H2O Al(OH)3 Al3++3OH-与强酸反应,其离子方程式为与强碱溶液反应,其离子方程式为热不稳定性:③制备方法:实验室中制取少量的氢氧化铝常用可溶性的铝盐与反应,反应的离子方程式为。
高三铝及其化合物复习学案
铝及其化合物复习学案一、铝的制取1.铝元素位于周期表、族,是较活泼的金属元素,在自然界中以态存在,在地壳中的含量占金属中的第位,铝元素在地壳中主要存在的物质是。
2.从铝土矿中提取铝的工艺流程为:写出反应的化学方程式:①②③④二、铝的性质1.物理性质:铝是色、带有金属光泽的固体,硬度、较,具有良好的导电性、导热性和延展性。
2.化学性质:① 与氧气发生反应:常温下,铝在空气中发生现象,因此常温下铝制品具有抗腐蚀的性能,但若遇到含有的溶液,会受到破坏,不宜长期放置。
点燃Al在纯氧中剧烈燃烧:② 在常温下,铝遇到、发生钝化。
③ 与非金属发生反应:与Cl2 反应:与S 反应:④ 与非氧化性酸发生反应:与稀硫酸反应,离子方程式为⑤ 铝是一种典型的两性金属,不仅能与酸反应,还能与强碱溶液反应,如与氢氧化钠溶液反应的离子方程式为。
⑥ 与金属氧化物反应(又叫)与氧化铁:三、铝的化合物1.氧化铝①)物理性质Al2O3是固体,其天然晶体叫,硬度大,熔点高(为2072℃),是很好的耐火材料②化学性质(典型的氧化物)与强酸反应,其离子方程式为与强碱溶液反应,其离子方程式为③用途作材料,如制、等;作冶炼铝的原料;红、蓝宝石。
2.氢氧化铝①)物理性质色状溶于水的固体,有较强的。
②化学性质(典型的氢氧化物)电离方程式:H++AlO2-+H2O Al(OH) Al3++3OH-与强酸反应,其离子方程式为与强碱溶液反应,其离子方程式为热不稳定性:③制备方法:实验室中制取少量的氢氧化铝常用可溶性的铝盐与反应,反应的离子方程式为。
思考:能否用可溶性的铝盐与强碱反应制取?3.铝盐和偏铝酸盐(1) 铝盐性质:①铝盐溶液发生水解反应,使溶液呈酸性。
思考:明矾的化学式为,在日常生活中明矾用于。
②铝盐与碱溶液反应与强碱溶液发生反应:适量强碱:过量强碱:与弱碱(氨水)发生反应:思考:写出Al2(SO4)3溶液与Na2S、NaHCO3、Na2CO3溶液反应的离子方程式。
高三化学教案-高三鲁科版铝及其化合物复习 最新

第2节铝及其化合物学案【学习目标】1、掌握铝的性质2、掌握铝的化合物之间的相互转化(铝三角)【学习重点】掌握铝的性质及化合物的相互转化【学习过程】课前知识梳理一、铝的性质1、铝元素位于周期表周期族,原子结构示意图。
据示意图可知铝具有较强的性。
2、铝的性质。
写出铝与盐酸反应的离子方程式。
铝与烧碱反应的离子方程式3、铝热反应,铝与Fe2O3的反应方程式二、铝的化合物1、氧化铝:氧化铝为色固体,熔点,硬度,可用作耐磨材料和耐火材料。
氧化铝与盐酸和氢氧化钠反应的离子方程式2、氢氧化铝氢氧化铝是固体溶于水。
书写Al(OH)3分别与强酸强碱的离子方程式。
△Al(OH)3===课堂探究重点突破重点突破知识点一铝的性质练习:1、(07广东理基)下列有关金属铝及其化合物的叙述正确的是()A、铝在常温下不能与氧气反应B、铝不能与氯气反应C、铝既能溶于酸,又能溶于碱D、氧化铝只能与酸反应,不能与碱反应2、(07广东化学)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是()A、AlB、Al(OH)3C、AlCl3D、Al2O33、(06广东化学)等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是()A、2mol·L-1H2SO4溶液B、18mol·L-1H2SO4溶液C、6mol·L-1KOH溶液D、3mol·L-1HNO3溶液4、铝热反应不仅被用于焊接钢轨,而且还常用于冶炼熔点较高的金属如:钒、铬、锰等,补全下列方程式并配平:①V2O5+Al②Co3O4+Al知识点二氢氧化铝的制备例题1、已知Al3++3[Al(OH)4]-===4Al(OH)3↓,现有稀硫酸、氢氧化钠溶液和金属铝为原料,请同学们设计途径制备Al(OH)3,写出各途径的离子方程式,并分析出最佳途径:总结:1、实验室制备Al(OH)3的方法:2、“铝三角”知识点三 Al(OH)3的有关计算例题2 向20mL 某物质的量浓度的AlCl 3溶液中滴入2mol ·L -1NaOH 溶液时,得到的沉淀质量与所滴加溶液的体积(mL )关系如图所示,试 回答下列问题:(1)图中A 点表示的意义是。
高三化学一轮复习精品学案6:铝及其重要化合物

第11讲铝及其重要化合物『考纲要求』了解铝及其重要化合物的主要性质及其应用。
考点一 铝的性质及应用『知识整合』 1.结构和存在铝位于元素周期表,原子结构示意图为。
铝是地壳中含量的金属元素。
自然界中的铝全部以化合态的形式存在。
2.物理性质银白色有金属光泽的固体,有良好的延展性、和导热性,、质地柔软。
3.化学性质(写出化学方程式)4.制备和用途 (1)制备电解熔融Al 2O 3:2Al 2O 3(熔融)=====电解冰晶石4Al +3O 2↑。
(2)用途纯铝用作导线,铝合金制备汽车、飞机、生活用品等。
『多维思考』1.常温下为什么能用铝制槽车储运浓硫酸或浓硝酸?2.在铝与烧碱溶液的反应中氧化剂是什么?『考点精讲』铝与酸、强碱溶液的反应1.铝能与酸溶液反应生成H 2和铝盐(Al 3+),但与稀HNO 3反应不生成H 2,且常温下在浓HNO 3、浓H 2SO 4中钝化。
2.铝与强碱溶液反应生成H 2和偏铝酸盐(AlO -2)。
3.铝与酸或碱溶液反应生成H 2的量的关系 有关离子方程式为 2Al +6H +===2Al 3++3H 2↑2Al +2OH -+2H 2O===2AlO -2+3H 2↑(1)等量Al 分别与足量酸(H +)和碱(OH -)溶液反应,生成H 2之比为1∶1,消耗H +和OH -之比为3∶1。
(2)足量Al 分别与含H +和OH -物质的量相等的溶液反应,生成H 2之比为1∶3。
(3)若产生H 2之比为13<V H +(H 2)V OH -(H 2)<11,则必定是:①与酸反应时,Al 过量、H +不足; ②与碱反应时,Al 不足、OH -过量。
『考向突破』 考向一 铝的性质1.下列有关铝及其化合物的叙述正确的是( ) A .铝粉与氧化镁共热可制取金属镁B .足量铝分别与含1 mol HCl 、1 mol NaOH 的溶液反应,产生相同量的氢气C .工业上用电解熔融Al 2O 3的方法冶炼铝D .在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化2.镁、铝单质的化学性质以相似为主,但也存在某些重大差异性,下列物质能用于证明两者存在较大差异性的是( ) ①CO 2 ②盐酸 ③NaOH 溶液 ④水 A .①④ B .①②③ C .①③D .②③④考向二 铝与酸、强碱溶液反应及其计算3.将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( ) A .3 mol·L -1盐酸 B .4 mol·L-1硝酸 C .8 mol·L-1氢氧化钠D .18 mol·L-1硫酸4.a g Mg 、Al 合金完全溶解在c 1 mol/L 、V 1L HCl 溶液中,产生b g H 2。
高考化学知识点铝元素复习:铝及其化合物

高考化学知识点铝元素复习:铝及其化合物为大家带来高考化学知识点铝元素复习:铝及其化合物,希望大家喜欢下文!
高考化学知识点铝元素复习:铝及其化合物
1.铝箔在氧气中剧烈燃烧
4Al+3O22Al2O3
2.铝片与稀盐酸反应
2Al+6HCl=2AlCl3+3H2
2Al+6H+=2Al3++3H2
3.铝与氢氧化钠溶液反应
2Al+2NaOH+2H2O=2NaAlO2+3H2
2Al+2OH-+2H2O=2AlO2-+3H2
4.铝与三氧化二铁高温下反应(铝热反应)
2Al+Fe2O32Fe+Al2O3
(引发条件、反应现象?)
5.镁在二氧化碳中燃烧
2Mg+CO22MgO+C(现象?)
6.氧化铝溶于氢氧化钠溶液
Al2O3+2NaOH2NaAlO2+H2O
Al2O3+2OH-===2AlO2-+H2O
7.硫酸铝溶液中滴过量氨水
Al2(SO4)3+6NH3H2O=2Al(OH)3+3(NH4)2SO4
Al3++3NH3H2O=Al(OH)3+3NH4+
8.①、氢氧化铝溶液中加盐酸
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O
②、Al(OH)3与NaOH溶液反应:
Al(OH)3+NaOH(6)NaAlO2+2H2OAl(OH)3+OH-=AlO2-+2H2O 9.偏铝酸钠溶液中加入酸
NaAlO2+H2O+HCl=Al(OH)3+NaCl
AlO2-+H++H2O=Al(OH)3
NaAlO2+CO2+2H2O=Al(OH)3+NaHCO3(CO2足量)
以上就是高考化学知识点铝元素复习:铝及其化合物的全部内容,更多考试资讯请继续关注 !。
高三化学一轮复习精品学案1:铝及其重要化合物

第2讲铝及其重要化合物明考纲要求理主干脉络1.了解铝的主要性质及应用。
2.了解铝的重要化合物的主要性质及应用。
基础知识梳理知识点一铝的性质及应用『知识清单』1.铝的物理性质及用途物理性质状态色泽密度熔点沸点硬度导电、导热性延展性固态银白色 2.7 g·cm-3660.4℃2 467℃较小很好良好用途纯铝用作导线,铝合金用于制备汽车、飞机、生活用品等2.铝的原子结构和存在铝位于元素周期表中第三周期第ⅢA ,在地壳中含量丰富,仅次于氧,自然界中的铝全部以化合态存在。
3.铝的化学性质写出图中有关反应的化学方程式或离子方程式:①②2Al+3Cl 2=====△2AlCl 3③④2Al+2OH -+2H 2O===2AlO -2+3H 2↑ ⑤2Al+Fe 2O 3=====高温 2Fe +Al 2O 3『方法清单』铝与酸、碱反应的计算方法铝分别与盐酸、NaOH 溶液反应的化学方程式为: 2Al +6HCl===2AlCl 3+3H 2↑ 2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑从化学方程式可以看出,Al 与酸、碱反应时生成H 2的实质是:Al ――→失3e -A l +3,所以不论是Al 与酸还是与碱反应,Al 与产生H 2的关系均是:2Al ~3H 2。
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为V HCl H 2V NaOH H 2=11。
(2)足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为V HCl H 2V NaOH H 2=13。
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为13<V HCl H 2V NaOH H 2<11,则必定是:①铝与盐酸反应时,铝过量而盐酸不足;②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
『应用体验』1.铝是中学化学阶段常见既能与酸、又能与碱反应放出H 2的金属,依据这一特殊性质,回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H 2的体积之比是________。
2023高考化学一轮复习知识点:铝及其化合物
2023高考化学一轮复习知识点:铝及其化合物1500字铝(Al)是一种常见的金属元素,原子序数为13,位于元素周期表的第三周期上。
它的原子结构包含13个质子和13个电子。
铝是地壳中的第三大元素,大约占地壳总质量的8%,在自然界中主要以氧化铝(Al2O3)的形式存在。
铝是一种轻便而又耐腐蚀的金属,具有良好的导电性和导热性。
这些特性使得铝在各种领域中得到广泛应用,如航空航天、汽车制造、建筑和包装等。
铝也是可回收利用的金属,所以在环保方面也有很大的优势。
铝的化学性质主要体现在与其他元素形成化合物的过程中。
下面我们来介绍一些常见的铝化合物:1. 氧化铝(Al2O3):氧化铝是铝最常见的化合物,它是一种无机物,也被称为刚玉或红宝石。
氧化铝具有很高的熔点和硬度,因此在炼钢、陶瓷和磨料的制造中得到广泛应用。
2. 氢氧化铝(Al(OH)3):氢氧化铝是一种白色的沉淀物,常常出现在铝与水反应的产物中。
它是一种弱碱性物质,可以用作制造铝盐、消化剂和防酸剂。
3. 硫酸铝(Al2(SO4)3):硫酸铝是一种无机盐,常见的形式是无色结晶体。
硫酸铝可以用作石油和纸浆工业中的催化剂,也是一种常见的水处理剂。
4. 氯化铝(AlCl3):氯化铝是一种无机物,常见的形式是白色结晶体。
它可以用作催化剂、阻燃剂和制药工业中的原料。
5. 碳酸铝(Al2(CO3)3):碳酸铝是一种稀有的铝化合物,常见的形式是无色结晶体。
它可以用作陶瓷和玻璃工业中的原料。
除了上述化合物,铝还可以与许多其他元素形成配合物或有机化合物。
这些化合物在化学工业、医药领域和农药制造中具有广泛的应用。
在学习铝及其化合物的过程中,需要了解铝的性质、制备方法、应用领域以及常见的化学反应。
同时,还需要掌握化学计算、化学方程式的书写和平衡等基础知识。
通过理论学习和实验实践相结合的方式,可以更好地理解和掌握铝及其化合物的相关知识。
学案17铝及其化合物及答案
铝及其化合物编号:17班级:组别姓名【学习目标】1、熟练掌握铝及其化合物的主要性质并灵活应用。
2、小组合作探究有关铝及其化合物的简单计算及Al(OH)3的制备方案。
3、以极度的热情投入课堂,体验学习快乐【使用说明】利用一节课完成学案,下课收齐。
下节课学生先自纠10分钟,再针对基础知识检测5分钟。
然后学生对出错多的题目讨论10分钟,学生展示、教师点拨15分钟,巩固落实5分钟【基础自学】一、铝1、物理性质:铝为______色金属,熔、沸点较高,密度较____,硬度较____,导电性仅次于____2、化学性质:(1)与非金属单质(O2、Cl2、S等)反应思考:①常温下铝不易被腐蚀的原因?②铝在氧气中燃烧的现象?反应的化学方程式?因此铝可用于制造______、______、______等。
(2)发生铝热反应思考:①引发铝热反应的实验操作是?现象?试举例写出铝热反应的化学方程式?②什么是铝热剂?铝热反应的应用是?(3) 铝能与某些盐溶液反应,写出铝与硫酸铜溶液反应的离子方程式______________________练习1、称取两份铝粉,第一份加入足量的浓氢氧化钠溶液,第二份加入足量的稀盐酸,如果要放出相同的气体(在同温同压下),两份铝的质量之比为()A.1︰2B.1︰3C.3︰2D.1︰1二、铝的化合物氢氧化铝是______________的白色胶状物质,氢氧化铝能_______水中的悬浮物,又能____________,因此可用于___________思考①铝、氧化铝、氢氧化铝既能溶于强酸,又能溶于强碱,故他们都是两性物质,这种说法对吗?试总结哪些物质既能与强酸反应,又能与强碱反应。
②如何分别以铝、氧化铝为原料制取氢氧化铝?(其他试剂自选)(写出相关的离子方程式)练习2、 0.02molAlCl 3的混合溶液中加入100mL1mol/LNaOH 溶液,溶液中___________离子增加,________离子减少,继续加入50mL1mol/LNaOH 溶液后,溶液中主要存在__________离子 【总结】铝及其化合物的转化(在箭头上填写转化所需的试剂以及反应条件)【合作探究】1、等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等物质的量的铝,生成氢气的体积比为5︰6,则甲、乙两烧杯中的反应情况可能分别是( ) A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量 C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量2、将3.9g 镁铝合金,投入到500mL2mol/L 的盐酸中,金属完全溶解,再加入4mol/L 的NaOH 溶液,若要生成的沉淀最多,加入的这种NaOH 溶液的体积是( ) A.125mL B.200mL C.250mL D.560mL3、现有一块已知质量为56.4g 的铝镁合金,欲测定其中镁的质量分数,两位同学设计了不同的实验方案。
2022化学第四单元材料家族中的元素第2节铝及其重要化合物学案
第2节铝及其重要化合物备考要点素养要求1。
了解铝及其重要化合物的制备方法。
2。
掌握铝单质及其重要化合物的主要性质及其应用。
1。
宏观辨识与微观探析:认识铝及其化合物的两性,能从铝化合物的多样性,理解铝及其化合物的性质。
2.科学探究与创新意识:能发现和提出有探究价值的有关铝及其化合物性质的探究方案,进行实验探究.考点一铝单质的性质及制备必备知识自主预诊知识梳理1。
铝的原子结构和在自然界中的存在铝的原子结构示意图为。
铝位于元素周期表,自然界中的铝全部以态存在。
2。
金属铝的物理性质铝是色、具有金属光泽的固体,硬度,具有良好的、导热性和延展性。
3。
铝的化学性质写出图中有关反应的化学方程式或离子方程式:①Al形成致密的氧化膜,②③④离子方程式:⑤微点拨(1)Al与MgO不能发生铝热反应,原因是Mg 的活泼性强于Al。
(2)铝是活泼金属,但抗腐蚀性能强,原因是常温下Al与O2反应生成一层致密的氧化物薄膜而防止内部金属进一步被氧化.4。
铝的制备工业上利用电解熔融氧化铝的方法制备铝单质:(写化学方程式)。
微点拨工业上冶炼Al用电解熔融Al2O3的方法而不用AlCl3作原料的原因是AlCl3是共价化合物,熔融态不导电.5。
铝热反应(1)实验原理:高温下铝将较不活泼的金属从其氧化物中还原出来。
(2)实验装置:铝粉还原氧化铁的实验装置如图所示。
(3)引燃剂和铝热剂:a.引燃剂:镁条、氯酸钾。
b。
铝热剂:铝粉和金属氧化物(Fe2O3、Cr2O3、V2O5等)组成的混合物。
(4)铝热反应的应用:a。
该反应为放热反应,铝在高温下还原出了金属单质。
在冶金工业上常利用这一原理制取熔点较高的金属,如3MnO2+4Al 2Al2O3+3Mn等。
b.该反应原理可以应用在生产上,如焊接钢轨等。
自我诊断1.在做铝的燃烧实验时,用坩埚钳夹住一小块铝箔,在酒精灯上加热至其熔化,看到的现象是铝箔熔化,失去光泽,但熔化的铝并不滴落。
原因是什么?2。
高三一轮复习《铝及其化合物》学案
《铝及其化合物》学案一、看组成、看价态、记特性看组成单质氧化物氢氧化物盐典型代表Al Al2O3Al(OH)3AlCl3NaAlO2分类别活泼金属_____氧化物_____氢氧化物____酸____碱盐____酸____碱盐看价态0 +3反应类型氧化还原与酸、碱、盐之间的复分解反应根据各类物质的反应规律,完善铝及其化合物的转化关系图(用箭头表示转化方向,并注明反应物)二、知识点应用——以铝、二氧化碳、稀硫酸、NaOH溶液、氨水为原料,制备Al(OH)3沉淀要求:画出实验流程图(如下示例),方框里填试剂,写出每步反应的离子方程式方法一:方法二:方法三:小测:1.下列说法不正确的是()A.Al是地壳中含量最多的金属元素B.铝制容器可盛装热的浓H2SO4C.明矾净水是因为形成了Al(OH)3胶体D.Al(OH)3可用于治疗胃酸过多2.下列离子组肯定能够大量共存的是()A.在NaCl溶液中:K+、Al3+、CO32-、SO42-B.加入铝粉能放出H2的溶液中:SO42-、NH4+、AlO2-、Na+C.使石蕊变红的溶液中:Ba2+、K+、Al3+、NO3-D.滴入KSCN显红色的溶液中:NH4+、Na+、SO42-、AlO2-3.(双选)短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第V A族,甲和丙同主族,丁的最外层电子数和电子层数相等,则正确的是()A.原子半径:丙>丁>乙B.单质的还原性:丁>丙>甲C.甲、乙、丙的氧化物均为共价化合物D.乙、丙、丁的最高价氧化物对应的水化物能相互反应4.日常生活中使用铝合金中的铝来自于电解氧化铝。
工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。
工业生产铝锭的工艺流程示意图如下:一些氢氧化物沉淀的pH如下表:沉淀物Al(OH)3 Fe(OH)3Mg(OH)2开始沉淀pH 4.0 1.2 10.4完全沉淀pH 5.2 3.4 12.4(1)步骤①加入盐酸时,氧化铝发生反应的离子方程式为。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Al及其化合物一、铝的存在1.铝元素位于周期表、族,是较活泼的金属元素,在自然界中以态存在,在地壳中的含量占金属中的第位,铝元素在地壳中主要存在的物质是。
二、铝的性质1.物理性质:铝是色、带有金属光泽的固体,硬度、较,具有良好的导电性、导热性和延展性。
常温下,铝在空气中生成(现象),因此常温下铝制品具有抗腐蚀的性能,但若遇到含有的溶液,会受到破坏,不宜长期放置。
三.铝的制法:铝的制法:四.铝的用途:制成种类繁多的轻质铝合金,在汽车、船舶、飞机、宇宙飞船等领域以及日常生活里的用途佷广,用作装饰品;纯铝作导线和电缆,制成铝箔,银粉防锈漆等。
五.铝的化合物1、氧化铝物理性质:色,溶于水,熔点,很。
属于氧化物。
化学性质:(1)与酸反应与HCl反应(离子方程式)与H2SO4反应(化学方程式)(2)与强碱反应(离子方程式)用途:冶炼金属铝的原料,是一种较好的耐火材料,可制造耐火坩埚、耐火管和耐高温的实验仪器。
2.氢氧化铝物理性质:色,溶于水,有较强的,可用作。
化学性质(典型的氢氧化物)其电离方程式为____________________________ ;______________________ _ (1)热稳定性(2)与酸反应(3)与强碱反应(与少量氢氧化钠反应)(与过量氢氧化钠反应)实验室制法:实验室常用和反应制取氢氧化铝。
思考:能否用可溶性的铝盐与强碱反应制取Al(OH)3?用途:医用的胃酸中和剂。
3.铝盐性质:①铝盐溶液发生水解反应,使溶液呈酸性其离子方程式为思考:明矾的化学式为,在日常生活中明矾用于。
②铝盐与碱溶液反应与强碱溶液发生反应离子方程式:适量强碱:过量强碱:与弱碱(氨水)发生反应离子方程式:思考:写出Al2(SO4)3溶液与Na2S、NaHCO3、Na2CO3溶液反应的离子方程式。
4.偏铝酸钠化学式,与少量盐酸反应的离子方程式:与过量盐酸反应的离子方程式:六.铝氢氧化物沉淀的图象氢氧化铝沉淀量图象大致可以分为如图六类。
[图中横坐标为加入试剂的体积](1)图为向AlCl3溶液中滴人NaOH溶液反应离子方程式:A~B段:B~C段:(2)图为向NaOH溶液中滴入AlCl3溶液反应离子方程式:A~B段B~C段(3)图为向盐酸酸化了的AlCl3溶液中滴入NaOH溶液A~B段:B~C段:C~D段:(4)图为向盐酸中加入NaAlO2溶液A~B段:B~C段:(5)图为向NaAl O2溶液中加入盐酸A~B段:B~C段:(6)图为向AlCl3溶液中滴入NaAlO2溶液(也可表示为Na[Al(OH)4]溶液)A~B段:关于KAl(SO4)2和Ba(OH)2反应的原理及图象:(1)沉淀物质的量变化图象(2)沉淀质量变化图象沉淀(g)沉淀(mol)0 V[Ba(OH)2]0 V[Ba(OH)2]沉淀物质的量最大时反应的化学方程式沉淀质量最大时反应的化学方程式七.铝三角⑴⑵⑶⑷⑸⑹八.铝及其化合物的转化关系⑴⑵⑶⑷⑸⑹⑺⑻⑼⑽⑾⑿⒀⒁⒂⒃1.下列图象中,纵坐标为沉淀物的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应的例1 在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。
下列表示氢氧化钠加入量(X )与溶液中沉淀物的量(Y )的关系示意图中正确的是(C )A .B .C .D .例2:向50mL bmol/L 的AlCl 3溶液中加入50mL a mol/L 的NaOH 溶液。
⑴当a 、b 关系不同时,反应所生成沉淀的质量不同。
填写下表:(⑴a≤3b ,1.3a ;3b <a <4b ,3.9(4b -a );a≥4b ,0。
⑵a 值为2.4 mol·L -1或3.2 mol·L -1) 例3 向含amoLAl 2(SO 4)3的溶液中加入含bmolBa(OH)2溶液,试求: (1)若b=3a ,则所得沉淀的物质的量为____________________mol (2)若b=4a ,则所得沉淀的物质的 量为____________________mol(3)若3a <b <4a ,则所得的沉淀的物质的量为__________mol 例4:将镁铝的混合物0.2 mol 溶于100 mL 4 mol/L 硫酸溶液中,然后再滴加2 mol/L 氢氧化钠溶液。
请回答:(1)滴加氢氧化钠溶液的过程中,沉淀质量随加入氢氧化钠溶液的体积V 变化如图所示。
当X 沉淀质量a=160 mL时,则金属粉末中镁的物质的量为mol,b= mL。
(2)在滴加氢氧化钠溶液的过程中,Mg2+、Al3+正好完全沉淀时加入的氢氧化钠溶液的体积为mL。
(3)若上述混合物中镁的物质的量分数(以镁的物质的量除以混合物的总物质的量)为x,在加入100 mL 4 mol/L硫酸溶液溶解后,然后又加入了2 mol/L 氢氧化钠溶液450 mL,所得沉淀中无Al(OH)3。
满足此条件的x的取值范围是。
例5现有AlCl3和FeCl3的混和溶液,其中Al3+和Fe3+的物质的量之和为0.1mol。
在此溶液中加入90mL4mol/L的NaOH溶液,使其充分反应;设Al3+的物质的量与总物质的量的比值为x;(1)根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质的量是多少?(2)计算沉淀中只有Fe(OH)3时的x的取值范围.请在图中画出沉淀总量(mol)随x(0 1)变化的曲线.(3)若Al3+和Fe3+的物质的量之和为Amol(A为合理数值),其它条件不变时,求沉淀中同时有Al(OH)3、Fe(OH)3时的x取值范围和各沉淀的物质的量(用含有A、x的式子表示)((1)按反应Fe3+ + 3OH- = Fe(OH)3↓0.1 mol -0.4×0.1 mol 3×0.06=0.06mol =0.18mol 0.06molAl3++4OH- = AlO2-+2H2O0.4×0.1 4×0.04剩余n(OH-)=0.09L×4mol/L-0.18mol-0.16mol=0.02mol>0因此有0.06molFe(OH)3沉淀。
⑵要使沉淀中无Al(OH)3,至少需n(OH-)=4×0.1mol×xx的最大取值为:0.1mol(1-x)×3+0.4molx=0.09×4mol,x=0.6因此,在0≤x≤0.6时,沉淀只有Fe(OH)3;x=0时, Fe(OH)3沉淀量为0.1mol,x=0.4时, Fe(OH)3沉淀量为0.06mol,x=0.6时, Fe(OH)3沉淀量为0.04mol,在0.6≤x≤1内,总沉淀量:n(总)=0.1mol(1-x)+0.1molx=0.04mol)例6:在标准状况下进行下列实验:甲、乙、丙各取30 mL同浓度的盐酸,加入同一镁铝合金产生气体。
有关数据列表如下:⑴盐酸的物质的量浓度为mol·L,表中可作为计算依据的是。
(填序号)⑵据表中(填序号)的数据,可计算出此镁与铝合金中镁与铝的物质的量之比为。
⑶在丙实验之后,向容器中加入一定量的1.00 mol·L-1的NaOH溶液能使合金的Al粉恰好溶解,再过滤出不溶性固体,请填下表:⑴1 mol·L -1,乙、丙。
⑵甲,1∶1。
⑶溶液中的溶质为NaCl 0.03 mol ,NaAlO 2 0.009 mol ,所加入NaOH 溶液的体积为39 mL 。
) 例7:将Na 2O 2溶于足量水完全反应后,再加入铝粉反应后溶液中无固体残留,先后共收集到气体1.008L (标准),这些气体置于密闭容器中用电火花引爆恰好完全反应。
求:⑴加入的Na 2O 2和铝粉的物质的量。
⑵上述反应后的溶液中需加入1mol/L 的盐酸多少亳升,理论上才能析出最多的沉淀物。
(解析:⑴由题意知:生成的气体为H 2和O 2,且两气体的体积比为2∶1,则 n (H 2) =L 4.22L 008.1×32=0.03mol n (O 2) =L 4.22L 008.1×31=0.015mol 2Na 2O 2 + 2H 2O = 4NaOH + O 2↑2mol 4mol 1moln (Na 2O 2) n (NaOH) 0.015mol可得:原固体中Na 2O 2的物质的量为:n (Na 2O 2)=0.03mol ,同时反应生成NaOH 的物质的量为:n (NaOH)=0.06mol 。
2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑2mol 2mol 2mol 3mol n (Al) n (NaOH) n (NaAlO 2) 0.03mol 可得:消耗Al 的物质的量为:n (Al)=0.02mol消耗NaOH 的物质的量为:n (NaOH)=0.02mol 生成NaAlO 2的物质的量为:n (NaAlO 2)=0.02mol因此原混合固体中Na2O 2和Al 的物质的量分别为0.03mol 、0.02mol 。
⑵由上述可知,反应后的混合液中含有NaOH 和NaAlO2。
且: n (NaOH)=0.06mol-0.02mol=0.04mol ,n (NaAlO 2)=0.02mol 。
欲使生成沉淀量最多,所加入的盐酸不仅先要中和余下的NaOH ,还要刚与NaAlO 2反应生成Al(OH)3沉淀。
则:AlO 2- + H + + H 2O =Al(OH)3↓ 1mol 1mol 0.02mol n(H +)n (H +)=0.02mol则消耗盐酸的物质的量为n (HCl)=0.04mol+0.02mol=0.06mol, V (HCl)=L/mol 1mol06.0=0.06L=60mL 。
