小蛋白转膜条件
wb小分子蛋白半干转条件

wb小分子蛋白半干转条件WB(western blot)是一种常用的蛋白质分析方法,由于其对蛋白质大小、数量和特异性的检测能力,被广泛应用于生物医学研究领域。
通过WB可以检测目标蛋白质在复杂混合样本中的存在和相对丰度,并进一步了解其功能和相关信号通路。
为了获得准确、可重复的实验结果,进行WB时需要控制并优化实验条件。
在本文中,将介绍WB实验中常见的几个关键步骤及其半干转条件。
WB实验主要包含以下几个步骤:细胞或组织的裂解,蛋白质的电泳分离,转膜到膜上,次级抗体的结合和信号检测。
其中,转膜是WB实验中的关键步骤之一,通过将凝胶上的蛋白质迁移到固相膜上,实现后续蛋白质的检测与结构分析。
转膜的传统方法是湿式转膜,即将凝胶与膜之间通过扩散作用隔开。
湿式转膜的缺点是需要较长时间进行转膜,并且存在仪器设备需求较高的问题。
为了解决这些问题,半干转膜(semi-dry blotting)技术应运而生。
半干转膜是相对于湿式转膜而言的一种新型转膜方法,其特点是转膜时间短、电流运行条件相对较低、仪器设备需求较少。
半干转膜是通过将蛋白质迁移到聚合物膜上,再将聚合物膜与毛细管纸或海绵等介质相接触,然后通过电流进行转膜。
半干转膜的步骤如下:1.准备转膜系统:选择合适大小和形状的聚丙烯酰胺凝胶和膜,将膜部分修剪成与凝胶大小相同的尺寸。
准备海绵或毛细管纸作为介质。
2.组装转膜装置:将蛋白质凝胶放在转膜装置的下层,将修剪好的膜放在凝胶上方,并在两者之间放置介质(海绵或毛细管纸)。
3.倒置蛋白质凝胶:将转膜装置倒置,将凝胶端放在电极盘上,转膜装置上方放置另一电极盘。
将两个电极盘连接到电源上。
4.进行转膜:根据需要选择合适的电流和转膜时间进行实验。
较好的转膜条件是0.8-1.2mA/cm2,通常转膜时间在15-30分钟内即可完成。
5.转膜结束后,可以对膜进行染色或进行进一步的免疫检测。
半干转膜与传统的湿式转膜相比,具有以下优点:1.转膜速度快:相比于湿式转膜,半干转膜时间大大缩短,使实验效率得到提高。
wb小分子蛋白半干转条件 -回复

wb小分子蛋白半干转条件-回复WB小分子蛋白半干转条件小分子蛋白半干转(Western Blot Semi-Dry Transfer)是一种常用的蛋白转印技术,用于将蛋白质从制备好的凝胶转移到膜上,以便进一步进行免疫印迹分析。
WB半干转法具有时间短、样品消耗少、结果可靠等优点,逐渐成为了实验室中最被推崇的蛋白转印方式之一。
本文将为您一步一步回答关于WB小分子蛋白半干转条件的问题。
第一步:准备工作在开始实验之前,您需要准备以下实验材料以及仪器设备:1. 蛋白凝胶:可以是SDS-PAGE凝胶、Native凝胶或者IEF凝胶等。
2. 转膜设备:一般使用膜构(membrane sandwich)装置。
3. 蛋白质转膜膜:可以选择PVDF膜或者NC膜等,根据需要选择合适的膜材。
4. 电源:选择合适电源以供电转印。
5. 混合溶液:制备半干转膜缓冲液。
第二步:制备半干转膜缓冲液半干转膜缓冲液一般由粗转膜缓冲液(Cathode Buffer)和精转膜缓冲液(Anode Buffer)混合而成。
其中,粗转膜缓冲液可视实验室条件选择具体配方,一般包括Tris-HCl缓冲液、甘油(glycerol)和SDS等成分;精转膜缓冲液包括甘油、Tris-HCl缓冲液以及SDS等。
具体的条件可以从文献中找到或者咨询相关实验室的技术人员。
第三步:装置装配1. 在半干转膜装置上安装内外层的导电网(wick)和滤纸等辅助物质。
内层wick(即离孔层)可以是滤纸或者海绵,而外层wick一般是滤纸。
2. 将内外层wick放置在半干转膜装置的相应位置上。
确保内外层wick与电极完全贴合,且相对平整。
3. 在内层wick上还可以放置一块滤纸,以增加液体的吸收能力。
第四步:蛋白转膜条件确定好实验条件后,即可进行蛋白转膜:1. 首先,在浸泡一段时间的转膜膜上进行标记,将蛋白凝胶与转膜膜定位对齐。
2. 将架于内阴极涂抹有粗转膜缓冲液的内层wick上,确保内外层wick贴合时形成一个平滑的表面。
小分子蛋白转膜条件

小分子蛋白转膜条件小分子蛋白转膜(small molecule protein transduction)是指通过低分子量化合物作为载体,将蛋白质转移到细胞内部的一种技术。
这种技术可以实现细胞内外蛋白质信息的转移,为生命科学研究提供了一种有力的手段。
本文将介绍小分子蛋白转膜技术的十分约定的条件,以及该技术的适用范围和局限性。
1. 载体选择条件(1)能够对于不同类型的蛋白质具有较好的转移效果,且不影响生物的正常功能。
(2)具有较好的穿膜性,能够有效地穿透细胞膜。
(3)具有稳定的药物性质,以保证能够在各种条件下保持有效的活性。
2. 蛋白质的选择条件(1)蛋白质的结构和功能应当被充分了解,并且能够被有效地表达和制备。
(2)蛋白质的大小、电荷、溶解性等物理化学特性应当符合载体的要求。
(3)蛋白质应当具有足够的亲和性或选择性,以保证在细胞内部能够被目标分子所识别。
3. 转膜条件小分子蛋白转膜的转膜条件应当满足以下条件:(1)适宜的浓度:小分子蛋白转膜的浓度应当符合最佳转移效果,一般为5~10μM。
(2)适宜的时间:小分子蛋白转膜的时间应当考虑到蛋白质的转移速度和活性变化。
一般在10~60min之间。
(3)适宜的温度和pH值:小分子蛋白转膜的转膜条件应当考虑到载体的稳定性和反应速率,多数情况下,25~37℃,7.2~7.5的pH值最适宜。
二、小分子蛋白转膜的适用范围和局限性小分子蛋白转膜技术不仅可以用于细胞生物学、分子生物学、病理学等领域的研究,还可以应用于生物医学以及药物研发等领域,如:1. 配合小分子蛋白转膜技术,可以将蛋白质引入细胞内部,分析和研究蛋白质的作用机制和生理功能。
然而,小分子蛋白转膜技术也存在局限性:1. 转膜效率低:小分子蛋白转膜技术在不同细胞和载体的情况下,转膜效率各异,转膜效率较低,约为10%~30%。
2. 免疫原性:蛋白质通过小分子蛋白转膜的方式进入细胞内部,会激发人体免疫反应,进而影响转膜效果和治疗安全性。
western 转膜及常见问题汇总
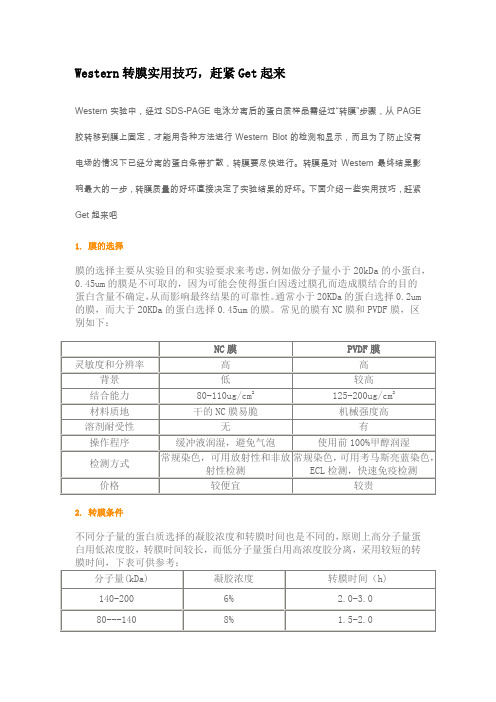
Western转膜实用技巧,赶紧Get起来Western实验中,经过SDS-PAGE电泳分离后的蛋白质样品需经过“转膜”步骤,从PAGE 胶转移到膜上固定,才能用各种方法进行Western Blot的检测和显示,而且为了防止没有电场的情况下已经分离的蛋白条带扩散,转膜要尽快进行。
转膜是对Western最终结果影响最大的一步,转膜质量的好坏直接决定了实验结果的好坏。
下面介绍一些实用技巧,赶紧Get起来吧1. 膜的选择膜的选择主要从实验目的和实验要求来考虑,例如做分子量小于20kDa的小蛋白,0.45um的膜是不可取的,因为可能会使得蛋白因透过膜孔而造成膜结合的目的蛋白含量不确定,从而影响最终结果的可靠性。
通常小于20KDa的蛋白选择0.2um 的膜,而大于20KDa的蛋白选择0.45um的膜。
常见的膜有NC膜和PVDF膜,区别如下:2. 转膜条件不同分子量的蛋白质选择的凝胶浓度和转膜时间也是不同的,原则上高分子量蛋白用低浓度胶,转膜时间较长,而低分子量蛋白用高浓度胶分离,采用较短的转3. 转膜操作注意事项(1)避免直接接触膜,全程戴手套并使用镊子,手指上的油脂与蛋白会封闭转膜效率并易产生背景污斑;(2) PVDF膜具有疏水性,使用之前需用甲醇浸泡;(3)排列三明治时,尽量用干净的玻璃棒或试管赶走胶和膜之间的气泡,避免转膜不均匀;(4)确认裁剪的膜和滤纸与凝胶尺寸相同,否则会导致电流不能通过膜,从而转膜无效;(5)鸡来源的抗体与PVDF和尼龙膜有较强的结合能力,从而产生较高背景,故如果选择鸡来源的抗体,最好使用**纤维素膜(NC膜)4. 转膜后丽春红染色为检测转膜是否成功,可以用丽春红进行染色,将膜放入TBST洗一次,然后置于丽春红染色工作液中,室温下摇动染色5分钟,大量的水洗膜,直至水变清无色,蛋白条带清晰。
Western Blot 常见问题汇总分析。
小分子 蛋白wb注意事项

小分子蛋白wb注意事项以小分子蛋白WB注意事项为标题,我们来讨论一下在进行小分子蛋白Western Blot(简称WB)实验时需要注意的事项。
一、实验前的准备工作在进行小分子蛋白WB实验之前,我们需要做一些准备工作,以确保实验的顺利进行。
首先,我们需要准备好实验所需的试剂和仪器设备。
这包括蛋白提取液、蛋白浓度检测试剂盒、凝胶电泳设备、转移膜等。
同时,我们还需要准备好实验所需的动物组织样本或细胞培养物。
二、蛋白提取与浓度检测在进行小分子蛋白WB实验之前,我们需要从组织样本或细胞中提取蛋白。
蛋白提取的方法有多种,如RIPA缓冲液法、细胞裂解液法等。
提取蛋白后,我们需要使用蛋白浓度检测试剂盒来确定蛋白的浓度,以便后续的凝胶电泳和转膜步骤。
三、凝胶电泳凝胶电泳是分离蛋白的常用方法,可以根据蛋白的大小和电荷来进行分离。
在进行凝胶电泳时,我们需要根据实验的需要选择合适的凝胶类型和浓度。
同时,我们还需要准备好电泳缓冲液,并根据实验的需求进行电泳条件的设置。
四、转膜转膜是将凝胶中分离的蛋白转移到转移膜上的过程。
在进行转膜之前,我们需要准备好转膜装置,并将其装配好。
在进行转膜时,我们需要注意转膜膜的选择,如聚丙烯酰胺膜(PVDF)或硝酸纤维素膜(NC)。
转膜的条件也需要根据实验的需求进行设置。
五、免疫检测在进行小分子蛋白WB实验时,我们通常会使用特异性抗体来检测目标蛋白。
在进行免疫检测之前,我们需要对抗体进行充分的验证,确保其具有良好的特异性和敏感性。
在进行免疫检测时,我们需要根据实验的需求进行合适的抗体稀释,并按照标准的免疫检测步骤进行操作。
六、结果分析在完成小分子蛋白WB实验后,我们需要对实验结果进行分析。
这包括对目标蛋白的表达水平进行定量分析,并与对照组进行比较。
同时,我们还可以进行进一步的数据统计和图像处理,以获得更准确的实验结果。
进行小分子蛋白WB实验时需要注意的事项包括实验前的准备工作、蛋白提取与浓度检测、凝胶电泳、转膜、免疫检测以及结果分析。
wb转膜条件公式

wb转膜条件公式摘要:一、前言二、WB 转膜条件的公式介绍1.WB 转膜条件公式背景2.公式内容3.公式意义三、WB 转膜条件公式的应用1.在实验中的应用2.在科研中的作用四、结论正文:一、前言WB(Western Blot,免疫印迹法)是一种在分子生物学中广泛应用的技术,用于检测蛋白质的表达和纯化。
在实验过程中,掌握合适的转膜条件至关重要。
WB 转膜条件公式作为一种理论依据,对实验结果有着直接影响。
本文将详细介绍WB 转膜条件公式及其应用。
二、WB 转膜条件公式介绍1.WB 转膜条件公式背景WB 转膜条件公式是基于膜的电阻抗、蛋白质的分子量和电荷等因素推导出来的。
这个公式可以帮助我们预测蛋白质在电场作用下通过聚丙烯酰胺凝胶的速率,从而为实验提供指导。
2.公式内容WB 转膜条件公式如下:R = (M * Q) / (2 * V * L)其中,R 代表电阻抗,M 代表蛋白质的分子量,Q 代表蛋白质的电荷,V 代表凝胶的电压,L 代表凝胶的厚度。
3.公式意义通过这个公式,我们可以了解到在特定条件下,不同分子量的蛋白质在电场中的迁移速率。
实验过程中,可以通过调整电压、凝胶厚度等条件,优化转膜效果。
三、WB 转膜条件公式的应用1.在实验中的应用在WB 实验过程中,转膜条件对实验结果至关重要。
通过WB 转膜条件公式,可以预测不同条件下的蛋白质迁移情况,从而选择合适的实验条件。
此外,公式还可以帮助我们分析实验结果,找出可能存在的问题。
2.在科研中的作用WB 转膜条件公式在科研中也有重要作用。
通过对公式的研究,可以加深对蛋白质转膜机制的理解,为进一步优化实验条件提供理论依据。
四、结论WB 转膜条件公式是分子生物学实验中一个重要的理论工具,能够帮助我们预测和优化实验条件。
wb转膜条件公式

wb转膜条件公式摘要:一、前言二、WB转膜条件的公式介绍1.WB转膜条件的含义2.公式推导过程3.公式中各参数的意义三、WB转膜条件公式的应用1.预测蛋白质分子量2.分析蛋白质翻译后修饰3.在实验设计中的应用四、WB转膜条件公式的局限性1.蛋白质结构的复杂性2.实际操作中可能存在的误差五、结论正文:一、前言Western Blot(WB)技术是生物化学和分子生物学中常用的一种实验方法,用于检测蛋白质的表达和翻译后修饰。
在WB实验中,转膜条件对实验结果具有重要影响。
本文将介绍一种WB转膜条件公式,帮助理解和优化实验条件。
二、WB转膜条件公式介绍1.WB转膜条件的含义WB转膜条件是指在实验过程中,蛋白质从凝胶电泳系统转移到固相支持物(例如聚偏氟乙烯膜)的条件。
这些条件包括电流、电压、时间等参数。
2.公式推导过程WB转膜条件公式是基于电流、电压和时间的关系推导出来的。
在实际操作中,通过改变电流、电压或时间来优化实验条件。
3.公式中各参数的意义公式中的参数包括电流(I)、电压(V)和时间(t)。
电流表示通过凝胶的电流强度,单位为安培(A);电压表示凝胶和固相支持物之间的电势差,单位为伏特(V);时间表示转膜过程所需的时间,单位为秒(s)。
三、WB转膜条件公式的应用1.预测蛋白质分子量通过WB转膜条件公式,可以预测蛋白质在转膜过程中的迁移率,从而预测其分子量。
这对于蛋白质的分离和鉴定具有重要意义。
2.分析蛋白质翻译后修饰WB转膜条件公式可以帮助研究者分析蛋白质翻译后修饰(如磷酸化、糖基化等)对其迁移率的影响。
这有助于深入了解蛋白质的功能和调控机制。
3.在实验设计中的应用在WB实验设计中,可以通过调整电流、电压和时间等参数来优化实验条件,从而获得更可靠的实验结果。
四、WB转膜条件公式的局限性1.蛋白质结构的复杂性WB转膜条件公式基于蛋白质的电荷和分子量进行预测,但忽略了蛋白质结构的复杂性。
因此,在实际应用中可能存在一定的误差。
小分子蛋白western注意事项及操作技巧

摘自丁香园:跟大家分享一下小分子蛋白的western-blot相关注意事项以及操作技巧:我搞得蛋白质是一个11KD的分泌性蛋白,并且是我实验设计中一个重要的指标,最初学习WB技术,受困于二抗不合格一直连内参都做不出来。
后面改换抗体之后,才相对顺利一点,其他指标也相继出来了。
所以抗体真的很重要。
但是在做WB实验的7、8个月过程中,我的核心的一个蛋白一直处于混沌状态,可能跑30次能现身一次,现身之后又没影好几个月,就这样捉摸不定,搞得我很烦,但又无可奈何。
询问了实验室的同学们,说法各一:1、有人说小分子量蛋白就是难跑,为什么难大家也说不清楚。
2、有的说分泌性蛋白本身胞内含量少,不好跑,需要加大上样量,似乎也是实话。
3、还有的说小分子量蛋白容易降解,你的蛋白质降解了吧,我姑且信了。
但是95%的时候我跑出的条带都是大白板,纵然我通过PCR、细胞的免疫荧光都能够发现这个蛋白,但是就是WB做不出来,4、也有朋友告诉我说分泌型蛋白你还是做ELISA吧,可是一来这个蛋白的ELISA试剂盒好贵的,二来我就是想做WB。
所以就开始了上下求索之路。
95%的时间跑出来的条带是这样的。
这一求索就是几个月的时间。
期间一直觉得电泳没什么技术含量,电转的过程才是重点,于是纠结于电转条件;也纠结过电转液的配置等。
就在最近,再次翻阅论坛里面大神的回帖,其中一个大神提到:小分子量蛋白容易在电泳过程中弥散,电泳在压缩胶里多压一会,在分离胶里面跑一半就好了。
对这个话百思不得其解,于是开始查询一些实验技术方面的文献,其中有几篇文献对我很有启发,其中有些技术原理方面的内容如下:在含SDS缓冲液的样品中,小分子多肽的浓缩是较困难的,因为小分子多肽与SDS形成的复合体具有与SDS本身类似的电荷和大小,所以偏离了相对迁移率和分子质量对数的相互关系,因此浓缩对于小分子多肽的SDS-PAGE来说就成了一个突出问题。
于是回去翻了翻自己曾经偶然跑出来的条带的模样,给我的感觉就是压缩的不好,然后还有弥散的现象(就是那种蛋白晕开的模样,例如这条带下面的波浪边缘,当然也可能是胶不均匀的原因吧,反正我当时就觉得是弥散的现象)然后我就突然有种恍然大悟的感觉,也许说的不对,但是我个人的感觉是:一般较大的分子量的蛋白(如20-70KD)与上样缓冲液中的SDS结合后,因为本身蛋白分子大,SDS附着在上面之后,还是和胶里面的SDS成分有较大差异的,那么在一定电流方向的作用下,就能够顺着电流方向向下电泳;而小分子蛋白被SDS包裹结合形成复合物后,因为蛋白分子小,包裹上SDS后就和胶里面本身的SDS差别没那么大了,那么此时就算有电流作用,它也不会那么听话的顺流而下,毕竟和周遭的胶里面的SDS区别不大,在电泳向下走的过程中,可能向其他方向混乱的运动,走着走着就晕染开了,就像墨点到宣纸上一样。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小蛋白转膜条件
小蛋白转膜的条件因人而异,根据实验目的和具体情况进行选择。
以下是一般适用的小蛋白转膜条件:
1. 选择适当的转膜膜:一般建议选择0.2~0.45μm的转膜膜。
如果分子量较小,建议选择0.1μm以下的转膜膜。
2. 准备完整的转膜缓冲液:建议选择十分精细的Buffer ,可能包括含10%~20%甘油并pH7.5以下。
3. 选择适当的电泳系统:建议选择适合转膜的小槽,如半干胶体系。
4. 转膜电流和时间:可以根据膜孔大小、转膜膜的厚度和样品量来调整电流和时间。
通常建议使用0.2A,300mA ~400V,常规时长为1小时 ~ 2小时。
5. 组织样品:对于含有丰富脂肪酸和粘液的组织样品,建议使用甲醇或异丙醇提取方法,以减小转膜条件下的组织破裂和蛋白质过氧化等损伤。
