离子键价键理论
《无机化学》第7章.化学键理论与分子结构

(2)方向性
①根据原子轨道最大重叠原理,形成共价键时,原 子间总是尽可能沿着原子轨道最大重叠的方向成 键,原子轨道重叠越多,两核间电子概率密度越 大,形成的键越牢固。
②在形成共价键时,除s轨道能在任何方向最大重叠 外,其它p、d、f 轨道只能沿一定方向才能最大重 叠成键。所以,当一个 A原子与其它一个或几个 B 原子形成共价分子时,B原子在A原子周围的成键 方位是一定的,这就是共价键的方向性。
激发
2p
2s
(激发态)
杂 化
p (杂化态)
sp2
3个sp2杂化轨道
杂化轨道理论
+
σ 2 sp -p
F
F
σ 2 sp -p
+
- + - +
B
F
120° F
-
F +
B
+F
-
平面三角形
图9-8 sp2杂化轨道的空间取向和BF3分子构型
sp2杂化
BF3分子形成时中心B原子的轨道杂化情况 和分子的空间构型。
对于同核双原子分子和多原子分子,如 H2 , O2,P4,S8等,由于成键原子的电负性相同, 共用电子对不发生偏移,核间的电子云密集区 域在两核的中间位置,两原子核正电荷所形成 的正电荷重心和成键电子对的负电荷重心恰好 重合,这种键叫非极性共价键。
极性共价键
NH3 等,成键原子的电负性不同,共用电子对 发生偏移,核间的电子云密集区域偏向电负性 较大的原子一端,使之带部分负电荷,电负性 较小的原子一端则带部分正电荷,键的正负电 荷重心不重合,这种键叫极性共价键。
BF3分子的空间构型
(3) sp3杂化: 杂化轨道间夹角109.5 º ,正四面体结构。
无机化学7.3化学键理论
n
价轨道数
最大成键数
2
4(2s,2px,2py,2pz)
4
3 9 (3s,3px,3py,3pz,3dz2,3dx2-y2,3dxy,3dxz,3dyz) 6
(2) 方向性
除s 轨道(角度部分为球形)外,p 、 d、f 原子轨 道在空间只有沿着一定的方向与别的原子轨道重叠, 才会产生“最大重叠”;两轨道重叠面积↑,电子在两 核间出现的几率密度↑,共价键强度↑。
键级=
成键分子轨道电子数
反键分子轨道电子数
2
20 2
1
(相当于共价单键)
2键. 级H2=+(1 氢2 0分子0.离5单子电)子键(HV2B[(无1S此)1说] 法)
3.He2 He 2 [( 1S )2 (1*S )2 ]
键级= 2 2 0 (不成键) 2
不能稳定存在
4. He2+
He2
(
1S
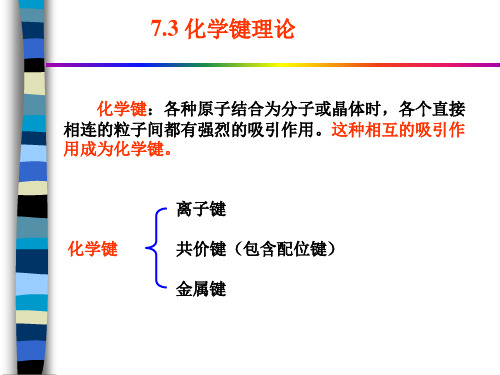
7.3 化学键理论
化学键:各种原子结合为分子或晶体时,各个直接 相连的粒子间都有强烈的吸引作用。这种相互的吸引作 用成为化学键。
化学键
离子键 共价键(包含配位键) 金属键
化学键理论
离子键理论: 共价健理论:
金属键理论:
Na+Cl-
, Ca2+O2-
H-H , H-Cl,
NN , H3C-CH3 , H2C=CH2 , HCCH Na, Mg, Al, K, Ca,
O2 , F2 , Ne2 :
E (2p) > E (2p)
第二周期元素分子轨道的形成
Li2 – N2
O2 – Ne2
第二周期同核双原子分子的分子轨道能级
Li2,Be2, B2, C2,N2 分子轨道能级顺序为:
化学键与分子结构(1)

头碰头
p-p
肩并肩
s-s s-p p-p
―头碰头”σ键
p-p
―肩并肩” π 键
共价键的特征
1、具有饱和性
2、具有方向性
共价键的方向性是指一个原子与周围原子形成 共价键有一定的角度。共价键具有方向性的原 因是因为原子轨道(p、d、f)有一定的方向性, 它和相邻原子的轨道重叠成键要满足最大重叠 条件。
心键等。
σ键的特点是重叠的电子在两核连线上,受原子核束 缚力较大,重叠程度也大,比较牢固,σ键绕轴旋转 时,电子云重叠程度不受影响。
π键的特点是重叠的电子云分布在两核连线的两方, 受原子核束缚力小,电子云重叠程要比σ键小得多, 所以π键不如σ键牢固。π键绕键轴(两轴连线)旋转后 会发生破裂。 所以π键电子的能量较高,易活动,其化学性质较σ 键活泼。 一般来说,π健不能独立存在,总是和σ键一起形成 双键或叁键。
二、σ键和π键——价键理论(一)
又称电子配对法:共价键是由不同原子的电子 云重叠形成的,是1927年海特勒(Heitler)和伦 敦(London)用量子力学处理H2问题所得结果的 推广。
两个核外电子自旋方向相反的氢原子靠近
V势能
0
r核间距
r0
v势能
0
r0
r核间距
r0
v势能
0
r0
r核间距
两个核外电子自旋方向相同的氢原子靠近
激发
↑ 2s
↑
↑ 2p
↑
sp3杂化
↑
↑
↑
↑
4个sp3轨道 重叠
↑↓ ↑↓ ↑↓ ↑↓
形成4个(sp3-s) σ键
sp3杂化轨道的形成过程
BF3
化学竞赛-价键理论

价键理论强调了电子在形成化学 键中的重要作用,并解释了分子 中的键合类型、键合强度和分子 几何结构等方面的信息。
价键理论的发展历程
19世纪初,价键理论的基本概念开始萌芽,当时科学 家们开始认识到电子在化学键中的作用。
20世纪初,价键理论得到了进一步的发展和完善,其 中最为著名的科学家是英国化学家莫里斯·威廉·皮尔兹
洪特规则
洪特规则是描述电子排布和化学键形成的规则之一,它指 出在相同能级的不同轨道中,电子优先以自旋方向相同的 方式占据轨道。
在形成化学键时,洪特规则可以预测电子在轨道中的排布 方式,从而影响化学键的类型和稳定性。
洪特规则可以解释许多化合物的电子构型和几何构型,是 理解和预测化学反应的重要工具。
03 价键理论的实际应用
分子的几何构型
分子构型的确定
价键理论不仅解释了共价键的形成,还为确定分子几何构型提供了理论基础。根 据电子对的排斥作用和最小化能量原则,可以预测分子的几何构型。
分子构型的稳定性
分子的几何构型不仅决定了分子的物理和化学性质,还影响了分子的稳定性。根 据价键理论,电子对的最大重叠和最小排斥原则有助于理解分子构型的稳定性。
以及金属与配体的相互作用。
无机化学
价键理论可以用来描述无机化合物的分子 结构和性质,如氢化物、氧化物和含金属 的化合物等。
生物化学
虽然价键理论在生物化学中的应用相对较 少,但它仍然可以用来描述某些生物分子 的结构和性质,如蛋白质和核酸等。
02 价键理论的基本原理
电子配对原理
01
电子配对原理是价键理论的核心,它指出原子在形成化学键时, 倾向于将未成对的电子配对成键,以使系统能量最低。
共价键的形成与断裂
共价键的形成
第七章 化学键理论概述

3
BF CH BeCl 3 4 2 实例 HgCl2 BCl3 SiCl4 Be(ⅡA) B(ⅢA) C,Si 中心原子 Hg(ⅡB) (ⅣA)
PH3 N,P
(ⅤA)
NH 3
H2O H2S O,S
(ⅥA)
(5)sp3d2杂化
定义:同一原子内,由1个ns轨道与3个np轨道、 2个nd轨道间发生的杂化叫sp3d2杂化。杂化后形成 的6个新轨道叫sp3d2杂化轨道。 特点:每个sp3d2杂化轨道中含有1/6s成分和 3/6的p成分、2/6的d成分。
2.杂化轨道类型与分子的空间构型 ①sp杂化
由1个ns轨道和1个np轨道进行杂化,组成2个等同的sp杂化轨道。
每个sp杂化轨道中含1/2 s成分和1/2 p的成分。 两个sp杂化轨道之间夹角为180°,分子空间构型为直线型。
BeCl2分子形成过程
②sp2杂化
1个ns轨道和2个np轨道经杂化组成3个等同的sp2杂化轨道。
第七章
分子结构
离子键理论 化学键理论 共价键理论 金属键理论
§7 - 1 离子键理论
一、离子键的特点 1. 离子键的本质是库仑静电作用力 + f ∝ q q /r
q+、q-为离子所带电荷, R为离子间距离。
离子键强度是用晶格能来描述的。
2.离子键的特点:
既无方向性,也无饱和性。 离子化合物是由正负离子通过离子键相互交替连 结而成的晶体结构。
Na(s) + 1/2F2(g) S Na(g) I 1/2D F(g) A
ΔH
NaF(s)
U
Na+(g)
+ F-(g)
式中 S为 Na 的升华热 (108.8 kJ· mol - 1) , I 为 Na 的电离势( 495.8 kJ· mol - 1) , D 为 F 的 键 能 (141.8 kJ· mol - 1 ) , A 为 F 的 电 子 亲 合 势 (-328.0 2 kJ· mol-1),ΔH为NaF的生成焓(-573.65 kJ· mol-1),U为NaF的晶格能。
化学键:

共轭效应
共轭效应:
形成离域π 键的分子,其物理和化学性质会产生某些特殊的变化,称为 共轭效应或离域效应。 ★影响分子的性质: •电性:离域π 键的形成增加物质的电导性能; •颜色:离域π 键的形成,增大π 电子的活动范围,使体系能量降低,能 级间隔变小,其光谱由σ 键的紫外光区移至离域π 键的可见光区。
2s
激发
2p
2s
3
sp 杂化
sp3
形成四个sp3杂化轨道。杂化后轨道伸 展方向,形状发生改变。
2.sp2杂化
F
BF3的空间构型 为平面三角形
B
F
F
2p
B: 2s22p1
2s
2p
2s
激发
2p
2s
sp2
sp2杂化
三个sp2杂化轨道
3.sp杂化 Be:2s2
2s
2p
BH2的空间构型为直线形 H Be H
BF3
CH 4
四面体
三角双锥 八面体
PCl5
SF 6
②LP≠0 :分子的空间构型不同于电子对的 VP=3原应是三角形,而一个顶点是 空间构型。 孤对电子,而不是原子,所以只有 VP LP 3
电子对的 空间构型
“三角形”的中心和两个顶多,成了 分子的 V型
空间构型
例
1 1
2
平面三角形 四面体 四面体 八面体
§2.3价键理论(二)杂化轨道
基本要点: •成键时能级相近的价电子轨道混合杂 化,形成新的价电子轨道——杂化轨道。 •杂化前后轨道数目不变。 •杂化后轨道伸展方向,形状发生改变。
1.sp3杂化
C如何与4个氢形成化 学键?
CH4的空间构型 为正四面体
第二章 价键理论、晶体场理论
第二章配合物的化学键理论内容:研究中心原子和配体之间结合力的本性。
目标:解释性质,如配位数、几何结构、磁学性质、光谱、热力学稳定性、动力学反应性等。
三种理论:①价键理论、②晶体场理论、③分子轨道理论第一节价键理论(Valence bond theory)由L.Pauling提出一、理论要点:①配体的孤对电子可以进入中心原子的空轨道;中心原子总是用空轨道杂化,然后用杂化轨道接收配体提供的孤对电子。
②中心原子用于成键的轨道是杂化轨道(用于说明构型)。
中心原子的价层电子结构与配体的种类和数目共同决定杂化类型。
③杂化类型决定配合物的空间构型,磁距和相对稳定性。
二、轨道杂化及对配合物构型的解释能量相差不大的原子轨道可通过线性组合构成相同数目的杂化轨道。
对构型的解释(依据电子云最大重叠原理:杂化轨道极大值应指向配体)指向实例sp3、sd3杂化四面体顶点Ni(CO)4sp2、sd2、dp2、d3杂化三角形顶点[AgCl3]2-dsp2、d2p2 杂化正方形顶点[PtCl4]2-d2sp3杂化八面体顶点[ Fe(CN)6]4-sp杂化直线型[AgCl2]-三、内轨型和外轨型若要形成ML6型配合物(L为单齿配体),则需要6个空杂化轨道接收6个L提供的孤电子对,满足该条件的杂化类型有d2sp3和sp3 d2。
尽管这两种杂化都导致八面体型配合物,但前者是次外层(n-1)d轨道,而后者是最外层nd轨道,因此与这两种杂化相应的配合物分别称内轨型和外轨型配合物。
中心原子的价层电子数和配体的性质都是影响配合物内轨型和外轨型的因素。
当d电子数≤3时,该层空d轨道≥2,总是生成内轨型配合物。
当中心原子价层d电子数为7~10时,即使强制d轨道中的电子配对,所能得到的该层空d轨道数也小于2,因此只能用最外层d轨道参与杂化,总是生成外轨型配合物。
当中心原子价层d电子数为4~6时,对于配位能力较强的配体,即配位原子电负性较小,容易给出孤电子对,对中心原子价层d电子排布影响较大,强制d电子配对,空出2个价层d轨道参与d2sp3杂化,生成内轨型配合物.若配体的配位能力较弱,即配位原子电负性较大,则不易给出孤电子对,对中心原子价层d电子排布影响较小,只能用最外层d轨道参与杂化,生成外轨型配合物。
1.离子键与价键理论 (1)
3、按共用电子对提供的方式分为: 普通共价键:成键原子双方各提供一个电子 配位键:共用电子对由一方单独提供
H
NH : [ H N H ]
H
4
+
形成条件:一方具有孤电子对, 另一方具有空轨道。
上页 下页 目录 返回
价键理论的优势与局限性
把共价键的本质由共用电子对上升到AO重叠
成功地解释共价键的饱合性和方向性
轨道对称轴方向进行重叠,只有这样才能
实现最大限度的重叠,形成的共价键才最 为牢固. 最大重叠原则
上页 下页 目录 返回
(二)共价键的特点
1、有饱和性 决定着共价化合物具有一定的组成。
2、有方向性 决定着共价化合物键与键间有一定夹角。 (三)共价键的类型 1、按共价键是否有极性分为:
极性共价键 强极性键:HCl、H2O 弱极性键:H2S、HI
θ 2, N H
398KJ mol
1
θ 1 NH(g) N(g) H(g) D3, 339KJ mol N H 1 θ θ θ θ 1 E N H (D1, N H D2, N H D3, N H ) 391KJ mol 3
上页 下页 目录 返回
HCl(g) →H(g) + Cl(g) E D 431KJ mol
θ θ
1
多原子分子:若有多个相同的键 ,则该键键 能为同种键逐级解离能的平均值。
θ 1 NH3 (g) NH2 (g) H(g) D1, 435KJ mol N H
NH2 (g) NH(g) H(g) D
分子间的作用力主要有范德华引力、氢键、超分子作用力等。
O2
H2SO4
SO42-
化学键知识点归纳总结
化学键知识点归纳总结一、化学键的基本概念1.1 化学键的定义化学键是原子或离子之间通过电子的相互作用形成的强烈吸引力,它将原子或离子结合成分子或晶体。
化学键的存在是物质稳定性的基础。
1.2 化学键的分类化学键主要分为以下几类:离子键:由正负离子之间的静电吸引力形成。
共价键:由原子间共享电子对形成。
金属键:金属原子之间的自由电子形成的键。
分子间作用力:包括范德华力和氢键,虽然不属于传统意义上的化学键,但对分子间相互作用有重要影响。
二、离子键2.1 离子键的形成离子键通常形成于金属和非金属之间。
金属原子失去电子形成阳离子,非金属原子获得电子形成阴离子,阳离子和阴离子通过静电吸引力结合在一起。
2.2 离子键的特点高熔点和沸点:由于离子键的强度较大,离子化合物通常具有高熔点和沸点。
导电性:在熔融状态或水溶液中,离子可以自由移动,因此离子化合物具有导电性。
易溶于水:许多离子化合物易溶于水,因为水分子可以有效地分离和稳定离子。
2.3 离子键的实例NaCl(氯化钠):钠失去一个电子形成Na⁺,氯获得一个电子形成Cl⁻,两者通过离子键结合。
CaCO₃(碳酸钙):钙失去两个电子形成Ca²⁺,碳酸根离子(CO₃²⁻)通过离子键与钙离子结合。
三、共价键3.1 共价键的形成共价键通常形成于非金属原子之间,通过共享电子对来实现电子的稳定配置。
3.2 共价键的类型单键:共享一对电子,如H₂(氢气)。
双键:共享两对电子,如O₂(氧气)。
三键:共享三对电子,如N₂(氮气)。
3.3 共价键的特点方向性:共价键具有明确的方向性,决定了分子的几何结构。
饱和性:每个原子能形成的共价键数量有限,取决于其未成对电子的数量。
极性:根据共享电子对的偏移情况,共价键可分为极性共价键和非极性共价键。
3.4 共价键的实例H₂O(水):氧原子与两个氢原子通过极性共价键结合。
CO₂(二氧化碳):碳原子与两个氧原子通过双键结合,形成线性分子。
化学键理论
化学键理论简介化学键是指将两个或多个原子结合在一起的力,是构成分子和化合物的基本单位。
化学键理论旨在解释化学键形成的原因以及化学键的类型和性质。
本文将介绍几个常见的化学键理论。
1. 价键理论价键理论也称为路易斯理论,是由美国化学家吉尔伯特·路易斯于1916年提出的。
根据这个理论,化学键形成是由于原子之间的电子共享或电子转移。
在化学键中,原子通过共享或转移电子以实现稳定状态。
共价键的形成是通过电子共享形成的,而离子键的形成是通过电子转移形成的。
2. 电子云理论电子云理论也称为量子力学理论,是由奥地利物理学家艾尔温·薛定谔等人在20世纪初提出的。
根据这个理论,电子不能被简单地看作是粒子,而是存在于原子周围的一种云状结构,称为电子云。
在化学键中,电子云之间的重叠是化学键的形成基础。
共价键形成是由于两个原子的电子云的重叠,而离子键形成是由于正负电荷之间的吸引力。
3. 分子轨道理论分子轨道理论是由德国化学家恩斯特·赫尔曼·福克和罗伯特·桥·休伊特于20世纪初提出的。
根据这个理论,分子中的电子不再局限于原子轨道,而是存在于整个分子的分子轨道中。
分子轨道可以是成键轨道(高能级)或反键轨道(低能级)。
共价键的形成是通过成键轨道的重叠,而离子键的形成是通过成键轨道和反键轨道之间的重叠。
4. 杂化轨道理论杂化轨道理论是由美国化学家林纳斯·鲍林在20世纪初提出的。
根据这个理论,原子轨道在形成化学键时会重新组合成一组新的杂化轨道。
杂化轨道具有介于原子轨道之间的性质,可以更好地解释一些分子的形状和键角。
杂化轨道的形成是为了最大限度地重叠,以实现更强的化学键。
5. 价电子对斥力理论价电子对斥力理论也称为VSEPR理论,是由英国化学家罗纳德·吉尔斯彭尼克在1940年代提出的。
根据这个理论,化学键的形成是为了最小化价电子对之间的斥力。
分子的几何形状取决于周围的原子和非键电子对的排列方式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
no =8+8+2×8=32
nv=4+6+2×7=24
ns = no - nv=32-24=8
成鍵数=8/2=4
nl = nv – ns=24-8=16
孤电子对数=16/2=8
画出结பைடு நூலகம்式:
Cl CO
Cl
离子键价键理论
画出CO32-的路易斯结构式
no =8+3×8=32
nv=4+3×6+2=24
ns = no - nv=32-24=8
离子键价键理论
•离子半径:离子晶体中,正负离子之间吸引和排斥保持 平衡时的距离为正负离子半径之和
A.同主族比较 B.电子层结构相同的离子比较 •离子键强弱判断:
A.NaCl NaBr NaI 8010 C 、7470 C、6600 C B. NaCl MgCl2 AlCl3 熔点比较
8010 C、7140 C、1940 C
NaCl晶体,其化学式仅表示Na离子与Cl离子的 离子数目之比为1∶1,并不是其分子式,整个 NaCl晶体就是一个大分子。
离子键价键理论
NaCl的晶胞结构
离子键价键理论
3.键的离子性与元素的电负性有关 用两元素的电负性差 x判断键的性质
离子键的形成:与元素的电负性差有关。实验表明, 即使是电负性差值最大的氟与铯形成化合物,离子 性也只有92%,仍有8%的共价性。当两个原子的电 负性差为1.7时,单间具50%的离子性,这是参考数 据。如果两个原子的电负性大于1.7。可判断它们之 间形成了离子键,是离子化合物,两个原子的电负 性小于1.7,可判断它们形成共价键,形成共价化合 物。 形成条件:两原子的电负性差值较大,电负性差值>1.7, 离子性大于50%,形成离子键。
离子键价键理论
离子键的要点
1.离子键的本质就是正、负离子间的静电作用。 2.既无方向性, 也无饱和性 由于离子键是正负离子通过静电引力作用相连
接的,从而决定了离子键的特点是既无方向 性, 也无饱和性。正负离子近似看作点电
荷,所以其作用不存在方向问题。没有饱和性 是指在空间条件许可的情况下,每个离子可吸
◢
离子键价键理论
● 路易斯价鍵理论的缺陷: 路易斯结构式可表示分子中的成鍵情况,但: 不能说明分子的空间几何构型; 八隅规则例外较多; 无法解释共价鍵的方向性; 无法解释单电子、叁电子鍵等。
的趋势(8电子稳定构型,又称八隅律) ,求得本 身的稳定。 而达到这种结构,可以不通过电子转 移形成离子和离子键来完成,而是通过共用电子对 来实现。
例如 • H + •H = H ••H
H2O
HOH H + Cl
H
离子键价键理论
NH3 Cl
HNH H
Lewis
1875年10月25日路易斯出生于美 国麻萨诸塞州的西牛顿市。他 从小聪明过人,在三岁时,父 母就开始在家里让他接受教育。 1893年进入著名的哈佛大学学 习,1896年获理学士学位,以 后在T.W.理查兹指导下继 续研究化学,于1899年24岁时 获哲学博士学位。
离子键价键理论
●路易斯结构式的写法: ① 画出分子或离子的骨架结构 (选择合理的、与实验事实相符的,一般氢原子、卤原子
在末端) 在每两个成鍵原子之间画上短线(其数目等于成鍵数)
② 计算成鍵数:成鍵数为成鍵电子数ns的1/2
ns = no - nv
no:各原子按相应周期稀有气体结构计算的最外层电子数之和
成鍵数 = ns/2 = 3 未参与成鍵的电子数 nl = nv – ns = 10-6 = 4 孤电子对数= 4/2 = 2
画出结构式:
CO
C原子应有5个价电子,比实际有的4个价电子多1个, 形式电荷为-1;
O原子应有5个价电子,比实际有的6个价电子少1个, 形式电荷为+1
离子键价键理论
●多电子结构:
nv :各原子的价电子数之和 ③ 计算孤对电子数:孤电子对数为未参与成鍵电子数(nl )
的1/2
nl = nv – ns
④ 将孤对电子分配到各原子,使其周围电子数达到8个
(H为2),不足时,可画成重鍵 (短线数目应等于成鍵数)
画出H2O、CO2的路易斯结构式
离子键价键理论
[例]COCl2(光气)的路易斯结构式
物质结构
离子键价键理论
原子结构
离子键
价键理论(电子配 对法VB)
物质结构 分子结构和
化学键
共价键理 论
杂化轨道理论
价层电子对互斥 理论(VSEPR)
晶体结构
金属键
分子轨道理论
离子键价键理论
第四章 化学键与分子结构
一.离子鍵理论 二.共价鍵理论
(1) 路易斯价鍵理论 (2) 电子配对法 (3) 杂化轨道理论 (4) 价层电子对互斥理论 三.金属鍵理论 四.分子间作用力和氢键
离子键价键理论
晶格能(U)
离子键的强度常用晶格能表示。 1mol气体阳离子和气态阴离子结合生成1mol固 态离子化合物所放出的能量称为晶格能
离子电荷越大,离子半径越小,则晶格能越大, 离子键越强,离子化合物的熔沸点、硬度越高
离子键价键理论
二.共价鍵理论
1 路易斯结构式( Lewis) 认为分子中的原子都有形成稀有气体电子结构
为达到稳定结构,成鍵原子价电子数比八隅体多
如:POCl3的稳定结构中,P原子周围有10个价电子, 多于8
● 缺电子结构:
为达到稳定结构,成鍵原子价电子数比八隅体少
如:BF3的稳定结构中,B原子周围只有6个价电子,
少于8
Cl
F
Cl P O
FBF
Cl
离子键价键理论
练习: 画NO2-、 NO2+路易斯结构式:
离子键价键理论
一、离子键理论
离子键(ionic bond)理论是1916年德国化 学家柯塞尔(W.Kossel)提出的,他认为原 子在反应中失去或得到电子以达到稀有 气体的稳定结构,由此形成的正离子 (positive ion)和负离子(negative ion)以静 电引力相互吸引在一起。
离子键的形成:与元素的电负性差有关。
成鍵数=8/2=4
nl = nv – ns=24-8=16
孤电子对数=16/2=8
画出结构式:
离子键价键理论
●形式电荷:原子满足八隅体时多余或缺少的电子数 QF = nv – ns– nl
形式电荷为0时最稳定 相邻原子的形式电荷为同号时,最不稳定 书写时形式电荷应尽可能地小
离子键价键理论
[例]写出CO的路易斯结构式,并标出形式电荷。 解: no= 8 + 8 =16; nv = 4 + 6 = 10 ns = no - nv = 16-10 = 6
