亚硝酸钠滴定法
亚硝酸钠标准溶液的配制与标定

亚硝酸钠标准溶液的配制与标定一、实验目的(1)掌握重氮化滴定的原理和滴定条件。
(2)熟悉永停滴定法的装置和实验操作。
二、实验原理永停滴定法属于电流滴定法。
它是用两个相同的铂电极插入待滴定溶液中,在两个电极间外加一电压(10~200mV),观察滴定过程中通过两极间的电流变化,根据电流变化的情况确定滴定终点。
永停滴定法装置简单,确定终点方便,准确度高。
对氨基苯磺酸是具有芳伯胺基的化合物,在酸性条件下,可与NaNO2发生重氮化反应而定量地生成重氮盐。
计量点前,两个电极上无反应,故无电解电流产生。
化学计量点后,溶液中少量的亚硝酸及其分解产物一氧化氮在两个铂电极上产生反应。
因此,滴定终点时,电池由原来的无电流通过而变为有电流通过,检流计指针发生偏转,并不再回到零,从而可判断滴定终点。
根据消耗的NaNO2体积数和基准物的称样量,便可计算出NaNO2标液的浓度。
三、仪器和试剂(1)仪器永停滴定仪,酸度计,铁心搅拌棒,铂电极,酸式滴定管(25ml),烧杯(100ml),细玻棒。
(2)试剂对氨基苯磺酸:基准试剂;浓氨试剂;NaNO2标准溶液:0.1mol/L;盐酸(1→2);淀粉碘化钾试纸;FeCl3:A.R;HNO3:A.R。
四、实验内容1.NaNO2标准溶液(0.1mol/L)的配制称取亚硝酸钠7.2g,加无水碳酸钠0.1g,加水使其溶解并稀释至1000ml,摇匀。
2.NaNO2标准溶液的标定精密称取在120℃干燥至恒重的基准物质对氨基苯磺酸约0.4g,置于烧杯中,加水30ml和浓氨液3ml。
溶解后,加盐酸(1→2)20ml,搅拌。
在30℃以下用NaNO2溶液迅速滴定。
滴定时,将滴定管尖端插入液面下约2/3处,边滴边搅拌。
在临近终点时,将滴定管尖端提出液面,用少量蒸馏水洗涤尖端,继续缓缓滴定,用永停法指示终点,至检流计指针发生较大偏转,持续1min不回复,即为终点。
取3份平行操作的数据,分别计算NaNO2浓度,求出浓度平均值及相对平均偏差。
药物分析之药物含量测定:亚硝酸钠滴定法适用的药物及其原理

药物分析学课程作业问题:举例分析亚硝酸钠滴定法使用的药物和原理。
回答:(一)亚硝酸钠滴定法测定药物含量的原理(1)亚硝酸钠滴定法适用范围:分子结构中具有芳伯氨基或水解后具有芳伯氨基的药物,在酸性条件下可与亚硝酸钠定量反应,均可用亚硝酸钠滴定法测定含量。
本法主要用于磺胺类药物以及其他含芳伯氨基(如对氨基水杨酸、盐酸普鲁卡因、苯佐卡因等)或潜在芳伯氨基(如醋氨苯砜经水解后具有氨基)的药物含量测定。
(2)亚硝酸钠滴定法原理具芳伯氨基的药物在酸性溶液中与亚硝酸钠定量反应,生成重氮盐,反应式如下:O H 2NaCl Cl N -Ar 2HCl NaNO NH -Ar 2-222++→+++(3)测定条件:重氮化反应的速率受多种因素的影响,且亚硝酸盐滴定液及反应生成的重氮盐均不够稳定。
因此在测定中应注意以下条件:①加入适量溴化钾加快反应速率在盐酸存在下,重氮化反应的机理为:NaCl HNO HCl NaNO 22+→+O H NOCl HCl HNO 22+→+第一步 第二步 第三步由反应式得,整个反应速率取决于第一步,而第一步反应的快慢与含芳伯氨基化合物中芳伯氨基的游离程度及NO +的浓度密切相关。
芳伯氨基的游离程度与被测物的结构与溶液的酸度相关。
在一定强度的酸性溶液中,当被测物确定以后,芳伯氨基的游离程度确定,重氮化反应速率与NO +的浓度密切相关。
测定时向供试液中加入适量的溴化钾,溴化钾与盐酸作用产生溴化氢,后者与亚硝酸钠生成NOBr :122K O H NOBr HBr HNO ,+↔+若供试液中仅有HCl ,则生成NOCl :222K O H NOCl HCl HNO ,+↔+由于K 1 ≈ 300 K 2,因此加入KBr ,可大大增加被测溶液中NO +的浓度,从而加快重氮化反应速率。
①加过量盐酸加速反应在不同酸中重氮化反应的速度为:HBr >HCl >H 2SO 4>HNO 3。
由于氢溴酸价格较贵,且胺类药物的盐酸盐较硫酸盐的溶解度大,反应速率也快,所以所采用盐酸盐。
亚硝酸钠滴定法

亚硝酸铵滴定法
一、基本原理
酸性溶液中芳伯氨基药物与NaNO2定量反应,生成重氮化合物:
Ar-NH2 + NaNO2 + 2HCl
Ar-N2+Cl- + NaCl + 2H2O
含潜在芳伯氨基药物,先经水解得到芳伯氨基,再测定:
Ar-NHCOR + H2O
H+
Δ
Ar-NH2 + RCOOH
H+
Ar-NO2 + Zn
Ar-NH2
亚硝酸铵滴定法
二、滴定条件
(1)加入过量的盐酸——1:2.5···6 (2)在室温条件(10—30℃)下滴定
亚硝酸铵滴定法
三、注意事项
为加快重氮化反应速度,应像供试液中加入适量溴化钾
其中第一步生成NOCl的反应速度较慢,是整个反应的限速步骤。 向供试液里加入适量溴化钾,可以使反应速度加快。
亚硝酸铵滴定法
四、终点指示-永停滴ຫໍສະໝຸດ 法电流计灵敏度应为10-9A/格; 终点前,溶液中无亚硝酸,线路无 电流通过,电流计指针指零。 终点时,溶液中有微量的亚硝酸存 在,电极起氧化还原反应,线路中 有电流通过,此时电流计指针突然 偏转,并不在回复,即为滴定终点。
亚硝酸钠滴定法测盐酸普鲁卡因的含量

亚硝酸钠滴定法测定盐酸普鲁卡因的含量
测定方法
取盐酸普鲁卡因0.5930g,精密称定,加水40ml与盐酸液(1→2)
15ml,置电磁搅拌器上,搅拌使溶解,再加溴化钾2g,照永停滴定 法插入铂-铂电极后,将滴定管尖端插入液面下约2/3处,用亚硝酸 钠滴定液(0.1055mol/L)迅速滴定,随滴随搅拌,至近终点时将 滴定管尖端提出液面,用少量水淋洗,继续缓缓滴定,至电流计指 针突然偏转不再回复,即为终点,消耗亚硝酸钠滴定液 (0.1055mol/L)20.10ml。中国药典(2005)规定,每1ml亚硝酸 钠滴定液(0.1mol/L)相当于27.28mg的C13H20N2O2•HCl。本品按干 燥品计算,含C13H20N2O2•HCl不得少于99.0%。请问,该供试品含量 是否合格?
亚硝酸钠滴定法测定盐酸普鲁卡因的含量
解析
盐酸普鲁卡因的百分含量%= V T F 100% W
=
20.10
27.28
0.1055 0.1
100%
0.59301000
= 97.55%
97.55%<99.0%,试验证明该盐酸普鲁卡因供试品含量不合 格。
亚硝酸钠滴定法

芳胺类药物
二、分析方法
(三) 含量测定 1. 亚硝酸钠滴定法
2. 非水溶液滴定法
3. 分光光度法
4. 高效液相色谱法
胺类药物的分析
芳胺类药物
(三) 含量测定
1. 亚硝酸钠滴定法(苯佐卡因,普鲁卡因,普鲁卡因胺,醋氨苯砜) (1) 原理:
NHCOR NH2 N2 +Cl -
H+/H2O [水 解 ] R
│ 慢
氯化亚硝酰
Ar-NH-NO
H转位 快 HCl
H+
Ar-N=N-OH
[Ar-N≡N]+Cl-
胺类药物的分析
芳胺类药物
1. 亚硝酸钠滴定法
酸的种类:
HBr > HCl > H2SO4
HNO2 + HBr → NO+ + Br- + H2O HNO2 + HCl → NO+ + Cl- + H2O K1 / K2 > 300
胺类药物的分析
芳胺类物
1. 亚硝酸钠滴定法
④ 滴定速度:
反应为分子反应, 速度较慢; 滴定不宜过快, 近终点更要慢滴; 滴定管尖插入液面下2/3处,一次加近终点体积 加1d后搅拌1~5分钟, 再确定终点
胺类药物的分析
芳胺类药物
1. 亚硝酸钠滴定法
(3) 终点指示方法:
① 外指示剂法(淀粉-碘化钾)——假终点(空气氧)
NO2
NaNO2/2HCl [重 氮 化 ] R R [还 原 ] + NaCl + 2 H2O
Zn+HCl
R
胺类药物的分析
芳胺类药物
亚硝酸钠的检验方法及化学性质

亚硝酸钠的检验方法及化学性质work Information Technology Company.2020YEAR亚硝酸钠的化验方法一、原理:在酸性溶液中,用高锰酸钾氧化亚硝酸钠。
根据高锰酸钾标准滴定液的消耗量计算出亚硝酸钠的含量。
二、试剂:硫酸:1+29溶液;1+5溶液。
按比例配制成硫酸后,加热至70℃左右,滴加高锰酸钾标准溶液至溶液至微红色为止,冷却,备用。
高锰酸钾:C(1/5KmnO4)约0.1mol/L标准滴定溶液。
草酸钠:C(Na2C2O4)约0.1mol/L标准滴定溶液:称取约6.7g草酸钠,溶解于300mL硫酸(1+29)中,用水稀释至1000mL容量瓶中摇匀,用高锰酸钾标准溶液标定。
三、测定:用移液管吸取25mL液体置于500mL容量瓶中,加水稀释至刻度,摇匀。
用滴定管滴加约40mL高锰酸钾标准溶液于300mL锥形瓶中,再移入25mL试样溶液,加入10mL硫酸(1+5)溶液,将溶液加热至40℃,用移液管加入10mL草酸钠标准滴定溶液,加热至70-80℃,继续用高锰酸钾标准溶液滴定至溶液呈粉红色并保持30秒不消失为终点。
(cv-c1v1)×0.0345×100含量(%)= ×100%m×25/500×(100-X1)69×(cv-c1v1)= ×100%m×(100-X1)式中:c:高锰酸钾标准溶液的摩尔浓度,mol/Lv:加入和滴定消耗的高锰酸钾的体积,mLc1:草酸钠标准溶液的摩尔浓度,mol/Lv1: 加入的草酸钠的体积,mLm:称样量,gX1:亚硝酸钠的水份含量,%0.0345:与1.00mL高锰酸钾相当的以克表示的亚硝酸钠的质量。
四、允许差:取两次平行测定的结果的算术平均值作为结果,平行测定的绝对差值不大于0.2%。
亚硝酸钠化学性质拼音名:Yaxiaosuanna英文名:Sodium Nitrite分子式:NaNO2分子量:69.00本品按干燥品计算,含NaNO2 不得少于99.0%。
亚硝酸钠标准溶液的配制与标定

亚硝酸钠标准溶液的配制与标定一、实验目的(1)掌握重氮化滴定的原理和滴定条件。
(2)熟悉永停滴定法的装置和实验操作。
二、实验原理永停滴定法属于电流滴定法。
它是用两个相同的铂电极插入待滴定溶液中,在两个电极间外加一电压(10~200mV),观察滴定过程中通过两极间的电流变化,根据电流变化的情况确定滴定终点。
永停滴定法装置简单,确定终点方便,准确度高。
对氨基苯磺酸是具有芳伯胺基的化合物,在酸性条件下,可与NaNO2发生重氮化反应而定量地生成重氮盐。
计量点前,两个电极上无反应,故无电解电流产生。
化学计量点后,溶液中少量的亚硝酸及其分解产物一氧化氮在两个铂电极上产生反应。
因此,滴定终点时,电池由原来的无电流通过而变为有电流通过,检流计指针发生偏转,并不再回到零,从而可判断滴定终点。
根据消耗的NaNO2体积数和基准物的称样量,便可计算出NaNO2标液的浓度。
三、仪器和试剂(1)仪器永停滴定仪,酸度计,铁心搅拌棒,铂电极,酸式滴定管(25ml),烧杯(100ml),细玻棒。
(2)试剂对氨基苯磺酸:基准试剂;浓氨试剂;NaNO2标准溶液:0.1mol/L;盐酸(1→2);淀粉碘化钾试纸;FeCl3:A.R;HNO3:A.R。
四、实验内容1.NaNO2标准溶液(0.1mol/L)的配制称取亚硝酸钠7.2g,加无水碳酸钠0.1g,加水使其溶解并稀释至1000ml,摇匀。
2.NaNO2标准溶液的标定精密称取在120℃干燥至恒重的基准物质对氨基苯磺酸约0.4g,置于烧杯中,加水30ml和浓氨液3ml。
溶解后,加盐酸(1→2)20ml,搅拌。
在30℃以下用NaNO2溶液迅速滴定。
滴定时,将滴定管尖端插入液面下约2/3处,边滴边搅拌。
在临近终点时,将滴定管尖端提出液面,用少量蒸馏水洗涤尖端,继续缓缓滴定,用永停法指示终点,至检流计指针发生较大偏转,持续1min不回复,即为终点。
取3份平行操作的数据,分别计算NaNO2浓度,求出浓度平均值及相对平均偏差。
2020版《中国药典》亚硝酸钠滴定液配制与标定操作规程
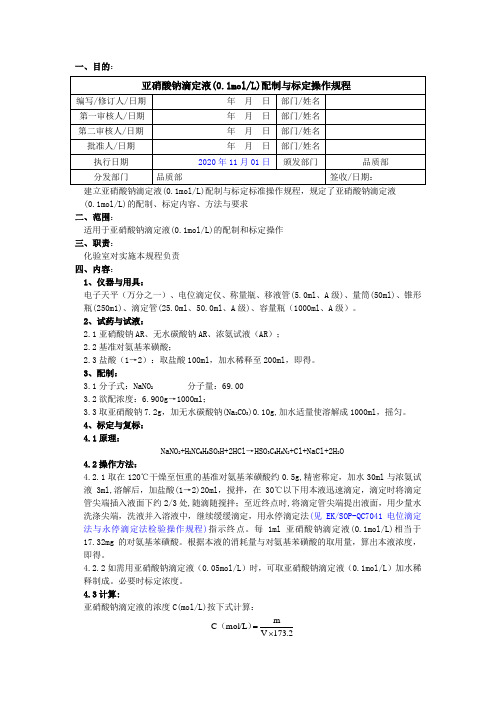
一、目的:(0.1mol/L)的配制、标定内容、方法与要求二、范围:适用于亚硝酸钠滴定液(0.1mol/L)的配制和标定操作三、职责:化验室对实施本规程负责四、内容:1、仪器与用具:电子天平(万分之一)、电位滴定仪、称量瓶、移液管(5.0ml 、A 级)、量筒(50ml)、锥形瓶(250m1)、滴定管(25.0ml 、50.0ml 、A 级)、容量瓶(1000ml 、A 级)。
2、试药与试液:2.1亚硝酸钠AR 、无水碳酸钠AR 、浓氨试液(AR );2.2基准对氨基苯磺酸;2.3盐酸(1→2):取盐酸100ml ,加水稀释至200ml ,即得。
3、配制:3.1分子式:NaNO 2 分子量:69.003.2欲配浓度:6.900g →1000ml ;3.3取亚硝酸钠7.2g ,加无水碳酸钠(Na 2CO 3)0.10g,加水适量使溶解成1000ml ,摇匀。
4、标定与复标:4.1原理:NaNO 2+H 2NC 6H 5SO 3H+2HCl →HSO 3C 6H 5N 2+Cl+NaCl+2H 2O4.2操作方法:4.2.1取在120℃干燥至恒重的基准对氨基苯磺酸约0.5g,精密称定,加水30ml 与浓氨试液3ml,溶解后,加盐酸(1→2)20ml ,搅拌,在30℃以下用本液迅速滴定,滴定时将滴定管尖端插入液面下约2/3处,随滴随搅拌;至近终点时,将滴定管尖端提出液面,用少量水洗涤尖端,洗液并入溶液中,继续缓缓滴定,用永停滴定法(见EK/SOP-QC7041电位滴定法与永停滴定法检验操作规程)指示终点。
每1ml 亚硝酸钠滴定液(0.1mol/L)相当于17.32mg 的对氨基苯磺酸。
根据本液的消耗量与对氨基苯磺酸的取用量,算出本液浓度,即得。
4.2.2如需用亚硝酸钠滴定液(0.05mol/L )时,可取亚硝酸钠滴定液(0.1mol/L )加水稀释制成。
必要时标定浓度。
4.3计算:亚硝酸钠滴定液的浓度C(mol/L)按下式计算:2.173V m mol/L C ⨯=)(式中:m为基准对氨基苯磺酸的称取量,mg;V 为本滴定液的消耗量,ml;173.2为与每1ml亚硝酸钠滴定液(1.000mol/L)相当以毫克表示的对氨基苯磺酸的质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亚硝酸钠滴定法
亚硝酸钠滴定法是一种氧化还原滴定法,以亚硝酸钠为标准溶液,用于测定有机胺类化合物。
该方法通常分为重氮化滴定法和亚硝基化滴定法两种。
重氮化滴定法主要适用于芳伯胺、酸性介质中的测定,而亚硝基化滴定法则适用于芳仲胺、酸性介质中的测定。
在重氮化滴定法中,酸的种类和速度对反应有影响,其中HBr中的反应速度最快,HCl次之,在硫酸或硝酸中最慢。
此外,亚硝酸钠法标准溶液的配制和滴定方法也需要特别注意,以确保测定结果的准确性。
