有机化学课件: 烯烃
合集下载
有机化学课件-6烯烃
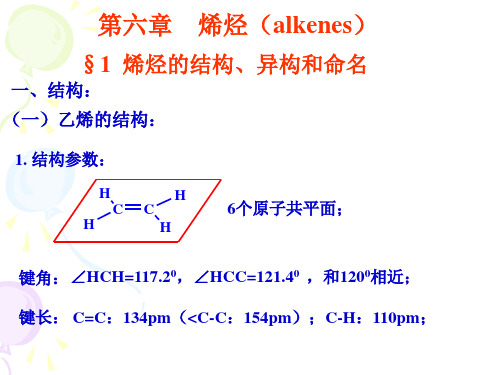
三、烯烃的命名(CCS系统命名法): (一)命名原则:
1. 主链选择:含碳碳双键(官能团)在内的最长碳链作为主链;
如:CH3CH2CH2CH2C=CH2 (√) CH2CH2CH(3 没有把碳碳双键都包含在内)
2-丙基-1-己烯 或2-丙基己烯(官能团处于1位时可省略去位次)
2. 主链编号:使碳碳双键处于尽量小的编号;
2×7 +2 - 8
,C7H8 ,Ω=
=4; 三个C=C和一个环
2
CH3CH2OH ,C2H6O ,Ω=
O
CH3C NH2,C2H5ON ,Ω=
2×2 +2 - 6
=0
2 2×2 +2 - 5 +1
=1
2
二、烯烃的同分异构: (一)构造异构:
如分子式为 C4H8 的烯烃的构造异构体有: CH3 CH3CH2CH=CH2 ,CH3CH=CHCH3 ,CH3C=CH2
CH3 CH
CH3
CH2CH3
C H
(E)-2,3-二甲基-3-己烯
和顺反命名法相比较,顺式的可能是Z构型的,也可能是E构型;
§2 烯烃的相对稳定性
一、燃烧热:
燃烧热kJ/mol
稳定性
例: CH3CH2CH=CH2
2718
H3C
CH3
CC
2711
HH
H3C
H
CC
2708
H
CH3
高
烯烃中碳碳双键上的烷基越多,稳定性越高;
6 CH3 如:CH3CH2CH=CHCH2CHCHCH3
1 2 3 4 5 CH37 8
6,7-二甲基-3-辛烯
3. 标明双键的位次;只写双键两个碳原子中位次较小的一个,放
《有机化学之烯烃》课件

生物有机化学中的烯烃
如生物脂质中的不饱和脂肪酸和植物类胡萝 卜素等。
同分异构体和立体化学
烯烃存在同分异构体,其中不同的同分异构体具有相同的分子式但不同的结构式,具有不同的性质和用 途。烯烃分子中双键的立体构型也会影响其化学性质和应用领域。
π-电子的共振现象
烯烃分子中的π电子可以发生共振现象,形成多重键而强化分子的稳定性和化学性质。共振对烯烃的光 学、电学和磁学性质起着重要的作用,如合成染料、光伏材料等领域。
烃类脱氢
利用催化剂促进烃类脱去氢,形成双 键结构的烯烃。
烷基汞试剂法
烷基汞试剂能和烯烃反应形成稳定的 Hg化合物,再通过还原去除Hg,得 到烯烃。
烯烃的特性和性质
分子结构
烯烃分子中有一个含有双键的可以引起分子的极性,使烯烃 表现出亲水性。
碳水化合物
烯烃的应用领域和未来发展趋 势
烯烃广泛应用于工业、医药、化妆品和生物领域,如生产橡胶、塑料、医药 中间体、清洁工业等。未来研究将继续扩展其应用领域,提高生产技术,并 探索更加环保和可持续的烯烃生产方式。
烯烃的工业生产和环境影响
烯烃是许多工业化学制品的基础原料,如塑料和橡胶。然而,烯烃的生产和 使用也会带来环境问题,如大气污染、废水处理、垃圾处理等。工业和社会 需要更加环保和可持续的生产方法和使用方式。
有机化学之烯烃
烯烃是有机物质中一种重要的类别,其分子中有C=C双键。烯烃被广泛应用 于生物、工业和其他领域。本课件将介绍烯烃的定义、结构和性质,以及相 关的反应和应用。
烯烃的制备与分类
1
烃类卤代反应
2
通过卤素与烃类反应形成卤代烃,再 发生消除反应去掉卤素即可得到烯烃。
3
加成反应与大环反应
有机化学课件 第三章 烯烃3
应经历溴 离子、反式加成。 • 反应经历溴鎓离子、反式加成。
Br H C C CH3 H H3C H C Br
+
H3C C C
H
H C
Br2
CH3
H Br
-
CH3 H CH3 C
Br
CH3
Br C H CH3
CH3 Br H (R) H Br (R) CH3 dl-
CH3 H Br (S) Br H (S) CH3
CH3 CH3 C CH=CH2 CH3 CH3 CH3 C CH CH3 + CH3 H3C Cl CH3 C CH CH3 Cl CH3 83%
HCl
17%
反应经历碳正离子中间体。 反应经历碳正离子中间体。 1,2-甲基迁移、1,2-负氢迁移。重排为更稳定的碳正离子。 1,2-甲基迁移、1,2-负氢迁移。重排为更稳定的碳正离子。
试比较下列分子或离子的超共轭效应大小。 [讨论] (1) 试比较下列分子或离子的超共轭效应大小。 讨论]
1) CH3CH=CH2 CH3CH2CH=CH2 (CH3)2CHCH=CH2 A B C 2) (CH3)3C (CH3)2CH CH3CH2 CH3 A B C D
+ + + +
(2) 试静态分析烯烃双键碳原子上电子云密度的大小。 试静态分析烯烃双键碳原子上电子云密度的大小。
碳正离子稳定性次序: 碳正离子稳定性次序: 3o C+ > 2o C+ > 1oC+ >CH3+
G
C
+
G
C
+
给电子基,使正电荷分散,碳正离子稳定: 给电子基,使正电荷分散,碳正离子稳定: 吸电子基,使正电荷更集中 碳正离子不稳定 碳正离子不稳定; 吸电子基,使正电荷更集中,碳正离子不稳定;
有机化学 第三章 烯烃全

KOH
Br
C2H5OH
+ HBr
17
3-4 烯烃的物理性质
物质状态 C2~C4 气体,C5~C18液体 ,C19~固体
沸点、熔点和相对密度 均随相对分子量的增加而上升;直链烯烃的沸 点略高于支链烯烃;末端烯烃(α-烯烃)的沸点 略低于双键位于碳链中间的异构体。
溶解性 不溶于水,易溶于有机溶剂。
HCl CF3CH2CH2 Cl
Cl
CF3CH2CH2
(主)
HCl CF3CHCH3
Cl
Cl
CF3CHCH3
35
烯烃的亲电加成反应
HX反应活性 HI > HBr > HCl > HF
H2C CH2
HBr HAc
CH2 Br
CH2 H
HCl H2C CH2 AlCl3
H2C CH3 Cl
36
与硫酸的加成 ——间接水合
H3C C
H
CH3 C
H
H C
H3C
CH3 C
H
顺式
反式
7
3-2 烯烃的异构和命名
系统命名法
选主链:选择含双键的最长碳链作主链, 称 “某烯”, 若碳原子数大于10, 则称为“某碳 烯”;
编号:从靠近双键的一端开始编号,确定双键 (两双键碳原子中编号小的数字)及其它取代 基的位次;
其它同烷烃的命名。
18
顺 反 异 构 体 的 差 异
极性较大, b.p. 较高 极性较小, b.p. 较低
对称性较差,m.p. 较低
对称性较好,m.p. 较高19
3-5 烯烃的化学性质(重点)
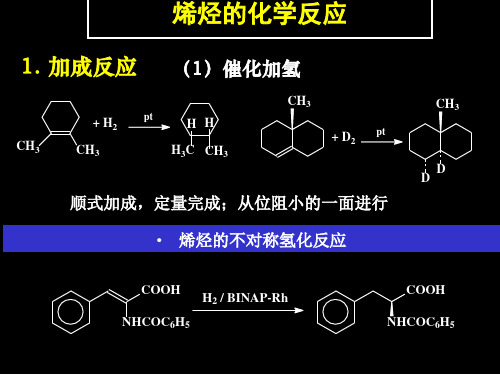
• 反应:加成、氧化、卤代
α HCCC
有机化学第4章 烯烃

4.1.3 烯烃的异构和Z/E标记法
•构造异构由于双键的位置不同引起同分异构现象。 构造异构由于双键的位置不同引起同分异构现象。 构造异构由于双键的位置不同引起同分异构现象 例1:丁烯有三个同分异构体 丁烯有三个同分异构体 (1) CH3-CH2-CH=CH2 1-丁烯 丁烯 (2) CH3-CH=CH-CH3 2-丁烯 丁烯 (3) CH3-C=CH2 2-甲基丙烯 异丁烯 甲基丙烯(异丁烯 甲基丙烯 异丁烯) CH3
HX=HCl,HBr,HI 烯烃 卤烷
加成反应历程 + 第一步: -C=C- + H X → -C-C- + X第一步 •生成碳正离子 H 生成碳正离子 第二步:碳正离子迅速与 结合生成卤烷. 第二步 碳正离子迅速与 X- 结合生成卤烷 -C-C- + X- → -C-C+ H HX
σ+ → σ-
4.2 烯烃的物理性质
自
学!!
4.3 烯烃的化学性质 •碳碳双键 碳碳双键 •断裂乙烷 断裂乙烷C-C σ 单键需要 单键需要347kJ/mol 断裂乙烷 •断裂双键需要 断裂双键需要611kJ/mol; 断裂双键需要 •说明碳碳 π 键断裂需要 说明碳碳 键断裂需要264kJ/mol •双键使烯烃有较大的活性 双键使烯烃有较大的活性. 双键使烯烃有较大的活性 • 烯烃的加成反应 --- 烯烃在起化学反应时往往 随着π 键的断裂又生成两个新的 σ 键,即在双键 即在双键 碳上各加一个原子或基团. 碳上各加一个原子或基团 >C=C< + Y-Z → -C-C(σ sp2) σ
4.1.1 烯烃的命名 命名规则(系统命名 命名规则 系统命名): 系统命名 • • • • (1)选择含碳碳双键的最长碳链为主链 母体 选择含碳碳双键的最长碳链为主链(母体 选择含碳碳双键的最长碳链为主链 母体); (2)碳链编号时 应从靠近双键的一端开始 碳链编号时,应从靠近双键的一端开始 碳链编号时 应从靠近双键的一端开始; (3)烯前要冠以官能团位置的数字 编号最小 烯前要冠以官能团位置的数字(编号最小 烯前要冠以官能团位置的数字 编号最小); (4)其它同烷烃的命名规则 其它同烷烃的命名规则. 其它同烷烃的命名规则 CH2﹦ –CH2CH3 C ︱ CH2CH2CH3
大学有机化学第三章烯烃ppt课件

c
(E)-构型
Entgegen(相反)
3.3.2 次序规则 (1)将双键碳原子所连接的原子或基团按其原子序数的大
小排列,把大的排在前面,小的排在后面,同位素则按 原子量大小次序排列。
I, Br, Cl,, S, P, O, N, C, D, H
13
(2)如果与双键碳原子连接的基团第一个原子相 同而无法确定次序时,则应看基团的第二个 原子的原子序数,依次类推。按照次序规则 (Sequence rule)先后排列。
例如:-CH(CH3)3 > -CH2CH3 > -CH3 又例如:
Cl
O
C H> C O
Cl
C O>
Cl CC
H
C
H
C
14
(3)含有双键和叁健基团,可认为连有二个或三个 相同原子
HC CH2
HH 12
C C (C)
(C) H
C1(C,C,H) C2(C,H,H)
H 12
C CH3
CH3
C1(C,C,H) C2(H,H,H)
32
CH2=CH2
98% H2SO4
H2O
C H3C H2O H
CH3CH=CH2
80 % H2SO4
H2O
OH
65 %
H2O
H2SO4
OH
33
(3)与水的的加成: 在酸催化下,烯烃与水作用得醇,副产物多, 实验室无制备价值。 工业上乙烯水解制备乙醇(p54)
(4)与卤素的加成: a)卤素的活泼性:F2>Cl2>Br2>I2 b)Br2/CCl4溶液可鉴定烯烃(黄棕色退为无色) e)反应历程也为亲电加成*
+ HBr
课件有机化学第3章 烯烃

第三章烯烃Alkenes12烯烃的结构烯烃的顺反异构烯烃的命名烯烃的物理性质CONTENT1234烯烃的化学性质烯烃的制备56SP杂化轨道C C C C7乙烯键长和键角乙烷键长和键角134 pm 烯烃的键长和键角烯烃的结构特征•sp2杂化•π-键•C=C键长比C-C短•π键电子云流动性较大•存在顺反异构——相同基团在双键同侧为顺式,不同侧为反式83.3 烯烃的命名•主链应含双键称“某碳烯”•C10•主官能团的位号尽可能小•如烯烃存在位置异构,母体名称前要加官能团位号•取代基的位置、数目、名称按“次序规则”顺序写在母体前面•Z或E加圆括号,写在化合物名称最前面123.5 烯烃的化学性质1. 烯烃的亲电加成2. 烯烃的自由基加成3. 硼氢化反应4. 催化氢化5. 烯烃的氧化6. 烯烃的α−卤化7. 聚合反应21烯烃亲电加成的原则当不对称烯烃与极性试剂加成时:试剂中的正离子(或带有部分正电荷的部分)加到带有部分负电荷的双键碳原子上试剂中的负离子(或带有部分负电荷的部分)加到带有部分正电荷的双键碳原子上24可能发生重排反应重排反应( rearrangement)——在化学键的断裂和形成过程中,组成分子的原子配置方式发生了改变,从而形成组成相同,结构不同的新分子。
31结论•反应是亲电加成反应•反应是分步进行的•立体化学上表现为反式加成38反应特点•Br2, Cl2对烯烃的加成主要为环正离子过渡态的反式加成•碘加成一般不发生,但ICl, IBr可与烯键发生定量加成反应,用来监测油脂中双键的含量40。
有机化学课件 第三章 烯烃1

X H3C
CH3 X
溴光离子
注意:氯光离子不易形成
3.4.2.2 烯烃与 HX的加成反应 (体系不加水,会使产物复杂化)
反应活性: HI HBr HCl HF 活性怎样? HI > HBr > HCl > HF
键能小,正碳易形成,快
如:
H2 C = C H2 + H I CH3 CH2I
H3C
CH CH2 I H
+ H3C CH3
Br Br
δ+ δ−
Br + H3C CH3 Br
即应
Br
CH3 Br
+
Br
Br CH3
并存
H3C
H3C
实际:
存在
不存在
若形成正碳离子应形成两种产物: 顺式与反式,但事实只有反式产物
实际上
Br - 背面进攻
Br
Br
C
Br
C
C
CБайду номын сангаас
C Br
C
Br
反式加成 解释了(3)
解释
Br H3C CH3 + Br
怎样命名以下化合物
CH3 C CH3CH2 C
CH2CH2CH3 CHCH3 CH3
顺式还是反式? 顺式还是反式?
E-Z命名法
E-Z 命名法: 命名法:
顺序规则
(1)取代基的游离架所在的原子按原子序数 排列,大的排在前, 排列,大的排在前,小的在后 -I, -Br, -Cl, -S, -P, -O, -N, -C, -D, -H, (2)如果游离架所在的原子都是碳原子,先 如果游离架所在的原子都是碳原子, 比较第一个碳原子所连接的原子序数的 大小,再比较第二个碳….. 大小,再比较第二个碳…..
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•顺反异构体的构型用Z(德文Zugammen,同侧)和E(德
•文Entgegen,异侧)来表示,构型是Z或E要用次序规则
•(i)按原子序数,同位素按原子量排列:
•如 H<D<B<C<N<O<F<Si<P<S<Cl<Br 等等
•(ii)如第一个原子序数相同则比较第二个,第三个…..
•如CH3-<CH3CH2-<(CH3)2CH-<(CH3)3C-
水解三烷基硼可得醇,产物为反马氏、顺式加成产物
4.烯烃的氧化
(1) 环氧化反应 (2)用高锰酸钾氧化
(3)臭氧化反应
5.催化氢化
利用催化加氢反应测定氢化热比较烯烃的稳定性
比较烯烃的稳定性大小
看图
6.聚合反应
聚乙烯是用途广泛的通用塑料,采用高压聚合法生成 高压聚乙烯
用齐格勒-纳塔催化剂可在低压和较底温度下 生成低压聚乙烯
(iv)重排:
(CH3)3CCH=CH2 HCl (甲基转移)
(CH3)2CHCH=CH2 HBr
(负氢转移)
(b)与卤素反应
(CH3)3CHClCH3 + (CH3)2CCl-CH(CH3)2
17%
83%
(CH3)2CHCHBrCH3 + (CH3)2CBr-CH2CH3
次要产物
主要产物
第一步
第二步
第三章 烯烃
主要内容
• 3.1烯烃的结构
• 3.4烯烃的化学性质
• 3.2烯烃的异构体和 命名
• 3.3烯烃的物理性质
• 3.5烯烃的来源与制 备
序
烯烃广泛存在于自然界中,例植物中 含有微量乙烯,它是植物的一种内源 激素。 烯烃又是重要的工业原料,用它可生 产:乙醇、乙醛、乙酸等,被称为化 学工业的基石。
一.烯烃的结构
烯烃分子中的双键的两个碳原子是SP2杂化,P轨 道互相平行侧面重叠形成π键。实验证明打开π 键约需要268KJ/mol,因而室温下无法旋转, 由此产生顺反异构体。
乙烷
乙烯
C-C 键能(KJ/mol) 636
368
C-C 键长(pm)
133
154
乙烯的模型 (球棍、比例)
二. 烯烃的异构体和命名
CH3CH3 CH3CH2CH-CHCH=CH2 3.4-二甲基-1-己烯
烯烃去掉一个氢原子的一价基为某烯基 CH2=CH- 乙烯基 CH3CH=CH-丙烯基(1-丙烯基) CH2=CHCH2-烯丙基(2-丙烯基)
•有两个自由价的基称为亚基 • H2C= 亚甲基 CH3CH= 亚乙基 - CH2CH2- 1,2-亚乙基
1.烯烃的异构体: a.构造异构:CH3-CH2-CH=CH2 (1-丁烯) CH3-CH=CH-CH3(2-丁烯)
CH3 CH3-C=CH2(2-甲基丙烯)
b.顺反异构:
2.烯烃的命名
简单的烯烃用普通命名法: CH2=CH2 乙烯
CH3
CH3-CH=CH2 丙烯 ,CH3C=CH2 异丁烯 复杂的用系统命名法:
(c)与次卤酸反应
第一步
第二步
(d)与硫酸反应
(e) 与水反应
第一步 第二步 第三步
2. 烯烃的自由基加成
不对称烯烃在过氧化物存在时与溴化氢反应却 得到反马氏规律的产物
第一步
第二步 第三步
第四步
3. 烯烃的硼氢化反应
在乙醚或四氧呋喃中,甲硼烷的三个B-H键加到烯 键上得到三烷基硼,用过氧化氢的氢氧化钠水溶液
四.烯烃的化学性质
1.亲电加成
前面我们已提到了在极性反应中,烯烃作为亲核试 剂(Lewis 碱)可与Lewis 酸发生反应 (a)烯烃与HX的亲电加成:
第一步
第二步
乙烯与HBr的反应
反应能量图
注意的几个问题
(i)HI>HBr>HCl>HF
(ii)(CH3)2C=CH2>CH3CH=CH2>CH2=CH2 (iii)区域选择性规律:绝大多数情况下符合马尔科夫 尼可夫规律
C
C
•(iii)-C=C- 当作 -C-C , -C C 当作 -C-C 等等3
H3C
Br
H3C
CH3
(E)-3-甲基-1,3-戊二烯
H2C
H
H
(E)-1-溴-2-异丙基-1,3-丁二烯
三.烯烃的物理性质
μ=0.33D bp: 3.7℃ mp:-138.9℃
μ=0.0D bp:0.9℃ mp:-105.5℃
7.α氢的卤代
与双键相连的碳为α碳,α碳上氢在高温或光照下可被卤 素(氯或溴)取代
五.烯烃的来源与制备
1. 在分子中导入烯键的常用方法
(a)醇脱水 (b)卤代烃去卤化氢 (c)连二溴代烃脱溴 2.乙烯的产量是衡量一个国家化工发展水半的主要依据, 乙烯的工业来源主要是原油的高温裂解,丙烯和几种 丁烯为生产乙烯付产品而同时得到。
