大学无机化学第20章 过渡金属元素习题答案 20120319
无机化学练习题(含答案)【精选文档】

无机化学练习题(含答案)第1章原子结构与元素周期系1-1 试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解1—2 Br2离需要吸收的最低能量子的波长与频率。
1—3 氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?1-4 周期系中哪一个元素的电负性最大?哪一个元素的电负性最小?周期系从左到右和从上到下元素的电负性变化呈现什么规律?为什么?1-5 什么叫惰性电子对效应?它对元素的性质有何影响?1-6 当氢原子的一个电子从第二能级层跃迁至第一能级层时发射出光子的波长是121。
6nm;当电子从第三能级层跃迁至第二能级层时,发射出光子的波长是656.3nm。
问哪一个光子的能量大?1-7 有A,B,C,D四种元素。
其中A为第四周期元素,与D可形成1:1和1:2原子比的化合物。
B为第四周期d区元素,最高氧化数为7。
C和B是同周期元素,具有相同的最高氧化数.D为所有元素中电负性第二大元素。
给出四种元素的元素符号,并按电负性由大到小排列之。
1-8有A,B,C,D,E,F元素,试按下列条件推断各元素在周期表中的位置、元素符号,给出各元系的价电子构型.(1)A,B,C为同一周期活泼金属元素,原子半径满足A〉B>C,已知C有3个电子层。
(2)D,E为非金属元素,与氢结合生成HD和HE。
室温下D的单质为液体,E 的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子。
第2章分子结构2-1 ~σ键可由s—s、s—p和p-p原子轨道“头碰头”重叠构建而成,试讨论LiH(气态分子)、HCl、Cl2分子里的~σ键分别属于哪一种?2—2 NF3和NH3的偶极矩相差很大,试从它们的组成和结构的差异分析原因。
2—3 一氧化碳分子与酮的羰基(〉C=O)相比,键能较小,键长较小,偶极矩则小得多,且方向相反,试从结构角度作出解释。
大学无机化学第二十章试题及答案上课讲义

第21章铁系元素和铂系元素总体目标:1.掌握铁系元素单质及其重要化合物的性质、结构和用途2.了解铂系元素单质及其化合物的性质和用途各节目标:第一节铁系元素的单质掌握铁、钴、镍单质的性质和用途第二节铁系元素的化合物1.掌握铁、钴、镍化合物的溶解性和颜色2.掌握铁、钴、镍的+2、+3氧化态稳定性变化规律、这些氧化态化合物在反应上的差异以及化合物的水解性第三节铁系元素的配位化合物了解铁、钴、镍的重要配位化合物的性质第四节铂系元素1.了解铂系元素单质的性质和用途2.了解铂系元素含氧化合物和卤化物的主要性质3.了解铂系元素主要配位化合物的性质习题一.选择题1.下列金属中,最活泼的是()(吉林大学《无机化学例题与习题》)A.FeB.CoC.NiD.Pd2.下列金属中,吸收H2能力最强的是()(吉林大学《无机化学例题与习题》)A.FeB.NiC.PdD.Pt3.向FeCl溶液中加入氨水生成的产物主要是()(吉林大学《无机化学例题与习题》) 33+ B.Fe(OH)Cl C.Fe(OH)Cl D.Fe)A.Fe(NH(OH)323622+作用的组要产物是()与H4.酸性条件下,OFe22+3+和HO; C.Fe和HO B.Fe H和,A.FeO; DFe3+和O 2222.5.形成六配位的水合离子时,磁矩为4.90B.M.(理论值)的离子是()(吉林大学《无机化学例题与习题》)3+ 2+2+2+D.Co C.Fe A.Cr B.Mn6.下列化合物中,与浓盐酸作用没有氯气放出的是()(吉林大学《无机化学例题与习题》)A.PbOB.FeOC.CoOD.NiO 332223 3 27.下列配离子中,还原能力最强的是()(吉林大学《无机化学例题与习题》)2+4-2+2+)HO D.Co)C.Co (NH)(A.Fe(HO) B.Fe(CN66623268.下列化合物中,颜色不为黄色的是()(吉林大学《无机化学例题与习题》)A.K[Fe(CN)].HOB.BaCrOC.K[Co(NO)]D.K[Fe(CN)6]6322433649.能用NaOH溶液分离的离子对是()(吉林大学《无机化学例题与习题》)3+3+2+2+ 3+3+2+3+Fe D.Cu和Fe和 B.Cu 和Zn C.CrA.Cr 和Al10.某金属离子在八面体弱场中磁矩为5.9B.M.,在八面体强场中的磁矩不为零,则该离子可能是()(吉林大学《无机化学例题与习题》)2+ 3+ 2+ 3+D.Co C.Co A.Fe B.Fe11.可以制得无水FeCl是下列中的()(川师大《无机化学学习指导》)3A.Fe+HCl→ B.FeCl+Cl→ C.Fe+Cl22212.NiO和盐酸反应的主要产物是()(川师大《无机化学学习指导》)32A.NiClB.NiClC.NiCl+Cl 2 33213.铂系元素中对酸最活泼的金属是()(川师大《无机化学学习指导》)A.OsB.RuC.Pd14.用氢氧化钠熔融法分解某矿石时,最合适的坩埚是()(川师大《无机化学学习指导》)A.铂坩埚B.镍坩埚C.瓷坩埚2+离子在水溶液中和在氨水溶液中的还原性是( 15.Co)(吴成鉴《无机化学学习指导》)A.前者大于后者B.二者相同C.后者大于前者D.都无还原性3+盐加KI来制取FeI,是因为 Fe16.不能在水溶液中由()(吴成鉴《无机化学3)学习指导》3+离子易水解易溶 B.FeA.FeI33+Y有氧化I-有还原性,的混合物D.Fe得不到FeI C.生成的产物不纯,是FeI和FeI33217.铁系元素和铂系元素,形成配合物倾向更强的是()(吴成鉴《无机化学学习指导》)A.铁系元素B.铂系元素C.两者均是D.两者均否、18.铁在潮湿空气中会生锈,铁锈是松脆多孔的物质,它的成分通常表示为()(吴成鉴《无机化学学习指导》)A.FeOB.FeOC.FeO.HOD.FeO.xHO2223234319.下列关于FeCl性质的叙述,正确的是()(吴成鉴《无机化学学习指导》)3A.FeCl是离子化合物3B.高温气态时,以FeCl单分子存在3C.可用加热FeCl.6HO的方法制取无水FeCl 323D.在FeCl中,铁的氧化态是+Ⅲ,是铁的最高氧化态320.下列物质与KCrO溶液反应没有沉淀生成的是()(大连理工大学《无机化722学习题详解》)A.HSB.KIC.HOD.AgNO 3 22221.在下列条件中,KMnO发生反应时产物中没有气体的是()(大连理工大学《无4机化学习题详解》)A.受热B.在酸性条件下放置C.在浓碱溶液中D.酸性条件下与HS反应222.下列物质不易被空气中的O氧化的是()(大连理工大学《无机化学习题详解》) 22+ 2+)(NH D.Co(OH) C.Fe B.NiA.Mn(OH)62 2 3二.填空题3+的杂化Fe 蒸汽,其中分子,其结构类似于 1.FeCl的蒸汽中含有3方式为.FeCl易溶于有机溶剂,原因是. (吉林大学《无机化3学例题与习题》)2.现有四瓶绿色溶液,分别含有Ni(Ⅱ),Cu(Ⅱ),Cr(Ⅲ),MnO42-.(1)加水稀释后,溶液变蓝的是.(2)加入过量酸性NaSO溶液后,变为无32色的是.(3)加入适量NaOH溶液由沉淀生成,NaOH过量时沉淀溶解,又得到绿色溶液的是. (吉林大学《无机化学例题与习题》)(4)加入适量氨水有绿色沉淀生成,氨水过量时得到蓝色溶液的是.吉(吉林大学《无机化学例题与习题》)3+2+2+3+2+2+中,易溶于过量氨水的是,Ni 3.在Cr ,Mn ,Fe ,Fe. ,Co (吉林大学《无机化学例题与习题》)4.向CoSO溶液中加入过量KCN溶液,则有.生成,放置后逐渐转化4为. (吉林大学《无机化学例题与习题》)2-)(CN .Ni化学组成为 5.具有抗癌作用的顺铂,其分子构型为.42-构型为-,而NiCl未成,.中心离子的未成对电子数为的构型为4对电子数为. (吉林大学《无机化学例题与习题》)6.铁系元素包括,铂系元素则包括,铂系元素因,—而在自然界中往往以——态形式共生在一起。
无机化学教材习题答案

答
23.判断下列各组分子之间存在着什么形式的分子间作用力?
①苯和CCl4;②氦和水;③CO2气体;④HBr气体;⑤甲醇和水。
答
24.试判断Si和I2晶体哪种熔点较高,为什么?
答
第五章
1.说出BaH2,SiH4,NH3,AsH3,PdH0.9和HI的名称和分类?室温下各呈何种状态?哪种氢化物是电的良导体?
NaF,AgBr,RbF,HI,CuI,HBr,CrCl。
答
6.如何理解共价键具有方向性和饱和性?
答
7.BF3是平面三角形的几何构型,但NF3却是三角的几何构型,试用杂化轨道理论加以说明。
答
8.指出下列化合物合理的结构是哪一种?不合理结构的错误在哪里?
(a)
(b)
(c)
答
N2O存在
9.在下列各组中,哪一种化合物的键角大?说明其原因。
答
(5)按斯莱脱规则计算K,Cu,I的最外层电子感受到的有效核电荷及相应能级的能量。
答
(6)根据原子结构的知识,写出第17号、23号、80号元素的基态原子的电子结构式。
答
(7)画出s,p,d各原子轨道的角度分布图和径向分布图,并说明这些图形的含意。
答见课本65页
s电子云它是球形对称的。
p电子云它是呈无柄的桠铃形。
答
2.如何利用路易斯结构和价层电子对互斥理论判断H2Se,P2H4,H3O+的结构?
答
3.写出工业制氢的三个主要化学方程式和实验室中制备氢气最简便的方法?
答
4.He在宇宙中丰度居第二位,为什么在大气中He含量却很低?
答
5.哪种稀有气体可用作低温制冷剂?哪种稀有气体离子势低,可做放电光源需要的安全气?哪种稀有气体最便宜?
无机化学 第15章 氮族元素习题解答 20120319
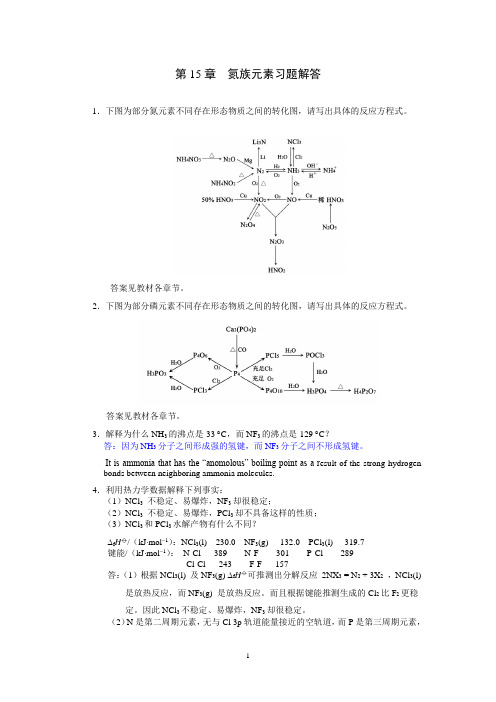
第15章氮族元素习题解答1.下图为部分氮元素不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
2.下图为部分磷元素不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
3.解释为什么NH3的沸点是-33 ︒C,而NF3的沸点是-129 ︒C?答:因为NH3分子之间形成强的氢键,而NF3分子之间不形成氢键。
It is ammonia that has the “anomolous” boiling point as a r esult of the strong hydrogen bonds between neighboring ammonia molecules.4.利用热力学数据解释下列事实:(1)NCl3不稳定、易爆炸,NF3却很稳定;(2)NCl3不稳定、易爆炸,PCl3却不具备这样的性质;(3)NCl3和PCl3水解产物有什么不同?∆f H/(kJ⋅mol-1):NCl3(l) 230.0 NF3(g) -132.0 PCl3(l) -319.7键能/(kJ⋅mol-1):N-Cl 389 N-F 301 P-Cl 289Cl-Cl 243 F-F 157答:(1)根据NCl3(l) 及NF3(g) ∆f H可推测出分解反应2NX3 = N2 + 3X2,NCl3(l) 是放热反应,而NF3(g) 是放热反应。
而且根据键能推测生成的Cl2比F2更稳定。
因此NCl3不稳定、易爆炸,NF3却很稳定。
(2)N是第二周期元素,无与Cl 3p轨道能量接近的空轨道,而P是第三周期元素,最低空轨道是3d轨道,与Cl的3p轨道能量接近,形成的PCl3中的P-Cl键除σ键以外,还有p-d 反馈π键,使P-Cl 键键级大于1,相对稳定。
所以NCl3不稳定、易爆炸,PCl3却不具备这样的性质。
(3)NCl3水解是亲电水解,产物是NH3和HOCl;PCl3水解是亲电加亲核水解,产物H3PO3和HCl。
第四版无机化学20章课后答案

第四版⽆机化学20章课后答案第20章 s区⾦属思考题20-1 在⾃然界中有⽆碱⾦属的单质和氢氧化物存在?为什么?解:在⾃然界中,没有碱⾦属单质及氢氧化物存在,因为碱⾦属是很活泼的⾦属,可被空⽓中的氧所氧化,也可与⾃然界中的⽔反应,故不能以单质存在于⾃然界;碱⾦属的氢氧化物都属于强碱,能与空⽓中的酸性⽓体(如CO2)和⾃然界中的酸性物质作⽤⽣成盐类,所以也不能存在于⾃然界中。
20-2 试根据碱⾦属和碱⼟⾦属元素价电⼦层构型的特点,说明它们化学活泼性的递变规律。
解:碱⾦属价层电⼦构型为ns1;碱⼟⾦属价层电⼦构型为ns2,从上到下,随着电⼦层数的增加,原⼦半径增⼤,核对外层电⼦的吸引⼒减⼩,⾦属活泼性增强。
⽽同周期,从碱⾦属到碱⼟⾦属,由于ns2构型⽐ns1稳定,所以⾦属的活泼性下降。
20-3 为什么半径⼤的s区⾦属易形成⾮正常氧化物?Li、Na、K、Rb、Cs和Ba在过量的氧中燃烧,⽣成何种氧化物?各类氧化物与⽔反应的情况为何?解:因为原⼦半径⼤,空间可容纳较多的氧原⼦,所以可形成⾮正常氧化物,如超氧化物,过氧化物。
碱⾦属在过量的氧中燃烧,Li由于半径特别⼩,只⽣成普通氧化物Li2O,Na⽣成过氧化物Na2O2,K、Rb、Cs皆形成超氧化物(MO2),Ba则形成过氧化物。
各类氧化物与⽔作⽤的通式为:M2O + H2O == 2MOHM2O2 + 2H2O == 2MOH +H2O22MO2 + 2H2O == 2MOH + H2O2 + O220-4 (1)能否⽤NaNO3和KCl进⾏复分解反应制取KNO3?为什么?(2)⽤Na2Cr2O7和KCl制取K2Cr2O7⼜如何?(3)为什么制⽕药要⽤KNO3,⽽不⽤NaNO3?(4)在分析测试中为什么要⽤K2Cr2O7,⽽不⽤Na2Cr2O7作基准试剂?解:(1) 能。
因为反应后⽣成的KNO3和NaCl在⽔中的溶解性不同,前者溶解度随温度变化⼤,⽽后者随温度变化⼩,因此可通过重结晶来分离。
张祖德无机化学答案18-20章

-
加热到 200 C 后 CrO3 逐步分解:CrO3
- -
Cr2O3(绿色) + 2Ba2+ + H2O
21. BaCrO4 在强酸中不易形成酸式盐 Ba(HSO4)2,∴BaSO4 不溶于强酸中。对 BaCrO4 言,强 酸中 CrO42 易转化为 Cr2O72 使 BaCrO4↓溶解: 2BaCrO4 +2H+ 22. 橙 绿 绿:Cr2O72 + 3Zn + 14H+
第十八章
答案
1. 过渡元素的价电子构型一般为(n—1)dxns2,当过渡元素克服电子成对能而失去一个 ns 上 的电子,成为+1 氧化态时,ns 上另一个电子也容易失去,∴+2 氧化态是过渡元素的特征 氧化态。在一些配合物中,过渡元素会显示+1 氧化态, OC 如 氧化态为+1,这是由 EAN 规则决定的。 2. 2Ti3+ + NH3OH+ + H2O
2
4Cr3+ + 2H2O
过渡金属元素习题及答案

本部分内容集中出现在选修三物质的结构与性质,主要考察的知识点有:1、原子或离子的电子排布式;2、分子的结构(特别是配合物结构的考察);3、中心离子的配位数;4、含有过渡元素晶体的密度和化学式的考察。
1.[物质结构与性质]K4[Fe(CN)6]强热可发生反应:3 K4[Fe(CN)6]2 (CN)2↑+12 KCN +N2↑+ Fe3C + C(1)K4[Fe(CN)6]中Fe2+的配位数为(填数字);Fe2+基态外围电子排布式为。
(2)(CN)2分子中碳原子杂化轨道类型为;1molK4[Fe (CN)6]分子中含有键的数目为。
(3)O与CN互为等电子体,则O的电子式为。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为。
2.芦笋中的天冬酰胺(结构如右图)和微量元素硒、铬锰等,具有提高身体免疫力的功效。
(1)天冬酰胺所含元素中, (填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有种。
(3)H2S和H2Se的参数对比见下表。
①H2Se的晶体类型为,含有的共价键类型为。
②H2S的键角大于H2Se的原因可能为。
(4)已知铝(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示A是 (填元素符号),B的价电子排布式为。
3.由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe3+的基态核外电子排布式。
(2)HCHO分子中碳原子轨道的杂化轨道类型为;1mol HCN 分子中含有σ键的数目为__________mol。
(3)N2O的空间构型为,与N2O互分等电子体的一种离子为。
(4)TiO2的天然晶体中,最稳定的一种晶体结构如下图,则黑球表示原子。
4.我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。
无机化学课后习题答案

第一章原子结构和元素周期律1-1. 不可能存在的是:(1)(2)(5)(6)(7)(8)1-2. C1-3. D1-4. D1-5. A1-6. B1-7. B1-8. A为Ca ,B为Mn ,C为Br ,D 为O1-9. A为Na ,B为Mg ,C为Al ,D 为Br ,E 为I ,F 为Cr第二章分子结构与晶体结构2-1. A2-2. C2-3. B2-4. B2-5. C2-6. AD2-7. BD2-8. D2-9. LiH属于s-s,HCl属于s-p,Cl2属于p-p2-10. 主要形成离子键的有:(1),(3),(8)主要形成极性共价键的有:(2),(5),(6),(7)主要形成非极性共价键的有:(4)第三章化学热力学基础3-1. C3-2. A3-3. D3-4.U3-6. (1)不对,可通过作功形式改变温度;(2)不对,热力学能的绝对值目前无法测得,热力学第一定律表达式中有ΔU而不是U;(3)对,冰熔化成0℃水需要吸热。
3-7.3-8.133 kJ·mol-13-9.解:(1)向真空膨胀W1 =-(2)恒外压膨胀J(3)两步恒外压膨胀J由于W3>W2>W1,说明膨胀次数愈多,则体系与环境的压力差愈小,做的功愈大。
3-10.解:=0.01 m3=810.5 JU =H = 0 ,Q = W = 810.6 J第四章化学动力学基础4-1. D 4-2. D 4-3. C 4-4. D 4-5. A4-6. C 4-7. D 4-8. B第五章 化学平衡与平衡原理5-1. 增加总压平衡向左移动;注入惰性气体平衡不变;升高温度平衡向右移动。
5-2. O H 2,+O H 3。
可以作为酸的有:-3HCO ;可以作为碱的有:33,,Ac NH HCO --。
5-3. 溶解度不变。
5-4. (1)AgCl 的溶解度会降低,但对溶度积没影响; (2)AgCl 的溶解度会增加,不影响溶度积; (3)AgCl 的溶解度会增加,不影响溶度积。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第20章d区过渡金属元素习题解答1.为什么过渡元素中,同族元素从上到下高氧化态物质的稳定性升高,而过渡后的p区元素同族自上而下低氧化态的物质趋于稳定?2.自ⅣB族到ⅦB族元素的最高氧化态在溶液中为什么不存在简单的离子M4+、M5+、M6+?3.为什么d区金属的密度、硬度、熔点、沸点一般较高?4.过渡元素的氧化态分布有何特点?5.由MnO2制备锰酸盐应在酸性介质还是碱性介质中进行?欲把Mn2+ 离子氧化为MnO4–离子应选用何种氧化剂?6.Cr3+与Al3+在生成化合物方面有何异同?7.根据下列实验现象,写出相应的化学反应方程式:(1)在酸性K2Cr2O7溶液中加入Na2SO3溶液,颜色由橙红变蓝绿色,此时加入乙醚,并用HNO3酸化,溶液变为深蓝色。
(2)黄色的BaCrO4溶在浓盐酸中,得到的是绿色溶液,写出化学方程式,说明颜色变化。
(3)Fe2(SO4)3溶液与Na2CO3溶液作用,得不到Fe2(CO3)3。
(4)在水溶液中用Fe3+与KI作用,不能制得FeI3。
(5)向Fe3+溶液中加入KSCN后出现红色,若再向溶液中加入Fe粉或NH4F晶体,红色又消失;(6)向CoCl2溶液中加入NaOH溶液,先析出粉红色沉淀,沉淀很快又转为灰绿色至褐色。
8.写出下列反应的化学方程式:(1)TiO2(s) + BaCO3(s) → ;(2)V2O5(s) + HCl(aq) → ;(3)Cr2O72–(aq) + Ag+(aq) + H2O(l) → ;(4)[Cr(OH)4]–(aq) + H2O2(l) + OH–(aq) → ;(5)MnO4–(aq) + Fe2+(aq) + H+(aq) → ;(6)MnO2(s) + HCl(aq,浓) → ;(7)Cr3+(aq) + MnO4–(aq) + H2O(l) → ;(8)Co2O3(s)+ HCl (aq,浓) → ;(9)K3[Fe(CN)6] (aq) + Fe2+(aq) → ;(10)PO43–(aq) + (NH4)2MoO4(aq) + H+(aq) → ;(11)PdCl2(aq) + CO(g) + H2O(l) → ;(12)Pt(s) + HNO3(aq) + HCl(aq) → 。
9.如何鉴别Fe3+、Fe2+、Co2+、Ni2+?写出反应方程式。
10.制备下列物质,写出反应方程式和反应条件。
(1)由钛铁矿制备四氯化钛。
(2)以铬铁矿Fe(CrO2)2为原料制取重铬酸钾K2Cr2O7。
(3)用二氧化锰作原料硫酸锰、锰酸钾和高锰酸钾。
11.某亮黄色溶液A,加入稀H2SO4转为橙色溶液B,加入浓HCl又转为绿色溶液C,同时放出能使淀粉KI试纸变色的气体D。
另外,绿色溶液C加入NaOH溶液即生成灰蓝色沉淀E,经灼烧后E转为绿色固体F。
试判断上述A、B、C、D、E、F各为何物?12.某深绿色固体A可溶于水,其水溶液中通入CO2即得棕黑色沉淀B和紫红色溶液C。
B与浓HCl共热时放出黄绿色气体D,溶液几乎无色,将此溶液和C的溶液混合,又得沉淀B。
将气体D通入溶液A,则得C。
试判断A是哪种钾盐。
写出有关的反应方程式。
13.说明变色硅胶的吸湿显色机理。
14.试分别用杂化轨道理论和晶体场理论解释为什么[Co(CN)6]4-在空气中容易被氧化为[Co(CN)6]3-。
15.试用杂化轨道理论讨论[Ni(CN)4]2-的杂化、成键过程,并预测其磁性。
16.分离Fe3+、Al3+、Zn2+和Cr3+的混合物。
17.用硫酸、石灰和亚硫酸氢钠,试设计一个从含Cr(VI)、Cr(III)的废水中除去铬的简单方案,并写出各步有关化学方程式。
18.通过计算说明下列情况下有无碘析出?(设有关物质浓度均为1 mol·dm–3)(1)Fe3+溶液中加入I–溶液;(2) Fe3+溶液中先加入过量NaCN,再加入I–溶液。
已知:E O(Fe3+/Fe2+) =0.771 V,E O(I2/I–) =0.535 V,lg OK稳[Fe(CN)63–] =42,lg OK稳[Fe(CN)64–] =35。
19.水溶液中Co(III)离子能氧化水,E O(Co3+/Co2+) =1.84 V,E O(O2/H2O) =1.23 V。
通过计算,说明[Co(NH3)6]3+在1.0 mol·dm–3氨水溶液中是否能氧化水。
已知:[Co(NH3)6]3+的OK稳= 1.4×1035,[Co(NH3)6]2+的OK稳= 2.4×104。
20.称取铁矿0.2000 g,经酸溶解和还原处理后,用0.01000 mol·dm–3K2Cr2O7标准溶液滴定,用去24.35 cm3,计算铁矿中铁的含量。
1. 为什么过渡元素中,同族元素从上到下高氧化态物质的稳定性升高,而过渡后的p区元素同族自上而下低氧化态的物质趋于稳定?答:对于p区元素,由于惰性电子对效应,同族自上而下低氧化态的物质趋于稳定。
而对于过渡元素,其外层电子排布与主族元素不同,即过渡金属元素原子随着有效核电荷增加,(n–1)d电子的电离倾向减小;此外,由于d电子云发散作用,形成d–p π键的能力3d < 4d < 5d,所以第二、三过渡系列元素的高氧化态趋于稳定。
2. 自ⅣB族到ⅦB族元素的最高氧化态在溶液中为什么不存在简单的离子M4+、M5+、M6+?答:由于ⅣB族到ⅦB族元素的最高氧化态离子的电荷高,半径小,因此溶液中不存在简单的离子M4+、M5+、M6+。
3. 为什么d区金属的密度、硬度、熔点、沸点一般较高?答:d区过渡元素的原子半径自左向右,随着有效核电荷依次增大,原子半径依次减少,原子质量依次增大,所以金属晶体密度自左向右一般是增大,由于镧系收缩影响,IVB~VIII 族的同一族中,第三系列和第二系列过渡元素的原子半径很接近,使得第三过渡系列金属密度特别大。
d区元素原子除最外层s电子外,次外层d电子也可参与形成金属键,自左向右未成对价电子增多,至VIB族可以提供6个单电子,晶格结点粒子间的距离短,相互作用力大,金属键强,因此d区金属的硬度、熔点一般较高。
4. 过渡元素的氧化态分布有何特点?答:第一过渡系列两端元素的氧化态变化少、氧化态低;中间元素的氧化态变化多,氧化态高。
5. 由MnO2制备锰酸盐应在酸性介质还是碱性介质中进行?欲把Mn2+ 离子氧化为MnO4–离子应选用何种氧化剂?答:碱性;PbO2, NaBiO3, (NH4)2S2O8。
6. Cr3+与Al3+在生成化合物方面有何异同?答:两者都具有两性,易形成各种类似的矾盐。
但是Cr3+易形成配位化合物,如与Al3+与氨水反应生成沉淀,而Cr3+则可与氨形成配位离子。
7. 根据下列实验现象,写出相应的化学反应方程式:(1) 在酸性K2Cr2O7溶液中加入Na2SO3溶液,颜色由橙红变蓝绿色,此时加入乙醚,并用HNO3酸化,溶液变为深蓝色。
(2) 黄色的BaCrO4溶在浓盐酸中,得到的是绿色溶液,写出化学方程式,说明颜色变化。
(3) Fe2(SO4)3溶液与Na2CO3溶液作用,得不到Fe2(CO3)3。
(4) 在水溶液中用Fe3+与KI作用,不能制得FeI3。
(5) 向Fe3+溶液中加入KSCN后出现红色,若再向溶液中加入Fe粉或NH4F晶体,红色又消失;(6) 向CoCl2溶液中加入NaOH溶液,先析出粉红色沉淀,沉淀很快又转为灰绿色至褐色。
解:(1)在酸性K2Cr2O7溶液中加入Na2SO3溶液,颜色由橙红变蓝绿色,此时加入乙醚,并用HNO3酸化,溶液变为深蓝色。
Cr2O72–(aq) + 3SO32- (aq) + 8H+(aq) =2Cr3+(aq) + 3SO42- (aq) + 4H2O(l)HCrO42–(aq) + 2H2O2(aq) + H+(aq) =2CrO(O2)2(aq) + 3H2O(1)(2)当黄色的BaCrO4溶在浓盐酸中,得到的是绿色溶液,写出化学方程式。
2BaCrO4(s) +16H+(aq) + 6Cl-(aq) =2Ba2+ (aq) + 2Cr3+(aq) +8H2O(1)+3Cl2(g)(3) Fe2(SO4)3溶液与Na2CO3溶液作用,得不到Fe2(CO3)3。
2Fe3+(aq) + 3CO32- + 3H2O(1) =2Fe(OH)3(s) + 3CO2(g)(4) 在水溶液中用Fe3+与KI作用,不能制得FeI3。
2Fe3+(aq) + 2I–(aq) =2Fe2+(aq)+ I2(s)(5) 向Fe3+溶液中加入KSCN后出现红色,若再向溶液中加入NH4F晶体,红色又消失;Fe3+(aq)+ n SCN−(aq) =[Fe(NCS)n]3–n(aq)[Fe(NCS)n]3–n(aq) + 6F–(aq) =[FeF6]3–(aq)+ n SCN−(aq)(6) 向CoCl2溶液中加入NaOH溶液,先析出粉红色沉淀,沉淀很快又转为灰绿色至褐色。
Co2+(aq)+ OH-(aq) =Co(OH)2(s)4Co(OH)2(s) + O2(g) =4CoO(OH) + 2H2O(1)8. 写出下列反应的化学方程式:(1) TiO2(s) + BaCO3(s) →(2) V2O5(s) + HCl(aq) →(3) Cr2O72–(aq) + Ag+(aq) + H2O(l) →(4) [Cr(OH)4]–(aq) + H2O2(l) + OH–(aq) →(5) MnO4–(aq) + Fe2+(aq) + H+(aq) →(6) MnO2(s) + HCl(aq,浓) →(7) Cr3+(aq) + MnO4–(aq) + H2O(l) →(8) Co2O3(s)+ HCl (aq,浓) →(9) K3[Fe(CN)6] (aq) + Fe2+(aq) →(10) PO43–(aq) + (NH4)2MoO4(aq) + H+(aq) →(11) PdCl2(aq) + CO(g) + H2O(l) →(12) Pt(s) + HNO3(aq) + HCl(aq) →解:(1)TiO2(s) + BaCO3(l) =BaTiO3(s) + CO2(g)(2)V 2O 5(s) + 6HCl(aq) = 2VOCl 2(aq) + Cl 2(g) + 3H 2O(l)(3)Cr 2O 72–(aq) + 4Ag +(aq) + H 2O(l) = 2H +(aq) + 2Ag 2CrO 4(s)(4)2[Cr(OH)4]–(aq) + 3H 2O 2(l) +2OH –(aq) = CrO 42–(aq) + 8H 2O(l)(5)MnO 4–(aq) + 5Fe 2+(aq) + 8H +(aq) = Mn 2+(aq) + Fe 3+(aq) + 4H 2O(l)(6)MnO 2(s) + 4HCl(aq ,浓) = MnCl 2(aq) + Cl 2(g) + 2H 2O(l)(7)10 Cr 3+(aq) + 6MnO 4–(aq) + 11H 2O(l) = 5Cr 2O 72–(aq) + 6Mn 2+(aq) + 22H +(aq)(8)Co 2O 3(s) + 6HCl (aq ,浓) = 2Co 2+(aq) + 3Cl 2(g) + 3H 2O(l)(9)K 3[Fe(CN)6] (aq) + Fe 2+(aq) = KFe[Fe(CN)6] (s) +2K +(aq)(10)PO 43–(aq) + 12(NH 4)2MoO 4(aq) + 24H +(aq) = (NH 4)3[PMo 12O 40 ](s) + 21NH 4+(aq) +12H 2O(l)(11)PdCl 2(aq) + CO(g) + 2H 2O(l) = Pd(s) + CO 2 (g) + HCl(aq)(12)3Pt(s) + 4HNO 3(aq) + 18HCl(aq) = 3H 2[PtCl 6](aq) + 4NO(g) + 8 H 2O(l)9. 如何鉴别Fe 3+、Fe 2+、Co 2+、Ni 2+?写出反应方程式。
