维生素B6注射液工艺流程图
03维生素B6注射液工艺规程分则

主题内容与适用范围1.本标准在小容量注射剂工艺规程通则的基础上,规定了维生素B6注射液的处方与依据,原辅材料、中间产品、成品质量标准、半成品的检验方法和控制、原辅材料的消耗定额等内容2.本标准适用于维生素B6注射液的生产质量控制及检查。
产品名称、剂型、规格1.产品名称:1.1.通用名称:维生素B6注射液1.2.汉语拼音:WeishengsuB6Zhusheye1.3.英文名:VitaminB6Injection2.规格:2ml:0.1g1ml:50mg3.剂型:注射剂4.性状:本品为无色或微黄色的澄明液体。
产品处方和依据1.维生素B650g氯化钠8.5g乙二胺四乙酸二钠0.02g活性炭0.1〜0.5%0注射用水加至1000ml2.依据:中国药典2005年版二部3.批准文号:国药准字H370214614.滤器要求:除炭过滤(5pm聚乙烯烧结棒)、粗滤(5pm聚乙烯烧结棒)、保证过滤(0.45pm滤芯)、精滤(0.22pm滤芯)。
5.药液配制5.1.根据配制量,向浓配罐内注入配制总量1/2的注射用水(温度90°C左右),打开入料口盖向上反放稳妥。
5.2.启动搅拌电源开关进行搅拌,边搅拌边向浓配罐内加入称量好的氯化钠、维生素B6粉、活性炭,关闭搅拌电源开关,用洁净搅拌棒手工搅拌5〜6分钟(防止浓配罐底原料堆积结块)。
启动自动搅拌,搅拌15分钟关闭。
5.3.关紧所需进料的稀配罐底出料口阀门,打开进料口阀门,打开浓配罐底放料口阀门。
5.4.启动浓配输液泵,将浓配液输送至稀配罐中,药液全部进入稀配罐时关闭输液泵.5.5.向清洗球内通入注射用水冲洗浓配罐内壁的残存药液,待冲洗水适量时,关闭冲洗水,再打开输送阀将冲洗水输送于稀配罐,关闭输送泵.同法洗涤两次,洗涤水全部过滤输送至稀配罐.5.6.打开夹层进水阀进行降温处理。
5.7.向稀配罐内注入注射用水至配制总量关闭注射用水阀。
5.8.启动稀配罐自动搅拌,开启惰性气体阀门,关闭精滤阀,打开回流阀,让药液通过粗滤循环。
维生素B6注射液批生产记录20130122
2.记录操作区温度:18-26℃湿度:45%-65%压差≥10Pa
温Байду номын сангаас:℃湿度: %压差:Pa
3.配剂室无与本批生产无关的物料,设备清洁合格。
□符合要求□不符合要求
4.配剂所用容器具已清洁并在有效期内。
□符合要求□不符合要求
5.检查配剂用本批记录文件齐全。
□齐全□不齐全
6.本批生产的房间状态标志牌已换挂。
□已挂标识牌□未挂标识牌
2.滤前气泡点试验
按气泡点试验方法对0.45µm、0.22µm的滤芯做气泡点试验,要求如下:0.45µm压力:≥0.20Mpa
0.22µm压力:≥0.25Mpa并附打印记录
0.45µm:压力:Mpa
0.22µm:压力:Mpa
3.药液管道的配剂前清洗
配剂罐、药液管道及过滤系统的配剂前清洁按SOP-CLP 309进行操作。清洗时间为30分钟以上。
□ 已清洗清洗时间:-
□ 未清洗
4.配剂操作
1.配剂罐内加配剂量约90%的注射用水,水温室温(10~30℃)
加注射用水ml水温:℃
岗位:
QA:
2.将维生素B6投入注射用水中,搅拌3+1分钟。
□按要求操作□未按要求操作
3.补加注射用水至全量。
注射用水加至ml
4.用5%碳酸氢钠溶液40ml-45ml缓慢加入上述溶液中,搅拌循环5分钟后测PH值在2.8—3.3。
3.灌封室设备清洁合格。
□符合要求□不符合要求
4灌封所用器具已清洁并在有效期内。
□符合要求□不符合要求
5.灌注系统及管道已清洗/灭菌并在有效期内。
□符合要求□不符合要求
6.检查灌封用本批记录文件齐全。
1012维生素B6注射液质量标准

1. 目的:建立维生素B注射液成品质量标准。
6注射液成品。
2. 范围:维生素B63. 术语或定义: N/A4. 职责:质量保证部、质量控制部5. 内容:5.1 产品名称5.1.1 中文名称:维生素B注射液6ZhuSheYe5.1.2 拼音名:Weishengsu B65.1.3 产品代码:C018 C0195.2 标准依据2010年版《中华人民共和国药典》5.3 处方依据及处方5.3.1 处方依据2010年版《中华人民共和国药典》5.3.2 处方5.3.2.1 处方1:规格2ml:0.1g维生素B50g6活性炭适量注射用水加至 1000ml制成1000ml5.3.2.2 处方2:规格2ml:50mg25g维生素B6活性炭适量注射用水加至 1000ml制成1000ml5.4 取样时,应检查的物理外观特性、取样方法、数量及取样地点:执行《取样标准操作规程》(SMP-QA022-00)。
5.5 质量标准及检查方法[性状]本品为无色至微黄色的澄明液体注射液成品检验操作规程》(SOP- QC1012-00)进行检验,必须符合[检查]按《维生素B6所有下述各项指标要求。
[外观]安瓿外观应光滑、均匀、端正、无条纹、气泡及毛口、无裂纹等。
印字及说明书字迹清晰、端正、无套印、偏斜。
纸盒要美观、大方、牌面文字清晰、图案端正、颜色搭配合理,端正不斜。
纸箱上喷印的批号、有效期限、生产日期等均应在相应的位置上,字迹清晰,易识读。
包装材料在包装过程中不得粘染污物,包装过程包装材料不得遗漏。
5.6 剂型:注射剂5.7 规格:2ml:50mg 2ml:0.1g包装规格:10×2ml/支/盒5.8 功能主治:5.8.1 适用于维生素B缺乏的预防和治疗,防治异烟肼中毒;也可用于妊娠、放射病及6抗癌药所致的呕吐,脂溢性皮炎等。
的补5.8.2 全胃肠道外营养及因摄入不足所致营养不良、进行性体重下降时维生素 B6充。
需要量增加:妊娠及哺乳期、甲状腺功能亢进、烧伤、长期5.8.3 下列情况对维生素B6慢性感染、发热、先天性代谢障碍病(胱硫醚尿症、高草酸盐症、高胱氨酸尿症、黄嘌呤酸尿症)、充血性心力衰竭、长期血液透析、吸收不良综合症伴肝胆系统疾病(如酒精中毒伴肝硬化)、肠道疾病(乳糜泻、热带口炎性肠炎、局限性肠炎、持续腹泻)、胃切除术后。
输液、注射液制剂生产流程5ppt课件

完整版课件
18
(5)注射液的灭菌与检漏
注射剂的灭菌
检漏
1~5ml安瓿:100℃30min 10~20ml安瓿:100℃45min 不 同 批 号 或 相 同 的 色 泽 , 不 同品种的注射剂,不得在同一 灭菌区同时灭菌。 注 射 剂 从 配 制 到 灭 菌 , 必 须 在规定时间内完成(12h)。 凡 能 耐 热 的 产 品 , 宜 采 用
完整版课件
28
(3) 柴胡注射液
【处方】北柴胡 氯化钠 吐温80 注射用水 加至
1000g 8.5g 10ml 1000ml
(主药) (等渗调节剂)
(增溶剂) (溶剂)
【制备】柴胡→10倍量的水→加热回流6h →蒸馏,初蒸 馏6000ml →重蒸馏至1000ml水→氯化钠、吐温80→过 滤→灌封→100℃, 30min灭菌。
6.安瓿的干燥和灭菌 一般置于120-140℃干燥;180℃,1.5h干热灭菌。 大生产中多采用隧道式烘箱,主要由红外线发射装置
和安瓿传送装置组成。
完整版课件
8
(三)注射液的配制与过滤
1.注射液的配制 (1)配制用具的选择与处理
常用装有搅拌器的夹层锅配液 用具的材料:玻璃、耐酸碱搪瓷、不锈钢、聚乙烯等。 用具的处理:清洁液或洗涤剂洗净→新鲜注射用水荡洗 (或灭菌)→备用,使用完毕后立即刷洗干净。 (2)配制方法 浓配法:配制药物浓溶液→过滤 →稀释 稀配法:一次配置成所需浓度的药物溶液→过滤
完整版课件
29
第四节 输液
一、概述 输液(infusion solution):是由静脉滴注输入 体内的大剂量(一次给药在100ml以上)注射液。 不含防腐剂或抑菌剂 包装:玻璃或塑料的输液瓶或袋 使用:输液器
维生素注射液生产工艺验证方案

验证周期:每 季度进行一次
全面验证
验证频率:每 年至少进行一
次全面验证
验证内容:包 括生产工艺、 设备、原材料、 人员操作等方
面
验证目的:确 保生产工艺稳 定可靠,提高 产品质量和生
产效率
验证周期:根据产频率:在验证周期内,对关键工艺参数进行定期检查和评估,确保工艺的稳定性和产品 质量的一致性 局部验证:针对产品或工艺的变更,进行局部验证,确保变更不会对产品质量产生不良影响
验证频率:根据生产计划和市场需求确定验证频率,确保产品在生产过程中的质量稳定性和 可靠性。
验证目的和范围
验证结果
添加标题
添加标题
验证方法
添加标题
添加标题
结论和建议
验证报告审核:对验证报告进行全 面审核,包括数据完整性、准确性、 一致性等方面
验证记录审核:对验证过程中的记 录进行审核,确保其真实、准确、 完整
性
确保维生素注射液的安全性和有效性 确保生产工艺的稳定性和可靠性 确保产品质量的一致性和可重复性 确保产品符合相关法规和标准要求
降低生产成本 提高产品质量 确保生产工艺的稳定性和可靠性 符合法规要求,保证产品安全有效
设备类型:包括原料处理设备、混合设备、灌装设备等 设备数量:根据生产规模确定 设备状态:确保设备处于良好状态,符合生产要求 设备校准:定期对设备进行校准,确保生产精度和质量
质量标准:根据产品标准和相关法规,制定详细的质量标准,确保产品质量符合标准要求
生产计划:根据生产计划安排验证周期和频率,确保生产过程中的产品质量和稳定性。
市场需求:根据市场需求调整验证周期和频率,以满足客户需求和提高市场竞争力。
验证周期:根据生产计划和市场需求确定验证周期,确保产品在关键生产阶段得到充分验证。
年产90吨维生素B6的制备加成过程工艺设计

学号:0120620400210课程设计年产90吨维生素B6的制备题目加成过程工艺设计学院化学工程学院专业制药工程班级制药0602姓名指导教师2010 年 1 月29 日目录1绪论 (3)2设计依据 (6)3工艺路线论证 (7)4工艺流程设计 (8)5生产工艺与流程概述 (9)6物料衡算 (9)7热量衡算 (12)8设备选型 (22)9车间布置设计 (27)10车间人员组成 (29)11劳动保护、安全生产及三废处理 (31)12小结与体会 (34)13参考资料 (35)1绪论1.1产品概述1.1.1名称、化学结构、理化性质1.1.1.1名称法定名称 维生素B 6 VitaminumB 6 VitamineB 6化学名称:6-甲基-5-羟基-3,4-吡啶二甲醇盐酸盐 商品名称: 盐酸吡多辛PyridoxineHydrochloride1.1.1.2化学结构 结构式:分子式: C 8H 11O 3N •HCl(分子量205.64)1.1.1.3理化性质本品为白色或类白色,结晶或结晶性粉末,无臭,味微苦遇光渐变质。
本品易溶于水(1:4.5),微溶于乙醇(1:90)。
微溶于丙酮,不溶于乙醚或氯仿。
水溶液呈酸性反应(10%水溶液PH2.4-3.0)。
水溶液对浓酸或热碱液都比较稳定,在过氧化剂或光的照射下易破坏,在中性水溶液中加热到120℃即发生聚合,形成二聚体或三聚体。
NCH 2OHCH 2OHHOH 3CHCl1.2质量标准、临床用途1.2.1质量标准1.2.2临床应用本品为具有酶作用的维生素,参与氨基酸及脂肪酸的代谢。
临床上可以治疗各种因缺乏维生素B6引起的病症,如癞皮症,皮脂溢出性皮炎、恶性贫血,妊娠呕吐、肌无力和颗粒型白血球缺乏症。
也可以治疗脑炎后遗症及其它类型的帕金森氏综合症。
能预防因服异烟肼而引起的神经炎。
对肝病,血管硬化或短波辐射所引起的灼伤也有疗效。
1.2.3包装规格要求及贮藏2设计依据2.1设计条件加成过程投料量一览表设产品的年产量为80~120吨维生素B 6,酯草过程收率为95%,环合过程收率为80%,加成过程收率为90%,精制过程收率为75%,七环过程收率为65%。
注射用维生素B6工艺验证方案0

验证报告编号:2305·429-00注射用维生素B6工艺验证方案起草人:日期:年月日审核人:日期:年月日批准人:日期:年月日×××药业有限公司注射用维生素B6(0.2g规格)生产工艺验证方案目录2.验证目的3.验证范围4. 验证小组成员及职责范围4.1 验证小组成员4.2 验证小组成员职责范围5.验证进度计划6.粉针主要生产设备一览表7.生产洁净区的划分及工艺流程8.生产和检验标准文件的引用9.产品生产工艺过程综合指标确认10.验证内容11. 验证条件监控12.拟订验证周期13. 验证结果评价与结论14.验证会签1 概述:本公司生产的注射用维生素B6,其规格为0.2/瓶。
为了证明在执行SP-MF-000-000-00注射用维生素B6生产工艺规程的情况下,能稳定地生产出符合质量标准的产品。
在这之前验证小组已对空调净化系统、纯化水和注射用水系统,以及在线设备分别进行了验证合格,同时对生产线也进行了验证合格,所以本方案主要就该产品生产工艺规程及其生产过程和最终产品质量等进行验证并作出评价。
2目的:为了证明在执行SP-MF-000-000-00注射用维生素B6生产工艺规程的情况下,连续生产三批,最终产品稳定性、可靠性并符合标准要求。
3 范围: 本验证方案适用于冻干车间的厂房、设施、设备、工艺条件下注射用维生素B6(0.2g规格)的生产,当上述条件发生改变时,应重新验证。
4 验证小组成员及职责范围:4.1验证小组成员:4.2.1制造部:负责起草验证方案和有关规程,按批准的验证方案起草验证方案,组织培训考核人员,组织实施验证并同时收集验证资料,会签验证报告。
4.2.2 质量部:检验方法验证、取样、检验、结果评价,结果评价方案,验证文件的文件管理,对供应商的确认。
QA:负责悬浮粒子、沉降菌主要工序温度、相对湿度及压差检查、及设备、设施的无菌、原辅料、内外包材、中间产品、成品取样。
大容量注射剂生产实用工艺流程图

大容量注射剂生产实用工艺流程图目录1.大容量注射剂生产区概况2.需要验证的关键工序及工艺验证3.工艺流程的实施4.操作过程及工艺条件5.技术安全、工艺卫生及劳动保护6.物料平衡及技经指标7.设备一览表8.岗位定员9.附件(含设备操作、清洁规程)10.变更记录1.大容量注射剂生产区概况本生产区面积904㎡,其中1万级净化区域167㎡,10万级净化区域174㎡。
大容量注射剂车间采用10万级和1万级(局部百级)空气净化洁净级别,10万级区域设置缓冲、更衣、洗涤、洁具、称量、配碳、浓配、洗瓶等,1万级区域设置缓冲、更衣更鞋、稀配、化验、灌装、加塞、轧盖、洗涤、存放、洁具等功能间,所有隔断采用无粉尘产生的静电喷涂彩钢板,结合处采用圆角处理,不易产生积灰;人员经过三次更衣和二次更鞋后进入洁净区操作,物料进入洁净区均采用传递窗或气闸进行传递,人流、物流的进入相对分开,保证了洁净区空气洁净度要求;生产设备均采用优质不锈钢材料制造,采用洗瓶、灌装、压塞、轧盖联动线生产,其中洗瓶出口、灌装、加塞采用百级层流保护,灭菌器采用水浴式灭菌器。
1.1 大容量注射剂生产工艺流程图(见后页)1.2 大容量注射剂生产区工艺布局布置图(见后页)1.3 大容量注射剂生产区工艺设备布置图(见后页)1.4 大容量注射剂生产区送回风口平面布置图(见后页)以上项目按验证文件规定,均已在规定周期内进行相关的验证,验证方案及报告见相应文件。
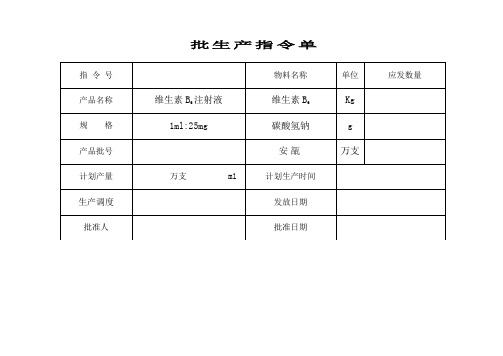
大容量注射剂生产工艺流程图3.1 批生产指令的签发3.1.1 批生产指令由车间技术负责人根据生产计划表起草,并依据产品工艺规程于生产前一个工作日制定。
3.1.2 批生产指令应经QA质监员审核并签字,由车间主任签字批准后生效。
3.2 生产批记录的发放3.2.1 除配制工序和包装工序外,工序相应的生产批记录于生产当日由车间工艺质监员发放给各工序负责人,并于工序结束当日填写完整返回车间工艺质监员处汇总。
3.2.2 配制工序和包装工序的生产批记录于生产前一天由车间工艺质监员随同批生产指令或批包装指令一同发放,并于工序结束当日填写完整返回车间工艺质监员处汇总。
