ELLMAN试剂法测定自由巯基和二硫键
Ellman’s assay

5,5-二硫二硝基苯甲酸 DTNB 现货供应产品描述:DTNB为Ellman试剂。
它用于比色法测定生物样品中巯基。
它易溶于水。
在巯基化合物的存在下,无色的DTNB将被转变成黄色的5-巯基-2-硝基苯甲酸。
由于5-巯基-2-硝基苯甲酸在412 nm处具有最大吸收,DTNB的吸收光谱并不干扰巯基的测定。
配置方法:准确称取0.198gDTNB用50mMNa2HPO4(pH=7.0)配制成50ml溶液,存放于棕色瓶中,于暗处低温保存备用。
应该注意的是配置缓冲、浓度,储存时要避免见光。
应用举例:半胱氨酸中自由巯基的定量检测方法一、试剂的配制:1、Tris-HCL缓冲液(0.25M):DDW准确配制后,用盐酸调节pH=8.3;2、半胱氨酸标准溶液(1mM):准确称取0.017563gL-半胱氨酸(175.63),用1ml甲酸溶解,以DDW定容至100ml;3、DTNB(分子量:396.35)标准溶液(10mM):准确称取0.198175gDTNB用50mMNa2HPO4(pH=7.0)配制成50ml溶液,存放于棕色瓶中,于暗处低温保存备用4、DTNB分析溶液(0.1mM):由1体积10mMDTNB标准液加99体积0.25M的Tris缓冲液配制而成,现用现配。
二、标准曲线的制作;1、25℃条件下,用Tris缓冲液稀释半胱氨酸标准液配成梯度的稀释液(5.0ml),其浓度分别为:0.00mM、0.025mM、0.05mM、0.1mM、0.15mM、0.2mM;2、取上述各浓度溶液1ml分别加入到5ml预先恒温于25℃水中的DTNB分析溶液,摇匀,准确静止10min,立即于波长412nm处测定吸光度值(A)。
根据目的蛋白的吸光度在标准曲线上读出对应的浓度即可Product Name:DTNBProduct Number:D8130Product Brand:SigmaCAS Number:69-78-3Molecular Formula:[-SC6H3(NO2)CO2H]2 Molecular Weight:396.35Ordering Information。
ellman测巯基
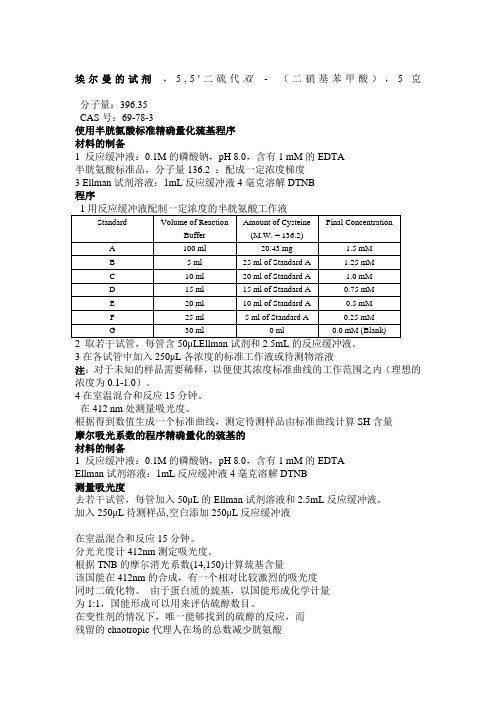
埃尔曼的试剂,5,5'二硫代双-(二硝基苯甲酸),5克分子量:396.35CAS号:69-78-3使用半胱氨酸标准精确量化巯基程序材料的制备1 反应缓冲液:0.1M的磷酸钠,pH 8.0,含有1 mM的EDTA半胱氨酸标准品,分子量136.2 :配成一定浓度梯度3 Ellman试剂溶液:1mL反应缓冲液4毫克溶解DTNB程序3在各试管中加入250μL各浓度的标准工作液或待测物溶液注:对于未知的样品需要稀释,以便使其浓度标准曲线的工作范围之内(理想的浓度为0.1-1.0)。
4在室温混合和反应15分钟。
在412 nm处测量吸光度。
根据得到数值生成一个标准曲线,测定待测样品由标准曲线计算SH含量摩尔吸光系数的程序精确量化的巯基的材料的制备1 反应缓冲液:0.1M的磷酸钠,pH 8.0,含有1 mM的EDTAEllman试剂溶液:1mL反应缓冲液4毫克溶解DTNB测量吸光度去若干试管,每管加入50μL的Ellman试剂溶液和2.5mL反应缓冲液。
加入250μL待测样品,空白添加250μL反应缓冲液在室温混合和反应15分钟。
分光光度计412nm测定吸光度。
根据TNB的摩尔消光系数(14,150)计算巯基含量该国能在412nm的合成,有一个相对比较激烈的吸光度同时二硫化物。
由于蛋白质的巯基,以国能形成化学计量为1:1,国能形成可以用来评估硫醇数目。
在变性剂的情况下,唯一能够找到的硫醇的反应,而残留的chaotropic代理人在场的总数减少胱氨酸目前可以衡量的。
经处理后减少的蛋白质与chaotropes及DTNB能够产生的半胱氨酸总数(半胱氨酸巯基加半胱氨酸-β-半胱氨酸)。
- -反应是敏感的碱性pH值(俄亥俄州)与RS竞争),酸性pH值(二硫化物可以打破),氧(R的巯基再氧化),以及温度(热致变色)。
因此,通常的反应是进行了过多的DTNB的蛋白质,在中性pH值固定的温度,erature,有时在厌氧条件。
ELLM试剂法测定自由巯基和二硫键

E L L M试剂法测定自由巯基和二硫键Prepared on 22 November 2020ELLMAN试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoicacid(DTNB)5,5-二硫基-双(2-硝基苯甲酸)5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB)[1]。
TNB2-在412nm有很强的吸收,可以用于对肽段的自由巯基进行定量分析[2]。
DTNBTNB2-根据文献记载,TNB的吸光系数在*103M-cm-~*103M-cm-之间[3,4]。
吸光度测量的最灵敏范围在之间。
A=εbc,其中A为吸光度,ε是摩尔吸收光系数或消光系数,ε单位为升/(摩尔·厘米)[L/(mol·cm)]。
以吸光度下限来计算(吸光系数取*103M-cm-),需要TNB的浓度为c=(*103LM-cm-*1cm)=*10-5mol/L*10-8mol/ml),需要蛋白浓度为*10-5mol/L*18790g/mol=L=ml.我们的条件可以达到这个检测限度。
ELLMAN试剂法测定自由巯基主要的影响因素有:1.EDTA的适量加入有助于TNB显色的稳定和成梯度线性关系[5]。
2.在不同缓冲液中,TNB的最大吸收波长略微不同,所以它们在412nm的吸收也不3.同,要根据选择的缓冲液来确定[5]。
另外,TNB的分光光度法分析对SDS很敏感[6]。
4.DTNB随着pH的升高,降解速度加快。
在,其降解速度为%/h,在5.pH值,其降解速度为%/h,随着pH值得升高,降解速度加快,在pH12时,15min之内会完全降解[7,8]。
6.摩尔吸收光系数在不同的温度下不同,随温度的升高而下降[4].试验方案主要材料:1.材料PEG-G-CSF批号:080229浓度mlG-CSF批号:080126浓度ml10k超滤膜PALL2.试剂SequencingGradeModifiedTrypsin,Promega,lot#237826。
ELLMAN试剂法测定自由巯基和二硫键

ELLMAN试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoic acid (DTNB) 5,5-二硫基-双(2-硝基苯甲酸) 5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB)[1]。
TNB2-在412nm有很强的吸收,可以用于对肽段的自2-吸光度0.2来计算-*1cm)1.4*101.2.不3.同,要根据选择的缓冲液来确定[5]。
另外,TNB的分光光度法分析对SDS很敏感[6]。
4.DTNB随着pH的升高,降解速度加快。
在pH7.0,其降解速度为0.02%/h,在5.pH值8.0,其降解速度为0.2%/h,随着pH值得升高,降解速度加快,在pH 12时,15min之内会完全降解[7,8]。
6.摩尔吸收光系数在不同的温度下不同,随温度的升高而下降[4].试验方案主要材料:1.材料PEG-G-CSF 批号:080229 浓度4.32mg/mlG-CSF 批号:080126 浓度6.9mg/ml小瓶。
NOB液:0.1%TFA/90%乙腈/H2O3.仪器质谱仪:BRUKER DALTONICS MALTI-TOF-TOF autoflexⅢ(厂内编号KC2007-011)Beckman 22R台式离心机(厂内编号AM-039)Beckman DU-800 紫外分光光度计(厂内编号KC2007-005)恒温循环仪:JULABO F12-ED(厂内编号KC2008-003)反相柱:Symmetry C18 5um 300à高压液相仪器:,(UV/Visible Detector)试验过程:一、缓冲液替换PEG-G-CSF和G-CSF进行缓冲液替换,超滤替换缓冲液为50mM NH4HCO3,稀释中加入G-CSF+DTT相分离收样:SF+DTT相分离集到之间的交由崔文喜冻干四、ELLMAN试剂测定自由巯基由于收集到的PEG肽段已经是自由巯基,所以可以跳过还原二硫键这一步。
ellman测巯基

埃尔曼的试剂,5,5'二硫代双- (二硝基苯甲酸),5克分子量:396.35CAS号:69-78-3使用半胱氨酸标准精确量化巯基程序材料的制备1 反应缓冲液:0.1M的磷酸钠,pH 8.0,含有1 mM的EDTA 半胱氨酸标准品,分子量136.2 :配成一定浓度梯度3 Ellman试剂溶液:1mL反应缓冲液4毫克溶解DTNB程序1用反应缓冲液配制一定浓度的半胱氨酸工作液Standard Volume of ReactionBuffer Amount of Cysteine(M.W. = 136.2)Final ConcentrationA 100 ml 20.43 mg 1.5 mMB 5 ml 25 ml of Standard A 1.25 mMC 10 ml 20 ml of Standard A 1.0 mMD 15 ml 15 ml of Standard A 0.75 mME 20 ml 10 ml of Standard A 0.5 mMF 25 ml 5 ml of Standard A 0.25 mMG 30 ml 0 ml 0.0 mM (Blank)2 取若干试管,每管含50μL Ellman试剂和2.5mL的反应缓冲液。
3在各试管中加入250μL各浓度的标准工作液或待测物溶液注:对于未知的样品需要稀释,以便使其浓度标准曲线的工作范围之内(理想的浓度为0.1-1.0)。
4在室温混合和反应15分钟。
在412 nm处测量吸光度。
根据得到数值生成一个标准曲线,测定待测样品由标准曲线计算SH含量摩尔吸光系数的程序精确量化的巯基的材料的制备1 反应缓冲液:0.1M的磷酸钠,pH 8.0,含有1 mM的EDTAEllman试剂溶液:1mL反应缓冲液4毫克溶解DTNB测量吸光度去若干试管,每管加入50μL的Ellman试剂溶液和2.5mL反应缓冲液。
加入250μL待测样品,空白添加250μL反应缓冲液在室温混合和反应15分钟。
ELLMAN试剂法测定自由巯基和二硫键

E L L M A N试剂法测定自由巯基和二硫键标准化工作室编码[XX968T-XX89628-XJ668-XT689N]E L L M A N试剂测定自由巯基试验基于的原理:5,5’-dithiobis-2-nitrobenzoicacid(DTNB)5,5-二硫基-双(2-硝基苯甲酸)5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB)[1]。
TNB2-在412nm有很强的吸收,可以用于对肽段的自由巯基进行定量分析[2]。
DTNBTNB2-根据文献记载,TNB的吸光系数在13.6*103M-cm-~14.25*103M-cm-之间[3,4]。
吸光度测量的最灵敏范围在0.2-0.7之间。
A=εbc,其中A为吸光度,ε是摩尔吸收光系数或消光系数,ε单位为升/(摩尔·厘米)[L/(mol·cm)]。
以吸光度下限0.2来计算(吸光系数取14.15*103M-cm-),需要TNB的浓度为c=0.2/(14.15*103LM-cm-*1cm)=1.4*10-5mol/L(1.4*10-8mol/ml),需要蛋白浓度为1.4*10-5mol/L*18790g/mol=0.2631g/L=0.2631mg/ml.我们的条件可以达到这个检测限度。
ELLMAN试剂法测定自由巯基主要的影响因素有:1.EDTA的适量加入有助于TNB显色的稳定和成梯度线性关系[5]。
2.在不同缓冲液中,TNB的最大吸收波长略微不同,所以它们在412nm的吸收也不3.同,要根据选择的缓冲液来确定[5]。
另外,TNB的分光光度法分析对SDS很敏感[6]。
4.DTNB随着pH的升高,降解速度加快。
在pH7.0,其降解速度为0.02%/h,在5.pH值8.0,其降解速度为0.2%/h,随着pH值得升高,降解速度加快,在pH12时,15min之内会完全降解[7,8]。
多肽药物游离巯基含量分析
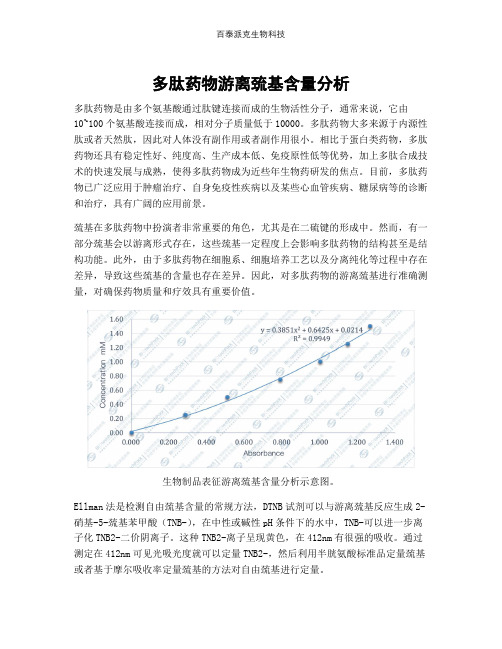
多肽药物游离巯基含量分析多肽药物是由多个氨基酸通过肽键连接而成的生物活性分子,通常来说,它由10~100个氨基酸连接而成,相对分子质量低于10000。
多肽药物大多来源于内源性肽或者天然肽,因此对人体没有副作用或者副作用很小。
相比于蛋白类药物,多肽药物还具有稳定性好、纯度高、生产成本低、免疫原性低等优势,加上多肽合成技术的快速发展与成熟,使得多肽药物成为近些年生物药研发的焦点。
目前,多肽药物已广泛应用于肿瘤治疗、自身免疫性疾病以及某些心血管疾病、糖尿病等的诊断和治疗,具有广阔的应用前景。
巯基在多肽药物中扮演者非常重要的角色,尤其是在二硫键的形成中。
然而,有一部分巯基会以游离形式存在,这些巯基一定程度上会影响多肽药物的结构甚至是结构功能。
此外,由于多肽药物在细胞系、细胞培养工艺以及分离纯化等过程中存在差异,导致这些巯基的含量也存在差异。
因此,对多肽药物的游离巯基进行准确测量,对确保药物质量和疗效具有重要价值。
生物制品表征游离巯基含量分析示意图。
Ellman法是检测自由巯基含量的常规方法,DTNB试剂可以与游离巯基反应生成2-硝基-5-巯基苯甲酸(TNB-),在中性或碱性pH条件下的水中,TNB-可以进一步离子化TNB2-二价阴离子。
这种TNB2-离子呈现黄色,在412nm有很强的吸收。
通过测定在412nm可见光吸光度就可以定量TNB2-,然后利用半胱氨酸标准品定量巯基或者基于摩尔吸收率定量巯基的方法对自由巯基进行定量。
百泰派克生物科技(BTP)采用ISO9001认证质量控制体系管理实验室,获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务。
我们基于Ellman法原理建立了自由巯基定量检测平台,为您提供一站式的多肽药物游离巯基含量分析服务,只需要将您的实验目的告诉我们并寄送样品,百泰派克生物科技负责所有项目后续,包括样品处理、上机分析、数据分析和项目报告。
欢迎免费咨询。
百泰派克生物科技多肽药物表征内容。
巯基化HA中巯基的取代度Ellman法详细步骤

首先制作半胱氨酸标准曲线,再用紫外分光光度法测定样品吸光度,计算出疏基含量,最终得出修饰率。
1、制作标准曲线:
缓冲液的配制:称取0.254gNaH2PO4与10.162gNa2HPO4于500ml容量瓶中,用
超纯水溶解,加入148.896mg的EDTA(乙二胺四乙酸),使其完全溶解,定容成500ml。
Ellman试剂的配制:称取4mgDTNB溶解在1ml缓冲液中。
取7只试管,分别在每只试管内加入50μL Ellman试剂与2.5ml磷酸钠缓冲溶液,混匀后,再在各试管内加入50μL标准溶液,混合均匀,在室温放置15min,以溶液G为空白,于波长412nm处测定半胱氨酸标准液的吸光度值(A),如表9所示:
制作标准曲线如图10所示。
得标准曲线方程为y=0.1692x-0.0001,R2=09994,满足要求。
2、测量半胱氨酸透明质酸结合物的修饰率:
配制样品溶液:称取10.5mg半胱氨酸透明质酸结合物(含0.0274mmol伯醇羟基)用缓冲液溶解并定容至5ml;
配制空白对照溶液:称取10.5mg透明质酸(含0.0274mmol伯醇羟基)用缓冲液溶解并定容至5ml;
取2只试管,分别在每支试管内加入50μL Ellman试剂与2.5ml磷酸钠缓冲溶液,混匀后,再在各试管内加入50μL待测样品,混合均匀,在室温放置15min,以透明质酸溶液做空白,于波长412nm处测定待测样品的吸光度值(A),如表10所示:
利用标准曲线和测得的样品溶液吸光度,计算样品中巯基的含量。
带入标准曲线计算:0.0385=0.1692x-0.0001,得出修饰率为3.5%(巯基数相对于透明质酸的双糖单位数)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
E L L M A N试剂法测定自
由巯基和二硫键
This manuscript was revised by the office on December 22, 2012
E L L M A N试剂测定自由巯基
试验基于的原理:
5,5’-dithiobis-2-nitrobenzoicacid(DTNB)5,5-二硫基-双(2-硝基苯甲酸)
5,5-二硫基-双(2-硝基苯甲酸)(DTNB)在412nm没有吸收,与巯基反应后,生成2-硝基-5-巯基苯甲酸(TNB)[1]。
TNB2-在412nm有很强的吸收,可以用于对肽段的自由巯基进行定量分析[2]。
DTNBTNB2-
根据文献记载,TNB的吸光系数在13.6*103M-cm-~14.25*103M-cm-之间[3,4]。
吸光度测量的最灵敏范围在0.2-0.7之间。
A=εbc,其中A为吸光度,ε是摩尔吸收光系数或消光系数,ε单位为升/(摩尔·厘米)[L/(mol·cm)]。
以吸光度下限0.2来计算(吸光系数取14.15*103M-cm-),需要TNB的浓度为c=0.2/(14.15*103LM-cm-*1cm)=1.4*10-5mol/L(1.4*10-8mol/ml),需要蛋白浓度为
1.4*10-5mol/L*18790g/mol=0.2631g/L=0.2631mg/ml.
我们的条件可以达到这个检测限度。
ELLMAN试剂法测定自由巯基主要的影响因素有:
1.EDTA的适量加入有助于TNB显色的稳定和成梯度线性关系[5]。
2.在不同缓冲液中,TNB的最大吸收波长略微不同,所以它们在412nm的
吸收也不
3.同,要根据选择的缓冲液来确定[5]。
另外,TNB的分光光度法分析对SDS
很敏感[6]。
4.DTNB随着pH的升高,降解速度加快。
在pH7.0,其降解速度为
0.02%/h,在
5.pH值8.0,其降解速度为0.2%/h,随着pH值得升高,降解速度加快,在
pH12时,15min之内会完全降解[7,8]。
6.摩尔吸收光系数在不同的温度下不同,随温度的升高而下降[4].
试验方案
主要材料:
1.材料
PEG-G-CSF批号:080229浓度4.32mg/ml
G-CSF批号:080126浓度6.9mg/ml
10k超滤膜PALL
2.试剂
SequencingGradeModifiedTrypsin,Promega,lot#237826。
20ug/小
瓶。
加入20ul50mMNH4HCO3,pH7.8溶解,配成1ug/ul的酶液。
1MDTT刘春凤提供
TFA(三氟乙酸):TEDIALot#705114
乙腈:FisherScientificLot#055848
StarterkitforMALDI-TOFMS:BRUKERDALTONICS,LotNO2007-208241-
001(includingα-Cyano-4-
hydroxycinnamicacid(HCCA),peptidecalibrationstandard,protein
calibrationstandardI,proteincalibrationstandardⅡ)
PEG肽段反相分离流动相
A液:0.1%TFA/H2O
B液:0.1%TFA/90%乙腈/H2O
3.仪器
质谱仪:BRUKERDALTONICSMALTI-TOF-TOFautoflexⅢ(厂内编号
KC2007-011)
Beckman22R台式离心机(厂内编号AM-039)
BeckmanDU-800紫外分光光度计(厂内编号KC2007-005)
恒温循环仪:JULABOF12-ED(厂内编号KC2008-003)
反相柱:S ymmetryC185um300à4.6*150mm,LotNO
高压液相仪器:,(UV/VisibleDetector)
试验过程:
一、缓冲液替换
PEG-G-CSF和G-CSF进行缓冲液替换,超滤替换缓冲液为
50mMNH4HCO3,pH7.8。
使用50mMNH4HCO3作为空白对照,样品用
50mMNH4HCO3稀释一倍后在DU-800紫外分光光度计上测浓度。
PEG-G-CSF的浓度约6.29mg/ml,G-CSF的浓度约10.81mg/ml。
二、酶切处理
1)取37ulG-CSF,共400ug,加入125.5ul50mMNH4HCO3稀释为终浓度为2mg/ml。
取63.ulPEG-G-CSF,共400ug,加入152ul50mMNH4HCO3稀释为终浓度为2mg/ml。
2)按质量比1:40往PEG-G-CSF中加入Trypsin10ul,往G-CSF中加入Trypsin10ul,同时各加入1ul1MDTT使终浓度为5mM。
另做一空白对
照,往300ul50mMNH4HCO3中加入Trypsin15ul。
37℃反应,开始时间为。
三、肽段反相分离
G-CSFTrypsin+DTT反相分离
PEG-G-CSFTrypsin+DTT反相分离
收集到之间的信号峰,交由崔文喜冻干
四、ELLMAN试剂测定自由巯基
由于收集到的PEG肽段已经是自由巯基,所以可以跳过还原二硫键这一步。
根据我们所查找到得文献,采用的参数如下:
反应缓冲液:0.10M磷酸钠+0.001MEDTA,pH7.27
温度:25℃
在这些参数下,摩尔吸收光系数为14.15±0.09*103LM-cm-[9].
1)标准曲线
用反应缓冲液配制10umDTT,20umDTT,40umDTT,80umDTT,
160umDTT,320umDTT。
用缓冲液配制10mM的ELLMAN试剂。
准备两个
比色皿。
①加入100ul反应缓冲液到样品管和对照管中,在412nm测定吸收
值,吸收值调节到0.
②加入100ul反应缓冲液到对照管中,加入100ulELLMAN试剂到样品
管中,在412nm测定吸收值A
DTNB。
③加入100ul蛋白质溶液到对照管中,加入100ul蛋白质溶液到样品
管中,混匀,3~5min后测定吸收值,直到值不再增加,记为A
final。
④A
412nm =A
final
-(3.1/3.2)(A
DTNB
-A
buffer
),制作标准曲线。
2)样品巯基测定
①加入100ul反应缓冲液到样品管和对照管中,在412nm测定吸收值,吸收值调节到0.
②加入100ul反应缓冲液到对照管中,加入100ulELLMAN试剂到样品管中,在412nm测定吸收值A
DTNB。
③加入100ul蛋白质溶液到对照管中,加入100ul蛋白质溶液到样品
管中,混匀,3~5min后测定吸收值,直到值不再增加,记为A
final 。
④A
412nm =A
final
-(3.1/3.2)(A
DTNB
-A
buffer
),根据标准曲线测定巯基。
参考文献:
1)THEODOREW.Tetal.SensitiveQuantitativeAnalysisofDisulfideBondsinPoly peptidesandProteins.ANALYTICALBIOCHEMISTRY138,181-I88(1984).
2)W.L.ANDERSONANDD.B.WETLAUFER.ANewMethodforDisulfideAnalysisofPeptid es.ANALYTICALBIOCHEMISTRY67.493-502(1975).
3)Ellman,G.L.,Arch.Biochem.Biophys.,74,443.(1958).
4)PeterEyer,etal.Molarabsorptioncoe?cientsforthereducedEllmanreagent: reassessment..AnalyticalBiochemistry312(2003)224–227
5)W.L.ANDERSONANDD.B.WETLAUFER.ANewMethodforDisulfideAnalysisofPeptid es.ANALYTICALBIOCHEMISTRY67.493-502(1975).
6)Sigma5,5’-dithiobis-2-nitrobenzoicacid(DTNB)产品说明书。
7)Riddles,P.W.etal.,Anal.Biochem.,94,75(1979)
8)Danehy,J.P,Elia,V.J.andLavelle,C.J.,.Chem.,36,1003(1971).
9)P.W.Riddles,R.L.Blakeley,B.Zerner,Ellmansreagent:5,5-dithiobis(2-nitrobenzoicacid)—areexamination,Anal.Bio-chem.94(1979)75–81.。
