有机反应活性中间体
有机化学常见活性中间体详解

有机化学常见活性中间体详解
高中化学常见官能团有:羟基(-oh)、羧基(-cooh)、醚键(-c-o-c-)、醛基(-coh)、羰基(c=o)等。
官能团,是决定有机化合物的化学性质的原子或原子团。
1、羟基(oxhydryl)是一种常见的极性基团,化学式为-oh。
羟基与水有某些相似的性质,羟基是典型的极性基团,与水可形成氢键,在无机化合物水溶液中以带负电荷的离子形式存在(oh-),称为氢氧根。
羟基主要分为醇羟基,酚羟基等。
2、羧基(carboxy),就是有机化学中的基本官能团,由一个碳原子、两个氧原子和一个氢原子共同组成,化学式为-cooh。
分子中具备羧基的化合物称作羧酸。
3、醚是醇或酚的羟基中的氢被烃基取代的产物,通式为r-o-r',r和r’可以相同,也可以不同。
相同者称为简单醚或者叫对称醚;不同者称为混合醚。
如果r、r'分别是一个有机基团两端的碳原子则称为环醚,如环氧乙烷等。
多数醚在常温下为无色液体,有香味,沸点低,比水轻,性质稳定。
醚类一般具有麻醉作用,如乙醚是临床常用的吸入麻醉剂。
4、羰基中的一个共价键跟氢原子相连而共同组成的一价原子团,叫作醛基,醛基结构简式就是-cho,醛基就是亲水基团,因此存有醛基的有机物(例如乙醛等)存有一定的水溶性。
5、羰基(carbonyl group)是由碳和氧两种原子通过双键连接而成的有机官能团
(c=o),是醛、酮、羧酸、羧酸衍生物等官能团的组成部分。
在有机反应中,羰基可以发生亲核加成反应,还原反应等,醛或者酮的羰基还可以发生氧化反应。
活性中间体及在有机合成中的应用

碳负离子
总结词
具有负电荷的碳原子,是亲核试剂,稳定性受电子效应影响。
详细描述
碳负离子是亲核反应中的关键活性中间体,通常由富电子的碳原子与带负电荷的基团结合形成。由于 负电荷的集中,碳负离子具有稳定性,其稳定性同样受电子效应影响。在有机合成中,碳负离子可以 作为中间体,参与多种反应,如取代、加成和消除等。
活性中间体的稳定性问题
总结词
稳定性问题是活性中间体面临的主要挑战之一,因为它们通常具有较高的反应活性,容 易发生副反应或自分解。
详细描述
在有机合成中,活性中间体的稳定性对其应用至关重要。由于活性中间体的高反应性, 它们在合成过程中往往容易发生副反应或自分解,导致产物的纯度和收率降低。为了解 决这一问题,研究者们通常采取一系列策略,如优化反应条件、使用稳定剂或保护基等,
多步骤合成
活性中间体在多步骤合成中起到关键作用,通过 一系列的反应步骤实现复杂有机分子的合成。
串联反应
利用活性中间体的性质,将多个反应串联起来, 一步完成多个化学键的生成,简化合成过程。
组合化学
利用活性中间体在组合化学中的反应,实现大量 不同有机分子的快速合成和筛选。
04
活性中间体在有机合成中的 挑战与解决方案
05
未来展望
新型活性中间体的开发
探索新型的活性中间体
随着科学技术的不断发展,将会有更多新型的活性中间体 被发现和开发出来,这些新型的活性中间体将会在有机合 成中发挥更加重要的作用。
深入研究活性中间体的性质
为了更好地利用活性中间体,需要对其性质进行更加深入 的研究,包括其稳定性、反应性、选择性等方面的研究。
以增加活性中间体的稳定性。
活性中间体的选择性控制
要点一
有机合成中的活性中间体合成及应用研究

有机合成中的活性中间体合成及应用研究活性中间体是有机合成中一类非常重要的中间化合物,具有较高的反应活性和可控性,并且在有机合成反应中起着关键的作用。
本文将介绍有机合成中的活性中间体的合成方法及其在化学领域的应用研究。
有机合成中的活性中间体合成方法多种多样,常见的有以下几种:首先是亲核性中间体的合成。
亲核性中间体是一类具有活泼的负电性亲核基团的中间体,例如负离子中间体、亲核取代中间体等。
合成亲核性中间体的方法主要有亲核取代反应、酸碱中和反应等。
亲核性中间体可以参与芳香和非芳香环上的求核反应,从而构建新的化学键。
其次是电子不足中间体的合成。
电子不足中间体通常具有较高的电阻性和较好的活性,可以参与各种求电子反应。
电子不足中间体的合成方法有烯烃电子不足中间体的合成,如烯烃酸化反应和氧化反应等。
此外,阴离子还原和亲电取代等方法也可合成电子不足中间体。
再次是自由基中间体的合成。
自由基中间体具有特殊的化学性质,广泛应用于自由基取代反应、引发聚合反应和自由基环化反应等。
自由基中间体的合成方法主要有热解反应、光解反应和自由基引发剂反应等。
其中,自由基引发剂方法是合成自由基中间体最常用的方法。
最后是碳正离子中间体的合成。
碳正离子中间体是一类电子不足的中间体,可以参与求电子反应和亲核反应。
碳正离子中间体的合成方法有酯酸的酯化反应、卤代烃的化学求电子反应等。
碳正离子中间体的稳定性较差,常通过立体位阻效应或加入配体等手段来增加其稳定性。
有机合成中的活性中间体在化学领域有着广泛的应用研究。
首先,活性中间体可用于有机分子的构建和功能化合物的合成。
活性中间体能提供化学键的构建位点,可通过选择性反应和控制反应条件,使得底物分子以特定的方式进行转化。
此外,活性中间体还可以被进一步修饰,合成出具有特定功能的有机小分子,如药物分子和功能性材料。
其次,活性中间体还在天然产物合成和药物合成中发挥着重要作用。
天然产物合成往往是有机合成中的挑战性课题之一,而活性中间体作为建立多样性结构的关键中间体,可用于合成复杂天然产物的核心骨架。
有机催化反应的活性中间体研究

有机催化反应的活性中间体研究有机催化反应是一种重要的有机合成方法,可以高效、选择性地构建有机分子的键合。
而在催化反应的过程中,活性中间体的研究是至关重要的,它们可以通过稳定的方式催化反应,加速和导向反应的进行。
本文将探讨有机催化反应中的活性中间体研究,并介绍一些典型的活性中间体。
活性中间体是指化学反应中的中间产物,其反应活性高于起始物和产物。
这些中间体可以通过稳定的方式存在于反应体系中,从而充当催化剂的角色,参与并促进反应的进行。
对活性中间体的研究可以揭示反应机理的细节,有助于理解反应的速率、选择性和底物适用范围等方面的问题。
在有机催化反应中,活性中间体的研究主要集中在两个方面:1)活性中间体的合成和表征;2)活性中间体的反应机理。
为了合成活性中间体,研究人员通常采用先进的有机合成技术,通过设计合适的前体分子和反应条件,合成出目标中间体。
在合成过程中,需要考虑合成反应的温度、溶剂选择、催化剂的选择等多个因素,以确保中间体的高产率和高纯度。
合成后,研究人员可以通过核磁共振、质谱等多种技术手段对中间体进行表征,确定其结构和性质。
在反应机理的研究中,研究人员通常通过理论计算和实验验证的方法来解析活性中间体的形成和转化。
理论计算可以通过计算化学方法(如密度泛函理论)模拟中间体的构型和能量,从而推断其形成机制。
实验验证可以通过反应体系中有机合成步骤的定位同位素标记和同位素交换等方法,确定活性中间体的反应路径和转化过程。
以活性烯烃为例,其官能团的空间构型对活性中间体的形成和反应至关重要。
研究人员可以通过合成不同官能团的烯烃前体,并进行反应选择性研究,来揭示活性中间体的种类和反应路径。
此外,环状中间体的形成机理也是一个研究热点。
通过环闭合反应的研究,研究人员可以揭示环中间体的活性和稳定性,并探索它们在催化反应中的作用。
活性中间体的研究不仅对于理解有机催化反应机理具有重要意义,也可以为合成方法的改进和新反应的开发提供指导。
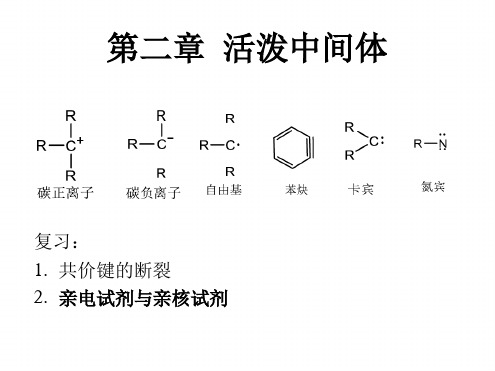
第二章 有机反应中的活性中间体详解
乙烯型正碳离子:
HC C H
R
+
C原子进行sp杂化, p轨道 用于形成π键,空着的是sp 杂化轨道,使正电荷集中。
苯基正离子:
结构同乙烯型正碳离子,正电荷 集中在sp杂化轨道上。
此二类碳正离子稳定性极差。
(2)空间效应
如果中心碳原子连接的基团越大,则原来张力也越大,因而形 成碳正离子后张力越松弛,碳正离子也越容易生成、稳定性越 大。所以碳正离子的稳定性叔>仲>伯的顺序也是空间效应的结 果。
(4)芳构化效应
具有芳香性的环状正离子比较稳定
2+
2+
三、碳正离子的形成
一般有三种方法产生碳正离子。 1.由反应物直接生成 :
与碳原子直接相连的原子或原子团带着一对成键电子裂解, 产生碳正离子。极性溶剂、Lewis酸常有促进效果。
1)X=H。烃很少自动失去氢负离子,只有在强亲电试剂如 Lewis酸或其它稳定正离子的因素存在下才能发生这一反应。
2)X=F、Cl、Br 或I。这是SN1异裂反应。Lewis酸或AgNO3可加 速这种电离作用。
3)X=OTs 酯类衍生物。OTs是一个很好的离去基团,这类 酯很易解离。
4)X=OCOZ ,其中Z= Cl、Br或I,其推动力是由于形成二 氧化碳。
5)X=H2O或ROH。断裂是由醚ROR中氧原子的质子化引 起的。
O RCHCH2R
RCHOH RCHCH2CHR
OH
2)亲电试剂与炔烃加成 3)小环在酸介质中开环 4)羰基质子化反应
55))环环氧氧化化合物物在在酸酸介介质质中中开开环环 练习: 6)卡宾质子化反应
3. 由其它正离子生成 (重排反应等 )
四、碳正离子参与的反应类型
第六章 有机反应活性中间体

RC
CR'
RX + R'2CuLi
R-R' + R'Cu + LiX
23
(3)羧基化和脱羧反应
羧化:
O O
RMgI+ O
C
O
H
OMgI
R
R
OH
O
O
CH3Li + O C O
物质量的比 1 : 1
H
OLi
H3C
R
OH
脱羧:
CH3COONa
-CO2 NaOH 400℃
CH3 + CO2 H+ CH4
当羧基的邻位 有拉电子基时, 可以在较低温 度下脱羧.
稳定的 自由基
O
( iii) 键的离解能 自由基是由共价键均裂产生的, 键 的离解能越大, 产生的自由基越不稳定,容易二聚生 成原来化合物。键的裂解能小的键如含有-O-O-, C-N=N-C 等弱键的化合物, 所产生的自由基比较 稳定。
30
常见自由基按稳定性排序:
(C6H5)3C > (C6H5)2CH > C6H5CH2 > CH2=C H CH2 > (CH3)3C > CH3 CHCH2CH3 >
- OH -
+ N2
(5)质子或其他带正电的原子团与不饱和键加成。
+ R+ (CH 3)3C=CH 2 + H+
CH 3
R (CH 3)3C+-CH 3 CH3CH-CH 2CH3
13
+ H+
6. 碳正离子的反应
1. 与带有电子的亲核体结合:取代反应(SN1) R+ + Nu- RNu
2 有机反应活性中间体
H2C CH2 H3C CH2 CH-NH2
50%
β - 插入
H2C CH2 H3CHC N H CH2
c.重排反应 (一般是烷基乃春重排) P88 .. R-C-N: RCH=NH 亚胺 (Schiff碱) H d.二聚
30%
2Ar-N:
Ar-N=NAr
Chapter 2
六.苯炔 (Benzyne)
Chapter 2
有机反应活性中间体
三.游离基(自由基 free radical)
自由基的反应一般有以下六种: ①偶联与歧化反应(偶联指二聚, 歧化一般是自由基夺取原子的反应) ②碎裂反应 ③重排反应(重排一般是芳基的迁移) ④取代反应(卤代等) ⑤自氧化反应 ⑥加成反应
Chapter 2
四.卡宾 (Carbenes)
b
Chapter 2
有机反应活性中间体
四.卡宾 (Carbenes)
H
CH2
H
H
C
H
sp2杂化 单线态
a b
sp杂化 三线态
CH2( )
惰性气体
CH2( )
液相中——以单线态进行 惰性气体中,光敏剂中——以三线态进行
Chapter 2
有机反应活性中间体
卡宾的类型:
①:CH2, :CHR, :CRR’ (R为烷基) ②:CHX, :CRX, :CXX’ (X为卤素) ③:CHY, :CRY, :CYZ (Y、Z为-OR、-SR、 -CN、-COOR等基团) ④CR2=C:,CR2=C=C
有机反应活性中间体
卡宾是一类包含只有六个价电子的两价碳原子 化合物的总称,其中四个价电子在二个共价键 上,另外两个电子未成键。其中最简单的是亚 甲基,其它可看作亚甲基的衍生物。 1.卡宾的结构、类型及命名 a.两个电子占据同一轨道,自旋相反 b.两个电子各占一个轨道,自旋相同或相反
有机反应活性中间体
常用氧化还原剂: Fe2+/Fe3+、Cu+/Cu2+、Ti2+/Ti3+、Co3+/Co2+等。
H2O2 + Fe2+ RCOOH + Fe2+
HO + OH- + Fe3+ RCO + OH- + Fe3+
采用电解法也能够产生自由基。
阳极:RCOO- -e R + CO2
阴极:2 R C R +e 2 R C R
可能填充方式:a)2个电子占据1个轨道,自旋相反; b)2个电子各自占据1个轨道,其自旋方宾
三线态卡宾
单线态、三线态是光谱学上旳术语。
一般以为:单线态卡宾中心碳原子采用sp2杂化,三线态 卡宾中心碳原子采用sp杂化,可被看成是双自由基。理 论上,单线态键角应为120º,三线态键角应为180º,实 际并非如此。
R H2O
b、对不饱和键旳加成
CZ H
C ZH
Z: O,C,S,N
CC
HCl
CC
Cl
C O H C OH
C OH
c、由其他正离子转化而生成
NH2 NaNO3
N2
HCl
HH
Ph3CSbF6
N2
SbF6
(3)非经典碳正离子
Brown和Schleyer以为:假如能用个别旳路易斯构 造式来表达,其碳正离子旳价电子层有六个电子, 与三个原子或原子团相连,如+CH3,R3C+等称为 经典碳正离子。
三线态卡宾
(2)卡宾旳生成
能形成卡宾旳化合物:HCCl3、CH2=C=O、CH2N2
主要有下列几种方式: 1)-消除反应
第一章 有机反应活性中间体-自由基
离子游离基具有顺磁性和导电性,这是由于离 子基分子内的未配对电子和离子键所引起的, 多数离子基具有特殊颜色
4.2 自由基的稳定性: 4.2.1自由基的稳定性可用共价键的离解能 衡量。次序同碳正离子, 叔碳自由基 > 仲 碳自由基 > 伯碳自由基, 但彼此之间能量 差很小,有的甚至在实验误差内。
第二章 有机反应活性中间体 及反应历程研究现状-2
4 自由基 4.1 自由基的发现:
自由基(Free radical)也叫游离基,一般指不带 电荷,中性单电子的原子,原子团或分子。 1900年Gomberg首次制得稳定的三苯甲基自 由基,确立了自由基的概念。 4.1.1 六苯乙烷的制备
2Ph3CBr 2 Ag Ph3C-CPh3 + 2AgBr
(CH3)3COOH + Co3+
4.4 自由基的反应:
特点: (1)离解能低,高温或加热的条件可直接进行。 (2)反应放热。 (3)添加过氧化物,偶氮化合物缓和反应条件。 (4)选择性差,难于控制 (5)不需要易污染环境的酸碱做催化剂,符合绿 色化学。
4.4.1 偶联反应:
Kolbe 反应
4.4.2 岐化反应:
CH3CH2OCHCH3 OOH PhC(CH3)2OOH
R CHCH=CH2 OOH
O
蒸馏时要特别注意不能蒸干
OOH
4.4.5 自由基加成:
4.4.6 卤代反应
应用:
4.4.7自由基聚合反应
(聚对苯二甲酸乙二醇酯)矿泉水瓶、碳酸饮料瓶 都是用这种材质做成的。这种材料耐热至70℃,装 高温液体或加热则易变形,有害物质会溶出。同时 这种塑料制品用了10个月后,可能会释放出致癌物 。
高等有机化学第四章有机反应中间体解析
正电荷分散程度大
共轭体系的数目越多,正碳离子越稳定:
CH2 CH 3C > CH2 CH 2CH > CH2 CHCH2
当共轭体系上连有取代基时,供电子基团使正碳离子 稳定性增加;吸电子基团使其稳定性减弱:
CH3
CH2 >
CH2 > O2N
CH2
环丙甲基正离子比苄基正离子还稳定:
3C >
2CH > CH2 >
含有带负电荷的三价碳原子的原子团。 是最早被确认的活性中间体
1、碳负离子的结构
两种构型: 未共用电子对占据p轨道
未共用电子对占据sp3杂化轨道
有利构型!
桥头碳负离子 角锥结构可以快速翻转,不具有手性
三元环碳负离子难于翻转 得到构型保持的氘代产物
当碳负离子与相邻的不饱和体系共轭时,平面结 构变为有利结构
CH2
环丙甲基正离子的结构:
C
其结果是使正电荷分散
CH2
空的 p 轨道与弯曲轨道的交盖
随着环丙基的数目增多,
CH2
CH2
正碳离子稳定性提高。
直接与杂原子相连的碳正离子结构:
氧上未共有电子对所 占 p 轨道 与中心碳原子上的空的 p轨道 侧面交盖,未共有电子对离域, 正电荷分散。
CH3 O CH2
CH3O CH2
HC CH
NaNH3 液 NH3
HC CNa
NH3
Ph3C H
NaNH3 液 NH3
Ph3CNa
NH3
CH3COCH2COOEt NaOEt CH3COCHCOOEt
常用的碱 ■ 有机锂试剂:n-BuLi, PhLi, MeLi ■ KOBut ■ LDA
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HOAc OBs
-OBs
OAc
+
+
+
2.碳负离子
碳负离子通常带有负电荷,也是有机化学中一类重 要的活性中间体,一般为共价键异裂后中心碳原子带 有负电荷的离子,实际常常是失去质子后所形成的共 轭碱。
C
H
:B
C:- + BH+
(1)碳负离子的结构
..
C
sp3杂化 棱锥型
109°28′
C
90°
sp2杂化 平面三角型
R
R
2R
均裂的难易主要取决于共价键的强度,即键的离解能。 自由基反应中常以过氧化物或偶氮化合物作为引发剂: 过氧化苯甲酰(BPO)、偶氮二异丁腈(AIBN),主要由 于其分子中含有较弱的键,容易均裂而产生自由基。
O C O O
O C
80-100oC
O C O.
. + O
CH3 CH3 C CN N N CH3 C CH3 CN
H3C H3C
C
CH3
sp2 - sp3 σbond
特点: 碳正离子带正电荷的碳是sp2杂化,与其它原
子结合构成三个σ 键在同一平面上,同时还 有一个空的p轨道,垂直于这个平面。
(CH3)3C F + SbF5 + (CH3)3C SbF6
1962年,Olah 把叔丁基氟溶于过量的超强酸介质SbF5中, 用1H-NMR检测到叔丁基正离子的存在。
CH2 C O h 或170 C CH2 + CO
CH2
N2
h 或 CH2 + N2
三卤代乙酸盐加热也可以制得卤代卡宾:
CCl3COOAg
CCl2 + CO2 + AgCl
3)三元环化合物的消除反应:可以看作卡宾与双键加 成的逆反应。
C6H5
h
C6H5CH
CH2 +
CH2
CN CN
h
+
C(CN)2
c、中性原子团消去
NH2 COOH
HNO2
N2 COOH
过渡态与中间体的区别:中间体位于两个过渡态之 间的能量最低点,故有一定的存活期,实际的寿命依赖 于凹陷的深度。下凹浅暗示下一步的活化能低,生存期 短,下凹深中间体的生存期越长;而过渡态只有一个转 瞬即逝的生存期,并代表反应途径中的能量极大值。
G
G
过渡态
Δ G1≠ C 中间体
Δ G2≠
Δ G 1≠ A+B 反应物 C 产物
Cl Cl
O CH3 C CH3
h <478.5nm
h ~320nm
CH3 +
Cl
O*
CH3
C O
CH3
CH3 C
CH3
+ CO
次氯酸酯(RO—Cl)和亚硝酸酯(RO—NO)也容易发生光解 产生烷氧自由基。
RO Cl
RO NO
h
h
RO
+ Cl
RO + NO
光解较之热解的优点:
(a)光解可以分解在通常合理温度下不容易分解或者 很难分解的强共价键。 (b)由于一定的官能团具有一定的吸收带,是特定能 量的转移,所以光解比热解具有更大的专一性。
CH3 CH2CH C CN O CH3
2
CN-
CH2 CH C CN O-
CH2(COOC2H5)2
C2H5ONa CH(COOC2H5)2
NaOEt
CH3COCH2COOEt
C2H5ONa
CH3COCHCOOEt
CH3NO2
CH2NO2
Na/THF -
CH3CH2Br
Mg (C2H5)2O
CH3CH2MgBr
H
ROH2
R
H2O
b、对不饱和键的加成
C Z H C ZH
Z: O,C,S,N
C C HCl
H
C C
Cl
C O
C OH
C OH
c、由其它正离子转化而生成
NH2
NaNO3 HCl
N2
N2
H
H Ph3CSbF6 SbF6
(3)非经典碳正离子
Brown 和 Schleyer 认为:如果能用个别的路易斯结 构式来表示,其碳正离子的价电子层有六个电子, 与三个原子或原子团相连,如+CH3,R3C+等称为经典 碳正离子。 相反地,一些桥键化合物通过 σ 键离域形成三中心 两电子的体系,称为非经典离子。
第 3章 有机活性中间体
有机化学反应有些是属于一步完成的,称为协同反 应,如双烯合成反应。而多数有机反应不是一步完 成的,反应过程中至少含有一个活性中间体的生成, 如SN1反应。这些中间体是“短寿命”的物种,很难 分离出来,又称为活性中间体,但用现代仪器可以 测定出来。它们来自共价键的均裂和异裂,如碳正 离子、碳负离子、碳自由基、卡宾、苯炔等,都是 反应中间体。 反应中间体与过渡态是不同的:过渡态是一种假想 状态,不具有客观性;中间体是具有客观性,可分 离或检测其存在。
O C6H5 C6H5
h
C6H5CHO + C6H5CH
4.苯炔
苯炔又称去氢苯。
H H
H
H
是苯环亲核取代反应中的重要活性中间体。其 存在已通过活性中间体捕捉集的方法得到证实。
O + O
(1)苯炔的结构:第三个键由两个sp2杂化轨道重叠而 成。
H H H H
苯炔中三键的形成基本上不影响苯环中离域的π体系,即 苯环的稳定性保持不变,而新的π键是由两个sp2杂化轨道侧 面交盖而形成的很弱的键,因此非常活泼,很不稳定。
三苯甲基正离子利用核磁共振谱证明为螺旋浆结构, 苯环之间的夹角为 58°,这主要是因为苯环邻位氢原 子的相互排斥的结果。
C
+
+ (C6H5)3C AlCl4
+ (C6H5)3C ClO4
(2)碳正离子的生成:
a、直接离子化
通过化学键的异裂而产生。
RX
Ph CH Cl Ph
R
X
Ph2CH Cl
R OH
C、氧化还原反应 一个电子自旋成对的分子失去或者得到一 个电子都可以导致产生自由基,这就是氧化 还原过程。因此氧化还原反应可以产生自由 基。 常用氧化还原剂: Fe2+/Fe3+、Cu+/Cu2+、Ti2+/Ti3+、Co3+/Co2+等。
H2O2 + Fe2+
RCOOH + Fe2+
HO
+ OH- + Fe3+
C 136 三线态卡宾 H
单线态卡宾
(2)卡宾的生成
能形成卡宾的化合物:HCCl3、CH2=C=O、CH2N2
主要有以下几种方式: 1)-消除反应
CHCl3 + OH—
-H2O
CCl3
CCl 2
+ Cl
CHCl3 + (CH3)3COK
CCl2 + (CH化合物如烯酮、重氮甲烷通过光解或热解可以 生成卡宾。
(1)自由基的电子构型
● ● ●
sp3
sp2
sp3
是sp3杂化的棱锥构型或sp2杂化的平面构型。 自由基的稳定性顺序: 苄基,烯丙基自由基(sp2) > 叔碳自由基(sp3) > 仲碳自 由基(sp2) > 伯碳自由基(sp2) > 甲基自由基 > 芳基 自由基
(2)自由基的生成
主要有三种产生自由基的方法:热解、光解 和氧化还原。 A、热解 在加热的情况下,共价键可以发生均裂而产生自 由基。
CH3 CH3 C . CN
C
O
80-100oC
CH3
+
N2
+ .C
CN
CH3
这些引发剂能在较低的温度下均裂,而生成自由基的 另一个原因是因为在离解过程中产生了稳定的N2和CO2, 其所放出的能量补偿了共价键均裂所需的能量。
B、光解
在可见光或者紫外光波段,对辐射具有吸收能力 的分子,利用光照可使之分解,而产生自由基。
sp2杂化
(2)苯炔的生成:主要是从苯环相邻的两个碳原子上,分别 去掉一个负电性基和正电性基而形成的。
a、脱卤化氢
Cl H C6H5Li + C6H6 + LiCl
CH3
CH3 Cl KNH2
CH3 KNH2 Cl
CH3 +
CH3
b、由邻卤代金属有机化合物制备
F Br F
Li
F Li
Slow
Fast -F
可能填充方式:a)2个电子占据1个轨道,自旋相反; b)2个电子各自占据1个轨道,其自旋方向可以相同。
H H H 单线态卡宾 三线态卡宾 H
单线态、三线态是光谱学上的术语。
一般认为:单线态卡宾中心碳原子采取sp2杂化,三线态 卡宾中心碳原子采取sp杂化,可被看成是双自由基。理 论上,单线态键角应为120º ,三线态键角应为180º ,实 际并非如此。
A+B 反应物
△G
D 产物
△G
a
单步反应
b
双步 反 应
BOND FISSION PROCESSES Generation of carbon reactive intermediates
键 断 裂 过 程
C
Y
HOMOLYSIS
HETEROLYSIS C + Y
异裂
C + Y CARB OCATION
均裂
RADICALS C + Y
