小鼠腹腔巨噬细胞的分离培养与鉴定
小鼠腹腔巨噬细胞的分离培养与吞噬功能测定
吞 噬百分 率=
吞噬鸡红细胞的巨噬细胞数 200 个巨噬细胞( 吞噬及未吞噬的)
×
100% ; 吞噬指数= 被2吞00噬个的巨鸡噬红细细胞胞÷2
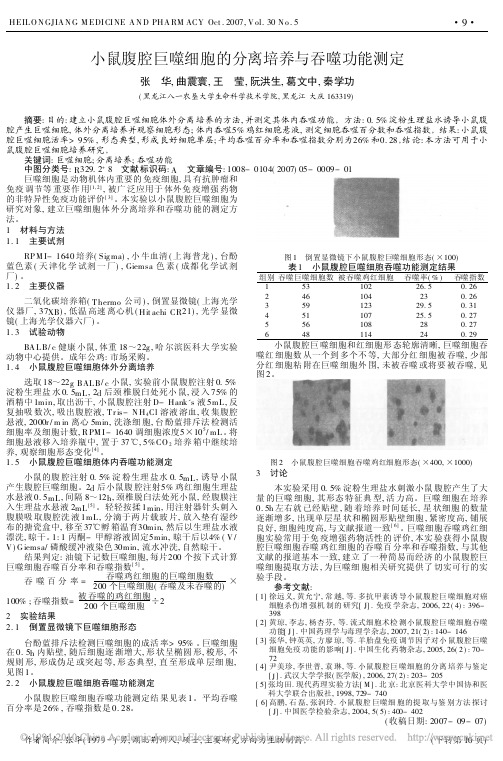
2 实验结果
2. 1 倒置显微镜下巨噬细胞形态
台酚蓝排斥法检测巨噬细胞的成活 率> 95% 。巨噬细胞 在 0. 5h 内贴壁, 随后细胞逐 渐增大, 形 状呈椭圆 形, 梭形, 不 规则 形, 形成伪足 或突起 等, 形 态典型, 直 至形成单 层细 胞, 见图 1。
表 1 胆源性胰 腺炎危险因素 L og istic 多因素回 归分析结果
因素
偏回归系数
标准误
W al d
P值
OR 值
OR95. 0% 可信限
下限
上限
A1
- 0. 851
0. 1981
14. 785
0. 001
0. 365
0. 256
0. 571
A2
0. 799
0. 220
13. 542
0. 0002
HEIL O N GJIA N G M EDI CI NE A N D PHA RM ACY Oct . 2007, V ol. 30 N o . 5 · 9·
小鼠腹腔巨噬细胞的分离培养与吞噬功能测定
张 华, 曲震寰, 王 莹, 阮洪生, 葛文中, 秦学功
( 黑龙江八一农垦大学生命科学技术学院, 黑龙江 大庆 163319)
布的搪瓷盒中, 移至 37℃孵 箱温育30min, 然后以生理盐水液
漂洗, 晾干。1: 1 丙酮- 甲醇溶液固定5min, 晾干后以4% ( V /
V ) G iemsa/ 磷酸缓冲液染色 30min, 流水冲洗, 自然晾干。
小鼠原代腹腔巨噬细胞提取方法(超详细~)

小鼠原代腹腔巨噬细胞提取方法(超详细)
实验前准备:
超净工作台、水平式低速离心机、10ml离心管、2.5mL注射器、细胞吸管、3%肉汤淀粉溶液、无菌眼科剪、无菌眼科镊、75%酒精溶液、无菌PBS溶液、DMEM细胞培养基、胎牛血清、细胞计数版、倒置显微镜等。
实验操作步骤
(1)我们对健康雄性C57BL/6小鼠腹腔注射3%肉汤淀粉溶液1 mL,持续3d,以便刺激腹腔巨噬细胞产生。
注:3%肉汤淀粉溶液提前配制,高温除菌后使用。
(2)小鼠颈椎脱臼处死,用75%酒精溶液对其充分消毒。
(3)固定小鼠,暴露腹腔。
(4)无菌条件下用剪刀沿腹中线剪开皮肤,暴露腹膜,切记勿伤及腹膜壁。
(5)向腹膜腔注射DMEM培养基3mL,并轻柔小鼠腹部片刻。
(6)用吸管反复冲洗腹膜腔并回收灌洗液。
(7)移入无菌的10ml的离心管中,以1000r/min,离心 5min,弃上清液。
(8)加入 5ml DMEM 培养基重悬细胞,上述步骤重复两次。
(9)加入含有10% FBS的DMEM培养液重悬细胞,细胞计数,调整细胞浓度为1×106 个/mL。
(10)将细胞悬液接种于 6 孔培养板中,放于37℃、5%二氧化碳
饱培养箱中培养,待后续实验研究。
小鼠腹腔巨噬细胞的分离培养与吞噬功能测定

小鼠腹腔巨噬细胞的分离培养与吞噬功能测定张华;曲震寰;王莹;阮洪生;葛文中;秦学功【期刊名称】《黑龙江医药科学》【年(卷),期】2007(030)005【摘要】目的:建立小鼠腹腔巨噬细胞体外分离培养的方法,并测定其体内吞噬功能.方法:0.5%淀粉生理盐水诱导小鼠腹腔产生巨噬细胞,体外分离培养并观察细胞形态;体内吞噬5%鸡红细胞悬液,测定细胞吞噬百分数和吞噬指数.结果:小鼠腹腔巨噬细胞活率>95%,形态典型,形成良好细胞单层;平均吞噬百分率和吞噬指数分别为26%和0.28.结论:本方法可用于小鼠腹腔巨噬细胞培养研究.【总页数】2页(P9,10)【作者】张华;曲震寰;王莹;阮洪生;葛文中;秦学功【作者单位】黑龙江八一农垦大学生命科学技术学院,黑龙江,大庆,163319;黑龙江八一农垦大学生命科学技术学院,黑龙江,大庆,163319;黑龙江八一农垦大学生命科学技术学院,黑龙江,大庆,163319;黑龙江八一农垦大学生命科学技术学院,黑龙江,大庆,163319;黑龙江八一农垦大学生命科学技术学院,黑龙江,大庆,163319;黑龙江八一农垦大学生命科学技术学院,黑龙江,大庆,163319【正文语种】中文【中图分类】R329.2+8【相关文献】1.低氧对小鼠腹腔巨噬细胞吞噬能力及氧依赖杀伤功能的影响 [J], 高世兰;张晓娜;胡方杰;李积东;蒲小燕;永胜;2.玉屏风散对小鼠红细胞免疫功能及腹腔巨噬细胞吞噬功能的影响 [J], 张红军;张晓莉;等3.BALB/c裸鼠与BALB/c小鼠腹腔巨噬细胞吞噬功能的比较 [J], 严朗;侍雯婧;田逸君;张吉芊竹;陈基快4.BALB/c裸鼠与BALB/c小鼠腹腔巨噬细胞吞噬功能的比较 [J], 严朗;侍雯婧;田逸君;张吉芊竹;陈基快5.小鼠腹腔巨噬细胞呼吸爆发中活性氧测定——影响小鼠腹腔巨噬细胞吞噬发光的实验因素 [J], 孙自镛;周宜开因版权原因,仅展示原文概要,查看原文内容请购买。
小鼠腹腔巨噬细胞原代培养实验具体步骤及方法

小鼠腹腔巨噬细胞原代培养实验具体步骤及方法巨噬细胞属免疫细胞,有多种功能,是研究细胞吞噬、细胞免疫和分子免疫学的重要对象。
巨噬细胞容易获得,便于培养,并可进行纯化。
巨噬细胞属不繁殖细胞群,在条件适宜下可生活2-3周,多用做原代培养,难以长期生存。
步骤一、实验材料准备1. 动物:各个品系的小鼠2-4只。
2. 试剂:RPMI1640培养基(含酚红),小牛血清,双抗,培养液(10%小牛血清、RPMI1640、双抗),台盼兰等。
碘酒绵球和酒精绵球。
3. 器械:一次性注射器、手术器械。
二、实验方法如果采用刺激物,则可在实验前三天腹腔注射3%巯基乙醇酸钠每只2 mL,获得的巨噬细胞数要多一些。
不采用刺激物,直接开始下面的步骤。
1. 拉颈处死小鼠,在75%酒精浸泡1-2分钟,移入超净台中,仰卧位固定于解剖板上,碘酒消毒腹部皮肤,酒精绵球脱碘。
用手术直剪充分剪开腹部皮肤,暴露腹部肌层,再用酒精绵球消毒腹部肌层。
2. 用注射器抽取5 mL含双抗的RPMI1640培养基注入腹腔,用绵球轻揉腹部1-2 min,然后,用眼科镊稍提起腹腔,并用眼科剪剪开一个小口,用吸管吸取细胞悬液,移入离心管中(个人认为,此法比用注射器抽吸好一些)。
3. 1 000 rpm离心5 min后,用含双抗的RPMI1640培养基洗涤一次,再次离心,重悬细胞于含10%小牛血清的RPMI1640培养液中,如果是作为饲养细胞使用,则选择相应的培养液。
台盼蓝拒染法计数,将细胞稀释到目的浓度后,接种即可。
4. 如果是作为饲养细胞使用,调整浓度至2x105个/mL,接种到96孔板中,每孔100-200 uL;如果作为其它实验使用,可以调整成2x106/mL,加到24孔平底培养板中,1 mL/孔;5% CO2温箱孵育2 h后,换液,并用RPMI1640培养基洗1-2次,弃去未粘附细胞,贴壁细胞为单层的巨噬细胞。
三、结果巨噬细胞刚贴壁时偏圆形,或者类似鹅卵石形状,然后慢慢伸出伪足,铺开呈三角形或多角形。
小鼠三个不同部位巨噬细胞的分离培养与鉴定

小鼠三个不同部位巨噬细胞的分离培养与鉴定[摘要] 目的建立小鼠三种不同部位巨噬细胞体外分离培养的方法,并对其进行鉴定。
方法分别从小鼠腹腔、脾脏、骨髓中分离获取巨噬细胞,经台盼蓝染色计数后于含10%胎牛血清的DMEM培养液、1%小牛血清的RPMI-1640培养基中培养;通过活细胞形态观察;HE 染色光镜观察;吞噬鸡红细胞功能检测;酸性磷酸酶及非特异性酯酶染色测定细胞内酶的表达等生物学技术鉴定培养的贴壁细胞性质。
结果获得高纯度的巨噬细胞,具有巨噬细胞的形态特征,具备良好的吞噬功能,鸡红细胞吞噬率分别为腹腔94.68%,脾脏92.47%,骨髓93.11%;酸性磷酸酶染色阳性率为腹腔89.43%,脾脏85.21%,骨髓88.55%;α-醋酸奈酚酯酶染色阳性率为腹腔85.32%,脾脏81.81%,骨髓85.76%。
结论小鼠三个不同部位均可简便实用的分离出巨噬细胞,可以满足不同的研究目的。
巨噬细胞不仅是许多病原体的宿主细胞,而且在先天性和后天性免疫应答过程中起着关键性作用[1-3],比如调节促炎和抗炎细胞因子的释放、吞噬或杀死胞内微生物和肿瘤细胞、降解和提呈抗原等。
它还可以与其他免疫细胞协同发挥更大的功能,比如树突状细胞、粒细胞、NK细胞和T细胞等。
小鼠巨噬细胞吞噬作用是反映机体非特异性免疫功能的主要指标,也是临床免疫学实验常用的方法之一。
现将已有的巨噬细胞分离方法改进,从3种不同部位分离小鼠巨噬细胞,并做以对比。
1 材料与方法1.1主要试剂和仪器DMEM培养基(Hyclone);RPMI-1640培养基(GIBCO);胎牛血清(GIBCO);倒置显微镜(Olympus);CO2培养箱(Binder,Thermo)。
1.2 从小鼠腹腔中分离巨噬细胞(1)取6~8周龄左右的小鼠,腹腔注射2mL无菌的液体石蜡。
待3~4d后收集腹腔细胞。
(2)颈椎脱臼法法处死小鼠,消毒,用注射器抽取5mL含双抗的RPMI1640培养基注入腹腔,用绵球轻揉腹部1~2 min,静置5min,用眼科镊稍提起腹腔,并用眼科剪剪开一个小口,用吸管吸取细胞悬液,移入离心管中。
小鼠腹腔巨噬细胞培养详细方法
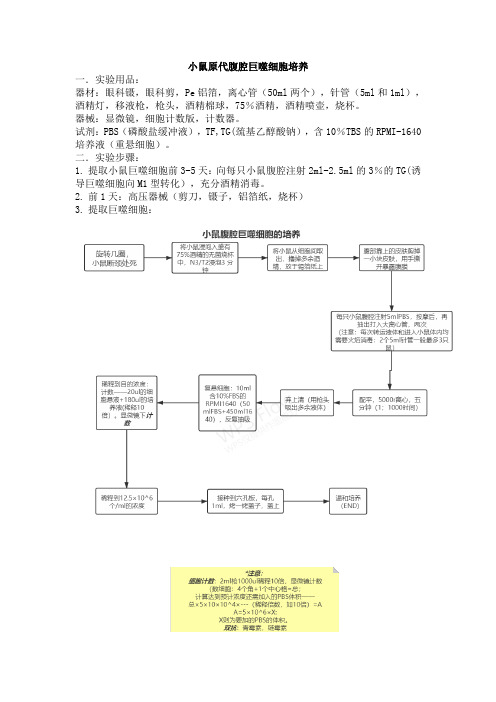
小鼠原代腹腔巨噬细胞培养一.实验用品:器材:眼科镊,眼科剪,Pe铝箔,离心管(50ml两个),针管(5ml和1ml),酒精灯,移液枪,枪头,酒精棉球,75%酒精,酒精喷壶,烧杯。
器械:显微镜,细胞计数版,计数器。
试剂:PBS(磷酸盐缓冲液),TF,TG(巯基乙醇酸钠),含10%TBS的RPMI-1640培养液(重悬细胞)。
二.实验步骤:1.提取小鼠巨噬细胞前3-5天:向每只小鼠腹腔注射2ml-2.5ml的3%的TG(诱导巨噬细胞向M1型转化),充分酒精消毒。
2.前1天:高压器械(剪刀,镊子,铝箔纸,烧杯)3.提取巨噬细胞:三.结果:巨噬细胞:刚贴壁时偏圆形,或者类似鹅卵石形状,然后慢慢伸出伪足,铺开呈三角形或多角形。
巨噬细胞有吞噬的特性,当与细菌混合在一起的时候,在40倍物镜下可以看到巨噬细胞吞噬细菌,因此,巨噬细胞作为饲养细胞可以清除部分污染的细菌、支原体和部分细胞碎片。
巨噬细胞属免疫细胞,有多种功能,是研究细胞吞噬、细胞免疫和分子免疫学的重要对象。
巨噬细胞容易获得,便于培养,并可进行纯化。
巨噬细胞属不繁殖细胞群,在条件适宜下可生活2-3周,多用做原代培养,难以长期生存。
小鼠腹腔巨噬细胞原代培养的应用:(1)用于细胞保种;(2)用于分子生物学研究;(3)用于基因治疗研究。
*注意:1. 巨噬细胞是终末分化细胞,不会增殖。
2. 很难消化下来,所以接种的时候,必须直接接种到目的培养器皿中。
3. 严格无菌操作,在超净台内进行。
4. 为避免交叉感染,每一只小鼠更换注射器。
5. 吸管吸取细胞悬液的时候,尽量不要吸到大小肠,否则容易引起成纤维细胞污染。
换液:培养液从4度取出回温,超净台中操作,用移液枪换液即可。
巨噬细胞的分离、纯化与培养
一、从小鼠、豚鼠或家兔腹腔中分离巨噬细胞1.取6周左右的小鼠(或600克左右的豚鼠,或3公斤左右的家兔),剃去腹部的毛并消毒。
腹腔注射1ml(豚鼠20ml,家兔200ml)无菌的液体石蜡或巯基乙酸肉汤或4%淀粉肉汤。
3~4天以后收集腹腔细胞。
2.如要收集腹腔静置巨噬细胞,不注射刺激物,直接从这一步开始。
放血处死动物,以减少腹腔中的红细胞。
消毒腹部,沿腹中线注入3~4ml(豚鼠20~40ml,家兔50~70ml)冰中预冷的无菌PBS-H (含10U/ml肝素和10%小牛血清的PBS)。
轻轻按摩腹部5分钟。
3.以下均无菌操作。
剪开腹壁,用吸管吸出渗出液,再用同样容量的预冷PBS-H冲洗腹腔2~3次。
合并渗出液于离心管中,4℃离心250×g 10分钟,去上清液。
4.用预冷的RPMI-1640培养液洗涤细胞3次,每次4℃离心250×g 10分钟,去上清液。
用预冷的适量RPMI-1640培养液悬浮细胞,台盼蓝染色计数细胞并决定细胞活力。
二、家兔肺泡巨噬细胞的分离和纯化1.取2~3公斤重的家兔,耳缘静脉注射10ml空气处死动物或注射2ml(含130mg)戊巴比妥麻醉动物。
仰卧固定,消毒胸部,剪开胸壁。
以下过程注意无菌操作。
小心从环状软骨下方剪下气管,分离心脏和血管,取出肺,剪去脂肪和结缔组织。
用无菌纱布小心擦净肺表面,称重。
2.分离肺泡巨噬细胞:用夹子夹住气管,使肺悬空。
向气管中注射40ml无菌的冷生理盐水,让生理盐水进入全部肺泡。
用镊子提起气管,从夹子下面剪断气管,将肺中的液体倒入离心管中。
再用同样方法,用40ml无菌冷生理盐水冲洗肺泡,合并浸出液,置4℃。
3.分离肺组织中的巨噬细胞:取出肺泡巨噬细胞后,剪去气管,将肺组织放在有冷RPMI-1640培养液的平皿中。
平皿置冰上,用吸满冷RPMI-1640培养液的20ml注射器接23号针头,一边灌注一边用针头梳离肺组织,直到肺组织与支气管树全部分离。
小鼠腹腔巨噬细胞分离
小鼠腹腔巨噬细胞分离
小鼠腹腔巨噬细胞分离
1.取6周左右的小鼠,腹腔注射2ml 4%巯基乙酸肉汤或淀粉肉汤。
3~4天以后收集腹腔细胞。
2.颈椎脱臼法处死小鼠,消毒腹部,沿腹中线注入5mL冰中预冷的无菌PBS-H(含10U/ml肝素和10%小牛血清的PBS)和2mL 空气。
轻轻按摩腹部5分钟。
3.剪开腹壁,用吸管吸出渗出液,再用同样容量的预冷PBS-H 冲洗腹腔2~3次。
合并渗出液于离心管中,4℃离心400g 5分钟,去上清液。
4.用预冷的RPMI-1640培养液洗涤细胞1次,4℃离心400g 5分钟,去上清液。
用预冷的适量RPMI-1640培养液悬浮细胞,台盼蓝染色计数细胞并检测细胞活力。
分离巨噬细胞的方法
分离巨噬细胞的方法巨噬细胞是免疫系统中重要的成分之一,其功能是吞噬和消化细菌、病毒、细胞残骸等病原体或异常细胞。
为了研究巨噬细胞的生理和病理功能,科学家需要从体内或体外分离出巨噬细胞。
下面将介绍几种常用的分离巨噬细胞的方法。
1. 腹腔巨噬细胞分离法这是一种常用的方法,适用于小鼠或大鼠的巨噬细胞分离。
首先,用适当的方法将小鼠或大鼠的腹腔打开,将腹腔洗液抽取出来。
洗液中含有大量的巨噬细胞。
然后,将洗液经过离心,将沉淀中的巨噬细胞收集起来。
最后,用适当的培养基培养巨噬细胞,使其继续生长和分化。
2. 骨髓巨噬细胞分离法这种方法适用于从小鼠或大鼠的骨髓中分离巨噬细胞。
首先,将小鼠或大鼠的骨髓从骨骼中取出,并用适当的方法将骨髓细胞洗涤干净。
然后,将洗液经过离心,将沉淀中的骨髓巨噬细胞收集起来。
最后,用适当的培养基培养骨髓巨噬细胞,使其继续生长和分化。
3. 化学法分离巨噬细胞这种方法利用化学试剂的特定性质,使巨噬细胞与其他细胞分离。
例如,可以利用巨噬细胞表面特定的受体,使用特定的抗体标记巨噬细胞,并通过离心或磁珠分离得到纯净的巨噬细胞。
此外,还可以利用化学试剂的特殊性质,如巨噬细胞对特定染料的亲和性,来分离巨噬细胞。
4. 细胞排序分离巨噬细胞细胞排序是一种高级的细胞分离技术,可以根据细胞的特定性质,如大小、形状、表面标记等,将巨噬细胞从混合细胞中分离出来。
这种方法可以高效地分离出纯净的巨噬细胞群体,但设备和技术要求较高。
总结起来,分离巨噬细胞的方法有腹腔巨噬细胞分离法、骨髓巨噬细胞分离法、化学法和细胞排序法。
这些方法各有优缺点,科学家可以根据实验需求选择适合的方法。
通过分离巨噬细胞,科学家可以更好地研究巨噬细胞的生理和病理功能,为疾病的治疗和预防提供理论基础。
小鼠腹腔巨噬细胞的分离与培养
小鼠腹腔巨噬细胞的分离与培养
目的:建立一种小鼠腹腔巨噬细胞分离的简便方法,为低强度激光照*对巨噬细胞功能的影响研究提供实验细胞.方法:以无血清的RPMI-1640培养液灌洗小鼠腹腔,分离获取小鼠腹腔巨噬细胞,在含10%小牛血清的RPMI-1640培养液中培养.采用倒置显微镜观察细胞形态,台盼蓝染*计算存活率,瑞氏染*计算纯度.结果:获得高纯度的巨噬细胞,具备巨噬细胞的形态特征.结论:本法是一种简便实用的分离小鼠腹腔巨噬细胞的方法.
肖丹,XIAODan(第四*医大学*事预防医学系,陕西,西安,710032)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠腹腔巨噬细胞的分离培养与鉴定
【摘要】目的建立一种小鼠腹腔巨噬细胞分离培养的简便方法。
方法以无血清的DMEM培养液灌洗小鼠腹腔,分离获取小鼠腹腔巨噬细胞,在含有10%成牛血清的DMEM培养液中培养。
采用倒置显微镜观察细胞形态,台盼蓝染色计算存活率,瑞氏染色计算纯度。
结果获得高纯度的巨噬细胞,具备巨噬细胞的形态特征。
结论该方法是一种简单可行的分离巨噬细胞的方法。
【关键词】小鼠;巨噬细胞;分离;培养;鉴定
0.引言
巨噬细胞是动物机体内重要的免疫细胞,具有抗肿瘤和免疫调节等重要作用[1,2] ,被广泛应用于体外免疫增强药物的非特异性免疫功能评价[3] 。
有很多文献报到已能从多种组织和器官中分离纯化巨噬细胞,但这些方法大多都是繁琐、复杂,所需时间长且耗资较大。
本实验以小鼠腹腔巨噬细胞为研究对象,探索建立一种巨噬细胞体外分离培养与鉴定简便的方法。
1.材料与方法
1.1实验对象
清洁级巴贝斯小鼠,体重在(30-32g),由兰州大学实验动物中心提供。
1.2实验方法
1.2.1小鼠腹腔单核巨噬细胞的分离培养
随机选取巴贝斯小鼠,腹腔注射不含小牛血清的RPMI-1640培养液5ml。
轻柔小鼠腹部2-3min,静置5-7min后将小鼠颈椎脱臼处死,至于解剖板上,无菌条件下打开腹腔,用注射器抽取腹腔液,离心5min (1000r/min),弃上清,用PBS洗涤2遍。
再用含10%成牛血清的RPMI-1640培养液(0.1%双抗溶液)调节至2×106ml-1,接种于培养瓶及6孔板,置37℃,5%CO2培养箱培养2h,弃上清。
用不含小牛血清的RPMI-1640培养液洗涤2遍,然后加含有10%小牛血清的RPMI-1640培养液在37℃CO2培养箱中继续培养[4]。
倒置显微镜观察细胞形态。
1.2.2巨噬细胞的观察与鉴定
(1)台盼蓝染色计算存活率。
4%台盼蓝母液:称取4g台盼蓝,加少量蒸馏水研磨,加双蒸水至100ml,用滤纸过滤,4度保存。
使用时。
用PBS稀释至0.4%。
(也可买Gibco的成品);
胰酶消化贴壁细胞,制备单细胞悬液,并作适当稀释。
染色:细胞悬液与0.4%台盼蓝溶液以9:1混合混匀。
(终浓度0.04%);计数:在三分钟内,分别计数活细胞和死细胞。
镜下观察,死细胞被染成明显的蓝色,而活细胞拒染呈无色透明状。
(2)瑞氏染色计算细胞纯度。
细胞涂片自然干燥后,用蜡笔在两端画线,以防染色时染液外溢。
随后将玻片平置于染色架上,滴加染液3-5滴,使其盖满涂片,大约1分钟后,滴加等量或稍多的II液,用吸耳球轻轻混匀。
冲洗:染色5-10分钟用流水染液,待干。
结果观察,将干燥后的血涂片置显微镜下观察。
先用低倍镜观察涂片,再用油镜。
2.结果
2.1小鼠巨噬细胞的分离培养
(1)巨噬细胞的观察与鉴定.
巨噬细胞体外培养24h观察结果。
如图1
(2)台盼蓝染色结果。
从腹腔分离出来的巨噬细胞进行台盼蓝染色结果显示巨噬细胞的成活率>95%,如图2
(3)瑞氏染色结果。
从腹腔分离出来的巨噬细胞进行瑞氏染色结果显示巨噬细胞的纯度>98%,如图3
图1巨噬细胞体外培养24h观察图2台盼蓝染色结果
图3 瑞氏染色结果
3.讨论及结论
巨噬细胞广泛分布于体内,它不仅参与非特异性免疫,而且是特异性免疫中一类关键的细胞,参与集体众多的生理和病理反应过程,如巨噬细胞的吞噬和消除病原微生物[5],通过加工处理提成抗原,启动特异性免疫应答[6],以及巨噬细胞通过细胞凋亡清除吞噬的致病病原体等。
由于腹腔巨噬细胞多游离存在于腹腔的腹水中,易于获得,因此许多实验室在进行基础或配合临床研究巨噬细胞功能及其与疾病的关系、或筛选免疫增强药物和探讨其作用机制时,往往选用小鼠腹腔巨噬细胞为研究对象。
虽然腹腔巨噬细胞的提取方法都是灌胃洗腹腔后,吸出含有巨噬细胞的灌洗液了,但具体操作略有差异[7]。
预先注入的巨噬细胞刺激剂有淀粉溶液、肉汤、糖原等,以产生大量的巨噬细胞计入腹腔。
虽然这些刺激剂能分离收集到大量的巨噬细胞,但注入的大分子抗原物质对巨噬细胞吞噬功能有一定的影响,获得的巨噬细胞已不再是原体内巨噬细胞的基础功能。
本实验提取巨噬细胞的方法是对文献中方法的改进,关键在于活体腹腔注射不含血清的培养液,轻揉腹部后静置几分钟,然后颈椎脱臼致死小鼠,无菌打开腹腔吸取腹腔液[4]。
此方法相对处死小数后进行系列操作而言,洗出的灌洗液中混杂的白细胞少,提取局势细胞的纯度高,是一种简便的小鼠腹腔巨噬细胞的分离方法,为巨噬细胞的相关研究奠定了基础。
【参考文献】
[1]徐远义,黄允宁,常越,等.多抗甲素诱导小鼠腹腔巨噬细胞对癌细胞杀伤增强机制的研究[J].免疫学杂志,2006,22(4):396-398.
[2]黄琼,李志,杨杏芬,等.流式细胞术检测小鼠腹腔巨噬细胞吞噬功能[J].中国药理学与毒理学杂志,2007,21(2):140-146.
[3]张华,钟英英,方廖琼,等.羊胎盘免疫调节因子对小鼠腹腔巨噬细胞免疫功能的影响[J].中国生化药物杂志,2005,26(2):70-72.
[4]李海涛,肖丹,等.小鼠腹腔巨噬细胞的分离与培养[J].现代生物医学进展杂志,2008,8(4):638-639.
[5]SO,IH,T-SH,etal.Rearrangement of action cytoskeletion during infection with Escherichia coli O157 in macrophage[J].Cell Struct Funct,1999,24(5):237-246.
[6]Fulton SA,Reba SM,Pai PK,etal.Inhibition of major histocompatibility complex Ⅱexpression and antigen processing in murine alveolar macrophage by mycobacterium bovis BCG and the 19-kilodalton mycobacterial lipoprotein[J].Infect Immun,2004,72(4):2010-2110.
[7]尹美珍,李世普,等.大鼠腹腔巨噬细胞的分离培养与鉴定[J].武汉理工大学学报,2009,31(9):40-42.。
