研究生配位化学第11章
第11章 配位化学-2

d轨道在不同配体场中 的相对值 轨道在不同配体场中∆的相对值 轨道在不同配体场中
2 晶体场稳定化能 ( C F S E ) d 电子在晶体场中分裂后的 轨道中排布,其能量 电子在晶体场中分裂后的d轨道中排布 轨道中排布, 表示,在球形场中的能量用E 表示。 用E晶 表示,在球形场中的能量用 球 表示。因晶体场 的存在, 的存在,体系总能量的降低值称为晶体场稳定化能 ( Crystal Field Stabilization Energy )。 。 由E球=0,则 , CFSE = E球-E晶 = 0 - E晶
CFSE = 0-[ (-2 /5 △o )×6 +2 P ] = 12 / 5 △o-2 p - - × - = 12 / 5×33800 cm-1-2×15000 cm-1 = 51120 cm-1 × ×
球形场
八面体强场
提示:原来有一对成对电子,现在又增加两对,所以加上 提示:原来有一对成对电子,现在又增加两对,所以加上2P;
y x
z x
z y
y
X
+
z
+
x
dxy
dxz
dy z
dx 2 y2
dz 2
上册 p133
1. 晶体场中 轨道的分裂 晶体场中d (1)八面体场 (octahedral field) )
八面体场中d轨道的分裂 八面体场中 轨道的分裂
球形场
(2) 四面体场 (tetrahedral field) )
(1)八面体场分裂后的 轨道的能量: )八面体场分裂后的d 轨道的能量: 列方程组 解得 : E dγ - E dε = △o , 3 Edε + 2 Edγ = 0 γ ε ε γ E dγ = 3⁄5 △o, E dε = - 2⁄5 △o , γ ε
无机与分析化学:第十一章配位化合物1

3.特性:
• 内界: 为一稳定的基团,稳定性由Kf决定。在水溶液中 不显示其阳离子或阴离子单独的性质;
• 外界: 显示各离子或分子的单独性质,
例:[Cu(NH3)4](OH)2 ~ (OH)- 、 [Cu(NH3)4]2+ 加入Al3+ 有 Al(OH)3 沉淀生成; 而K4[Fe(CN)6]~ K+ 、 [Fe(CN)6]4加什入么O条H件- ?没)有Fe(OH)3 沉淀生成。(还要有
• 键合异构:两可配位体,与中心离子形 成配位键的配位原子不同;
• 几何异构:由于配位体在中心离子(原 子)周围的排列方式不同所致, 顺反异构 旋光异构
8.配位化合物的存在及应用
• 生物体中的配位化合物:
[HmFe]+O2 [HmFe O2 ]
• 湿法冶金:
NiS+6NH3 [Ni(NH3)6]2++H2 • 分析化学:
4.配位体和配位数
配位体:
• 简单配位体,含有一个配位原子; • 多基配位体,含有2个或以上的配位原子, 可
形成螯合物; • 两可配位体,可形成键合异构现象,如 SCN-、
NCS-;ONO-、NO2-等。
配位数:
• 配合物中所形成的配位键的数目,一般为4,6; • 影响配位数的因素:本质、浓度、温度。
配合物价键理论的评价
• 解释配合物的空间构型,无论是内轨或 外轨,只要轨道数和类型一定,空间构 型即定;
• 结合软硬酸碱理论,较好地解释了配合 物的稳定性,如Co(NH3)62+与 Co(NH3)63+;
• 定性的讨论,无法解释配合物的颜色; • 无法解释Cu(NH3)42+的平面正方型结构,
配位化学教材全文版

第1章配位化学导论配位化学(coordination chemistry)是无机化学的一个重要分支学科。
配位化合物(coordination compounds)(有时称络合物complex)是无机化学研究的主要对象之一。
配位化学的研究虽有近二百年的历史,但仅在近几十年来,由于现代分离技术、配位催化及化学模拟生物固氮等方面的应用,极大地推动了配位化学的发展。
它已广泛渗透到有机化学、分析化学、物理化学、高分子化学、催化化学、生物化学等领域,而且与材料科学、生命科学以及医学等其他科学的关系越来越密切。
目前,配位化合物广泛应用于工业、农业、医药、国防和航天等领域。
配位化学发展简史历史上记载的第一个配合物是普鲁士蓝。
它是1704年由柏林的普鲁士人迪斯巴赫(Diesbach)制得,它是一种无机颜料,其化学组成为Fe4[Fe(CN)6]3·nH2O。
但是对配位化学的了解和研究的开始一般认为是1798年法国化学家塔萨厄尔()报道的化合物CoCl3·6NH3,他随后又发现了CoCl3·5NH3、CoCl3·5NH3·H2O、CoCl3·4NH3以及其他铬、铁、钴、镍、铂等元素的其他许多配合物,这些化合物的形成,在当时难于理解。
因为根据经典的化合价理论,两个独立存在而且都稳定的分子化合物CoCl3和NH3为什么可以按一定的比例相互结合生成更为稳定的“复杂化合物”无法解释,于是科学家们先后提出多种理论,例如,布隆斯特兰德()在1869年、约尔更生()在1885年分别对“复杂化合物”的结构提出了不同的假设(如“链式理论”等),但由于这些假设均不能圆满地说明实验事实而失败。
1893年,年仅27岁的瑞士科学家维尔纳()发表了一篇研究分子加合物的论文“关于无机化合物的结构问题”,改变了此前人们一直从平面角度认识配合物结构的思路,首次从立体角度系统地分析了配合物的结构,提出了配位学说,常称Werner配位理论,其基本要点如下:(1) 大多数元素表现有两种形式的价,即主价和副价;(2) 每一元素倾向于既要满足它的主价又要满足它的副价;(3) 副价具有方向性,指向空间的确定位置。
第11章 配位化学基础

N P
O S
F Cl
Ne Ar Kr Xe Rn
Sr Y 配位原子 Ba Lu
Tc Re Bh
Fr Ra Lr Rf Db Sg 配体中与中心金属直接 结合的原子。
Cu Zn Ga Ge As Se Br •Ni 排列在中心金属周围 Ag Cd In Sn Sb Te I •Pd分子或者阴离子 Pt Au Hg Tl Pb Bi Po At • 分为单齿配体与多齿配体
2018/5/31
21
配合物的分类
特殊配合物
1)夹心配合物:
金属原子 M 被夹在两个平行的碳环之间,形成夹心配合物。
2)羰基配合物
以 CO 为配体的配合物称为羰基配合物。
3)原子簇状化合物
有两个或两个以上金属原子以金属 –金属键( M–M)直接结合而 形成的化合物。
4)多核配合物
含两个或两个以上中心金属离子的配合物。
单齿 配体
特点 多齿 配体 举例
有两个或两个以上的配位原子同时与中心金属
结合。可分为二齿、三齿、多齿配体等。
O :O
N N
O H 2C :N CH2 CH 2 N: CH2 C O O: H 2C CH2 C O:
C C O
:O
邻二氮菲 (phen)
乙二胺四乙酸根 (EDTA4-)
配位数
配合物的组成
2018/5/31
11
[Fe(SCN)(H2O)5]2+, [Co(SCN)4(H2O)2]2-, [Cu(NH3)4(H2O)2]2+, [CuBr4]22018/5/31
12
2018/5/31
第11章 配位化合物
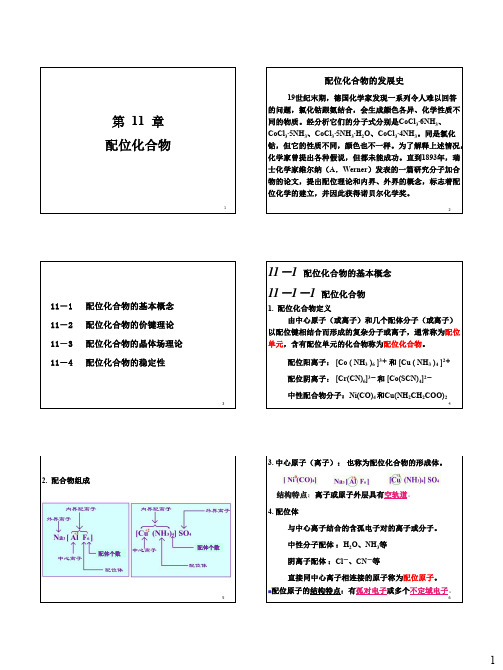
1第 11 章 配位化合物2配位化合物的发展史19世纪末期,德国化学家发现一系列令人难以回答的问题,氯化钴跟氨结合,会生成颜色各异、化学性质不同的物质。
经分析它们的分子式分别是CoCl 3∙6NH 3、CoCl 3∙5NH 3、CoCl 3∙5NH 3∙H 2O 、CoCl 3∙4NH 3。
同是氯化钴,但它的性质不同,颜色也不一样。
为了解释上述情况,化学家曾提出各种假说,但都未能成功。
直到1893年,瑞士化学家维尔纳(A .Werner )发表的一篇研究分子加合物的论文,提出配位理论和内界、外界的概念,标志着配位化学的建立,并因此获得诺贝尔化学奖。
311-1 配位化合物的基本概念11-2 配位化合物的价键理论 11-3 配位化合物的晶体场理论 11-4 配位化合物的稳定性411-1 配位化合物的基本概念 11-1-1 配位化合物1. 配位化合物定义由中心原子(或离子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元,含有配位单元的化合物称为配位化合物。
配位阳离子: [Co ( NH 3 )6 ]3+ 和 [Cu ( NH 3 )4 ]2+ 配位阴离子: [Cr(CN)6]3- 和 [Co(SCN)4]2-中性配合物分子:Ni(CO)4 和Cu(NH 2CH 2COO)252. 配合物组成配体个数配体个数63. 中心原子(离子): 也称为配位化合物的形成体。
4. 配位体与中心离子结合的含孤电子对的离子或分子。
中性分子配体 :H 2O 、NH 3等 阴离子配体 :Cl -、CN -等直接同中心离子相连接的原子称为配位原子。
结构特点:离子或原子外层具有空轨道。
配位原子的结构特点:有孤对电子或多个不定域电子。
75 配位数在配位个体中与一个中心离子(原子)成键的配位原子的总数称为该形成体的配位数。
例如[Cu(NH 3)4]2+中,Cu 2+的配位数为4; [CoCl 3(NH 3)3]中Co 3+的配位数为6。
《配位化学》课程教学大纲

《化学原理》课程教学大纲一、课程基本信息1、课程代码:2、课程名称:化学原理(含元素化学、配位化学两部分)3、学时/学分:484、先修课程:无机及分析化学、有机化学、结构化学等。
5、面向对象:化学、应用化学、生物学、药学及化学相关专业。
6、开课院(系)、教研室:化学化工学院无机及分析化学教研室7、教材、教学参考书:《无机化学》下册主编,北师大、华中师大、南京师大,高教出版社《无机化学》下册孟天佑主编,吉林大学出版社《配位化学》(教材)刘伟生主编,化学工业出版社, 2013。
《配位化学》罗勤慧著,科学出版社, 2012。
《中级无机化学》项斯芬姚光庆编著,北京大学出版社,2003。
《配位化学-原理与应用》章慧等著,化学工业出版社,2010。
二、课程性质和任务物质性质及反应的有关事实是化学中最为本质的东西,而元素化学则是阐述物质性质及其变化规律理论的基础学科。
《配位化学》是无机化学中极为重要的分支学科,在化学基本理论研究及实际应用方面有着越来越重要的地位, 近年来它已渗透到生物、分离分析、医药、催化冶金、材料科学、环境科学等领域,与各学科有着日益广泛的联系,目前,文献上报道的新化合物绝大多数是配位化合物。
配位化学的基础则是化学原理以及元素的基本性质。
作为化学类相关专业学生的选修课, 本课程主要通过课堂教学使学生掌握元素性质递变规律及配位化学的基本知识、基本理论,了解单质的制备方法及各主族、副族元素化合物的性质,掌握配位化学的研究方法、应用及其发展趋势。
三、教学内容和基本要求本课程分为两部分: 第一部分为元素化学部分,包括1—13章,主要研究元素周期表中原子的核外电子排布及元素化学的关系,要求学生能进一步地应用无机化学基本原理(主要是热力学原理及物质结构原理)去学习元素的单质及其化合物的存在、制备、性质及反应性的变化规律,进一步加深对无机化学基本原理的理解,也进一步学会运用有关原理去研究、讨论、说明、理解、预测相应的化学事实。
无机化学第11章 配位化合物
发生重排;若实验测得 ≠ 0,推出 n ≠ 0,说明3d 6 电子
不重排。
27
杂化类型小结:
1. 外轨型配合物:中心离子提供最外 层的ns、np、nd轨道杂化成键。
【特点】内层电子排布不发生变化,未成 对的d电子尽可能分占轨道而自旋平行, 故高自旋,顺磁性,且未成对电子越多, 磁矩越大,又由于中心离子以能量较高的 最外层轨道杂化成键,故配合物稳定性小。
4
11-1
配位化合物的基本概念 配位化合物
11-1-1
1. 配位化合物定义 由中心原子(或离子)和几个配体分子(或离子) 以配位键相结合而形成的复杂分子或离子,通常称为配位
单元,含有配位单元的化合物称为配位化合物。
配位阳离子: [Co ( NH3 )6 ]3+ 和 [Cu ( NH3 )4 ]2+ 配位阴离子: [Cr(CN)6]3- 和 [Co(SCN)4]2- 中性配合物分子:Ni(CO)4 和Cu(NH2CH2COO)2
[Co(NO2) (NH3)5]Cl2 和 [Co(ONO) (NH3)5]Cl2。
15
2. 立体异构
(1)顺反异构 : [Co(en) 2Cl2]+ 顺式(紫色)和反式(绿色)
顺:cisN N N N Cl Cl
Cl N N N N Cl
反:trans-
(2)旋光异构:四面体配合物中Mabcd有旋光异构体。
第 11 章 配位化合物
11-1
11-2
配位化合物的基本概念
配位化合物的价键理论
11-3
11-4
配位化合物的晶体场理论
配位化合物的稳定性
3
配位化合物的发展史
19世纪末期,德国化学家发现一系列令人难以回答
宋天佑版无机化学 第11章配位化学基础
-
F
-
F
-
F
-
F
-
3.内轨型与外轨型配合物
内轨型配合物
中心离子或原子以部分次外层轨道(n-1)d 参与组成杂化轨道,接受配体的孤电子对形成 内轨型配合物。如: d2sp3、dsp2、dsp3等。 特点:由于配体影响,形成体的电子重新 分布,未成对电子数减少。
成对能P:在形成内轨型配合物时,要违反 洪特规则,使原来的成单电子强行在同一d轨道 中配对,在同一轨道中电子配对时所需要的能 量叫做成对能(用P表示)。
11.1.3 配合物的命名
基本遵循一般无机化合物的命名原 则 1.整体命名:先阴离子,后阳离子 配离子为阳离子 外界是简单阴离子(OH-、Cl-), “某化某” [Ag(NH3)2]OH [Pt(NH3)6]Cl4 外界是复杂阴离子,“某酸某”
配离子为阴离子 外界为氢离子 “某酸” H2[PtCl6]
F HCI Br I
配体类型 单齿配体:一个配体中只含一个配位原子 NH3、OH-、X-、CN-、CO、SCN-等 多齿配体:一个配体中含2个或2个以上配位原子 草酸根(C2O42-) -OOC-COO- 双齿 乙二胺(en) NH2-CH2-CH2-NH2 双齿 乙二胺四乙酸根(EDTA或Y) 六齿 P862-863 部分配体名称: 硝基:NO2;亚硝酸根:ONO-;硫氰酸根:SCN-;异 硫氰酸根:NCS-;羰基:CO;羟基:-OH
MA2B2C2—正八面体的异构体。
平面偏振光
当平面偏振光通过某种介质时,有的介质对偏 振光没有作用,即透过介质的偏振光的偏振面 保持不变。而有的介质却能使偏振光的偏振面 发生旋转。这种能旋转偏振光的偏振面的性质 叫做旋光性。具有旋光性的物质叫做旋光性物 质或光活性物质。
配位化学教材全文最新版
第1章配位化学导论配位化学(coordination chemistry)是无机化学的一个重要分支学科。
配位化合物(coordination compounds)(有时称络合物complex)是无机化学研究的主要对象之一。
配位化学的研究虽有近二百年的历史,但仅在近几十年来,由于现代分离技术、配位催化及化学模拟生物固氮等方面的应用,极大地推动了配位化学的发展。
它已广泛渗透到有机化学、分析化学、物理化学、高分子化学、催化化学、生物化学等领域,而且与材料科学、生命科学以及医学等其他科学的关系越来越密切。
目前,配位化合物广泛应用于工业、农业、医药、国防和航天等领域。
1.1 配位化学发展简史历史上记载的第一个配合物是普鲁士蓝。
它是1704年由柏林的普鲁士人迪斯巴赫(Diesbach)制得,它是一种无机颜料,其化学组成为Fe4[Fe(CN)6]3·nH2O。
但是对配位化学的了解和研究的开始一般认为是1798年法国化学家塔萨厄尔(B.M.Tassaert)报道的化合物CoCl3·6NH3,他随后又发现了CoCl3·5NH3、CoCl3·5NH3·H2O、CoCl3·4NH3以及其他铬、铁、钴、镍、铂等元素的其他许多配合物,这些化合物的形成,在当时难于理解。
因为根据经典的化合价理论,两个独立存在而且都稳定的分子化合物CoCl3和NH3为什么可以按一定的比例相互结合生成更为稳定的“复杂化合物”无法解释,于是科学家们先后提出多种理论,例如,布隆斯特兰德(W.Blomstrand)在1869年、约尔更生(S.M.Jørgensen)在1885年分别对“复杂化合物”的结构提出了不同的假设(如“链式理论”等),但由于这些假设均不能圆满地说明实验事实而失败。
1893年,年仅27岁的瑞士科学家维尔纳(A.Werner)发表了一篇研究分子加合物的论文“关于无机化合物的结构问题”,改变了此前人们一直从平面角度认识配合物结构的思路,首次从立体角度系统地分析了配合物的结构,提出了配位学说,常称Werner配位理论,其基本要点如下:(1) 大多数元素表现有两种形式的价,即主价和副价;(2) 每一元素倾向于既要满足它的主价又要满足它的副价;(3) 副价具有方向性,指向空间的确定位置。
第十一章 配位化学(上)
关于汉语命名原则
件
课 p 含络离子的配合物:阴离子名称在前,阳离子名称在后,
理 阴 、 阳 离 子 名 称 之 间 加 “ 化 ” 字 或 “ 酸 ” 字 。 例 如 原 [Ag(NH3)2](OH) 和 [CrCl2(H2O)4]Cl 分别叫氢氧化二氨合银 化学 (I) 和一氯化二氯·四水合铬(III); 而 [Cu(NH3)4]SO4 叫硫酸四
阳光 n CO2 + n H2O 叶绿素 (CH2O)n + n O2
课件
理
原 叶绿素 (chlorophylls a) 是镁的大环配合物,作为配位体的
学 卟啉环与 Mg2+ 离子的配位是通过 4 个环氮原子实现的;叶绿 化 素分子中涉及包括 Mg 原子在内的 4 个六元螯环。
京大学 2014/7/30 南
化
例如: 单齿配体
学 Cu(NH3 )42+ 京大 [PtCl3 (NH3 )]−
20多14齿/配7/体30
南[CoCl2 (en) 2 ]2+
[ ] Al(C 2O4 )3 3− [Ca(EDTA) ]2−
4 3+1= 4 2+2×2 = 6 3×2 = 6 1× 6 = 6
配位数的大小与配位体的性质件有关 课
p单齿配体: 一个配体中只含一个配位原子件
课
X−
•
理 O H−(羟基) C N− SCN− (硫 氰 根)
原 •
•
•
C O ( 羰基 )
•
N
•
O
− 2
化学 H 2
O
•
N
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4)与碱反应
6.1.6
金属羰基配合物的应用
1.制备纯金属 首先使金属与CO反应生成金属羰基配合物,再 加热分解,可制得纯度较高的金属。如铁与CO 反应生成挥发性的Fe(CO)5,再将Fe(CO)5蒸汽喷 入容器内进行分解,制得纯铁。
2.做抗爆剂 汽油中通常加入的抗爆剂是四乙基铅,某 些金属的羰基配合物如 Fe(CO)5也具有同样 的抗爆作用。 3.做催化剂 羰基配合物是有机合成中的重要催化剂, 催化反应实例很多,如烯烃的醛基化反应 使用CO、H2对烯烃加成,合成为醛;催化 烯烃双键位置移动而进行异构化反应;甲 醇在 [Rh(CO)2I2]- 或 Rh(CO)(PPh3)2C1 等铑羰 基配合物的催化作用下转化为醋酸。
如:羰基配合物 Ni(CO)4 Fe(CO)5 Cr(CO)6 EAN规则 28+2x4=36 26+2x5=36 24+2x6=36 18电子规则 10+2x4=18 8+2x5=18 6+2x6=18
如果金属的原子序数是奇数,通过简 单地结合 CO 分子不能满足 ENA 规则 的要求,解决这个问题的办法,一是 从还原剂夺得一个电子形成配阴离子 [M(CO)n]- ;另一办法是含有奇数电 子的金属配合物中间体跟其他含有一 个未成对电子的原子或基团以共价键 结合,如HM(CO)n或M(CO)nCl;
第六章 一些特殊配合物简介
6.1 过渡金属羰基配合物 6.1.1 概 述 CO是重要的σ 给予体和π 接受体,它作为 配体与低氧化态(+1,0,负氧化态)的过渡 金属形成的配合物叫做羰基化合物。它们 在周期表中的分布如表1所示:
表1 一些二元过渡金属羰基配合物
金属羰基配合物属于非经典配合物,有以 下三个特点: ①CO不是一个很强的路易斯碱,但它与 金属形成很强的化学键。中心原子和配位 体之间不仅存在σ 键,还有较强的π 键。 ②中心原子或离子总是呈现出较低的氧化 态,甚至是零或负氧化态。 ③大多数(99%)金属羰基配合物服从有效 原子序数规则。
-π 配键的
形成
CO分子轨道主要由 C 的 2s和 2p 轨道和 O
的2s和2p轨道按对称性匹配原则线性组
合而成,考虑2s和2pz轨道间的杂化情况, 能级图如6-1所示。
由CO的分子轨道能级图可见,在四组被电子占 据的轨道中,4σ 轨道由于电子云大部分集 中在C和O两个原子核之间,不能参与同其他原 子成键,3σ 、1π 和5σ 的电子能够授予金属原 子电子对。其中3σ 电子是属于O的孤电子对, 由于O的电负性大于C的电负性,除少数情况外 ,O是难于将3σ 电子对给予中心金属原子的。 因此,只有1π 和5σ 有可能向金属原子提供 σ 配位键。其中5σ 为最高占有轨道,具有C的孤 电子对的性质。 CO 将 5σ 电子给予金属原子的 空的杂化轨道形成配位键,如图6-2(a)所示。
2.CO的配位方式
CO和过渡金属原子的配位方式,不
仅有C原子位于端基的端基配位,还 有 C 原子与 2 个或 3 个金属原子形成 的双桥或三桥基配位,还有包括 O 原子在内的多桥基配位,见图6-3
3.影响C-O键伸缩振动频率的因素
(1)CO的配位方式
中性分子中, CO 以端基配位时, C-O 键
例如,Fe(CO)5是黄色液体,Fe2(CO)9是金 黄色固体,Fe3(CO)12为墨绿色。金属羰基 配合物都是典型的共价化合物,易溶于非 极性溶剂,易分解为金属及CO,有剧毒, 有些与空气混合时会发生爆炸,使用时要
格外小心。
2.化学性质
(1)取代反应 金属羰基配合物中的 CO可被其他π
酸配体如 PPh3、PX3、SR2等取代。这些配体或配位原 子都具有空的轨道可接受过渡金属原子的 d电 子而形成反馈π 键。
(2)氧化还原反应
金属羰基配合物既可被还原为羰基阴离子,
也可被氧化为羰基阳离子。
(3)亲核反应 由于金属羰基配合物中碳原子上带正电荷,因 而亲核试剂如 Py 、 NR2- 、 Me- 、 H- 等都可进攻 金属羰基配合物中的CO而发生亲核反应。
若没有其他的奇数电子可以结合,则配合
物中间体彼此结合成二聚体,例如Co的原 子序数是27,它需要得到9个电子才能达 到Kr的原子序数,而每个CO提供两个电 子,所以不能形成单核羰基配合物,只能 形成Co2(CO)8多核配合物。在多核配合物 中存在着金属一金属键。
绝大多数 ( 约 99 % ) 的金属羰基配合物的组 成符合 ENA 规则,但也有例外情况,如 V(CO)6是顺磁性化合物, V有 23 个电子, 按 ENA 规则应形成稳定的 V2(CO)12 ,但实 际上是V(CO)6稳定。其原因可能是空间位 阻效应妨碍二聚体的形成。
同时,金属原子已充有电子的d轨道,由 于符合对称性匹配和能量相近原则,还能 和CO的空的反键2π 轨道重叠,形成反馈 π 键(金属原子向CO提供电子对),如图 6-2(b)所示。由于反馈π 键的形成,电子 从金属原子转移(反馈)到CO反键π *轨道, 结果,一方面削弱了C-O键的强度,使 CO分子活化(反键轨道上多了电子);
(3)其他取代基的影响
当羰基配合物的部分 CO 被其他基团 L 取
代时,若L接受d电子的能力比CO弱,则 C-O键伸缩振动频率将进一步减小, L 接 受d电子的能力越弱,C-O键伸缩振动频 率降低得越多;若L的电负性很大,吸引 电子能力强,使金属原子上的电子密度 减小,向CO反馈的作用减弱,则C-O键 伸缩振动频率降低得少,如
另一方面,减小了金属的电子密度, 导致金属的有效核电荷增加,使得 配体 - 金属的 σ 配键增强;金属原子 周围积累更多的负电荷,又促进了 反馈 π 键的形成,这两种成键作用 相辅相成,增加了成键效应,因此 称为“协同效应”。协同效应的存 在,使得低或零氧化态的金属与CO 形成稳定的羰基配合物。
在羰基配合物中,形成σ 配键时,电子从 CO的成键轨道转移至金属原子,而反馈π 键的形成,电子又从金属原子转移至CO的 反键 π * 轨道,导致 CO 中成键电子减少, 而反键电子增加,使金属-配体间的键增强 而具有双重性,键长比单键短;而C≡O键 减弱,键长增加。例如Ni(CO)4中,M-C键 长为 182pm ,而 Ni 和 C 原子的单键共价半 径之和为198pm。实验测得羰基配合物 C-O 键长为 115pm ,而游离的 CO 中 C-O 键 长为112.9pm。
伸缩振动频率降到 2000cm- 左右; CO 以 双桥基配位时,C-O键伸缩振动频率降到 1800cm- 左右; CO 以三桥基配位时, CO键伸缩振动频率最低可达 1700cm-左右。
(2)金属原子半径和氧化态
金属原子半径越大或氧化态越低, 意味着有
更多负电荷从金属流向配体,反馈作用增强, C三O更弱,C-O键伸缩振动频率下降就多; 反之, 金属半径越小或氧化态越正,反馈作 用就减弱,C-O键伸缩振动频率下降得就少。 如 羰基配合物 Ni(CO)4 v(c--o) 2060 Co(CO)41 890 Fe(CO)421 790
6.1.2有效原子序数(EAN)规则
20世纪30年代,西奇威克 (Sidgwick)提出了“有效原子序数规 则”(Effective Atomic Number)。所 谓有效原子序数就是配合物中过渡 金属原子全部电子总数与所有配体 提供成键的电子总数之和等于该金 属所在周期中稀有气体的原子序数 。
因为当形成V2(CO)12时,V的配位数变为7,
配位体过于拥挤,配位体之间的排斥作用 超过二聚体中的V-V弱成键作用。然而, VCO)6还是比符合ENA规则的羰基化合物 的稳定性低,容易从还原剂夺得一个电子
变成[V(CO)6]-离子。
6.1.3 金属羰基配合物中的化学键
1.CO的分子轨道能级图和σ
1.金属羰基配合物
(1)金属与CO直接反应 金属中, Ni 和 Fe 能在较温和的条件下直接和 CO反应,形成羰基配合物
2.金属羰基阴离子
3.金属羰基阳离子
6.1.5金属羰基配合物的性质
1.物理性质
过渡金属的羰基配合物在常温下,只有
Fe(CO)5 、 Ni(CO)4 、 Ru(CO)5 、 Os(CO)5 是液体,其他羰基配合物是低 熔点的固体,很容易升华。单核羰基配 合物多为无色物质,多核羰基配合物为 有色物质,且颜色随分子中金属原子数 目的增加而加深。
通俗地说,每一个CO分子提供两个 电子给金属原子,金属原子接受这些 电子对后,其核外电子总数与该元素 处于同一周期的稀有气体原子序数相 同,如36(Kr)、54(Xe)、86(Rn),则 该配合物是稳定的。
另一种说法是:过渡金属在形成羰基配 合 物 时 , 趋 向 于 采 取 (n-1)d10nS2np6 或 (n2)f14(n-1)d10ns2np6电子构型,每个金属原子 的价电子数和它周围配体提供的电子数加 在一起等于18,又叫做18电子规则。
羰基配合物 MO(CO)6
MO(CO)3(PPh3)3 Mo(CO)3(NH3)3
VC--O(cm-1)
羰基配合物 VC--O(cm-1)
2000
Mn2(CO)10 2044
1 949
Mn(CO)5I 2125
1 855
Mn(CO)5Br
2 133Mn(CO)来自Cl2 1386.1.4羰基配合物的制备
