溶液吸附法测固体比表面积
溶液吸附法测固体比表面积

实验五 溶液吸附法测固体比表面积一、实验目的:1.了解溶液吸附法测定固体比表面的优缺点。
2.掌握溶液吸附法测定固体比表面积的基本原理和测定方法。
3.用亚甲基蓝水溶液吸附法测定活性碳、硅藻土、碱性层析氧化铝比表面积。
二、实验原理:① Langmuir 吸附定律:在一定温度下以及一定的浓度范围内,大多数固体对次甲基蓝的吸附是单分子层吸附,与固体对气体的吸附很相似,可用Langmuir 单分子层吸附模型来处理。
Langmuir 吸附理论的基本假定是:a) 固体表面是均匀的;b) 吸附是单分子层吸附;c) 被吸附在固体表面上的分子相互之间无作用力;d) 吸附剂一旦被吸附质覆盖就不能被再吸附;e) 吸附平衡时,吸附和脱附建立动态平衡;f) 吸附平衡前,吸附速率与空白表面成正比,解吸速率与覆盖度成正比。
根据以上假定,推导出吸附方程:设固体表面的吸附位总数为N ,覆盖度为θ,溶液中吸附质的浓度为c ,根据上述假定,有?)c (kr= kN (1-为吸附速率常数) 吸附速率: 1 1吸? = rkN(k 为脱附速率常数)脱附速率: -1 -1脱?? N = N (1-k )c 当达到吸附平衡时: r= r 即 k -11 脱吸Kc :由此可得 (1)吸 θ? 1?Kc 吸式中K=k/k 称为吸附平衡常数,其值决定于吸附剂和吸附质的性质及温11-吸度,K 值越大,固体对吸附质吸附能力越强。
若以q表示浓度c 时的平衡吸附量,吸? =q/: q 以q 表示全部吸附位被占据时单分子层吸附量,即饱和吸附量,则?? q 代入式(1)得)(2 式中:K 为吸附作用的平衡常数,也称为吸附系数,与吸附质、吸附剂性质及温度有关,其值越大,则表示吸附能力越强;q 为平衡吸附量,1g 吸附剂达吸附平衡时,吸附的溶质的物质的量(mg/g );q 为饱和吸附量,1g 吸附剂的表面∞上盖满一层吸附质分子时所能吸附的最大量(mg/g );c 为达到吸附平衡时,溶 质在溶液本体中的平衡浓度。
实验6 溶液吸附法测定固体吸附剂的比表面积 操作步骤

实验6 溶液吸附法测定固体吸附剂的比表面积注意事项:1.吸附用溶液和标准溶液均需精确配制。
2.活性炭颗粒应均匀,且称重应尽量接近,称量速度要快。
3.实验所用活性炭位于马弗炉里,磨口小试管位于靠窗口的烘箱中。
实验步骤:1.活化样品:称取给定活性炭约 1 g,置于磨口瓶中。
将电子恒温干燥箱的接触温度计调至200 ℃,将称好的活性炭放入,恒温1-2 h。
(已提前由老师准备好)2.亚甲基蓝溶液A的稀释:用刻度移液管分别取2.00 mL、2.50 mL、3.00 mL、3.50 mL和4.00 mL亚甲基蓝溶液A于5个已洗净的10 mL 容量瓶中,用去离子水稀释到刻度,摇匀备用。
3.溶液吸附:从靠窗口的恒温干燥箱中取出活性炭立即放入干燥器中,待凉至室温后取出,用电子分析天平迅速称取5份各20.0 mg活性炭,放入已洗净烘干的磨口小试管中(烘干的试管位于靠窗口的烘箱里),倒入步骤2中已稀释好的各溶液,迅速塞上塞子。
放入振荡器中恒温(20-30℃)振荡2h.4. 配制标准溶液:用刻度移液管分别取2.00 mL、4.00 mL、6.00 mL、8.00 mL、10.00 mL和12.00 mL亚甲基蓝溶液B于6个已洗净的50 mL容量瓶中,用去离子水稀释到刻度,摇匀备用。
5.取上述标准溶液1份,以去离子水为空白液,测定最大吸收波长λmax。
该波长即为工作波长。
在此波长下,测不同浓度标准溶液的吸光度。
6.待步骤3振荡结束后取出磨口瓶,静置使活性炭沉淀。
取上层清液放入离心管内,离心分离5-10分钟。
将澄清溶液注入比色皿内(注意5份溶液的编号不要乱!)7.在步骤5所测得最大吸收波长下测5份待测液的吸光度,再根据标准工作曲线求出各平衡溶液的浓度。
数据处理:1.绘制A~c工作曲线。
2.由工作曲线确定吸附平衡后各溶液的浓度,并计算相应浓度对应的吸附量。
3.作c / ~ c图,由直线斜率求出饱和吸附量。
4.依据式(6-3)计算活性炭的质量表面积A m。
溶液吸附法测定固体比表面积

2 -1 2 -1
次甲基蓝原始溶液 2g·dm ;次甲基蓝标准溶液 0.1g·dm ;颗粒活性炭。 三、实验步骤 1.活化样品 将活性炭置于瓷坩埚中放入 500℃马福炉中活化 1h(或在真空箱中 300℃活化 1h), 然后 置于干燥器中备用。 2.溶液吸附 取 50mL 带塞锥形瓶 5 只,分别准确称取活化过的活性炭约 0.1g,按照下表给出的比例 配制不同浓度的次甲基蓝溶液 50mL,塞上包有锡纸的软木塞,然后放在振荡器上振荡 3h。 编号 V(次甲基蓝溶液)/mL V(蒸馏水)/mL 3.配制次甲基蓝标准溶液 用台称分别称取 2g、4g、6g、8g、11g 浓度为 0.3126×10 mol·dm 的标准次甲蓝溶液 于 100mL 容量瓶中,用蒸馏水稀释至刻度,待用。 4.原始溶液的稀释 为了准确测定原始溶液的浓度,在台称上称取浓度为 0.2%的原始溶液 2.5g 放入 500mL 容量瓶中,稀释至刻度。 5.平衡液处理 样品振荡 3h 后,取平衡溶液 5mL 放入离心管中,用离心机旋转 10min,得到澄清的上 层溶液。分别取 5g 澄清液放入 500mL 容量瓶中,并用蒸馏水稀释到刻度。 6.选择工作波长 用某一待用标准溶液,以蒸馏水为空白液,在 600nm~700nm 范围 内测量吸光度,以最 大吸收时的波长作为工作波长。 7.测量吸光度。 在工作波长下, 依次分别测定五个标准溶液的吸光度, 以及稀释以后的原始溶液及平衡 溶液的吸光度。 四、注意事项 1.标准溶液的浓度要准确配制,原始溶液及吸附平衡后溶液的浓度都应选择适当的范围, -3 -3 本实验原始溶液的浓度为 2g·dm 左右,平衡溶液的浓度不小于 1g·dm 。 2.活性炭颗粒要均匀,且五份称重应尽量接近。 3.振荡时间要充足,以达到吸附饱和,一般不应小于 3h。 五、数据处理 1.把数据填入下表 稀释后原始溶液的吸光度:1.332 标准溶液 A 平衡溶液 A 标准溶液称 取量 浓 度 /(mol/L) 2g 0.289 1 2.121 2.作 A—C 工作曲线。 2g 0.0626 4g 0.125 6g 0.188 8g 0.25 11g 0.344 4g 0.662 2 0.466 6g 1.257 3 0.137 8g 1.672 4 0.118 11g 1.999 5 0.044
固液吸附法测定比表面思考题

固液吸附法测定比表面思考题一、引言二、固液吸附法的原理和方法1. 原理2. 方法三、比表面的概念和计算方法1. 概念2. 计算方法四、固液吸附法测定比表面的步骤及注意事项1. 步骤2. 注意事项五、固液吸附法测定比表面的优缺点及应用前景1. 优点2. 缺点3. 应用前景六、结论一、引言比表面是材料科学中一个重要的物理量,它反映了单位质量或单位体积材料表面积的大小,是研究材料物理化学性质和应用性能的基础。
因此,测定材料比表面是许多领域研究中必不可少的工作。
固液吸附法是常用的测定材料比表面积的方法之一,本文将对该方法进行详细介绍。
二、固液吸附法的原理和方法1. 原理固液吸附法是利用气体分子在固体表面上发生吸附现象来测定固体比表面积的方法。
当气体分子在固体表面上发生吸附时,会占据一定的表面积,因此可以通过测量吸附剂在固体表面上所占据的面积来计算固体比表面积。
2. 方法固液吸附法一般采用液态吸附剂,如水、乙醇等。
其具体操作步骤如下:(1)将待测样品置于吸附瓶中;(2)向瓶中加入一定量的液态吸附剂;(3)在一定温度下静置一段时间,使吸附平衡达到稳定;(4)取出瓶中样品,用滤纸或其他方法去除多余的液态吸附剂,并称重;(5)根据液态吸附剂在样品表面上所占据的面积计算出样品比表面积。
三、比表面的概念和计算方法1. 概念材料比表面是指单位质量或单位体积材料内部和外部界面总和。
它是材料物理化学性质和应用性能的基础,与催化反应、传质、电化学反应等密切相关。
2. 计算方法材料比表面的计算方法根据不同的测定方法而异。
在固液吸附法中,比表面的计算公式如下:S = (m2 - m1) / (ρV)其中,S为比表面积,m1为样品质量,m2为样品与吸附剂共同质量,ρ为吸附剂密度,V为吸附剂体积。
四、固液吸附法测定比表面的步骤及注意事项1. 步骤固液吸附法测定比表面的步骤主要包括:(1)准备好待测样品和液态吸附剂;(2)将待测样品置于吸附瓶中;(3)向瓶中加入一定量的液态吸附剂;(4)在一定温度下静置一段时间,使吸附平衡达到稳定;(5)取出瓶中样品,用滤纸或其他方法去除多余的液态吸附剂,并称重;(6)根据液态吸附剂在样品表面上所占据的面积计算出样品比表面积。
实验考试题汇总
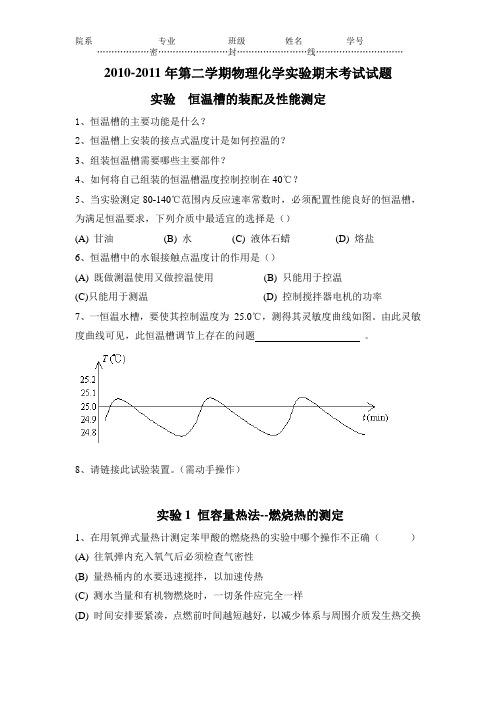
2010-2011年第二学期物理化学实验期末考试试题实验恒温槽的装配及性能测定1、恒温槽的主要功能是什么?2、恒温槽上安装的接点式温度计是如何控温的?3、组装恒温槽需要哪些主要部件?4、如何将自己组装的恒温槽温度控制控制在40℃?5、当实验测定80-140℃范围内反应速率常数时,必须配置性能良好的恒温槽,为满足恒温要求,下列介质中最适宜的选择是()(A) 甘油(B) 水(C) 液体石蜡(D) 熔盐6、恒温槽中的水银接触点温度计的作用是()(A) 既做测温使用又做控温使用(B) 只能用于控温(C)只能用于测温(D) 控制搅拌器电机的功率7、一恒温水槽,要使其控制温度为25.0℃,测得其灵敏度曲线如图。
由此灵敏度曲线可见,此恒温槽调节上存在的问题。
8、请链接此试验装置。
(需动手操作)实验1 恒容量热法--燃烧热的测定1、在用氧弹式量热计测定苯甲酸的燃烧热的实验中哪个操作不正确()(A) 往氧弹内充入氧气后必须检查气密性(B) 量热桶内的水要迅速搅拌,以加速传热(C) 测水当量和有机物燃烧时,一切条件应完全一样(D) 时间安排要紧凑,点燃前时间越短越好,以减少体系与周围介质发生热交换2.在燃烧热的测定实验中,我们把( )作为体系(A) 氧弹 (B) 氧弹式量热计(C) 氧弹和量热桶内的水 (D) 被测的燃烧物3、在用氧弹测定燃烧热的实验中,公式r V H Q nRT ∆=+∆中的温度T 为:( )(A) 氧弹中最高燃烧温度; (B) 内筒中3000cm 3水的温度;(C) 外套中的水温; (D) 298.15K4、实验室常用钢瓶的颜色分别是:(A) N 2瓶蓝色、H 2瓶黑色、O 2瓶绿色 (B) N 2瓶黑色、H 2瓶绿色、O 2瓶蓝色(C) N 2瓶绿色、H 2瓶黑色、O 2瓶蓝色 (D) N 2瓶黑色、H 2瓶蓝色、O 2瓶绿色5、实验室某仪器使用电源插头有三只脚,则该仪器所使用的交流电源为:(A) 单相 (B)两相 (C) 三相 (D) 两相加地线6、用高压钢瓶充氧气时冲气阀门是(A) 顺时针为开 (B) 逆时针为开7、在燃烧热实验中,热量计不可避免要与环境发生热量交换,为了消除它对测量的影响,可以用哪些方法来尽量消除?怎么消除?8、测定燃烧热实验中,打开氧弹的盖子后,发现坩埚里面有一些炭黑,这是由于什么原因,造成这种现象的原因是什么?9、回答氧弹量热计的构造,简述各部件功能。
实验七 溶液吸附法测定固体比表面积

实验七溶液吸附法测定固体比表面积一、实验目的1.用次甲基蓝水溶液吸附法测定颗粒活性碳的比表面。
2.了解Langmuir单分子层吸附理论及溶液法测定比表面的基本原理。
3.了解722型光电分光光度计的基本原理并熟悉其使用方法。
二、实验原理根据光吸收定律,当入射光为一定波长的单色光时,某溶液的吸光度与溶液中有色物质的浓度及溶液层的厚度成正比:A=lg(I0/I)=KCL式中A为吸光度,I0为入射光强度,I为透射光强度,K为消光系数,c为溶液浓度,L为液层厚度。
一般来说光的吸收定律可适用于任何波长的单色光,但同一种溶液在不同波长所测得的吸光度不同,如果把吸光度A对波长λ作图可得到溶液的吸收曲线,为了提高测量的灵敏度,工作波长一般选在A值最大处。
次甲基蓝在可见区有两个吸收峰,445nm和Array 665nm;但在445nm处,活性碳吸附对吸收峰有很大的干扰,故本实验选用的工作波长为665nm。
水溶液染料的吸附已用于固体比表面的测定,在所有染料中次甲基蓝具有最大的吸附倾向。
研究表明,在一定的浓度范围之内,大多数固体对次甲基蓝的吸附是单分子吸附,即符合朗格缪尔型(图7—1)。
但当原始溶液的浓度过高时,会出现多分子层吸附,而如果平衡后的浓度过低,吸附又不能达到饱和,因此原始溶液的浓度以及吸附平衡后的浓度都应选择在适当的范围之内,本实验原始溶液的浓度为0.2%左右,平衡溶液浓度不小于0.1%。
次甲基蓝具有以下矩形平面结构:阳离子大小为17.0×7.6×3.25×10-30m2。
次甲基蓝的吸附有三种取向:平面吸附投影面积为135×10-20m2;侧面吸附投影面积为75×10-20m2;端基吸附投影面积为39×10-20m2;;对于非石墨型的活性碳,次甲基蓝是以端基吸附取向。
根据实验结果推算,在单层吸附的情况下,1毫克次甲基蓝复盖的面积可按2.45米2计算。
测比表面积的方法
测比表面积的方法比表面积呢,就是指单位质量物料所具有的总面积。
那咋测这个比表面积呀?有一种方法叫气体吸附法。
这就像是给那些小颗粒的东西找好多好多小气体分子做朋友,然后看这些气体分子能在材料表面吸附多少。
就好比小颗粒是一个个小房子,气体分子就是来住房子的客人。
通过测量吸附气体的量,再经过一些复杂的计算,就能算出比表面积啦。
这种方法特别适合那些粉末状的材料哦,像咱们常见的活性炭,它的比表面积可大了,就很适合用这个方法来测。
还有压汞法呢。
这个方法就有点像给材料的孔隙里灌水银。
因为水银不会自己跑到材料的小孔隙里去,得给它加点压力才行。
根据压入材料孔隙中的水银量和所施加的压力,就能算出材料的比表面积。
不过这个方法有点麻烦,而且水银可是有毒的,使用的时候可得特别小心,就像对待一个有点危险但又很有用的小怪兽一样。
溶液吸附法也能测比表面积。
把材料放到溶液里,让溶液里的某些分子吸附在材料表面。
然后通过测量溶液浓度的变化来确定吸附量,再计算出比表面积。
这个方法相对来说比较简单,就像做一个简单的小实验一样。
不同的方法都有自己的优缺点。
气体吸附法比较准确,应用也很广泛,但是设备可能有点贵。
压汞法能测量的范围比较广,但是操作危险又复杂。
溶液吸附法简单又便宜,不过准确性可能就稍微差一点。
咱们在选择测量比表面积的方法的时候,得根据材料的性质、测量的精度要求还有自己的条件来决定。
要是材料很珍贵,精度要求又高,那可能气体吸附法就比较合适。
要是预算有限,对精度要求不是特别高,溶液吸附法也能凑合用。
总之呀,测量比表面积就像一场探索材料微观世界的小冒险,每个方法都是一条不同的小路,就看咱们怎么选啦。
溶液吸附法测量固体物质的比表面积(详细参考)
实验十 溶液吸附法测量固体物质的比表面积一、实验目的:1.了解溶液吸附法测定固体比表面的原理和方法。
2.用溶液吸附法测定活性炭的比表面。
3.掌握分光光度计工作原理及操作方法。
二、实验原理:本实验采用溶液吸附法测定固体物质的比表面。
在一定温度下,固体在某些溶液中吸附溶质的情况可用Langmuir 单分子层吸附方程来处理。
其方程为KcKcm+Γ=Γ1式中:Γ为平衡吸附量,单位质量吸附剂达吸附平衡时,吸附溶质的物质的量(mol ·g-1);Γm 为饱和吸附量,单位质量吸附剂的表面上吸满一层吸附质分子时所能吸附的最大量(mol ·g-1);c 为达到吸附平衡时,吸附质在溶液本体中的平衡浓度(mol ·dm-3);K 为经验常数,与溶质(吸附质)、吸附剂性质有关。
吸附剂比表面S 比 : S 比 =ΓmLA式中:L 是阿伏加德罗常数;A 是每个吸附质分子在吸附剂表面占据的面积。
配制不同吸附质浓度c0的样品溶液,测量达吸附平衡后吸附质的浓度c ,用下式计算各份样品中吸附剂的吸附量mVc c )(0-=Γ 式中:c0是吸附前吸附质浓度(mol ·dm-3);c 是达吸附平衡时吸附质浓度(mol ·dm-3);V 是溶液体积(dm3);m 是吸附剂质量(g )。
Langmuir 方程可写成Kc cm m Γ+Γ=Γ11 根据改写的Langmuir 单分子层吸附方程,作Γc~c 图,为直线,由直线斜率可求得Γm甲基兰的摩尔质量为373.9g ·mol -1。
假设吸附质分子在表面是直立的,A 值取为1.52×10-18m 2。
三、实验步骤:1.样品活化2.溶液吸附取5只洗净的干燥的带塞锥形瓶编号,分别用分析天平准确称取活化过的活性炭0.1g ,至于瓶中,分别配置五种浓度的次甲基蓝50ml ,振荡4-6h ,分别移取滤液2ml 放入250ml 容量瓶中,并定容,待用; 3.原始溶液处理4.次甲基蓝标准溶液的配制用移液管分别移取0.4、0.6、0.6、1.0、1.2、1.4ml 的0.3126×10-3mol/L 标准次甲基蓝溶液于100ml 容量瓶中,用蒸馏水稀释至刻度,待用; 5.工作波长的选择:665nm 6.测量吸光度四、数据记录及处理:1.实验基础数据2.作A-CA3.求次甲基蓝原始溶液的浓度和平衡溶液的浓度 C 将实验测定的稀释后原始溶液的吸光度,从 A —C 工作曲线上查得对应的浓度,然后乘以稀释倍数 100,即为原始溶液的浓度;计算得:0.0019 mol/L 将实验测定的各个稀释后的平衡溶液吸光度,从 A —C 工作曲线上查得对应的浓度,然 4.计算吸附溶液的初始浓度 C 05.计算吸附量由平衡浓度 C 及初始浓度 C 0数据,由Γ=(C-C 0)V/m6.作朗缪尔吸附等温线:以Γ 为纵坐标,C 为横坐标0.0400.0420.0440.0460.0480.0500.0520.0540.0560.0580.060吸附量ΓC/(mol/L)7.求饱和吸附量作C/Γ-C 图,由图求得饱和吸附量Γ∞。
固液吸附法测比表面积
物理化学实验报告院系化学院环境工程学院班级 0409402学号 23姓名张玉日期 2011/11/24同组者姓名张永胜实验二十 固液吸附法测定比表面Ⅰ.次甲基蓝在活性炭上的吸附一、实验目的1.用溶液吸附法测定活性炭的比表面。
2.了解溶液吸附法测定比表面的基本原理。
二、预习要求1.掌握比表面的概念及其计算式。
2.明确实验所测各个物理量的意义,并掌握测定方法。
三、实验原理比表面是指单位质量(或单位体积)的物质所具有的表面积,其数值与分散粒子大小有关。
测定固体比表面的方法很多,常用的有BET 低温吸附法、电子显微镜法和气相色谱法,但它们都需要复杂的仪器装置或较长的实验时间。
而溶液吸附法则仪器简单,操作方便。
本实验用次甲基蓝水溶液吸附法测定活性炭的比表面。
此法虽然误差较大,但比较实用。
活性炭对次甲基蓝的吸附,在一定的浓度范围内是单分子层吸附,符合朗格缪尔(Langmuir)吸附等温式。
根据朗格缪尔单分子层吸附理论,当次甲基蓝与活性炭达到吸附饱和后,吸附与脱附处于动态平衡,这时次甲基蓝分子铺满整个活性粒子表面而不留下空位。
此时吸附剂活性炭的比表面可按下式计算:()060C C G S 2.4510W-=⨯⨯ (1)式中,S 0为比表面(m 2·kg -1);C 0为原始溶液的质量分数;C 为平衡溶液的质量分数;G 为溶液的加入量(kg);W 为吸附剂试样质量(kg);2.45×106是1kg 次甲基蓝可覆盖活性炭样品的面积(m 2·kg -1)。
本实验溶液浓度的测量是借助于分光光度计来完成的,根据光吸收定律,当入射光为一定波长的单色光时,某溶液的光密度与溶液中有色物质的浓度及溶液的厚度成正比,即: E=KCL 。
式中,E 为光密度;K 为常数;C 为溶液浓度;L 为液层厚度。
实验首先测定一系列已知浓度的次甲基蓝溶液的光密度,绘出E—C工作曲线,然后测定次甲基蓝原始溶液及平衡溶液的光密度,再在E—C曲线上查得对应的浓度值,代入(1)式计算比表面。
比表面积测定
固液吸附法测定固体比表面积(6学时) 综合性实验教学及实验内容:基本要求:用亚甲基蓝水溶液吸附法测定颗粒活性炭的比表面积;了解朗谬尔(Langmuir )单分子层吸 附理论及溶液法测定比表面积的基本原理 重 点:掌握溶液法测定比表面积的基本原理和方法。
难 点:溶液法测定比表面积的基本原理。
实验 固液吸附法测定固体比表面积(6学时)一、实验目的1、掌握用固液吸附法测定活性炭的比表面积基本原理和方法。
2、掌握分光光度计的工作原理及使用方法。
二、实验原理比表面积是指单位质量(或单位体积)的物质所具有的表面积,其数值与分散粒子大小有关。
测定固体比表面的方法很多,常用的有BET 低温吸附法、电子显微镜法和气相色谱法,但它们都需要复杂的仪器装置或较长的实验时间。
而固液吸附法则仪器简单,操作方便,还可以同时测定许多个样品。
活性炭对亚甲基蓝的吸附,在适当的浓度范围内是单分子层吸附,符合朗格缪尔吸附等温式。
当亚甲基蓝与活性炭达到饱和吸附后,吸附与脱附处于动态平衡,这时亚甲基蓝分子铺满整个活性炭粒子表面而不留下空位。
吸附剂活性炭的比表面可按下式计算:600() 2.4510c c VS W-=⨯⨯ (1)式中,S 0为比表面积(m 2/kg),c 0为原始溶液的浓度(kg /L),c 为平衡溶液的浓度(kg /L),V 为溶液的加入量(L),W 为吸附剂试样质量(kg),2.45×106代表单分子层吸附的情况下每kg 亚甲基蓝可以覆盖活性炭样品的面积(m 2/kg)。
本实验通过分光光度法测定测定亚甲基蓝原始溶液及吸附平衡时溶液的吸光度,在工作曲线上查得相应的浓度,由上式即可计算活性炭比表面积。
三、主要仪器与试剂1. 仪器: 722型分光光度计及其附件一套,(共用) SX2-4-13箱式电阻炉一台(共用),HY -3多功能调速振荡器一台(共用),砂芯漏斗,100mL 容量瓶5个,500mL 容量瓶2个,250mL 带塞磨口锥形瓶1个 50mL 移液管1支,10mL 刻度移液管1支2. 试剂:亚甲基蓝原始溶液(2g/L ),亚甲基蓝标准溶液(0.1g/L ),颗粒活性炭(非石墨型)若干,四、实验步骤1. 样品的活化将颗粒活性炭置于瓷坩锅中,放入箱式电阻炉内,500℃下活化1h(或在真空烘箱中300℃下活化1h),然后放入干燥器中备用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验五 溶液吸附法测固体比表面积一、实验目的:1.了解溶液吸附法测定固体比表面的优缺点。
2.掌握溶液吸附法测定固体比表面积的基本原理和测定方法。
3.用亚甲基蓝水溶液吸附法测定活性碳、硅藻土、碱性层析氧化铝比表面积。
二、实验原理:① Langmuir 吸附定律:在一定温度下以及一定的浓度范围内,大多数固体对次甲基蓝的吸附是单分子层吸附,与固体对气体的吸附很相似,可用Langmuir 单分子层吸附模型来处理。
Langmuir 吸附理论的基本假定是:a) 固体表面是均匀的;b) 吸附是单分子层吸附;c) 被吸附在固体表面上的分子相互之间无作用力;d) 吸附剂一旦被吸附质覆盖就不能被再吸附;e) 吸附平衡时,吸附和脱附建立动态平衡;f) 吸附平衡前,吸附速率与空白表面成正比,解吸速率与覆盖度成正比。
根据以上假定,推导出吸附方程:设固体表面的吸附位总数为N ,覆盖度为θ,溶液中吸附质的浓度为c ,根据上述假定,有吸附速率: r 吸 = k 1N (1-θ)c (k 1为吸附速率常数)脱附速率: r 脱 = k -1N θ (k -1为脱附速率常数)当达到吸附平衡时: r 吸 = r 脱 即 k 1N (1-θ)c = k -1N θ由此可得: c K c K 吸吸+=1θ (1) 式中K 吸=k 1/k -1称为吸附平衡常数,其值决定于吸附剂和吸附质的性质及温度,K 吸值越大,固体对吸附质吸附能力越强。
若以q 表示浓度c 时的平衡吸附量,以q ∞表示全部吸附位被占据时单分子层吸附量,即饱和吸附量,则: θ =q/q ∞代入式(1)得 q (2) 式中:K 为吸附作用的平衡常数,也称为吸附系数,与吸附质、吸附剂性质及温度有关,其值越大,则表示吸附能力越强;q 为平衡吸附量,1g 吸附剂达吸附平衡时,吸附的溶质的物质的量(mg/g );q ∞为饱和吸附量,1g 吸附剂的表面上盖满一层吸附质分子时所能吸附的最大量(mg/g );c 为达到吸附平衡时,溶质在溶液本体中的平衡浓度。
② 吸附剂对亚甲基蓝的吸附溶液吸附法的吸附质一般用亚甲基蓝、苯酚、硬脂酸等,水溶性吸附质广泛应用于测定固体比表面积,由于在所有染料中亚甲基蓝具有最大的吸附倾向,故本实验选用亚甲基蓝作为吸附质,以活性碳、硅藻土、碱性层析氧化铝作为固体吸附剂。
亚甲基蓝(Methylene Blue trihydrate )具有以下矩形平面结构:摩尔质量为319.85g/mol ,阳离子大小为17.0 ×7.6× 3.25 Å3。
亚甲基蓝的吸附有三种取向:平面吸附投影面积为135Å2,侧面吸附投影面积为75 Å2,端基吸附投影面积为39.5 Å2。
对于非石墨型的活性碳及硅藻土,亚甲基蓝可能不是平面吸附而是端基吸附,根据实验结果推算,在单层吸附的情况下,1mg 亚甲基蓝的覆盖面积可按2.45m 2计算。
而对Al 2O 3则可能是侧面吸附。
本实验将定量的三种固体吸附剂与一定量的亚甲基蓝溶液相混合,在常温下振荡,使其达到吸附平衡。
用分光光度计测量吸附前后亚甲基蓝溶液的浓度。
从浓度的变化求出每克活性碳吸附亚甲基蓝的吸附量q 。
q= (3)式中:q 为吸附量(mg/g ),c 0为亚甲基蓝原始浓度(ppm ),c 为亚甲基蓝平衡浓度(ppm),w 为固体样品重(g )。
求出三种固体吸附剂对亚甲基蓝的饱和吸收量后,就可以由下式求出各种固体比表面积。
S=qa (4)式中:q 为吸附量(mg/g ),a 为1mg 亚甲基蓝覆盖固体的面积,对活性碳和硅藻土为2.45 m 2。
③Lambert-Beer 定律:根据光吸收定律,当入射光为一定波长的单色光时,某溶液的吸光度与溶液中有色物质的浓度及溶液层的厚度成正比kc bc I I A ==-=ε0lg (5) 式中,A 为吸光度,I 0为入射光强度,I 为透过光强度,ε为摩尔吸光系数,b为光径长度或液层厚度,c 为溶液浓度。
由于同一种溶液在不同波长处测得吸光度不同,为提高测量灵敏度,将吸光度A 对波长作图得溶液吸附曲线,工作波长就选取在吸光度A 最大处。
亚甲基蓝溶液在可见区有2个吸收峰:445nm 和665nm 。
但在445nm 处活性碳吸附对吸收峰有很大的干扰,故本试验选用的工作波长为665nm,并用分光光度计进行实际测量。
可见分光光度计的结构一般由五部分组成:三、仪器和试剂:1)、仪器:722型光电分光光度计及其附件1台(如下图Fig#1);康氏振荡器1台(如下图Fig#2);分析天平一台;烘箱一台;容量瓶:1000ml 1只,100mL 5只,50mL 1只;移液管:5ml 1支,10ml 1支;具塞锥形瓶:100mL 3个;长颈玻璃漏斗3只;烧杯:50ml 4个;洗瓶一个;洗耳球一只;滴管若干。
2)、试剂:亚甲基蓝(100ppm标准溶液);粉末状非石墨型活性碳;硅藻土;碱性Al2O3 。
四.实验装置图:Fig#1 722型光电分光光度计 Fig#2康氏振荡器四、实验步骤:样品活化步骤略去。
1、吸附量的测定准确配制100ppm亚甲基蓝1000ml。
取100ml具塞锥形瓶3只,洗涤烘干。
分别准确称取活性碳0.01g;硅藻土0.1g;碱性Al2O30.3g,(实际各试剂称取量见表Tab#1)各置于一个锥形瓶中,编号。
再分别加50ml(容量瓶取)100ppm 亚甲基蓝溶液,加塞后置于振荡器上振荡1.5h。
2、配制亚甲基蓝标准溶液用移液管吸取1mL,3mL,5mL,8mL,10mL浓度为100ppm的标准亚甲基蓝溶液于100mL容量瓶中。
用蒸馏水稀释至刻度,定容摇匀,即得1ppm、3ppm、5ppm、8ppm、10ppm的标准溶液,待用。
亚甲基蓝溶液的密度可以用水的密度代替。
3、选择工作波长对于亚甲基蓝溶液,工作波长为665nm,由于各台分光光度计波长刻度略有误差,应自行选取工作波长。
可取3ppm标准溶液,在600nm~700nm范围内先按10nm间隔测吸光度,再于最大吸光波长左右分别以2nm为间隔测吸光度,以吸光度最大的波长作为工作波长。
得到入射光波长与吸光度关系表Tab#2,并绘制亚甲基蓝吸收曲线图Fig#3。
测量时发现最大吸收波长为664nm,故步骤4和步骤5即采用664nm作为工作波长。
4、制作亚甲基蓝工作曲线以蒸馏水为空白,用1cm比色皿分别测定1ppm 、3ppm、5 ppm、8 ppm、10 ppm亚甲基蓝标准溶液的吸光度。
得到亚甲基蓝浓度与吸光度关系表Tab#3,并作吸光度A-亚甲基蓝浓度c工作曲线Fig#4,备用。
5、测定亚甲基蓝平衡浓度样品振荡1.5小时后,取下锥形瓶,分别用滤纸和玻璃长颈漏斗过滤,分别用烧杯收集滤液,根据颜色深浅稀释不同倍数,使吸光度在工作曲线范围内。
测定三种稀释液的吸光度,并在工作曲线上求出相应浓度,乘以稀释倍数求出三种滤液的平衡浓度,得数据见Tab#5。
实验测定完成后,关闭分光光度计,倒掉比色皿中溶液,用蒸馏水、乙醇洗净,放入盒中。
倒掉残余的亚甲基蓝溶液,洗净各类玻璃仪器,整理试验台,指导老师签字。
五、数据记录与处理(原始数据记录见附页1)(1)亚甲基蓝溶液工作波长的确定最大吸收波长的测量,以质量分数为3ppm的标准溶液为待测液,λ与A关系表λ/nm 600 610 620 630 640 650 652 6654 656 658 A 0.275 0.326 0.343 0.360 0.423 0.519 0.530 0.547 0.563 0.577 λ/nm 660 662 664 666 668 670 680 690 700 -A 0.595 0.597 0.604 0.602 0.596 0.579 0.363 0.157 0.064 -Tab#2绘制吸收曲线如下图Fig#3:Fig#3可以看出,当吸收波长为664nm时候,溶液的吸光度最大,故选取664nm为工作波长。
(2) 吸光度A-亚甲基蓝浓度c标准工作曲线的制作标准溶液编号 1 2 3 4 5V(标准溶液)/mL 1.00 3.00 5.00 8.00 10.00 溶液浓度/ppm 1.00 3.00 5.00 8.00 10.00 吸光度A 0.229 0.604 0.943 1.453 1.767做出吸光度A-亚甲基蓝浓度c标准工作曲线如下图Fig#4:Fig#4Tab#4可得线性拟合方程为:A=0.17052c+0.0784 线性匹配度R2 =0.99903 (3)三种固体吸附亚甲基蓝平衡浓度测定:由三稀释液的吸光度A分别求出其稀释后浓度c,再乘上稀释倍数即得亚甲吸附剂活性碳硅藻土碱性氧化铝稀释倍数10 10 10吸光度A 1.173 0.914 1.115稀释液浓度/ppm 6.419 4.900 6.079平衡浓度c/ppm 64.19 49.00 60.79(4)三种固体的饱和吸附量将Tab#5中三种吸附剂平衡浓度及Tab#1中三种吸附剂固体样品重代入公式(3)q= (3)式中:q为吸附量(mg/g),c为亚甲基蓝原始浓度(ppm),c为亚甲基蓝平衡浓度(ppm),w为固体样品重(g)。
固体吸附剂活性碳硅藻土碱性氧化铝平衡浓度c/ppm 64.19 49.00 60.79原始浓度c/ppm 100 100 100固体样品重w/g 0.0106 0.1008 0.3018吸附量q/(mg·g-1)168.9 25.30 6.496 由表可以看出对于亚甲基蓝的吸附量顺序为:活性碳>硅藻土>碱性Al2O 3可能存在这种情况,由于使用的活性碳选取的是粉末状,会使其吸附比较充分而导致测得吸附量偏大,但与颗粒状活性碳吸附量相比不会存在太大偏差,故依然是以上顺序。
(5)三种固体比表面积的计算将Tab#6中三种固体的吸附量代入计算公式(4)进行计算:S=qa(4)式中:q为吸附量(mg/g),a为1mg亚甲基蓝覆盖固体的面积,对单层端基吸附的活性碳和硅藻土为2.45 m2,对单层侧面吸附的碱性Al2O3其a可以按照2222固体吸附剂活性碳粉末硅藻土碱性氧化铝吸附量q/(mg·g-1)168.9 25.30 6.4961mg覆盖面积a/ m2 2.45 2.45 4.65比表面积S 414 62.0 30.2六、思考题:1.亚甲基蓝浓度过高或过低有何缺点,如何调整?本实验用到的是符合Langmuir模型的单分子层吸附,当亚甲基蓝溶液浓度过高时,会出现多分子层吸附,如果平衡后的浓度过低,吸附又不能达到饱和。
因此原始溶液浓度和平衡浓度都应选择在适当的范围,本实验原始溶液浓度为100ppm左右,平衡浓度不小于10ppm。
