金刚石晶胞计算专题
晶胞计算习题

1.回答下列问题(1)金属铜晶胞为面心立方最密堆积, 边长为acm。
又知铜的密度为ρ g·cm-3, 阿伏加德罗常数为_______。
(2)下图是CaF2晶体的晶胞示意图, 回答下列问题:①Ca2+的配位数是______, F-的配位数是_______。
②该晶胞中含有的Ca2+数目是____, F-数目是_____, ③CaF2晶体的密度为ag·cm-3, 则晶胞的体积是_______(只要求列出算式)。
2.某些金属晶体(Cu、Ag、Au)的原子按面心立方的形式紧密堆积, 即在晶体结构中可以划出一块正立方体的结构单元, 金属原子处于正立方体的八个顶点和六个侧面上, 试计算这类金属晶体中原子的空间利用率。
(2)(3)3、单晶硅的晶体结构与金刚石一种晶体结构相似, 都属立方晶系晶胞, 如图:(1)将键联的原子看成是紧靠着的球体, 试计算晶体硅的空间利用率(计算结果保留三位有效数字, 下同)。
(2)已知Si—Si键的键长为234 pm, 试计算单晶硅的密度是多少g/cm3。
4、金晶体的最小重复单元(也称晶胞)是面心立方体, 如图所示, 即在立方体的8个顶点各有一个金原子, 各个面的中心有一个金原子, 每个金原子被相邻的晶胞所共有。
金原子的直径为d, 用NA表示阿伏加德罗常数, M表示金的摩尔质量。
请回答下列问题:(1)金属晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积, 除假定金原子是刚性小球外, 还应假定_______________。
(3)一个晶胞的体积是____________。
(4)金晶体的密度是____________。
5.1986年, 在瑞士苏黎世工作的两位科学家发现一种性能良好的金属氧化物超导体, 使超导工作取得突破性进展, 为此两位科学家获得了1987年的诺贝尔物理学奖, 实验测定表明, 其晶胞结构如图所示。
(4)(5)(6)(1)根据所示晶胞结构, 推算晶体中Y、Cu、Ba和O的原子个数比, 确定其化学式。
专题10 常见晶体模型及晶胞计算(突破训练)(解析版)

2021-2022学年高二化学重难点专题突破模块三晶体结构与性质专题10 常见晶体模型及晶胞计算一.选择题1.下面有关晶体的叙述中,不正确的是()A.金刚石为立体网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子答案:B解析:金刚石中由共价键构成的最小环状结构中有6个碳原子;NaCl晶体中,每个Na+周围紧邻6个Cl-,每个Na+周围紧邻12个Na+;氯化铯晶体中,每个Cs+周围紧邻8个Cl-,每个Cs+周围紧邻6个Cs +;干冰晶体中,每个CO2分子周围紧邻12个CO2分子。
2.KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O-2代替,则下列对于KO2晶体结构的描述正确的是()A.与K+距离相等且最近的O2-共有8个B.与K+距离相等且最近的O2-构成的多面体是正八面体C.与K+距离相等且最近的K+有8个D.一个KO2晶胞中的K+和O-2粒子数均为8答案:B解析:K+位于晶胞棱心,与K+距离相等且最近的O2-位于顶角和面心,共有6个,故A错误;与K+距离相等且最近的O2-共有6个,构成正八面体,K+位于正八面体中心,故B正确;K+位于晶胞棱心,则被横平面、竖平面和正平面共有,且每一个平面有4个K+距离最近,共4×3=12个,故C错误;K+位于晶胞棱心和体心,数目为12×1/4+1=4,O2-位于顶角和面心,数目为8×1/8+6×1/2=4,即一个KO2晶胞中的K+和O2-粒子数均为4个,故D错误。
3、下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是()A.图①和图③ B.图②和图③C.图①和图④ D.只有图④解析:根据NaCl 的晶体结构(),在每个Na +周围最近的等距离的Cl -有6个(上、下、左、右、前、后),故①正确;从NaCl 晶体中分割18可得图④结构。
选修三专题:晶胞计算

晶胞计算晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。
晶体结构的计算常常涉及如下数据:晶体密度、N A 、M 、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。
解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
有关晶胞各物理量的关系:1、晶胞质量=晶胞占有的微粒的质量=晶胞占有的微粒数×MN A 。
2、空间利用率=晶胞占有的微粒体积晶胞体积。
3、金属晶体中体心立方堆积、面心立方堆积中的几组公式(设棱长为a )(1)面对角线长=2a 。
(2)体对角线长=3a 。
(3)体心立方堆积4r =3a (r 为原子半径)。
(4)面心立方堆积4r =2a (r 为原子半径)。
对于立方晶胞,可简化成下面的公式进行各物理量的计算:a 3×ρ×N A =n ×M ,a 表示晶胞的棱长,ρ表示密度,N A 表示阿伏加德罗常数的值,n 表示1 mol 晶胞中所含晶体的物质的量,M 表示摩尔质量,a 3×ρ×N A 表示1 mol 晶胞的质量。
1、【2012全国1】(6)ZnS 在荧光体、光导体材料、涂料、颜料等行业中应用广泛。
立方ZnS 晶体结构如下图所示,其晶胞边长为540.0 pm .密度为 (列式并计算),a 位置S 2-离子与b 位置Zn 2+离子之间的距离 pm (列示表示)44.1 2、【2013全国1】(6)在硅酸盐中,SiO 4- 4四面体(如下图(a ))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。
图(b )为一种无限长单链结构的多硅酸根,其中Si 原子的杂化形式为 ,Si 与O 的原子数之比为 ,化学式为 。
(6)sp 3 1∶3[SiO 3]2n- n (或SiO 2-3)3、【2014全国1】(4)铝单质为面心立方晶体,其晶胞参数a =0.405nm ,晶胞中铝原子的配位数为 。
关于金刚石原胞体积的计算方法及金刚石的晶胞和原胞的比较

关于金刚石的原胞体积的计算方法及金刚石原胞与晶胞的一些区别下面这张图片是作者制作的金刚石模型晶体中的原胞,外面是晶胞,晶胞里面是原胞。
为了说明原胞的组Array成,我们把上面这张金刚石原胞的模型图片用左面这张示意图片来表示:这张图片是晶体学中的一部分截图,它清楚地表明了什么是原胞,简单说来,金刚石的原胞就是晶胞的六个面心相互连结起来的一个平行六面体,从体积来说它是晶体的最小结构单元。
本文想谈谈关于金刚石的晶胞和原胞的几个问题,与大家共同讨论。
一,关于原胞的体积的计算方法。
这张截图已证明出原胞体积是晶胞体积的四分之一,并有推导过程,不过这个体积的计算方法比较复杂,学生不太容易看懂。
我们是用简单的数学方法计算出原胞的体积也是晶体体积的四分之一。
第一种方法是用切割法。
如果我们有一个原胞的模型来观察,不难看出,这个原胞是由两个正四面体(棱长为a1=a2=a3)和一个正八面体(棱长都和a1相同)组成。
设晶胞的棱长为a,则不难推知原胞的棱长a1=2a/2∵正四面体的体积V=2/12 a13 (a1为正四面体的棱长)正八面体的体积V=2/3 a13(a1为正八面体的棱长)∴正四面体的体积V=2/12 a13=2/12(2a/2)3=a3/24正八面体的体积V=2/3 a13=2/3(2a/2)3 = a3/6∴原胞的体积=2×a3/24+a3/6=a3/12+ a3/6 = a3/4第二种方法是用台体体积=底面积×高来计算∵原胞的高即正四面体的高=6/3×棱长=6/3×a1=6/3×2a/2 =3a/3原胞的底面积是一个夹角为60度的菱形的面积= a12×sin60°=(2a/2)2×3/2=3a2/4原胞的体积=3a2/4×3a/3 = a3/4这两种原胞的体积计算方法,对于中学生来说是最容易的,因此与大家交流共享。
二,原胞和晶胞的关系和区别1,晶体是由无数个晶胞所组成的,但是,晶胞并不是晶体的最小组成单位,原胞才是晶体最小的周期性重复的最小单元,它是一个平行六面体,整个晶体可以看成是由无数个原胞无间隙地紧密排列而成。
金刚石的计算
8
Ca2+:
8ห้องสมุดไป่ตู้
Ca2+: 4 F-: 8
F-: 4 F-: 4
碱土金属卤化 物、碱金属氧 化物。
氯化钠的晶胞
(1)钠离子和氯离子的位置:
①钠离子和氯离子位于立方体的顶角上,并交错排列。 ②钠离子:体心和棱中点;氯离子:面心和顶点,或者 反之。
CsCl的晶体结构及晶胞构示意 图
---Cs+
---Cl-
(3)CaF2型晶胞
①Ca2+的配位数:8 ②F-的配位数:4 ③一个CaF2晶胞中 含: 4个Ca2+和8个F-
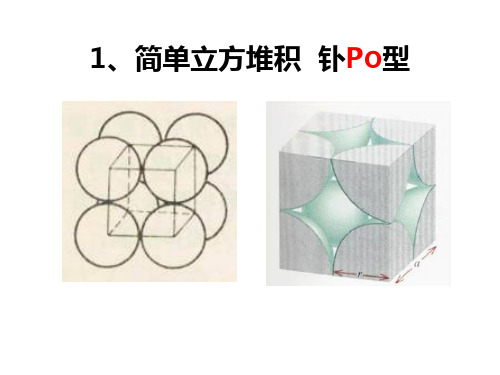
1、简单立方堆积 钋PO型
简单立方晶胞空间利用率
2r
4 3 r V球 3 空间利用率= 100 % 100% 3 V晶胞 8r
=52%
立方体的棱长为2r,球的半径为r 过程: 1个晶胞中平均含有1个原子 4 3 V晶胞=(2r)3=8r3 V球= r 3
体心立方堆积 钾型
配位数:8 空间占有率: 68.02%
Na+: 4 Cl-: 4 Cs+: 1 Cl-:1
KBr AgCl、 MgO、CaS、 BaSe CsCl、CsBr、 CsI、TlCl
AB
CsCl 型 ZnS型
2+: Zn 4 ZnS、AgI、 4 Zn2+: Zn2+: 4 2S2-: 4 S2-: 4 S : 4 BeO
AB2
CaF2 型
Ca2+:
( 体 心 立钾 方型 堆 积 )
( 面 心 六 方铜 密型 堆 积 )
( 六 方镁 密型 堆 积 )
金属晶体的原子空间堆积模型3
六方最密堆积A3:
计算专题晶胞的计算

晶胞的计算二、常见的晶胞计算题:晶胞密度ρ =m(晶胞)/V(晶胞)空间利用率=[V(球总体积)/V(晶胞体积)]×100% 【注】1m =10dm =102cm =103mm =106um =109nm =1012pm① 简单立方堆积:假设球的半径为r cm ,则该堆积方式的空间利用率为:② 体心立方堆积:假设球的半径为r cm ,则该堆积方式的空间利用率为:③ 面堆积:,则该堆积方式的空间利用率为:Mg/mol ,N A 为阿伏伽德罗常数的数值,试计算该晶胞的密度:总结】必须掌握的常见晶胞及晶体结构分子晶体:干冰、冰晶胞图形、晶胞组成特点;原子晶体:金刚石(晶体硅)、二氧化硅晶胞组成特点、边长(体积、密度、原子最近距离)的计算方式;金属晶体:四种堆积方式的名称、图形、代表金属、边长(体积、密度、原子最近距离)的计算方式;离子晶体:NaCl 、CsCl 、CaF 2晶胞图形、晶胞组成、边长(体积、密度、原子最近距离)的计算方式。
【练习】中学化学教材中展示了NaCl 晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni 2+与最临近O 2-的核间距离为a cm ,计算NiO晶体的密度(已知NiO 的摩尔质量为74.7 g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni 2+空缺,另有两个Ni 2+被两个Ni 3+所取代。
其结果为晶体仍呈电中性,但化合物中Ni 和O 的比值却发生了变化。
某氧化镍样品组成为Ni 0.97O ,试计算该晶体中Ni 3+ 与Ni 2+的离子个数之比。
第二类:晶胞灵活变形及计算【例1:2012年新课标·37】【化学——选修3物质结构与性质】(15分)VIA 族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA 族元素的化合物在研究和生产中有许多重要用途。
晶胞的相关计算专项训练练习题及解析
晶胞的相关计算专项训练练习题及解析一、晶胞的相关计算1.根据下列结构示意图,判断下列说法中正确的是A.在CsCl晶体中,距Cs+最近的Cl-有6个B.在CaF2晶体中,Ca2+周围距离最近的F-有4个C.在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子D.在铜晶体中,每个铜原子周围距离最近的铜原子有12个2.补铁剂常用于防治缺铁性贫血,其有效成分般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。
回答下列问题:(1)能表示能量最低的亚铁离子的电子排布式是__(填标号)。
a.[Ar]3d54s2b.[Ar]3d54s1c.[Ar]3d64s2d.[Ar]3d6(2)琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是__,碳原子的杂化方式是__;琥珀酸亚铁中存在配位键,在该配位键中配位原子是__,中心原子是__。
(3)富马酸和马来酸互为顺反异构体,其电离常数如下表:物质名称K a1K a2富马酸()7.94×10-4 2.51×10-5马来酸() 1.23×10-2 4.68×10-7请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:__。
(4)β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a=870pm、b=680pm、c=479pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。
在该晶胞中,硫酸根离子在空间上有__种空间取向,晶胞体内硫酸根离子的个数是__,铁原子周围最近的氧原子的个数为__;设阿伏加德罗常数的值为N A,则该晶体的密度是__g·cm-3(列出计算表达式)。
3.新型冠状病毒来势汹汹,但是它依然可防可控。
84消毒液具有强氧化性,可将冠状病毒外的包膜破坏后使RNA被降解,使病毒失活,以达到灭菌的效果。
制取84消毒液的氯气可用加热浓盐酸和MnO2混合物来制取,也可用浓盐酸和KClO3直接混合来制取。
晶胞的相关计算专项训练(讲义及答案)附解析
晶胞的相关计算专项训练(讲义及答案)附解析一、晶胞的相关计算1.以N A表示阿伏加德罗常数的值,下列说法正确的是()A.36g冰(图甲)中含共价键数目为4N AB.12g金刚石(图乙)中含有σ键数目为4N AC.44g干冰(图丙)中含有N A个晶胞结构单元D.12g石墨(图丁)中含σ键数目3N A2.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
3.碳、氮、硫、硒等元素的单质及其化合物有重要的科学研究价值。
回答下列问题:(1)氰[化学式(CN)2]、硫氰[化学式(SCN)2]等与卤素单质性质相似,又称类卤素。
(CN)2中π键和σ键的数目之比为__________。
金刚石的计算课件
05
金刚石计算的发展趋势与挑战
发展趋势
算法优化
金刚石计算在算法上正在不断进 行优化和改进,以提高计算效率
和准确性。
硬件加速
随着GPU、TPU等硬件的发展, 金刚石计算正在朝着硬件加速的
方向发展,以提升计算性能。
分布式计算
随着云计算技术的发展,金刚石 计算正在朝着分布式计算的方向 发展,以解决大规模数据集的计
分子动力学模拟
总结词
分子动力学模拟是一种基于经典力学原理的计算方法,可用于研究材料的微观 结构和动态行为。
详细描述
分子动力学模拟通过求解原子间的相互作用力,可以模拟材料的微观结构和动 态行为,如金刚石的晶格振动和热力学性质等。该方法适用于研究材料在不同 温度和压力条件下的性质变化。
蒙特卡洛方法
总结词
总结词
常用的密度泛函理论计算软件
详细描述
VASP是一款常用的密度泛函理论计算软件,由维也纳大学开发,适用于电子结构计算和材料性质模 拟。
VASP(Vienna Ab initio Simulation Package)
特点 支持多种晶体结构预测
可以模拟固体、液体和表面的性质
VASP(Vienna Ab initio Simulation Package)
金刚石的应用
工业应用
金刚石在工业领域的应用包括制 造切割工具、钻头、研磨剂等, 以及作为高温高压条件下的实验
材料。
珠宝应用
金刚石因其高硬度和闪亮的外观而 广泛用于珠宝制造,如戒指、项链 等。
其他应用
除工业和珠宝应用外,金刚石还可 以用于制造光学器件、电子器件等 高科技产品。
02
金刚石的计算方法
密度泛函理论(DFT)
有关晶胞的计算
2.金属晶体 (1)金属晶体的结构与金属晶体性质的内在 联系 ①金属晶体的结构与金属导电性的关系 在金属晶体中存在许多自由电子,这些自由 电子的运动是没有方向性的,但在外加电场 的作用下,自由电子就会发生定向移动形成 电流,所以金属容易导电。
②金属晶体的结构与金属导热性的关系 金属容易导热,是由于自由电子在运动时与 金属离子碰撞而引起能量的交换,从而使能 量从温度高的部分传到温度低的部分,使整 块金属达到相同的温度。
有关晶胞的计算
1、根据石墨晶体结构示意图及提供的资料计算(保留三
位有效数值),有关公式,资料见图.试回答石墨中:
(1)碳原子数目与碳碳σ键数目之比为
。
(2)碳原子数目与正六边形数目之比为
。
(3)碳正六边形数目与碳碳σ键数目之比为 。
(4)12g石墨中,正六边形的数目有
个。
(5)石墨的密为
。
1、金刚石是一种无色透明的固体,每个碳原子被相邻四 个碳原子包围,处于四个碳原子中心,以共价键结合成正四 面体网状结构,如图所示,在金刚石中,含有共价键形成的 碳原子环,试回答:
③金属晶体的结构与金属延展性的关系 大多数金属具有较好的延展性,是由于金属离 子与自由电子之间的相互作用没有方向性。 当金属受到外力时,晶体中的各原子层就会 发生相对滑动后,相互作用没有被破坏,金 属虽然发生了形变但不会导致断裂。
④金属晶体的结构与金属颜色的关系 由于金属原子以最紧密堆积状态排列,内部 存在自由电子,所以当光辐射到它的表面上 时,自由电子可以吸收所有频率的光,然后 很快释放出各种频率的光,这就使得绝大多 数金属呈现银灰色以至银白色光泽。而金属 在粉末状态时,金属的晶面取向杂乱,晶格 排列不规则,吸收可见光后辐射不出去,所 以金属粉末常呈暗灰色或黑色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精选课件
3
思考:1.一个金刚石晶胞里有_8_个碳原子? 2.平均每个碳原子有__2 _个C--C键? 3.每个碳原子为__12__个六元环共ቤተ መጻሕፍቲ ባይዱ? 4.每个C-C键为___6 _个六元环共用?
金刚石晶胞计算专题
精选课件
1
(4))下图为B元素的某种单质晶体的晶胞,该晶体中B原子 的空间占有率为________________
精选课件
2
思考:1.金刚石晶胞中,每个C原子均可与相邻的__4_ 个C构成实心的正四面体?
2.在一个小正四面体中平均含有__2_个碳原子? 3. 在金刚石中最小的环是___6_元环?
共价键,而冰融化需要破坏氢键
• (3)实验测得冰中氢键的作用力为18.5 kJ/mol,而冰的 熔化热为5.0 kJ/mol,这说明冰熔化成水,氢键 ___部__分____(填全部或部分)被破坏。 (4)假如冰晶胞边长为a cm,则冰的密度是 _____1_44_/a_3_N_A ______g·cm-3 (阿伏伽德罗常数用NA表示)。
精选课件
7
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
精选课件
4
1个金刚石晶胞含几个碳碳键? 如 何算?
精选课件
5
• 晶胞是构成晶体的基本重复单元.在二氧 化硅晶胞中有8个硅原子位 于立方晶胞的8 个顶角,有6个硅原子位于晶胞的6个面心, 还有4个硅原子与16个氧原子在晶胞内构成 4个硅氧四面体,它们均匀错开排列于晶胞 内.根据图示二氧化硅晶胞结构,每个晶 胞内所含“SiO2”基元数为( ) C A.4个
• B.6个
• C.8个
• D.18个
精选课件
6
• 冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如下 图:
(1)一个水分子含___2__个孤电子对,水分子能与很多 金属离子形成配合物,请写出它与铜离子形成的一种蓝色 的配合物离子的化学式为__C_u_(H_2_O_)4_2_+ _。 (2)每个冰晶胞平均占有__8__个水分子,冰的熔点远低 于金刚石熔点的原因是破__坏_的_作__用_力__不_同_,__金_刚_石__融。化需要破坏
