谷氨酸循环及谷氨酸兴奋性毒性
谷氨酸神经递质的兴奋性调节

谷氨酸神经递质的兴奋性调节神经递质是指在神经元之间传递信息的化学物质。
谷氨酸是一种兴奋性神经递质,在中枢神经系统中起着重要的调节作用。
本文将详细探讨谷氨酸神经递质的兴奋性调节机制。
一、谷氨酸的合成和释放1. 谷氨酸的合成谷氨酸主要通过谷氨酸合成酶催化谷氨酸酸性氨基酸谷氨酰胺和谷氨酸半胱氨酸之间的转化来合成。
2. 谷氨酸的释放谷氨酸在突触间隙中通过钙离子的介导而释放。
神经元兴奋时,细胞内的钙离子浓度增加,导致谷氨酸泡膜与细胞膜融合并释放谷氨酸。
二、谷氨酸的作用机制1. 兴奋性作用谷氨酸作为兴奋性神经递质,能够与神经元上的谷氨酸受体结合,激活相应的信号转导通路,进而增强神经元的兴奋性。
这使得谷氨酸在学习、记忆、认知等脑功能中发挥至关重要的作用。
2. 神经元间的信号传递谷氨酸能够从兴奋性神经元释放到靶神经元,传递神经信号。
这种信号传递包括电化学信号和化学信号的相互作用,进而调节神经元活动。
三、谷氨酸兴奋性调节的调控机制1. 谷氨酸受体的调节谷氨酸在神经元之间的传递主要通过谷氨酸受体来实现。
这些受体可分为离子通道受体和G蛋白耦联受体两大类。
离子通道受体包括NMDA受体、AMPA受体和kainate受体,它们的开放调节了细胞内钙离子浓度的变化。
G蛋白耦联受体则主要通过细胞内信号转导通路进行调节。
2. 谷氨酸的再摄取和降解为了维持谷氨酸浓度的平衡,神经元通过再摄取和降解的方式进行调节。
再摄取可通过谷氨酸转运体将外泌的谷氨酸重新吸收到细胞内,降解则通过谷氨酸酸解酶将谷氨酸转化为二氧化碳和水,进而排泄出体外。
3. 神经调质的参与神经调质是指对谷氨酸神经传递过程产生调控作用的其他神经递质。
例如,GABA和谷氨酸具有相互抑制的作用,当GABA释放增加时,会抑制谷氨酸的释放,从而调节谷氨酸兴奋性。
四、谷氨酸神经递质的相关疾病和临床应用1. 神经退行性疾病在神经退行性疾病中,如阿尔茨海默病等,谷氨酸的兴奋性调节失衡导致神经元的损伤和死亡。
脑缺血时谷氨酸释放机制_梅和珊

Pase功能障碍 , 转运体无法摄取细胞外的 Glu, 细胞
· 394·
中国药理学通报 ChinesePharmacologicalBulletin 2005 Apr;21(4)
内高浓度的 Glu便成为巨大的 Glu储库 , 在细胞内 高浓度的 Glu驱动下 , 谷氨酸转运体发生 逆转 , 使 Glu转运到细胞外 , 造成细胞外 Glu堆积 , 进而激活 GluRs, 触发神经元死亡的级联反应[ 4] 。 大鼠大脑中 动脉闭 塞 (MCAO)后 , 缺 血侧 大脑 皮 层 GLT-1 和 EAAC1的 mRNA表达和蛋白水平均明显降低[ 5] ;对 野生小鼠和 GLT-1突变小鼠缺血后海马 CA1区细 胞外 Glu水平动态变化的比较研究显示 , 缺血 5分 钟突变小鼠 [ Glu] o明显高于野生小鼠 , 引起迟发性 神经元死亡 ;而当缺血时间延长至 20 min, 则野生小 鼠 [ Glu] o明显高于突变小鼠 , 海马 CA1区可见急 性神经元变性坏死 , 提示 GLT-1在缺血早期通过摄 取细胞外 Glu起到保护神经元的作用 , 而在缺血后 期则主要通过释放胞浆内的 Glu而产生神经毒性作 用 [ 6] 。全细胞膜 片钳技术对脑缺血 时海马神经元 Glu释放 的研究 证实 , 能量 丧失时 [ Glu] o增 加是 Ca2 +-依赖性和 Ca2 + -非依赖性 Glu释放增加综合作 用的结果 , 而维持细胞外低水平的 Glu有赖于 Glu 释放和摄取功能之间的动态平衡[ 7] 。 2.2 Na+-非依赖性谷 氨酸转运体 ———胱氨酸 -谷 氨酸转运体调节的谷氨酸释放 除了 Na+-依赖性 的谷氨酸转运体 , 体内尚有其他的转运体也参与了 细胞外 Glu稳态的调节作用 , 尤其是胱氨酸 -谷氨酸 转运体 。 该转运体为 Cl-依赖性的 , 其功能与 Na+ 无关 , 可在多种细胞内表达 , 已被成功地克隆 。 经胱 氨酸 -谷氨酸转运体交换进入细胞内的胱氨酸是细 胞合成抗氧化剂谷胱甘肽的重要前体物质 , 通常胶 质细胞将摄取的胱氨酸转化为半胱氨酸 , 半胱氨酸
谷氨酸兴奋性毒性的产生及其相关机制

谷氨酸兴奋性毒性的产生及其相关机制陈艳清 杨 璇 甄 然 王玉波中图分类号:R749.1 文献标识码:A 文章编号:1006-351X (2020) 03-0319-04谷氨酸兴奋性毒性参与多种神经退行性疾病的致病机制,包括阿尔茨海默病,多发性硬化症,帕金森病,亨廷顿舞蹈病,额颞叶痴呆和肌萎缩侧索硬化症等[1]。
因此,全面了解谷氨酸兴奋性毒性所介导的细胞死亡将会对多种神经退行性疾病的致病机制研究提供重要的信息。
一、细胞外过量谷氨酸介导的兴奋性毒性及其相关机制谷氨酸释放的增加以及谷氨酸转运体的功能障碍所致谷氨酸摄取的减少都会引起细胞外谷氨酸水平的增加,进而过度活化谷氨酸受体并启动兴奋性毒性,造成神经元的功能异常和死亡。
1. 谷氨酸的释放异常谷氨酸是脊椎动物中枢神经系统(central nervous system,CNS)中主要的兴奋性神经递质,其在长时程增强和学习记忆等认知功能中起关键作用。
研究发现星形胶质细胞主要通过Ca2+依赖性胞吐作用释放谷氨酸[2]。
在星形胶质细胞中,由囊泡ATP酶(vacuolar ATPase, V-ATPase)产生的质子梯度可以活化囊泡谷氨酸转运体(vesicular glutamate transporters,VGLUT) VGLUT 1和VGLUT2,进而将部分谷氨酸转移到小的胞内囊泡中。
内质网释放Ca2+后可以导致胞浆内Ca2+的升高,促进囊泡相关膜蛋白(vesicle-associated membraneprotein, VAMP)VAMP2和VAMP3与星形胶质细胞膜融合蛋白(syntaxin)和可溶性N-乙基马来酰亚胺敏感因子附着蛋白23(soluble N-ethylmaleimide-sensitive factor attachmentprotein 23, SNAP23)的融合,最终导致谷氨酸从囊泡释放到细胞外间隙[3]。
已有研究发现炎症递质的过量释放,如肿瘤坏死因子-a( tumor necrosis factor- alpha, TNF-a)和前列腺素E,可以导致星形胶质细胞中的Ca2+升高,这一过程与Ca2+依赖的谷氨酸的过量释放所引起的神经元兴奋性毒性的发生有关[4]。
氨基酸的脑功能调节机制

氨基酸的脑功能调节机制氨基酸是构成蛋白质的基本组成部分,同时也扮演着大脑功能调节的重要角色。
通过调节神经递质的合成和释放,氨基酸在脑功能的调节中发挥着重要的作用。
本文将探讨氨基酸在脑功能调节中的机制,并深入了解其对大脑健康和神经系统疾病的影响。
氨基酸在脑内主要分为两类:神经递质氨基酸和非神经递质氨基酸。
常见的神经递质氨基酸包括谷氨酸、天冬氨酸、γ-氨基丁酸(GABA)和甘氨酸,而非神经递质氨基酸主要是作为蛋白质合成的原料。
这两类氨基酸在脑功能调节中扮演不可或缺的角色。
首先,我们来讨论神经递质氨基酸在脑功能调节中的作用。
谷氨酸和天冬氨酸是两种兴奋性神经递质,它们在神经元之间传递信号及调节大脑的兴奋性活动。
它们通过活化谷氨酸和天冬氨酸受体产生兴奋性反应,并参与学习、记忆和认知等高级脑功能的调节。
然而,过量的谷氨酸和天冬氨酸会导致神经细胞的兴奋性过度,产生毒性作用,并与多种神经系统疾病如帕金森病、阿兹海默症和脑卒中等相关。
与兴奋性神经递质相反,GABA是一种抑制性神经递质。
它的主要作用是通过活化GABA受体,减少神经元之间的兴奋性传递从而产生抑制性反应。
GABA的不足会导致脑内的兴奋性活动增加,可能引发焦虑、抑郁等精神障碍。
因此,保持GABA的平衡对于维持大脑的正常功能至关重要。
此外,氨基酸还是合成其他神经递质的前体物质,通过调控神经递质合成影响脑功能。
例如,酪氨酸是合成多巴胺、肾上腺素和去甲肾上腺素的前体物质,而色氨酸是合成血清素和褪黑激素的前体物质。
这些神经递质在情绪调节、睡眠和认知功能中发挥重要作用。
因此,通过摄入含有适量氨基酸的食物,可以调节神经递质的合成,有助于维持大脑健康和正常功能。
在神经系统疾病的治疗中,氨基酸也发挥着重要的作用。
各类氨基酸的补充可以改善神经系统疾病的症状和预防疾病的进展。
例如,谷氨酸调节剂可以通过抑制谷氨酸受体的过度兴奋来改善帕金森病患者的症状。
GABA受体激动剂可用于焦虑症和抑郁症的治疗。
谷氨酸酶在神经元代谢中的作用

谷氨酸酶在神经元代谢中的作用谷氨酸酶是一种重要的酶类物质,其作用在神经元代谢中是至关重要的。
神经元是构成神经系统的重要细胞之一,其工作需要大量的能量和营养物质,而谷氨酸酶恰好是能够合理调整神经元内营养物质代谢的重要酶类物质。
在神经元代谢中,谷氨酸是一种重要的兴奋性氨基酸,其在神经元内充当信息传递的重要媒介。
当神经元接收到外界刺激信号时,会释放出谷氨酸,通过与其他兴奋性物质相互作用,从而引起神经元的兴奋作用。
但是,由于谷氨酸具有毒性,在积累到一定程度时会对神经元产生伤害。
因此,谷氨酸酶的作用就显得尤为重要。
谷氨酸酶的主要功能是将神经元内积累的谷氨酸转化为无毒的谷氨酸酐和丙酮酸。
谷氨酸酰胺是一种无毒化合物,其不会对神经元产生影响,而丙酮酸则可以参与神经元内的能量代谢。
因此,谷氨酸酶不仅能够消除谷氨酸对神经元的毒性影响,还能够提供神经元所需的能量和代谢物质,从而保证神经元的正常活动。
除了消除谷氨酸的毒性作用,谷氨酸酶还具有其他重要的代谢调节作用。
例如,谷氨酸酶可以调节神经元内谷氨酸和谷酰胺酸等代谢物质的平衡。
这些代谢物质不仅是神经系统中的重要物质,还参与机体内其他系统的生理功能调节。
因此,谷氨酸酶的作用可以直接或间接影响到整个机体的生理状态。
此外,谷氨酸酶还可以参与一些神经元内信号转导途径的调控。
例如,谷氨酸酶可以调节神经元内钙离子的水平,影响到神经元内的兴奋性和抑制性作用。
这种调节作用可以影响到神经元的整体活动状态,从而对机体的各种生理功能产生重要影响。
总之,谷氨酸酶在神经元代谢中的作用是非常重要的。
它不仅能够消除谷氨酸对神经元的毒性作用,还可以参与神经元代谢物质的平衡调节,参与到神经元内信号转导途径的调节中。
因此,对于神经系统的正常功能维持,谷氨酸酶的作用不容忽视。
谷氨酸循环及谷氨酸兴奋性毒性
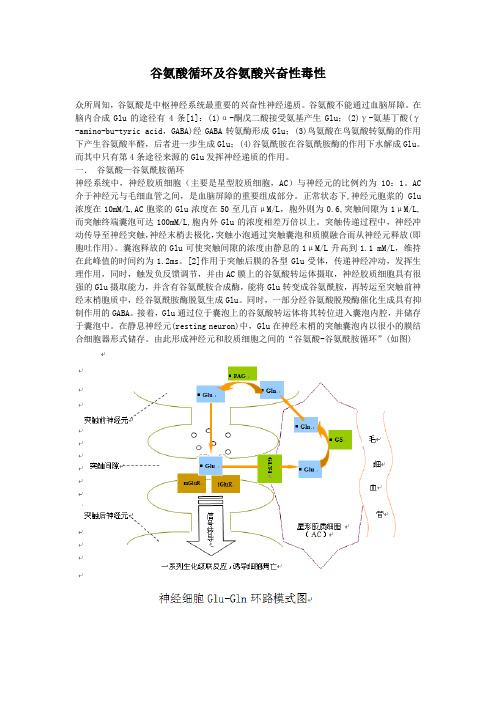
谷氨酸循环及谷氨酸兴奋性毒性众所周知,谷氨酸是中枢神经系统最重要的兴奋性神经递质。
谷氨酸不能通过血脑屏障。
在脑内合成Glu的途径有4条[1]:(1)α-酮戊二酸接受氨基产生Glu;(2)γ-氨基丁酸(γ-amino-bu-tyric acid,GABA)经GABA转氨酶形成Glu;(3)鸟氨酸在鸟氨酸转氨酶的作用下产生谷氨酸半醛,后者进一步生成Glu;(4)谷氨酰胺在谷氨酰胺酶的作用下水解成Glu。
而其中只有第4条途径来源的Glu发挥神经递质的作用。
一.谷氨酸—谷氨酰胺循环神经系统中,神经胶质细胞(主要是星型胶质细胞,AC)与神经元的比例约为10:1。
AC 介于神经元与毛细血管之间,是血脑屏障的重要组成部分。
正常状态下,神经元胞浆的Glu 浓度在10mM/L,AC胞浆的Glu浓度在50至几百μM/L,胞外则为0.6,突触间隙为1μM/L,而突触终端囊泡可达100mM/L,胞内外Glu的浓度相差万倍以上。
突触传递过程中,神经冲动传导至神经突触,神经末梢去极化,突触小泡通过突触囊泡和质膜融合而从神经元释放(即胞吐作用)。
囊泡释放的Glu可使突触间隙的浓度由静息的1μM/L升高到1.1 mM/L,维持在此峰值的时间约为1.2ms。
[2]作用于突触后膜的各型Glu受体,传递神经冲动,发挥生理作用,同时,触发负反馈调节,并由AC膜上的谷氨酸转运体摄取,神经胶质细胞具有很强的Glu摄取能力,并含有谷氨酰胺合成酶,能将Glu转变成谷氨酰胺,再转运至突触前神经末梢胞质中,经谷氨酰胺酶脱氨生成Glu。
同时,一部分经谷氨酸脱羧酶催化生成具有抑制作用的GABA。
接着,Glu通过位于囊泡上的谷氨酸转运体将其转位进入囊泡内腔,并储存于囊泡中。
在静息神经元(resting neuron)中,Glu在神经末梢的突触囊泡内以很小的膜结合细胞器形式储存。
由此形成神经元和胶质细胞之间的“谷氨酸-谷氨酰胺循环”(如图)二.谷氨酸受体GluR分为亲离子型受体和代谢型受体(mGluR)。
耳蜗谷氨酸循环在听力损伤机制中的研究进展
带状 突触呈 阳性 。Z a n a z z i 等 证实 R I B E Y E是 带状 突触 的 主
要成分 , 且R I B E Y E只存在 于带状 突触。至少有 五大家族 的细 胞基质蛋 白在带 状 突触周 围集 聚 , 组 成纤维 网络 , 使 含有 神经 递质 的囊泡聚集在此 区域 , 并且相互 之间紧密联 系 。这些 细胞
C a v 1 . 3将 导致耳聋 , 表现 为对 听觉刺激缺乏反应 以及 听性脑 干 反应 ( a u d i t o r y b r a i n s t e m r e s p o n s e ,A B R) 阈值 升高 … 。几 乎所
5 一 甲基_ 4 一 异恶唑丙酸( A MP A) 受体 区域却更小 。由此导致 了同
冬氨酸转运体能将 突触 间隙过量 的谷 氨酸转运 进入支 持细胞 , 在谷 氨酸合成酶 的作用 下合成谷 氨酰胺 , 维持 突触 间隙 内谷 氨
酸 的平 衡 。这就是 哺乳 动物 耳蜗 内 的谷 氨酸 循环 通 路。若 突
触 间隙谷氨酸积聚 , 将产生兴奋性神经毒性 , 导致听力损伤 。
中国 眼 耳 鼻 喉 科 杂 志 2 0 1 3年 1 1月 第 1 3卷 第 6期
403
・
综
述 ・
耳 蜗 谷 氨 酸循 环 在 听 力损 伤 机 制 中的
研 究进展 △
赖 玉婷 梁琴
【 摘要 】 谷氨酸是人 和哺乳 动物耳 蜗突触的主要神经递 质 。耳蜗 内存在谷 氨酸循环 , 既保证 有足量 的谷
一
内毛细细胞不 同方 位对 应神 经纤维 的敏感 性 和 自发性 放 电 比率的差异 。
了解谷氨酸大脑中的兴奋性神经递质
了解谷氨酸大脑中的兴奋性神经递质谷氨酸,作为一种重要的神经递质,在大脑中扮演着重要的角色。
它是人体神经系统中的一种兴奋性神经递质,能够参与到神经信号传递、学习记忆以及神经发育等多个方面的功能。
本文将通过几个方面来详细介绍了解谷氨酸在大脑中的作用。
一、谷氨酸的概述谷氨酸是一种非常常见的神经递质,在人体中广泛存在。
它由谷氨酸酸脱羧酶催化谷氨酸转变而来,通常以颗粒形式储存在突触前神经元的终站中。
谷氨酸主要通过胺基酸转运体,在细胞外和突触间隙中与谷氨酸受体结合,执行其生理功能。
二、谷氨酸的兴奋性作用谷氨酸是大脑中的一种兴奋性神经递质,主要通过激活NMDA受体来产生兴奋性作用。
当神经元活动增强时,细胞膜上的NMDA受体通道打开,允许钙离子进入神经元,从而增强细胞内信号传递。
这种兴奋性作用可以促进神经元之间的信息传递和处理,参与到记忆形成等认知功能中。
三、谷氨酸在学习和记忆中的作用谷氨酸作为一种兴奋性神经递质,参与到学习和记忆过程中。
在学习中,兴奋性的谷氨酸可以增加神经元之间的连接强度,促进信息的传递和处理。
而在记忆形成过程中,谷氨酸参与到突触可塑性的调节中,增强神经元之间的连接,加强记忆的存储和保持。
四、谷氨酸在神经发育中的作用除了在成人大脑中的功能外,谷氨酸在神经发育中的作用也非常重要。
在早期的神经发育过程中,谷氨酸能够作为一种信号分子,参与到突触形成、神经元迁移和调整等关键过程中。
这些作用有助于大脑神经回路的形成与建立,对于神经系统的正常发育起到重要的调控作用。
五、谷氨酸功能失调与神经系统疾病的关系谷氨酸功能的失调与多种神经系统疾病的发生和发展密切相关。
例如,谷氨酸兴奋性过高或谷氨酸受体功能异常可能导致神经元的超度兴奋,引发癫痫等神经系统疾病。
此外,一些精神疾病如抑郁症、焦虑症等也与谷氨酸功能紊乱有关。
六、谷氨酸的药物应用由于谷氨酸在神经递质中的重要作用,一些与谷氨酸代谢有关的药物亦被广泛应用于临床治疗。
谷氨酸介导中枢系统损伤神经毒性的分子机制概述
体 表达 的结果 。16 9 9年 , 用 “ 奋 毒 A P过 程 中 的 电 子 传 导 破 坏 ,激 活 并 过 高 度 依 赖 于 N 1 4 他 兴 T R — b的 表 达 上 调 ,使 用 性 ” 来 描 述 兴奋 性 氨 基 酸 介 导 的 神 经元 度 活 化 某 些 酶 ,如 钙 蛋 白酶 及 其 他 蛋 白 反 义 寡 核 苷 酸 减 少 N — b的 表 达 水 平 R1 4 变 性 l。 在 9 5 0年 代 初 ,asLpo [ K s、itn 和 酶 、 白 激 酶 、 氧 化 氮 合 酶 ( O ) 核 会 造 成 视 网膜 神 经 节 细 胞 的存 活 率 明显 蛋 一 N S和 R tma t oh n 曾研 究 缺 氧 条 件 下 兴 奋 毒 性 酸 内切 酶 等 。 些 酶 活 性 的 变 化会 导致 : 降 低 。 据 这些 观察 得 出如 下 结论 : 变 这 根 改 的 效果 。他 们 发 现 利 用 镁 离 子 减 弱 突触 ① 增 加 了 有 毒 性 反 应 的 活 性 氧 簇 ( O ) 接 合 体 的 接 合 方 式 会 使 原 有 N A 受 R S MD 传 导 后 可 减 少 神 经 元 在 低 氧 / 氧 情 况 的 产 生 ,如 一 氧 化 氮 ( O) 缺 N 、过 氧 化 物 体 构 成 发 生 改 变 ,并 且 使 谷 氨 酸 活 化 反 下 的死 亡 。 无论 在体 内还 是 体 外 试 验 . 阻 ( 和过 氧 化 氢 ; 细 胞 骨 架 结 构 的变 应 的 应答 发生 变 化 。 O一 ) ②
中枢神经系统兴奋性递质谷氨酸
中枢神经系统兴奋性递质谷氨酸谷氨酸作为一种兴奋性递质,在中枢神经系统中起着至关重要的作用。
它是一种非常特殊的氨基酸,无论在人体还是动物体内都广泛存在。
除了在神经系统中发挥重要作用之外,它还对于肌肉的强度和身体的免疫力有一定的调节作用。
细胞内的谷氨酸和其衍生物谷氨酰胺是中枢神经系统的两种主要成分之一,它们通过神经元之间的突触传递信号,控制着人体的许多生理、心理和认知过程。
谷氨酸在中枢神经系统中充当兴奋性递质的角色,它可以调节人体的神经系统活动,使得人体能够适应外界的环境变化。
除了在神经系统中发挥重要作用之外,谷氨酸还对人体的酸碱平衡有极大的影响。
如果身体内的酸度过高,会导致谷氨酸的浓度达到危险的水平,从而出现各种健康问题。
因此,保持身体的酸碱平衡是保持谷氨酸正常水平的重要工作之一。
谷氨酸对肌肉的强度和身体的免疫力也有一定的调节作用。
身体内存储的谷氨酸和其衍生物谷氨酰胺可以转化为支链氨基酸,而支链氨基酸对肌肉增长和维持身体健康非常重要。
此外,谷氨酸还可以提高身体的免疫力,加速身体对病菌的清除速度。
目前,人们对于谷氨酸在中枢神经系统中的应用非常广泛。
研究表明,增加谷氨酸浓度可以改善认知能力、降低焦虑和抑郁症状以及提高大脑的功能性,尤其在老年人群中表现得更加突出。
而谷氨酸不仅可以供外源性补充,它的前体物质,如天然植物和食品,也可以通过膳食的摄入而提高人体的谷氨酸水平。
然而,值得注意的是,过多的谷氨酸会产生过多的刺激神经元,从而导致神经元死亡和分泌毒素,严重影响身体的健康。
因此,正确的使用谷氨酸以及注意身体的饮食、运动、休息等多方面存在的因素,才能发挥谷氨酸的最佳效果。
综上所述,作为兴奋性递质的谷氨酸对身体的健康起着至关重要的作用。
不仅可以提高人体在中枢神经系统中的认知能力和功能性,而且还有利于肌肉和身体免疫力的改善。
通过饮食、运动和休息等多方面的综合控制,人们可以更好地发挥谷氨酸的作用,使身体保持在一个良好的状态之中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
谷氨酸循环及谷氨酸兴奋性毒性众所周知,谷氨酸是中枢神经系统最重要的兴奋性神经递质。
谷氨酸不能通过血脑屏障。
在脑内合成Glu的途径有4条[1]:(1)α-酮戊二酸接受氨基产生Glu;(2)γ-氨基丁酸(γ-amino-bu-tyric acid,GABA)经GABA转氨酶形成Glu;(3)鸟氨酸在鸟氨酸转氨酶的作用下产生谷氨酸半醛,后者进一步生成Glu;(4)谷氨酰胺在谷氨酰胺酶的作用下水解成Glu。
而其中只有第4条途径来源的Glu发挥神经递质的作用。
一.谷氨酸—谷氨酰胺循环神经系统中,神经胶质细胞(主要是星型胶质细胞,AC)与神经元的比例约为10:1。
AC 介于神经元与毛细血管之间,是血脑屏障的重要组成部分。
正常状态下,神经元胞浆的Glu 浓度在10mM/L,AC胞浆的Glu浓度在50至几百μM/L,胞外则为0.6,突触间隙为1μM/L,而突触终端囊泡可达100mM/L,胞内外Glu的浓度相差万倍以上。
突触传递过程中,神经冲动传导至神经突触,神经末梢去极化,突触小泡通过突触囊泡和质膜融合而从神经元释放(即胞吐作用)。
囊泡释放的Glu可使突触间隙的浓度由静息的1μM/L升高到1.1 mM/L,维持在此峰值的时间约为1.2ms。
[2]作用于突触后膜的各型Glu受体,传递神经冲动,发挥生理作用,同时,触发负反馈调节,并由AC膜上的谷氨酸转运体摄取,神经胶质细胞具有很强的Glu摄取能力,并含有谷氨酰胺合成酶,能将Glu转变成谷氨酰胺,再转运至突触前神经末梢胞质中,经谷氨酰胺酶脱氨生成Glu。
同时,一部分经谷氨酸脱羧酶催化生成具有抑制作用的GABA。
接着,Glu通过位于囊泡上的谷氨酸转运体将其转位进入囊泡内腔,并储存于囊泡中。
在静息神经元(resting neuron)中,Glu在神经末梢的突触囊泡内以很小的膜结合细胞器形式储存。
由此形成神经元和胶质细胞之间的“谷氨酸-谷氨酰胺循环”(如图)二.谷氨酸受体GluR分为亲离子型受体和代谢型受体(mGluR)。
离子型受体包括:使君子酸受体(Quisqatate,QA)、海人藻酸受体(Kainate,KA)和N -甲基-D -天门冬氨酸受体(N -M ethy1-D -A spartate,NMDA)等共有十四种亚基,是与通道相连的受体一通道复合物,介导快速兴奋性突触传递过程,与神经系统发育过程中神经网络的形成、学习和记忆过程中的突触传递、可塑性改变等生理过程有密切关系;同时还介导脑缺血、颅脑损伤、神经变性疾病所致的神经元死亡的神经毒作用。
后来又发现d-氨基-3 -羟基-5-甲基-4异恶唑呤(AMPA)作用于QA受体,较QA受体本身是更有效的激动剂,所以又称QA受体为AMPA受体。
代谢型谷氨酸受体(mGluRs)是一个与G一蛋白偶联的受体家族,通过激活G一蛋白产生第二信使而发挥其生物学效应。
根据mGluRs氨基酸序列的同源性、胞内信号转导机制以及药理学特性,分为三型共计八种亚型 (表1)。
即Ⅰ型:mGluR1,mGluR5。
Ⅱ型:mGluR2,mGluR3。
Ⅲ型:mGluR4,mGluR6,mGluR7,mGluR8。
研究证实,多数mG1uRs位于突触前膜,对谷氨酸(及其它神经递质)的释放发挥负反馈调节,通过突触前机制对谷氨酸的释放产生抑制作用。
而I型mGluRs主要位于突触后〔2〕,被激活后可加强离子型受体的效应。
mGluR1,5激活细胞内磷酸脂酶C,该酶使磷酸肌醇脂分解为磷酸肌醇(IP23)和二脂肪酰甘油脂(DAG),IP23诱导细胞内Ca2+释放;II型mG1uRs位于突触前而不是突触后[3〕。
Shigemot等〔4〕利用免疫组化及电镜技术详尽观察了mG1uRs在海马的分布及突触定位。
结果显示,mGluR2,3位于突触前而不是突触后。
电镜观察证实了mGluR2,3的突触前定位,但同时发现它们并不是位于释放递质的活性区,而是在远离活性区的外突触区。
Yokoi [ 5〕利用mG1uR2基因敲除的小鼠明确显示了该受体在海马的突触前定位。
有报道认为,mG1uR:基因敲除的小鼠并不显示功能异常,这意味着mG1uR2对正常的兴奋性突触传递可能不发挥重要作用[6]。
mGluR4,mGluR6,,mGluR8同样位于外突触区。
, mG1uR4 , mG1uR8对谷氨酸具有很高的亲和力(分别为0. 3一20 , 0. 04一5,3一38,3一11μM/L)[7],这符合它们的突触定位,因为这四种受体均位于远离活性区的外突触区,不大可能获得与活性区相同的谷氨酸浓度,只有亲和力很高才有可能被激活。
与其它mG1uRs相比,mG1uR7在脑内分布最广,且研究最充分,积累资料也最多〔1,4,7,8]。
mG1uR7的突触前定位,恰好位于轴突末梢的活性区,与其他mG1uRs相比,mGluR7与内源性配体谷氨酸的亲和力(EC50 > lmmol/L)远低于任何一种突触前受体。
实验发现,谷氨酸浓度需达到毫摩尔级水平,才能激活mG1uR7,从而观察到该受体激活后产生的对CAMP的抑制〔4)正常突出传递中,突触间隙谷氨酸浓度峰值约为 1.1 mM/L,非常符合位于活性区且作为突触前自身受体的mG1uR:对谷氨酸的亲和力,即它对谷氨酸的亲和力很低,需很高浓度的谷氨酸才能被激活。
有可能被激活。
mG1uR7非常符合突触前自身受体的条件。
因而当递质由囊泡释放至突触间隙,激活突触后受体产生突触后效应时,在一定条件下也使作为突触前自身受体的mGluR7兴奋,发挥对递质释放的负反馈调节,从而使突触间隙的递质浓度维持在生理水平;而其它位于突触前的mG1uRs都是在远离活性区的外突触区,生理条件下突触传递所释放的递质量不可能激活这些受体。
只有在异常情况下,递质过量释放才能使其由活性区溢出(spillover)至外突触区,激活这些受体,抑制递质的再释放。
这样看来,对突触传递过程中递质释放的调控至少存在两种机制,即正常突触传递的情况下,由mG1uR7作为自身受体发挥的负反馈调节;以及在异常情况下,由于递质过量释放激活的mG1uR2 , mGluR3 , mG1uR4 ,mGluR8发挥的对递质释放的负反馈调节。
另外,还存在着突触前mGluRs对其它递质如GABA释放过程的调节机制。
因此,突触前mGluRs,对突触传递过程递质的释放,存在一整套复杂而完善的调控机制。
三.谷氨酸转运体和谷氨酸胱氨酸转运体(一)谷氨酸转运体现在已知的谷氨酸转运体有两种:高亲和力转运体(也称为兴奋性氨基酸转运体,excitatory amino acid transporters,EAATs)和低亲和力转运体(也称为囊泡膜谷氨酸转运体,ve-sicular glutamate transporters,VGLUTs)。
1高亲和力转运体位于细胞膜共有5种,分别为:GLAST(EAAT1)、GLT-1 (EAAT2)[9,10]、EAAC1(EAAT3)、EAAT4[11,12]和EAAT5[13]。
其中GLAST、GLT-1主要在星型胶质细胞表达,在终止谷氨酸能神经传递、维持细胞外液Glu 浓度处于低水平、防止其兴奋性毒性作用以及对过量Glu的转运中发挥着主要作用[14]。
脑内谷氨酸的清除主要由这二者承担,并以GLT-1为主。
高亲和力转运体对Glu的转运功能具有Na+依赖性,胞内外的Na+浓度差为其提供势能[15]。
在正常情况下,胞外Glu与EAAT 结合后,顺着Na+的浓度梯度共同转运至胞内,EAAT每摄取1个Glu-同时摄入2个Na+和1个H+,并排出1个K+和1个OH-(或HCO3-),从而产生内向电流,因此转运是生电过程。
Na+-K+泵来维持细胞内外Na+、K+的正常浓度,因此EAAT转运Glu是一种离子依赖性的耗能过程,整个转运过程是可逆的,当跨膜浓度差逆转时,EAAT可变摄取为释放Glu。
2低亲和力转运体VGLUTs有3种:Ⅰ型囊泡谷氨酸转运体(VGLUT1)、Ⅱ型囊泡谷氨酸转运体(VGLUT2)和Ⅲ型囊泡谷氨酸转运体(VGLUT3)。
VGLUTs分布于囊泡膜上,它能够特异地将突触囊泡外的Glu转运进入突触囊泡内[16,17,18]。
VGLUTs与EAATs生理作用不同,其Glu的摄取由横跨囊泡膜并由空泡型三磷酸腺苷酶(vacuolar-typeATPase)产生的质子依赖的电化学梯度(protondependentelectrochemicalgradient)所驱动,并具有严格的底物特异性(对L-Glu高度特异)和相对低的亲和性(Km=1-3mmol/L),主要依赖于囊泡膜电位梯度的存在,而不是pH梯度。
对于它的最大活性来说,低浓度的氯化物(2-5mmol/L)是必要的[19](二)谷氨酸-胱氨酸转运体谷氨酸-胱氨酸转运体在脑内主要分布于星形细胞与神经元。
生理状态下释放1分子的谷氨酸,摄取1分子胱氨酸入胞,两者藕联转运。
胱氨酸在胞内迅速被还原成半胱氨酸,一部分参与胞内重要自由基清除剂谷胱甘肽的合成,另一部分则出胞氧化成胱氨酸,重新参与谷氨酸-胱氨酸系统循环。
谷氨酸-胱氨酸转运体转运功能依赖于谷氨酸及胱氨酸跨膜浓度差高低,而非Na+依赖性,提高突触间隙谷氨酸浓度可抑制胱氨酸的摄入,提高胞内胱氨酸浓度也可抑制谷氨酸的释放,两者相互抑制[20]。
高浓度谷氨酸情况下,胞内外的谷氨酸浓度倒置将出现反方向转运,胱氨酸摄取被阻滞。
由于Xc-系统的胱氨酸摄取是谷胱甘肽合成的限速步骤[21],因此胱氨酸的摄取阻滞导致胞内谷胱甘肽合成减少,造成氧自由基的堆积,广泛攻击细胞超微结构,尤其是线粒体,介导后续反应,导致细胞损伤乃至死亡。
四谷氨酸的兴奋性毒性当脑出血,脑外伤,或其他理化因素导致脑神经细胞外液Glu剧增时,过度刺激谷氨酸受体会引起引起神经兴奋性毒性。
Glu与突触后非NMDAR(QA/KA受体,现称AM PA、KA受体)结合,Na+通道开放,大量的Na+向细胞内移动,可以在伤后1~2小时内出现急性细胞肿胀,甚至溶解,造成立即性神经元死亡,是第一阶段;另外,大量Glu与NMDAR结合,使Ca2+通道反复开放,且NMDAR结合时间较长,导致大量Ca2+内流、超载,可从伤后24小时延长到5~7天,成为延迟性细胞死亡,是第二阶段。
此两阶段变化因非NMDAR和NMDAR分布重叠,反应交错,加上代谢型GluR激活使细胞内钙池大量释放Ca2+,出现致死性的Ca2+超载,细胞膜的自溶进入独立过程,导致一系列严重后果。
线粒体功能不全是Glu神经毒性的主要步骤,过量Ca2+沉积在线粒体,干扰线粒体呼吸链功能,氧自由基生成增多。
氧自由基攻击膜结构,通透性增加,Ca2+内流加剧,Na+—Ca2+交换加强。
