界面溶质分配系数-资料
分配系数的测定

实验十一分配系数的测定一、实验目的掌握药物在互不相溶的两液相中的分配系数测定方法及应用二、实验原理在恒定温度下,将一种溶质(A)溶在两种不互溶的液体溶剂中;达到平衡时,此溶质在两种溶剂中的分配符合一定的规律性。
该定律(即分配定律)为:若溶质(A)在此两种溶剂中皆无缔合作用,A在1,2两种溶剂中浓度比(严格地说是活度比)将是一个常数,它,不随溶质加入量不同而变化,该常数称为分配系数K。
如下式:K=C1/C211-1式中C1和C2分别为A在溶剂1及2中的浓度。
若使K保持常数,除温度恒定外,尚需较小,可以用浓度代替活度;2.溶质在两种溶满足两个条件:1.溶液的浓度很稀,C1、C2都剂中分子形态相同,即不发生缔合、解离、络合等现象。
如果该溶质在溶液中发生化学变化,如缔合、解离、水解及络合反应等,则同种的分子或离子在两液相之间也仍遵守分配定律,但总平衡浓度比,则不一定是一个常数。
如果溶质在溶剂1和2中的分子形态不同,分配系数的形式也要做相应的改变。
例如溶质A在溶剂1中发生缔合现象,即A n=nA(溶剂1中)(溶剂2中)式中n是缔合度,表明缔合分子是由n个组成的。
则分配系数符合关系式:K=C2n/C1 11-2C1是A n分子在溶剂1中的浓度。
因此,可以计算出溶质在溶剂中的缔合情况。
上述例子也可看成A n分子在溶剂2中解离,故也可用以研究溶质的解离性质。
在许多情况下,特别是无机离子在有机相和水相中分布时,情况较为复杂。
其间不仅有络合效应,而且金属离子和有机溶剂还可能发生络合作用。
此外,溶质在两相中的分配还与有机溶剂的性质、溶质浓度,介质酸度、温度等因素有关。
分配系数是药物制剂中设计处方,开发新药以及临床应用时的重要参数之一。
如配置乳剂确定处方时应知药物、防腐剂等的分配系数才能决定正确用量,配置缓释制剂,软膏剂,栓剂以及贴片等,药物从基质释放到粘膜,皮肤或进入体内后的分配系数与其吸收等均有密切关系,知道有关的分配系数才能更正确地控制剂量。
《分配系数理论》课件

contents
目录
• 分配系数理论概述 • 分配系数计算方法 • 分配系数与物质性质关系 • 分配系数理论在环境科学中的应用 • 分配系数理论的发展趋势与展望
分配系数理论概述
01
定义与概念
分配系数理论
一种研究物质在两种不相混溶的液相之间分配行为的理论。
分配系数
描述物质在两相之间分配平衡的常数,数值上等于物质在某一相 中的浓度与该物质在两相中总浓度的比值。
分配等温线
表示物质在两相之间分配达到平衡时,各相中物质浓度的关系曲 线。
理论发展历程
1 2
起源
20世纪初,科学家开始研究物质在两相之间的分 配行为。
发展
20世纪中叶,分配系数理论逐渐完善,被广泛应 用于环境科学、化学工程和生物工程等领域。
3
最新进展
随着计算机技术的发展,分配系数理论在数值模 拟和计算化学等领域的应用越来越广泛。
分配系数计算方法
02
计算公式与步骤
• 计算公式:分配系数(D)是物 质在固定相和流动相之间的平衡 浓度之比,常用符号“D”表示 。计算公式为:D = (cs)/(cm)。 其中cs是固定相中的浓度,cm是 流动相中的浓度。
计算公式与步骤
01
步骤
02
1. 准备实验样品,确保样品质量可靠;
03
2. 选择合适的色谱柱,确保固定相和流动相的纯度 ;
总结词
溶解度越大,分配系数越大
详细描述
物质的溶解度越大,其在两个相中的分配系数也越大。这是因为溶解度大的物质更容易在两个相之间传递,使得 更多的物质存在于一个相中,从而影响分配系数。
分配系数与吸附性质关系
总结词
何谓结晶过程中的溶质再分配平衡分配系数Ko定义答结晶

1. 何谓结晶过程中的溶质再分配?平衡分配系数Ko 定义?答:结晶过程中的溶质再分配:是指在结晶过程中溶质在液、固两相重新分布的现象。
溶质再分配不仅由平衡分配系数K 0决定 ,还受自身扩散性质的制约,液相中的对流强弱等因素也将影响溶质再分配。
2. A-B 二元合金原始成分为 C O =C B =2.5%,K O =0.2,m L =5,自左向右单向凝固,固相无扩散而液相仅有扩散(D L =3×10−5cm 2⋰s )。
达到稳定态凝固时,求: (1)S-L 界面的C S ∗和C L ∗; (2)S-L 界面保持平整界面的条件。
解:(1)求固-液界面的**L S C C 和 :由于固相中无扩散而液相中仅有限扩散的情况下达到稳定状态时,满足: 00*K C C L = ,C *S = C 0 代入C 0=C B =2.5%,K 0=0.2即可得出: 00*K C C L ==2.0%5.2=12.5% C *S = C 0 = 2.5%(2)固-液界面保持平整界面的条件 :当存在“成分过冷”时,随着的“成分过冷”的增大,固溶体生长方式 将 经历:胞状晶→柱状树枝晶→内部等轴晶(自由树枝晶) 的转变过程,所以只有当不发生成分过冷时,固-液界面才可保持平整界面,即需满足R G L ≥000)1(K K D C m LL − 代入L m =5,C 0=C B =2.5% ,D L =3×10-5cm 2/s , K 0=0.2可得出:RG L ≥1.67×104 ℃/cm 2s 即为所求. 2. 成分过冷与热过冷的涵义以及他们之间的区别和联系。
答:成分过冷的涵义:合金在不平衡凝固时,使液固界面前沿的液相中形成溶质富集层,因富集层中各处的合金成分不同,具有不同的熔点,造成液固前沿的液相处于不同的过冷状态,这种由于液固界面前沿合金成分不同造成的过冷。
热过冷的涵义: 界面液相侧形成的负温度剃度,使得界面前方获得大于k T ∆的过冷度。
溶质再分配与成分过冷
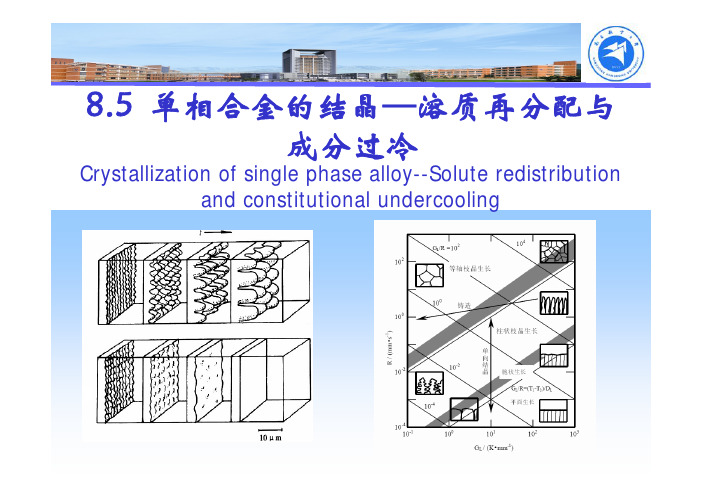
8.5 单相合金的结晶—溶质再分配与成分过冷Crystallization of single phase alloy--Solute redistribution and constitutional undercooling溶质再分配固液两相成分不同除纯金属外,单相合金的结晶是在固液两相区间内完成溶质再分配类似于凝固潜热的释放随着凝固过程的进行,由于固液两相成分差,越来越多的溶质原子被排出,释放到前方液相中与凝固潜热释放不同,液相中溶质扩散不可能很快均匀除间隙固溶体外,溶质原子在固相中扩散系数比液相低4个数量级液相中溶质扩散系数比热扩散系数也要低4个数量级溶质再分配具体分配形式与决定传质过程的动力学因素密切相关,决定着界面处,乃至固液两相内部成分变化溶质再分配影响到宏观及微观成分及偏析现象、晶体的生长形态、组织分布,一定程度上决定了材料各种性能同温度分布一样,溶质再分配也是合金结晶一大特点,二者共同控制晶体生长行为相图基本知识对于单相合金,将液相线和固相线近似看成直线当合金成分为C 0时液相线及液相线斜率m l 固相线及固相线斜率m s00*C m T T l l +=液相线温度00*C m T T s s +=固相线温度当合金成分为T 时()l l m T T C /0−=液相成分()ss m T T C /0−=固相成分平衡溶质分配系数平衡溶质分配系数s l ls m m c c k ==**0液固相直线:k 0为常数固相和液相内部的成分始终相等结晶初期,T = T L 时:C S *=C 0k 0,C L *=C 0结晶末期,T = T S 时:C S *=C 0,C L *=C 0/k 0平衡条件下溶质再分配-杠杆定律合金原始成分为C 0,固液两相在某一瞬间平衡成分为C S *与C l *,相应质量分数为f S *和f l *,则有:****c f c f c l l s s =+平衡结晶中溶质再分配;)1(10*00*k f k c c s s −−=)1(0*00*k f k c c l l−+=平衡条件下溶质再分配-杠杆定律A-B相图一部分液相线温度附近(凝固初期)固相线温度附近(凝固末期)液固相线区间内(中间阶段)近平衡/非平衡条件下溶质再分配一般条件下:溶质原子在液态金属中扩散系数为5×10-9m 2/s数量级溶质原子在固相中的扩散系数为5×10-12m 2/s数量级平衡凝固是指液、固相溶质成分完全达到平衡相图对应的平衡成分,即固、液相中成分均能及时充分扩散均匀平衡结晶极难实现,实际结晶过程都是近/非平衡结晶几种情况下溶质分配系数平衡凝固:平衡分配系数(界面与固液相内部均平衡)近平衡凝固:有效分配系数(仅界面处相平衡)非平衡凝固:非平衡分配系数(均不满足相平衡)近平衡凝固条件下溶质再分配-Scheil 公式凝固时,固相原子来不及扩散,液相中如存在足够对流和搅拌,任一温度下都能保证液相溶质原子的均匀分布,其成分沿着液相线变化除间隙固溶体外,溶质原子在固相中扩散系数比液相低四个数量级近平衡凝固条件下溶质再分配-Scheil 公式以水平圆棒自左向右单向结晶为例。
溶质的平衡分配

实用文档
4
§1.4凝固过程的溶质再分配 ——总结
• 溶质平衡分配系数的概念
– 恒温条件下固相溶质浓度与液相溶质浓度达 到平衡时的比值
k0
CS CL
实用文档
5
§1.4凝固过程的溶质再分配 ——总结
• 溶质平衡分配系数的计算
– 二元合金溶质平衡分配系数的热力学计算公 式
S
L
Cs1
Cs1
Cs2
C0
Cs(eq) C(To) CL(eq)
实用文档
C,%
18
问题2:
• 什么条件下固相成分等于合金的原始成 分?(稳定态凝固)
条件1:固相成分可能范围必须包含C0。如果与成分为 C0的液相共存的固相可能的成分范围包括原始成分C0 , 则固相成分等于合金的原始成分是可能的。如果与成 分为C0的液相共存的固相可能的成分范围不包括原始 成分C0 ,则固相成分不可能等于合金的原始成分。
k0' 1 Vms,Bk 1Vms,Bk
k0 RmT(1xs) RmT
– 压力对对溶质平衡分配系数的影响
k0'' 1 VmBp
k0
RT 实用文档 m
9
§1.4凝固过程的溶质再分配 ——总结
• 压力和界面曲率对液相线斜率的影响
界面曲率的影响
mL'
RTm2(1k0' ) Hm
压力的影响
mL"
RTm2(1k0") Hm
界面成分与界面溶质 分配系数
实用文档
16
问题1:
• 具体凝固条件下固液界面上液相成分和 固相成分究竟是多少?
根据L、S的G-X 曲线利用公切线法可以确定平衡 凝固条件下的液相成分和固相成分。
界面流体力学研究中的溶质输运分析

界面流体力学研究中的溶质输运分析引言界面流体力学是研究流体与固体表面(或两种不同流体之间的界面)相互作用的学科,它在多个领域有着广泛的应用,如材料科学、生物医学、化学工程等。
溶质输运是界面流体力学研究中的重要内容之一,它涉及溶质在流体中的传输、扩散和浓度分布等问题。
本文将从理论和实验两个方面,探讨界面流体力学研究中的溶质输运分析方法和应用。
一、理论分析界面流体力学中的溶质输运分析主要依赖于数学模型和数值方法的建立和求解。
以下介绍几种常用的理论分析方法:1. 对流扩散方程模型对流扩散方程是描述溶质在流体中输运和扩散的一种数学模型。
它结合了对流和扩散两个过程,并考虑了溶质浓度随时间和空间的变化。
对流扩散方程的一般形式如下:$$\\frac{\\partial c}{\\partial t} = D\\frac{\\partial^2 c}{\\partial x^2} +v\\frac{\\partial c}{\\partial x}$$其中,c是溶质的浓度,t是时间,x是空间位置,D是扩散系数,v是流体速度。
通过求解对流扩散方程,可以得到溶质的浓度分布随时间和空间的变化规律,从而分析溶质在流体中的输运行为。
2. 边界元方法边界元方法是一种数值求解偏微分方程的方法,它通过将问题的边界条件表示为问题的解在边界上的积分形式,从而减少了问题的维数。
在界面流体力学中,边界元方法可以用于建立数学模型和求解溶质输运问题。
通过将流体运动方程和扩散方程表示为边界积分形式,可以得到离散化后的方程组,再通过数值求解方法求解得到溶质的浓度分布。
3. 多尺度模拟在界面流体力学研究中,由于界面的特殊性质和微观尺度的存在,常常需要进行多尺度模拟。
多尺度模拟是将系统分为不同的尺度层次,通过在各个尺度上建立数学模型和求解方案,最后通过耦合和协调各个尺度的结果得到系统整体的行为。
在溶质输运分析中,可以利用多尺度模拟方法,从分子尺度到宏观尺度,逐层分析溶质在界面流体中的传输过程。
6.3凝固过程溶质再分配全解
第三节 “成分过冷”对合金单相固溶体
结晶形态的影响
第四节 共晶合金的凝固
1
第一节 单相合金的凝固 ----溶质再分配
教学内容:
平衡凝固时的溶质再分配;近平衡凝固时的溶质再 分配;非平衡凝固时的溶质再分配
教学要求 : 1. 了解平衡凝固时的溶质再分配规律 2. 理解近平衡凝固时的溶质再分配规律
8
• 随着固相分数(fS)增加,凝固界 面上固、液相中的溶质含量均增 加,因此已经凝固固相的平均成 分比平衡的要低。 • 当温度达到平衡的固相线时,势
必仍保留一定的液相(杠杆原
理),甚至达到共晶温度TE时仍有 液相存在。这些保留下来的液相 在共晶温度下将在凝固末端形成 部分共晶组织。
9
三、液相只有有限扩散时的溶质再分配
四、液相中部分混合(有对流作用)
6
一、平衡凝固条件下的溶质再分配
开始( T=T )时: CS = K C = C 0 0 L L 0 0C0 : C 的平衡成分,即固、液相中成分均能及时充分 扩散均匀 。 凝固终了时,固相成分均匀地为 C = C S C S fS C f LC S 1 (1 0 K 0 ) f S C sC0 ( f S f L ) C1 SL L CL
K C
平衡凝固是指液、固相溶质成分完全达到平衡状态图对应温度 凝固过程 固、液相质量分数 ( T = T* )中,固 fs 、fL -与固液相成分匀时的溶质再分配
该情况下溶质在固相中没有扩散,而在液相中充分混合均匀。 起始凝固时与平衡凝固时相同: 接着凝固时由于固相中无扩散,
60% 30% 20%
56%
21
溶质再分配与成分过冷
8.5 单相合金的结晶—溶质再分配与成分过冷Crystallization of single phase alloy--Solute redistribution and constitutional undercooling溶质再分配固液两相成分不同除纯金属外,单相合金的结晶是在固液两相区间内完成溶质再分配类似于凝固潜热的释放随着凝固过程的进行,由于固液两相成分差,越来越多的溶质原子被排出,释放到前方液相中与凝固潜热释放不同,液相中溶质扩散不可能很快均匀除间隙固溶体外,溶质原子在固相中扩散系数比液相低4个数量级液相中溶质扩散系数比热扩散系数也要低4个数量级溶质再分配具体分配形式与决定传质过程的动力学因素密切相关,决定着界面处,乃至固液两相内部成分变化溶质再分配影响到宏观及微观成分及偏析现象、晶体的生长形态、组织分布,一定程度上决定了材料各种性能同温度分布一样,溶质再分配也是合金结晶一大特点,二者共同控制晶体生长行为相图基本知识对于单相合金,将液相线和固相线近似看成直线当合金成分为C 0时液相线及液相线斜率m l 固相线及固相线斜率m s00*C m T T l l +=液相线温度00*C m T T s s +=固相线温度当合金成分为T 时()l l m T T C /0−=液相成分()ss m T T C /0−=固相成分平衡溶质分配系数平衡溶质分配系数s l ls m m c c k ==**0液固相直线:k 0为常数固相和液相内部的成分始终相等结晶初期,T = T L 时:C S *=C 0k 0,C L *=C 0结晶末期,T = T S 时:C S *=C 0,C L *=C 0/k 0平衡条件下溶质再分配-杠杆定律合金原始成分为C 0,固液两相在某一瞬间平衡成分为C S *与C l *,相应质量分数为f S *和f l *,则有:****c f c f c l l s s =+平衡结晶中溶质再分配;)1(10*00*k f k c c s s −−=)1(0*00*k f k c c l l−+=平衡条件下溶质再分配-杠杆定律A-B相图一部分液相线温度附近(凝固初期)固相线温度附近(凝固末期)液固相线区间内(中间阶段)近平衡/非平衡条件下溶质再分配一般条件下:溶质原子在液态金属中扩散系数为5×10-9m 2/s数量级溶质原子在固相中的扩散系数为5×10-12m 2/s数量级平衡凝固是指液、固相溶质成分完全达到平衡相图对应的平衡成分,即固、液相中成分均能及时充分扩散均匀平衡结晶极难实现,实际结晶过程都是近/非平衡结晶几种情况下溶质分配系数平衡凝固:平衡分配系数(界面与固液相内部均平衡)近平衡凝固:有效分配系数(仅界面处相平衡)非平衡凝固:非平衡分配系数(均不满足相平衡)近平衡凝固条件下溶质再分配-Scheil 公式凝固时,固相原子来不及扩散,液相中如存在足够对流和搅拌,任一温度下都能保证液相溶质原子的均匀分布,其成分沿着液相线变化除间隙固溶体外,溶质原子在固相中扩散系数比液相低四个数量级近平衡凝固条件下溶质再分配-Scheil 公式以水平圆棒自左向右单向结晶为例。
界面溶质分配系数
配置不同浓度的溶液
根据实验需求,配置一系列不同浓度的溶质 溶液。
进行实验操作
将配置好的溶液分别加入到两相界面中,记 录溶质在不同浓度下的分配情况。
数据处理与分析
对实验数据进行整理、分析和处理,计算出 溶质的分配系数。
实验结果分析
分析实验数据
对实验结果进行统计分析,评估实验数据的可靠性和 准确性。
结果解释与讨论
数。
模拟计算结果分析
结果准确性评估
比较模拟结果与实验数据的差异,评估模拟方法的准确性。
结果解释
分析模拟结果,解释溶质在界面上的行为和相互作用机制。
结果应用
根据模拟结果,优化溶质分离和提纯过程,提高分离效率 和纯度。
05 界面溶质分配系数研究展 望
深入研究界面溶质分配系数的机理
1
深入研究界面溶质分配系数与物质性质、界面性 质、温度、压力等变量的关系,建立更精确的数 学模型和理论体系。
2
探索界面溶质分配系数与微观分子运动、相互作 用机制的联系,揭示其本质和规律。
3
开展实验研究和模拟计算,对界面溶质分配系数 的机理进行深入探讨,为实际应用提供理论支持。
提高界面溶质分配系数的测量精度
01
优化实验方法和测量技术,提高界面溶质分配系数的测量精 度和可靠性。
02
开展交叉验证和对比实验,确保测量结果的准确性和一致性 。
溶质的分子量、分子结构、极性等性 质对界面溶质分配系数有显著影响。
溶剂性质
溶剂的极性、粘度、表面张力等性质 对界面溶质分配系数有较大影响。
温度与压力
温度和压力的变化会影响溶质和溶剂 的物理化学性质,进而影响界面溶质 分配系数。
界面性质
界面性质如表面张力、界面张力等对 界面溶质分配系数有一定影响。
单相合金凝固过程的溶质分布规律
•单相合金凝固过程的溶质分布规律•1)平衡凝固•把液相线简化为直线→K值为常数。
•设原始成分为C0的二元合金。
•将其熔化浇入长度为l的容器中,并从一端开始进行凝固。
•凝固开始温度为T L,结晶出的固相成分为K0C0。
•此时从固相中排出来的多余溶质通过界面很快地扩散到液相体中去,见图2-17(a)。
•由于K值为常数,随着凝固过程的进行,液相和固相中溶质都在逐渐提高。
图2-17 平衡凝固条件下溶物再分布示意图(a )凝固开始(b )在温度时凝固(c )凝固结束(d )相图•2)非平衡凝固•指固相内溶质无扩散,液相内通过扩散、对流等方式传质的凝固过程。
•(1)固相无扩散、液相内有对流•--液相均匀混合、扩散可不考虑•设合金的原始成分为C0,熔化后将其注入长度为l的容器中,并令其从一端开始凝固。
•当合金温度降到T L时,液相内开始形成少量固体,其成分为K0C0,多余的溶质排入界面前液相内。
•由于液相完全对流,排入的溶质会引起液相内溶质的平均浓度有所提高,使随后结晶的固相溶质浓度高于已凝固固相。
•由于固相中无扩散,随着凝固界面的不断推进,液相平均溶质浓度不断提高,导致固相的溶质浓度也不断提高。
•当温度为时,•界面上会有成分为的固相,•从成分为的液相中凝固出来,如图。
•凝固结束后,晶体内沿长大方向上溶质分布的情况如图2-17(c )所示。
*T *S C *L C界面前液相通过对流溶质完全混合情况下的溶质分布•某时刻,界面上的固、液两相成分各为和•,相应的质量分数为和;•当界面处固相增量为时,•有的溶质排除而使剩余液相的浓度增高,根据溶质质量守衡原则,有:*S C*LC *S f *L f S df S S L df C C )(**−)1(S S df f −−*LdC ***)1()(LS S S S L dC df f df C C −−=−•经过简化积分得:•此式被称之为“非平衡凝固的杠杆定律”,又叫Scheil 方程。
