包装材料表面微生物检验记录
包装材料微生物限度检查检验记录
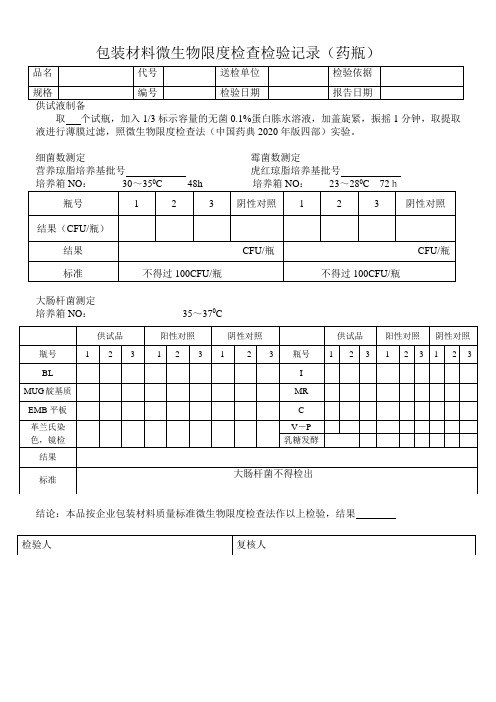
包装材料微生物限度检查检验记录(药瓶)
取个试瓶,加入1/3标示容量的无菌0.1%蛋白胨水溶液,加盖旋紧,振摇1分钟,取提取液进行薄膜过滤,照微生物限度检查法(中国药典2020年版四部)实验。
细菌数测定霉菌数测定
营养琼脂培养基批号虎红琼脂培养基批号
00
大肠杆菌测定
培养箱NO:35~370C
结论:本品按企业包装材料质量标准微生物限度检查法作以上检验,结果
包装材料(复合膜、袋)微生物限度检查检验记录
供试液制备
取试样用开孔面积为20cm2的消毒过的金属模板压在内层面上,将无菌棉签用无菌0.1%蛋白胨水溶液稍沾湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置用2支棉签共擦抹10次。
共擦抹5个位置100cm2。
每支棉签擦抹完后立即剪短,投入盛有30ml无菌0.1%蛋白胨水溶液的锥形瓶中,全部擦抹棉签均投入瓶中后。
迅速摇晃1分钟,即得供试液。
细菌数测定:霉菌数测定:
营养琼脂培养基批号玫瑰红纳琼脂培养基批号
培养箱NO:℃48h 培养箱NO:℃72h
大肠杆菌测定:
胆盐乳糖培养基批号:MUG培养基批号:
培养箱NO:36℃±1℃
结论:本品按国家药品监督管理局,国家药品包装容器(材料)标准(试行),药品包装通则,微生物限度检查法检验,结果规定。
包装材料检验标准

一、目的1.规范进厂所有包装材料的验收,保证进厂的包装材料都是合格的。
2.此标准对于包装内袋(铝箔包装袋)、卷膜、铁盒、纸盒、热收缩膜以及纸箱的质量要求、检验方法以及检验规则作出具体规定。
二、范围本标准适用于进厂的包装内袋、卷膜、铁盒、纸盒、热收缩膜以及纸箱的验收。
三、职责1、采购部负责确定产品材质、规格、版面等技术参数,并根据生产需要下订单。
2、质量部负责产品验收和审核,并作好相关记录以及检验报告的索取。
3、包装材料库负责按订单收货入库,并作好相关记录。
四、引用标准:1.GB2828-2003逐批检查计数抽样程度及抽样表(适用于连续批的检查)2.GB/10004-1998耐蒸煮复合膜、袋3.GB/T 10005-1998 双向拉伸聚丙烯(BOPP )/低密度聚乙烯(LDPE )复合膜、袋4.GB 6543-2008 瓦楞纸箱 5.GB 12904-2003 商品条码 6.GB191-2000包装贮运图示标识 7.GB 9683-88 复合食品包装袋卫生标准 8.YS/T 435-2000易拉罐罐体用铝合金带材附件1 包装材料验收标准文件编号:XYLT/ZLB/0179.GB7718-200410.GB/T21302-200711.GB/T11680-198912.GB/T13024-2003五、检验程序1.运输要求:预包装食品标签通则包装用复合膜、袋通则食品包装用原纸卫生标准箱纸板运输车辆符合卫生要求,干净无污染,有必备的防雨、防尘措施2.内包装材料:铝箔包装袋和卷膜2.1标样的确定:由采购部与供应商共同协商确定,定版后将标样以及相关技术参数交予质量部,质量部按标样进行验收。
如果标样有所改动,请及时通知质量部。
2.2抽样方案:采用正常检查一次抽样方案,具体如下表:表1表2.3样本采集:确定样本量后,采样要全面。
箱(袋)的上中下三个方位都要采集到。
2.4技术要求及检测方法:2.4.1材质:按GB/T10005—1998要求。
2015版ISO9001年度HACCP体系验证记录及报告

HACCP 体系验证记录及报告 ———————————————
依据 GB/T27341-2009 标准
《危害分析与关键控制点(HACCP)体系食品生产企业通用要求》编制
编 审 版 受 发 控 状
制: 批: 本: 态: 号: A/0 受 控
发布日期:201X.9.12
实施日期:201X.9.12
现场观察、人流、物流、水流、气流按控制措施要求执行,清洁、消毒措施得到有效实施,设备、工器具、车间、 现场观察、查验记 地面、空间等保持洁净,卫生设施符合要求且运行良好,交叉污染得到有效控制 录、微生物检验 现场观察洗手消毒设施符合要求,全部为非手动,洗手液、消毒液的配制符合要求,并由标识,员工按要求洗手 消毒,查验相关记录与实际相符可靠 包装材料的存放、使用前处理符合要求,包装材料进出车间符合要求,包装间清洁、消毒、卫生控制符合要求, 人员、设备、工器具、空间、地面、相关设施符合要求,检验记录微生物指标合格 有专用储藏柜、专人管理,建立购买、领用、配制登记,有毒有害化学物容器有效处理 原料收购进行了索证、验证管理,符合安全产品所需,生产用水进行净化处理、管路材料符合要求、日常监控按 要求执行,检验结果符合要求。 现场观察、查记录、 微生物检验 现场观察、查验记 录、微生物检验 现场观察、查记录 现场观察、查记录、 水质检验
生产设施及维护管理
空气
空间进行紫外线杀菌,通风设计符合生产要求,门窗采用密闭较好,通风口设有滤网防虫、防鼠、 现场观察、询问、查 防尘,由清洁区流向非清洁区。 验记录 城市自来水,水质经过净化处理,每年送权威部门进行检验,厂内定期进行检测、监控,并进行 现场观察、询问、查 适当杀菌消毒,供排水管路无交叉,生产用水符合生活饮用水卫生标准要求。供水设施定期清洁、 验记录 消毒。 电力供应充足;照明设施、采光充足,生产线及产品裸露的场所照明装置具有防护罩,配备移动 紫外线杀菌灯。 消防设施充足,配有消防栓、灭火器,确保消防安全,厂区对地面进行绿化、硬化,与公路距离 较远,生产、生活区有效隔离,厂区内远离车间处设置水冲式厕所,并专人负责、保持清洁、卫 生,厂区内设置淋浴室,保持个人卫生 废水直接排入厂区外排水沟排走,不沉积、发酵,废弃物有专用存放场所,并及时清理、采取灭 蝇、灭虫措施,保持整洁,远离车间、设在本地区主风向的下风向——厂区东南角。 根据产品特点、生产车间布局、危害分析、生产所需制定了适宜的卫生控制措施,并在加工过程 中认真实施,保留相关记录 现场观察、询问、查 验记录 现场观察、询问、查 验记录 现场观察、询问、查 验记录 现场观察、询问、查 验记录
食品包装材料的质量标准和检验方法

食品包装材料的质量标准和检验方法食品包装材料的质量标准和检验方法食品包装材料是保护食品免受污染、延长食品保质期、提升食品观赏性的重要组成部分。
为了保证食品包装材料的质量和安全性,制定了一系列的质量标准和检验方法。
本文将介绍食品包装材料的质量标准以及常用的检验方法。
一、食品包装材料的质量标准食品包装材料的质量标准主要包括物理性能指标、化学性能指标、微生物指标等。
1. 物理性能指标物理性能指标是评估食品包装材料物理性能的关键指标,主要包括拉伸强度、撕破强度、热封强度、渗透性等。
拉伸强度和撕破强度可以反映材料的抗拉、抗撕裂能力,热封强度可以评估材料的密封性能,而渗透性则是检验材料是否阻隔气体和湿气的重要指标。
2. 化学性能指标化学性能指标是评估食品包装材料在食品接触过程中是否会产生有害物质的重要指标。
常用的化学性能指标包括迁移限量、溶出物限量、可溶性重金属含量等。
迁移限量反映食品包装材料中可迁移的物质对人体健康的潜在危害,溶出物限量则是评估材料是否会释放有害物质到食品中,可溶性重金属含量则是评估材料对有害重金属的释放情况。
3. 微生物指标微生物指标是评估食品包装材料是否卫生安全的重要指标。
微生物污染可能导致食品变质、霉变甚至传染疾病。
常用的微生物指标包括总大肠菌群、霉菌和酵母菌等。
这些指标可以反映材料是否存在微生物污染和是否符合微生物卫生标准。
二、食品包装材料的检验方法为了保证食品包装材料的质量和安全性,需要进行相应的检验。
常用的检验方法主要有以下几种:1. 物理性能的检验方法拉伸强度和撕破强度可以使用拉伸试验机进行测试,热封强度可以使用热封强度仪进行测试,渗透性可以使用透湿仪进行测试。
2. 化学性能的检验方法迁移限量可以使用萃取法或模拟食品浸提法进行测试,溶出物限量可以使用提取浸泡法进行测试,可溶性重金属含量可以使用原子吸收光谱仪进行测试。
3. 微生物指标的检验方法总大肠菌群可以使用总大肠菌计数法进行测试,霉菌和酵母菌可以使用菌落计数法进行测试。
原辅料、包装材料、半成品、成品取样方法和操作规程

水、沉降菌、浮游菌、悬浮粒子检测法规、指南取样指令:1、当原辅料或包装材料到货时,评价室应收到发自物料部的一份化验申请单、一份厂商的化验证书。
成品生产实现后,评价室应收到生产部的化验申请单.评价人员检查过这些资料后根据化验申请单在批化验记录相应地位上填写代号、批号、名称,并将化验申请单和批化验记录发至取样员。
对于增补取样,由评价室填写化验申请单,在备注栏内注明“增补取样"。
2、取样员根据化验申请单所记载的来料包装数目预备留检标签、留样标签和清洁干燥的取样容器(对无菌罐装产品用原辅料,取样器具灭菌后应保留在密闭的无菌容器内,超过两周应从新灭菌)。
粘好留检标签后,即可着手取样。
取样方法:1、对原辅料、半成品(中间产品)、成品、副产品及包装材料、工艺用水都应分辨制定取样办法.2、对取样环境的洁净要求、取样人员、取样容器、取样部位温柔序、取样方法、取样量、样品混合方法、取样容器的清洗、保存、必要的留样时间以及对无菌及麻毒、精力药品在取样时的特别要求等应又明白的规定。
3、原辅料、内包装材料,可在仓储区原辅料取样间或支架式层流罩内取样.4、取样环境的空气洁净度级别应与生产要求一致。
5、中间品、成品取样可以在生产结束时进行,也能够在生产过程的前、中、后期取样.(1)原则:根据取样规划单进行取样,取样时,应留神样品的代表性.如非均一的物料(如悬浮物)在取样前应使其均一;如不可能这样做或不懂得物料是否均一,则应注意从物料不同部位取样;如取样不能达到物料的所有部位时,应随机地在可到达的部位取样;物料表面和物料主题可能会存在差别,抽样时,不应只从表面抽取样品.对于混合样品,如某批号有2个混合样品,则每一个留样样品应由等量的混合样品混合组成。
(2)取样个别由专职取样员进行。
也可由车间工人或者中控人员根据相应的BPR或SOP取样,然后由取样员进行收集,但抽样人员必需经由恰当的培训和考察,以避免差错,保障抽样的代表性.(3)一定要做到某一个时间只取一个样品,样品容器在取样前即应帖上事先准备好的取样标签,免得产生差错.混合样品及分样,应在吻合洁净度要求的取样间进行。
包装材料微生物检验标准方法

1.0目的:确保包装材料的微生物质量,规范包材之微生物检验方法。
2.0适用范围:喷头、软管、乳液瓶、铝皿、内座、磨指器、内塞、眼毛修饰器、粉扑、假睫毛、眼影棒、睫毛刷、剃须刀。
3.0参考资料3.1、《化妆品微生物检验标准方法总则》(SOP-HYS-002)。
3.2《细菌总数检验标准方法》(SOP-HYS-003)。
3.3《霉菌、酵母菌总数检验标准方法》(SOP-HYS-004)。
3.4《金黄色葡萄球菌检验标准方法》(SOP-HYS-005)。
3.5《绿脓杆菌检验标准方法》(SOP-HYS-006)。
3.6《粪大肠菌群检验标准方法》(SOP-HYS-007。
4.0定义:略5.0所需设备:略6.0安全需求:略7.0程序:7.1检验前先核对化验申请单之样品编号与实际样品上的编号是否相符。
检查样品包装之完好性,包装完好之样品方可进行检验,包装不完整或疑有取样污染之样品退回IQC重新取样送检。
7.2样品稀释7.2.1磨指器、内塞、眼毛修饰器、粉扑、假睫毛、眼影棒、睫毛刷、剃须刀等体积较小的包装材料稀释:取10ml消毒过的生理盐水顷注于100ml 烧杯内,将内塞、眼毛修饰器、粉扑、假睫毛、剃须刀、眼影棒海棉端、睫毛刷毛端放于烧杯内与生理盐水混匀备用。
7.2.2铝皿、内座的稀释:取10ml消毒过的生理盐水顷注于100ml烧杯内,用消毒过的酒精棉球蘸取烧杯内的生理盐水擦拭铝皿、内座内表面3遍,将此酒精棉放于盛有生理水折烧杯中摇匀备用。
同时计算铝皿、内座内表面的表面积。
7.2.3喷头的稀释:取消毒过的生理盐水10ml顷注于100ml烧杯内,用喷头将此生理盐水吸于喷头内后喷出,如此 5遍,摇匀此生理盐水备用。
7.2.4软管、乳液瓶的稀释:取10ml消毒过的生理盐水倒入待测定的软管、乳液瓶内,并上下左右摇晃至少5次,使生理盐水与软管、服液瓶内壁完全接触清洗,倒出生理盐水于100ml烧杯内备用,同时计算出待测定之软管、乳液瓶内表面的总表面积。
微生物检验作业作业指导书.

1 目的通过对微生物检测流程的规范确保检验工作有序进行.2 范围适用于微生物检测的全过程。
3 职责3.1 检验人员严格按检测流程做好各项工作。
3.2 检测主管做好监督检查工作.4 内容4.1 准备工作4。
1.1 卫生清洁整理普通检验室内的各类检验物品,检查工作台面和地面卫生。
4.1.2样品收集登记4。
1.2。
1与收样员沟通,确定检样品种、数量(如仓库到货的茶原料、内包膜,车间生产的半成品、成品,研发样品,采购样品,稳定性试验的样品、定期跟踪检测的样品)。
4.1.2。
2与质保员沟通,确定检样品种、数量(如自来水、纯水、一楼生产过程跟踪的各阶段液体)。
4.1。
2。
3 按检测计划自行确定的检样品种、数量(如工作间空气、设备内表面、员工手部)。
4.1。
2.4各项确定后,收集并登记样品。
4。
1.3检测方法的确定4.1.3。
1样品收集后进行分类,确定样品的检测方法,若无方法的要尽快上报或查找相关方法。
4.1。
3.2微生物各项目所采用的检测方法(见附表1)4.2 试剂配制、物品包扎4。
2。
1玻璃容器的包扎:灭菌前器皿应包扎紧密完整后才进行灭菌,以防止灭菌后器皿受到污染。
4。
2。
2平皿、吸管按量分成若干单元用牛皮纸、报纸包扎;4.2.3试管及三角瓶应塞硅胶塞,在瓶口再用报纸包扎;4.2.4其它玻璃或金属取样工具也要用报纸包扎;4。
2。
5生理盐水按氯化钠加水比例0.84%配制;平板计数琼脂(PCA)、孟加拉红、月桂基硫酸盐胰蛋白胨肉汤(LST)、煌绿乳糖胆盐肉汤(BGLB)则以标签上规定的比例进行配制。
按需要量分装成于不同规格的容器中。
4。
3 高压灭菌4。
3。
1培养基及器皿的灭菌:4.3.1.1高压蒸汽灭菌:金属器具、玻璃器皿、基础培养基及其它耐热物品均放入锅内灭菌。
4。
3。
1.2灭菌参数:121℃(0。
1034MPa),15~20min;4.3.2染菌培养物:121℃(0.1034MPa),30min;4.3.3含糖类不耐热培养基(按试剂要求):115℃(0。
包装封口验证

包装封口验证编制:日期:审核:日期:批准:日期:目录一、总则1. 1验证目的1. 2 验证依据1. 3 验证范围1. 4 工艺概述1. 5验证用监视和测量设备1. 6 验证小组及职责二、IQ 验证开展三、OQ验证开展3. 1 工艺参数设置3. 2 试样准备3. 2. 1 试验对象3. 2. 2质量要求四、PQ验证开展4. 1工艺参数设置4. 1. 1 运行试验4. 2 性能确认4. 2. 1 包装材料密封过程的适应性4. 2. 2 包装材料的微生物屏障特性4. 2. 3 包装材料与贮存、运输过程的适合性五、验证结果及分析5. 1 验证结果5. 2 验证结论六、再验证6. 1 影响过程参数的原材料改变6. 2 设备相关改动,与吸塑、热封部位的维护、改动6. 3 设备地点的变迁6. 4产品上市后每年的重新确认6. 5有严重产品相关质量事故发生一、总则1. 1 验证目的对单包装封口过程有效性进行验证,确认产品的封口参致是否完持续充分、适宜,有效,以确保本公司单包装封口过程能满足产品加工要求。
1. 2 验证依据1)《医疗器械生产质量管理规范附录无菌医疗器械》;2)《医疗器械生产质量管理规范无菌医疗器械现场检查指导原则》;3) 各设备操作规程以及使用说明书;4)GB/T19633 《最终灭菌医疗器械包装》,YY/T0698.5-2009《最终灭菌医疗器械包装材料第5部分》1. 3 验证范围适用于本公司生产的医用一次性防护服,初包装采用塑料复合膜袋。
涉及该过程的设备如下:表1:封口机技术参数表1. 4工艺概述a、接通电源,调节加热时间,温度速度,待温度稳定后方可使用。
b、将产品放入包装袋,将袋内空气排出。
c、双手持袋沿封口机输送带相同转动方向放入产品(从右往左)。
封好后整齐摆放在工位器具内。
d、包装袋封口处应对齐放平,将袋口抹平(进料口)送入,当封口处被封口带咬合使包装袋自动向前行进,此时不要任意推动或阻挡,否则会造成封口皱叠或故障。
