北京大学普通化学b第四章中
北京大学分析化学课件

[M]+[MOH]+M(OH)2 ]+ ⋅⋅⋅ + [M] +[MA]+[MA2 ] + ⋅⋅⋅ - [M]
= α M(OH) + α M(A) - 1
若有n个副反应:
α M = α M(A1)+ α M(A2) + … +α M(An)- (n-1)
29
例4.2 用EDTA滴定Zn2+至化学计量点附近, pH = 11.00,[NH3]= 0.10mol·L-1, 计算 lgαZn 解:
18 16 14 12 10 8 6 4 2 0 0 2
lg αM(OH)~pH
Al Fe3+ Zn Cd Cu Bi Pb Fe2+
lg α M(OH)
4
6 pH
8
10
12
14
28
两个副反应同时存在时:
αM =
=
[M]+[MOH]+ M(OH)2 ]+ ⋅⋅⋅ + [MA]+[MA2 ] + ⋅⋅⋅ [M]
n
β n = K1 K 2 ⋅ ⋅ ⋅ K n =
[MLn ]= β n [M] [L]n
15
酸的分布系数的计算
Ka Ka [A2- ] 1 2 x0 = = +2 c(H2A) [H ] + K [H+ ]+ K K a a a
1 1
2
=
1 [H ] [H ] + +1 Ka Ka Ka
1 2 2
= [M] [M](1 + [L]β1 + [L]2 β 2 + ⋅ ⋅ ⋅ + [L]n β n )
2024版年度《北京大学有机化学》ppt课件

2024/2/2
31
THANKS
感谢观看
2024/2/2
32
14
酚
酚的分类与命名
根据羟基所连苯环的不同,酚可 分为一元酚和多元酚等。
2024/2/2
酚的物理性质
多数酚为无色或淡黄色晶体,具有 特殊气味,微溶于水,易溶于有机 溶剂。
酚的化学性质
酚分子中的羟基和苯环相互影响, 使得酚具有一些特殊的化学性质, 如酸性、氧化反应等。
15
醚
醚的分类与命名
根据醚键两端所连基团的不同,醚可分为单醚、混醚等。
实例与应用
乙炔是常见的炔烃之一,广泛应用于 焊接、切割、照明等领域。
10
芳香烃
定义与通式
结构特点
芳香烃是由苯环或稠环结构组成的烃类化合 物。
芳香烃分子中含有苯环或稠环结构,具有特 殊的稳定性和芳香性。
性质与反应
实例与应用
芳香烃的化学性质较为特殊,可以发生取代、 加成、氧化等多种反应,但反应条件较为苛 刻。
机溶剂。
卤代烃的化学性质
03
卤代烃中的卤素原子较为活泼,可发生取代反应、消除反应等。
13
醇
醇的分类与命名
根据羟基所连碳原子的不 同,醇可分为伯醇、仲醇、 叔醇等。
2024/2/2
醇的物理性质
多数醇为无色液体,具有 特殊气味,可溶于水,也 可溶于有机溶剂。
醇的化学性质
醇分子中的羟基具有亲核 性,可发生氧化反应、酯 化反应等。
遵守实验室规章制度,尊重实验数据,不抄袭、不造假,保持诚信 和实事求是的科学精神。
29
实验操作规范与安全注意事项
1
实验前准备
熟悉实验步骤和操作规程,检查实验仪器和试剂 是否齐全、完好,做好个人防护措施。
北京大学普化B实验四问题3讨论报告

关于本次试验系统测量精确度的讨论完成日期:2013.10.21 作者:马千程、黄慧、袁之航、王瑶、贾盼盼所在学院:药学院指导教师:高昂一、摘要:在实验四中我们利用电解法测定阿伏伽德罗常数及气体常数,并将实验值与文献值作了比较,发现存在一定的误差。
那么,本实验中各个环节都有哪些误差?又是哪个环节的系统误差决定了本实验的系统测量精确度?本实验方法的系统测量精度还可能提高吗?又该如何改进?本次我们小组成员在查找文献和小组讨论之后对问题进行了解答和说明,并完成本报告。
二、前言而气体常数的误差可以通过多次实验取平均值的办法消除。
三、内容(一)误差分析我们将实验大体分为三部分:电解前、电解过程中和电解后。
1、电解前(1)实验仪器的清洗当酸式滴定管和移液管并未清洗干净,管壁上挂水时,会使结果有误差。
此外,在实验过程中,我们发现部分实验组都出现了滴定管清洗不干净的情况,可能原因:如果酸式滴定管活塞上用于密封的凡士林涂抹不均匀,就会使凡士林进入酸式滴定管内壁,而当铬酸洗液清洗过凡士林后,铬酸洗液没有足够的时间将凡士林全部氧化,就会使下一名清洗的同学的滴定管内壁沾有凡士林,因此就发生了部分滴定管清洗不干净的情况。
(2) 滴定管下端无刻度部分的体积的测量在测量滴定管下端无刻度部分的体积时,可能会产生一定的误差,但大多数同学得出的数据误差较小,对实验影响并不大。
(3)电解装置的调试在调试电解装置的过程中,铂丝上可能附有气泡,如果未将气泡除干净,在电解时也会产生误差。
(4)铜片的称量铜片如果没有打磨干净,或用千分之一称称量时读数不准,均会产生误差。
(5)温度和气压的测定2、电解过程中(1)电解过程中的主要误差来自于电流的不稳定。
电阻:在刚进行电解时,电流并不能很快的稳定下来,这一部分误差影响较大;在电解过程中,电流出现微小变化时,实验者往往不能及时调节电阻箱阻值使电流恢复;同时,由于铜片上不断有铜生成,铜片的电阻会有一定的改变,影响电流大小;在实验过程中,两电极间间距的改变,也会对电路电阻产生影响,进而影响电流的稳定性;铂丝上附着的气泡对电阻同样有影响。
分析化学课后习题答案 北大版(第4章+思考题)

4.1 已知铜氨络合物各级不稳定常数为 K 不稳1=7.8×10-3 K 不稳2=1.4×10-3 K 不稳3=3.3×10-4 K 不稳4=7.4×10-5(1)计算各级稳定常数K 1~K 4和各级累积常数β1~β4;(2)若铜氨络合物水溶液中Cu(NH 3)2+4的浓度为Cu(NH 3)2+3的10倍,问溶液中[NH 3]是多少?(3)若铜氨络合物溶液中c (NH 3)=1.0×10-2mol 〃L -1,c (Cu 2+)=1.0×10-4 mol 〃L -1(忽略Cu 2+,NH 3的副反应),计算Cu 2+与各级铜氨络合物的浓度。
此时溶液中Cu(Ⅱ)的主要存在型体是什么? 答案: (1)K 不1 K 不2 K 不3 K 不47.8×10-3 1.4×10-3 3.3×10-3 7.4×10-5141K K =不 231K K =不 321K K =不 411K K =不 1.4×1043.0×1037.1×1021.3×10211K β= 212K K β=3213K K K β=43214K K K K β=1.4×1044.2×1073.0×10103.9×1012(2)()[]()[][]10NH NH Cu NH Cu 34233243==++K []1243L mol 107.710NH --⋅⨯==K(3)()()14123L mol 100.1Cu L mol 100.1NH ----⋅⨯=⋅⨯=c c()()[]4433332231302][NH ]NH [NH ]NH [1Cu Cu ]Cu [βββ βc x c ++++=⋅=+12810674424109.3100.1100.3100.1102.4100.1104.1100.11100.1⨯⨯⨯+⨯⨯⨯+⨯⨯⨯+⨯⨯⨯+⨯=-----1944L mol 104.1103.7100.1---⋅⨯=⨯⨯= ()[]()[]174413123L mol 109.1100.1103.7 NHCu NH Cu ---+⋅⨯=⨯⨯⨯=⋅=βx c()[]()[]16442232223L mol 108.5100.1103.7NH Cu NH Cu ---+⋅⨯=⨯⨯⨯=⋅=βxc()[]()[]15443333233L mol 101.4100.1103.7NH Cu NH Cu ---+⋅⨯=⨯⨯⨯=⋅=βxc()[]()[]15444434243L mol 103.5100.1103.7NH Cu NH Cu ---+⋅⨯=⨯⨯⨯=⋅=βxc溶液中以Cu(NH 3)+24,Cu(NH 3)+23为主4.2 乙酰丙酮(L )与Fe 3+络合物的lg β1~lg β3分别为11.4,22.1,26.7。
《普通化学B》课程教学大纲

普通化学B课程教学大纲(General Chemistry B)学时数:32其中:实验学时:0课外学时:0学分数:2适用专业:兽医、饲料与动物营养一、课程的性质、目的和任务普通化学课程是高等学校,特别是农林院校各专业学生的一门必修的重要公共基础课,它是为培养我国社会主义现代化建设所需要的高素质建设人才服务的。
通过本课程的学习,要使学生获得以下知识:1.分散系2.化学热力学基础3.化学平衡原理4.化学反应速率5.酸碱反应6.沉淀-溶解反应7.氧化还原反应8.配位化合物本课程的教学目的是使学生能较全面地掌握物质化学变化的各种规律、物质的重要性质及其相互关系。
为此结合化学变化的能量关系、化学动力学和化学平衡的基本知识,来加深对物质变化规律、各类平衡和元素及其化合物性质的认识,为有关后继课程和专业培养目标打好必要的化学基础。
在内容的安排上是基本化学原理为主。
先从能量变化角度来介绍化学热力学知识,继而从一般的化学动力学知识和平衡原理开始,讲授反应速率和化学平衡的基本理论,然后将这些原理、规律和基础知识应用于各类平衡之中加以深化。
注重培养学生分析和解决在农业生产上遇到的化学问题的能力,进而提高学生的综合素质。
二、课程教学的基本要求(一)分散系1、了解液体的蒸发过程、理解蒸气压的产生及影响因素2、掌握溶液中物质的组成量度3、掌握非电解质稀溶液的依数性(二)化学热力学基础1、了解内能、焓等状态函数的概念2、了解状态函数的变化只决定于体系的始态和终态与变化的途径无关3、了解热力学第一定律和盖斯定律的基本内容及其在热化学中的应用4、理解从物质的运动观点来了解熵函数的物理意义5、掌握利用自由能状态函数来研究化学反应的自发性(三)化学平衡原理1、掌握自由能和化学平衡的关系,应用标准自由能变计算化学反应的平衡常数。
2、利用自由能函数来加深对化学平衡移动规律的理解(四)化学反应速率1、了解化学反应速度、基元反应、反应级数等概念。
药物化学北大04精品PPT课件
乙酰胆碱受体的分类
HO
H3C
O
N+(CH3)3
Muscarine
N CH3 N
Nicotine
M受体:M1,M2,M3,M4,M5 N受体:N1,N2
M受体的结构- G蛋白偶联受体
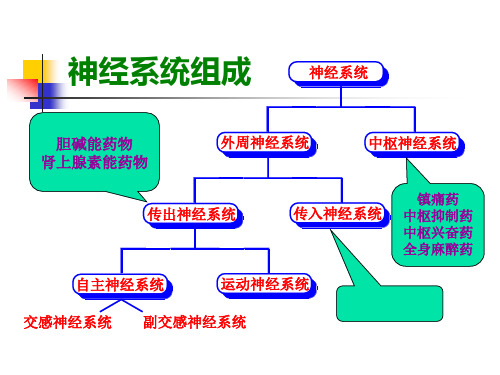
神经系统组成
神经系统
胆碱能药物 肾上腺素能药物
外周神经系统
中枢神经系统
传出神经系统
传入神经系统
镇痛药 中枢抑制药 中枢兴奋药 全身麻醉药
自主神经系统
运动神经系统
交感神经系统 副交感神经系统
传出神经系统
CNS
自主神经
神经节
乙酰胆碱 N胆碱受体
传出神经系统药 物的作用环节
乙酰胆碱 神经节
N胆碱受体
去甲肾上腺素 肾上腺素能受体
O
N+(CH3)3
—
O
CH3
口腔粘膜干燥症;
H3C
O
N+(CH3)3 Cl- 支气管哮喘诊断剂
O
H2N
O
O
CH3
H2N
O
N+(CH3)3 ClN+(CH3)3 Cl-
青光眼;缩瞳 腹气胀;尿潴留
Bethanechol的手性
CH3
H O
CH2N+(CH3)3
H
H3C O
CH2N+(CH3)3
O
NH2
ACh的生物合成、贮存、释放和摄取
Choline
LA 6
synaptic cleft
Choline
普通化学课件 北大 卞江教授 第四章

北京大学化学与分子工程学院普通化学/ 第三章(2006)北京大学化学与分子工程学院普通化学/ 第三章(2006)化学动力学的三位先驱阿伦尼乌斯Svante August 范特霍夫Jacobus Henricus 奥斯特瓦尔德Wilhelm Ostwald 1853-1932普通化学/ 第三章(2006)Jiang Bian李远哲(1936-华裔美国化学家交叉分子束实验装置普通化学/ 第三章(2006)Jiang Ahmed H. Zewail 埃及裔美国化学家Caltech, USA 北京大学化学与分子工程学院普通化学/ 第三章(2006)Jiang 普通化学/ 第三章(2006)瞬时速率定义为平均速率的极值:若推广至一般情况:aA + bB →cC反应速率的定义:若反应分子一步(碰撞)直接转化为产物,则此方程即为质量作用定律。
上式中,a 为A 的反应级数,b 为B 的反应级数,为反应的总级数,k 为速率常数。
可以从基元反应出发写出反应速率的表达式。
、n要通过实验测定。
m、n分别为反应级数。
,n ≠b,则该反应必为非基元反应。
根据反应速率的定义:分别把上述实验结果代入进去,得到:n = 2普通化学/ 第三章(2006)一级反应的半衰期。
的定义:反应物减少一半所需的时间,符号作图,得一直线,其中直线的斜率为:普通化学/ 第三章(2006)北京大学化学与分子工程学院普通化学/ 第三章(2006)写出积分反应速率方程:) = 0.480 mg/100 cm 3和(A) = 0.222 mg/100 应当在下午2点42分之前注射第二针。
高能宇宙射线在大气层中产生中子,中子与反应生成。
t 1/2= 5730 a -14断代法:北京大学化学与分子工程学院指前因子(基元反应的活化能)普通化学/ 第三章(2006)为单位体积内分子的个数,即浓度。
为分子半径。
2A →B ,若假设两个反应分子碰撞是一个基元反应,即:所以化学反应速率为:同时,因为:把它带入上式,得到:24A RT d N M π=我们立刻发现它们是相似的,其中指前系数要。
北京大学有机化学课件(2024)

六元杂环化合物
吡啶和嘧啶
含有氮的六元杂环化合物,具有芳香性和弱碱性,是许多药物和生 物活性分子的核心结构。
哒嗪和嘌呤
含有两个氮原子的六元杂环化合物,具有重要的生物功能,如DNA 和RNA的组成成分。
氧杂蒽类化合物
如喹啉、异喹啉等,具有多种生物活性,如抗菌、抗炎等。
2024/1/29
25
生物碱简介
醇、酚、醚具有亲核取代 反应、氧化反应和还原反 应等化学性质。其中,亲 核取代反应是它们最重要 的反应之一,可以生成酯 、卤代烃等化合物。
2024/1/29
14
醛、酮、醌
01
02
03
04
05
醛的分类和命名
酮的分类和命名
醌的分类和命名
醛、酮、醌的物 理性质
醛、酮、醌的化 学性质
醛是羰基与一个烃基和一 个氢原子相连的化合物。 根据羰基所连碳原子的类 型,醛可分为甲醛、伯醛 和仲醛。醛的命名以羰基 为定位基,遵循系统命名 法。
33
分类
按碳骨架分类为开链化合物、碳环化合物和杂环化合物;按 官能团分类为烃类、醇类、酚类、醚类、醛类、酮类、羧酸 类、酯类等。
5
有机化学研究意义
揭示生命现象本质
推动材料科学发展
有机化合物是生命体的基础物质,研究有 机化学有助于揭示生命现象的本质。
有机高分子材料在现代社会中应用广泛, 研究有机化学可以为材料科学的发展提供 理论支持。
促进医药事业发展
探索新能源和环保技术
许多药物都是有机化合物或其衍生物,研 究有机化学可以为药物设计和合成提供思 路和方法。
有机化合物在新能源和环保技术中具有潜在 应用价值,研究有机化学可以为相关领域的 发展提供技术支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基元反应的特点
(1) 若正向反应是基元反应,其逆向反应也是基元 反应,并且中间活化体也是相同的,该反应 的H = Ea – Ea’。
(2) 基元反应的速率服从质量作用定律。 (3) 基元反应的平衡常数K = k正/k逆
CO + NO2
NO + CO2 = k正 (CO)(NO2) = k逆 (NO)(CO2)
(1) Cl2 (2) Cl + H2 (3) H + Cl2 (4) Cl + Cl (5) H + H
2Cl HCl + H (链增长)
(链引发)
HCl + Cl (链增长) Cl2 H2 (链终止) (链终止)
(6) H + Cl
HCl
(链终止)
此类反应称为链式反应。一旦引发出活化的Cl原子,反应即可快速进行。按此机理即 可推导出上述速率方程。
固态物质、微粒间直接碰撞的机会更少。因此固相发应只限于接触界面,所 以往往采用压片、烧结、研磨、加温、加压等多种手段促使反应进行。固相反应 速率一般都很慢。
●
反应机理研究的意义
通过反应机理的研究,可以了解决定反应速率的关键步骤,以便我们能
主动控制反应速率,能更多更快的制造产品。 反应机理研究在很大程度上决定于实验技术的发展。近年来,分子束、 激光、闪光光解等新技术的发展,使人们已能够实验研究快速反应的动力学 问题。
A + BC AB C AB + C
反应物 (始态)
活化络合物 (过渡态)
产物 (终态)
过渡状态位能示意图
过渡状态理论(transition state theory)
过渡态的位能高于始态也高于终态,由此形成
一个能垒。按过渡状态理论,过渡态和始态的位能
差就是活化能,或者说活化络合物的最低能量与反 应物分子最低能量之差为活化能。 该理论计算若干典型简单反应的活化能与 Arrhenius 实验活化能数值相符。 过渡状态理论着眼于分子相互作用的位能,与 碰撞理论着眼于分子相撞的平动能不同。
3
● 活化能的物理意义 A+B
Exothermic Reaction
C+D
Endothermic Reaction
The activation energy (Ea) is the minimum amount of energy required to initiate a chemical reaction.
5
NOTE: 碰撞理论着眼于相撞分子对的平动能,而过渡状态理论着眼于分子相互作用 的位能。它们都能说明一些实验现象,但理论计算与实验结果相符的还只限于很 少的几个简单反应。 须指出,有许多反应的速率并不符合Arrhenius公式,其规律性尚待进一步研 究。 最近30年,随着分子束以及激光等技术的应用,使化学反应速率的实验工作 和理论研究都有迅速的发展,动力学理论研究仍是当前的热点。
H2 + I2 2HI
实验事实:1)
v
d(H2) dt
k (H2)(I2)
二级反应
2) 用波长578nm光照可加速反应速率,且该波长的光只能使I2分子解离。
反应机理:
(1) I2 (2) 2I + H2
2I (快) 2HI (慢)
第一步为快反应,第二步为慢反应,反应速率由慢的一步所控制,快的一步会产生足 够的I供慢的一步所需,所以反应速率可写为: d(H2) dt
4.6 催化作用
2H2O2 (aq)
2H2O (l) + O2 (g)
加入KI
20
N2 (g) + 3H2 (g) 2NH3 (g)
rGmө(298) 33 kJmol1 rGmө(673) 41.7 kJmol1 Kpө = 6.1 105 Kp 5.8 104 (298 K) (673 K)
d(HBr) = k2 (H2) [K1(Br2]1/2 = k (H2) (Br2)1/2 dt
式中 k = k2(K1)1/2。上式与实验测定结果相符。
H2 + Cl2 2HCl
实验事实:1) v= d(HCl) dt = k (H2)(Cl2)1/2 1.5级反应
2) 室温下暗处反应速率极慢,加热并加光照反应剧烈,瞬间即可完成。
● 何谓反应机理?
所谓反应机理就是对反应历程的描述,研究参与反应的分子是如何转化为生 成物分子的。
化学反应可分为基元反应和非基元反应两大类。基元反应是一步完成的反应,
它也是构成非基元反应历程的各基本步骤。反应机理研究即是将一个非基元反应 分解为数个由基元反应构成的基本反应步骤。
10
Activated complex
v=-
= k2 (H2) (I)2
其中活化碘原子浓度 (I) 可由第一步快速平衡的关系式求得: I2 2I [I]2 = K1
[I2]
考虑到第一步的快速平衡以及I2的解离度很小,可近似有: [I] (I), [I2] (I2), 所以, - d(H2) dt 从而有 (I)2 = K1 (I2) = k2 (H2)K1(I2) = k (H2)(I2)
2NO (g) + O2 (g)
2NO2 (g)
N2O2 is detected during the reaction!
Elementary step:
+ Elementary step: Overall reaction:
NO + NO
N2O2 + O2 2NO + O2
N2O2
2NO2 2NO2
● 溶液相和固相反应
反应速率研究以气相居多,由此得到的一些概念(如碰撞、活化能、方位因素 等)也可用于溶液反应。 溶液反应的特点是溶质分子不像气体分子那样能自由运动,所以碰撞机会少 得多。但溶剂却能发挥特殊的作用,当溶质分子经扩散一旦碰撞,就被包围在溶 剂分子的“笼中”,而能多次碰撞,称为“笼效应”。溶剂的性质对反应速率有 明显的影响。
谢谢大家
第四章 化学反应动力学基础
—— 反应速率与反应机理
4.1 什么是化学动力学? 4.2 化学反应速率的含义及其表示法 4.3 浓度与反应速率:微分速率方程与反应级数 4.4 温度与反应速率:活化能与反应速率理论 4.5 反应机理 4.6 催化作用
4.7 化学动力学前沿话题
4.5 反应机理
d(CO) v正 = - dt d(NO) v逆 = - dt
平衡时v正 = v逆,所以 K = k正/k逆
H = Ea – Ea’
11
● 非基元反应
要确定一个非基元反应的历程,首先要系统的进行实验,测定速率常数、 反应级数、活化能、中间产物等。综合实验结果,参考理论,利用经验规则推 测反应历程。再经过多方面推敲,才能初步确立一个反应的机理。
在无催化剂时,该反应的活化能很高,反应进行的非常缓慢。如果用铁做催 化剂,反应速率即可大大加快。机理如下:
合成NH3过程中N2的催化吸附
Fritz Haber (1868-1934)
Carl Bosch (1874-1940)
N2 (g) + 2Fe (s) 2N-Fe (s) 2N-Fe(s) + 3H2(g) 2NH3(g) + 2Fe(s) N2 (g) + 3H2 (g) 2NH3 (g)
第一步为快反应,但反应产率很低。第二步为慢反应,是整个反应的控制
步骤,所以: d(HBr) v= dt
= k2 (H2) (Br)
其中活化Br原子浓度 (Br) 由第一步的平衡关系决定,即: [Br]2 = K1, [Br] = (K1[Br2])1/2 或 (Br) = [K1(Br2)]1/2 [Br2] 所以,
在催化剂的作用下,上述反应过程的活化能显著降低,使活化分 子的百分数增大,因此大大增大了反应速率。
在实际生产中,通过维持一定的高温 (573 773K)并使用催化剂提高反应速率, 通过高压并不断移去混合气中的氨,使反 应向有利于生成氨的方向进行。
One of the high-pressure vessels used for the catalytic synthesis of ammonia. The vessel must be 22 able to withstand internal pressures of greater than
式中 k = k2K1。上式与实验测定结果相符。
速率控制步骤的概念
H2 + Br2 2HBr
实验事实:
反应机理:
d(HBr) v= = k (H2)(Br2)1/2 d (1) Br t 2Br
2
1.5级反应 (快) (慢) (快)
(2) Br + H2 (3) H + Br2
HBr + H HBr + Br
● 过渡状态理论 (transition state theory):
随着人们对原子分子内部结构认识的深入,20世纪30年代提出了反应速率的 过渡状态理论。
该理论利用量子力学方法对简单反应进行处理, 计算反应物分子对相互作用过程中的位能变化,认为 反应物在相互接近时要经过一个中间过渡状态,即形 成一种“活化络合物”,然后转化为产物。这个过渡 状态就是活化状态,如
