药物分析手性hplc
手性药物的分离在色谱法中的应用

手性药物的分离在色谱法中的应用
手性药物是指具有手性结构的药物分子,即能够存在两种非重叠的立体异构体,分别为左旋体和右旋体。
左旋体和右旋体的生物学活性、药理学效应以及代谢动力学等方面可能存在显著差异。
对手性药物的分离具有重要的意义。
色谱法是一种常用的分离手性药物的方法,可通过多种不同的基质和条件实现手性药物的分离。
色谱法是通过样品在固定或移动相上的分配和传递行为实现分离的方法。
常见的色谱法包括高效液相色谱法(HPLC)、气相色谱法(GC)和超高效液相色谱法(UPLC)等。
高效液相色谱法(HPLC)是一种广泛应用于药物分析的方法。
在手性药物的分离中,HPLC常用的手性担子包括α-酮基-β-环糊精、β-环糊精、碘化环糊精等。
这些手性担子能够与手性药物形成包合物,从而实现手性药物的选择性分离。
还可以通过改变流动相的组成、pH值和温度等条件来调节手性药物与手性担子之间的相互作用,进一步优化分离效果。
HPLC分离后的手性药物可以通过光学旋光仪进行旋光度测定,以确定药物的手性纯度和相对含量。
HPLC在药物分析中的应用

高效液相色谱及其在药物分析中的应用摘要:高效液相色谱法的发展非常迅猛,许许多多的新方法不断涌现,它具有分离效率高,选择性好,分析速度快,操作自动化和应用范围广的特点。
本文主要简单介绍高效液相色谱的知识及其在药物分析中的广泛应用,通过实例描述了高效液相色谱法的优点。
高效液相色谱(HPLC)是结合经典液相色谱及气相色谱的分离原理。
由于与气相色谱法相比,高效液相色谱法具有下列主要优点:①不受试样的挥发性和热稳定性的限制,应用范围广②可选用不同性质的各种溶剂作为流动相,而且流动相对分离的选择性有很大作用,因此分离选择性高;③一般在室温条件下进行分离,不需要高柱温。
因而广泛应用于生物化学,生物医学,石油化工,合成化学,环境监测,食品卫生,以及商检,法检和质检等许多分析检验部门。
高效液相色谱不仅仅是一种有力的分析工具,而且越益成为分离制备和纯化的手段。
液相色谱在国内和国外已被广泛地应用于药物分析,尤其在我国,近十几年来HPLC方法越来越受到重视。
中国药典1985年版才规定使用,该版只有8个品种规定使用HPLC方法检测,到了1995版达到113个品种,2000版药典的应用达到了282种,2005版仅药典一部的应用达到了479种,涉及518项;药典二部中采用高效液相色谱法的品种有848种,较2000年版增加了566次,其中复方制剂、杂质或辅料干扰因素多的品种多采用高效液相色谱法。
2010年药典则更多的用液相色谱法取代了某些药物含量测定的薄层法,并引入了各式各样的检测器。
由此可见,我国高效液相色谱法在药物分析中的重要性。
1. 高效液相色谱仪的进展高效液相色谱(HPLC)是20世纪70年代迅速发展起来的一种分离分析技术,是目前各种色谱模式中应用最广的一个领域。
据估计,世界上几百万种化合物中除20%宜用气相色谱(Gc)分离分析外,其余80%的化合物,包括大(高)分子化合物、离子型化合物、热不稳定化合物以及有生物活性的化合物都可以用不同模式的HPLC(正相HPLC、反相HPLC、离子交换色谱和离子色谱、体积排除色谱、亲合色谱等)进行分离分析。
手性药物HPLC分析

一、概述
分子中含有手性中心的药物为手性药物.
20世纪90年代以来, 药物的光学活性与生 物活性之间的关系引起人们日益重视,手 性药物的研究与开发已成为国内外医药 工作者的一个重要研究方向.
一、概述
手性药物的研究近二十年来发展速度 较快. 2001年诺贝尔化学奖授予3位从 事不对称反应研究的科学家.
法严格控制起始原料或试剂的光学纯 度,制定合理可行的手性杂质的限度.
二、手性药物药学研究的基本思路
(一)合成过程中控制光学纯度
1. 直接从起始原料或试剂中引入 其次要根据后续反应的机理,充分分
析后续反应是否会影响已有手性中心 的构型,如可能会产生影响时,应研究 与优化工艺条件,尽量避免或减少外
消旋化的产生.
引入手性环境使对映异构体间呈现物理特性的 差异是手性HPLC进行光学异构体拆分的基础.
四、手性药物的HPLC分析方法
手性固定相法
色谱柱:Chiral-AGP (100mm×4.0mm) 流动相:含0.5%异丙醇的20mM醋酸铵 缓冲溶液(pH4.1,醋酸盐总浓度约 110mM) 流 速:1mL/min 检测波长:225nm
一、概述 单一异构体药物
消旋体药物中的药理活性和治疗作用只由单一 对映体产生. 消除(或减轻)原有混旋体药物的副作用; 降低使用剂量; 提高疗效; 故使用单一活性异构体代替外消旋体药物, 已成为当今制药业的趋势. 2003年世界销售额领先前10之一: 降血脂药辛伐他丁、胃酸分泌抑制剂艾美拉唑
3
HO HO
CH2
C COOH CH3 3
四、手性药物的HPLC分析方法
L-甲基多巴样品中D-对映体的限量检查 流动相添加剂法
手性药物的拆分——高效液相色谱(HPLC)
其它类型的旋光性聚合物CSPs还包含旋光性聚酰 胺、聚氨酯类、含有轴手性联萘基的旋光性聚合物、 (+)-聚-N-二苯甲基马来酰亚胺等。
2.手性拆分实例
2.1 高效液相色谱手性固定相法分离酸性化合物对 映体
手性柱 涂敷型CDMPC(20 nm, 300 mm×4.0 mm) Pirkl(S,S)WhelkO1(12mm,250mm×4.0mm )
1.4 多模式环糊精固定相
环糊精衍生化固定相既可以用于反相分离又可以用于正相分 离,因而称为多模式手性固定相。手性识别作用既有包容络 合,又有π-π电荷转移,氢键和立体排斥相互作用等多种作 用,应用范围广泛。
制备过程有四个步骤:
(1)硅胶上键合N-(2-氨乙基-3-氨丙基)基团 (2)用对甲苯磺酰氯专一性的磺化环糊精的羟基 ( 3)2-氨乙基-3-氨丙基键合硅胶与甲苯磺酰氯-β-环糊精反应;通
淀粉手性固定相的制备方法与纤维素手性固定相相似,首先 用淀粉与相应的有机化合物,如苯甲酰氯,苯基异氰酸酯等 反应,得到淀粉衍生物,再将这种衍生物涂敷在氨丙基键合 硅胶上,便可以得到淀粉类手性固定相。
1.3 环糊精手性固定相
OH
HO O OHOHO
OHO OH O
HO
OH
OOH
O
OH
O
HO
OH
+
SiO2
O O Si O
CH2CH2CH2NHCOCH2CH2CONHCH2CH2NH
3.碳氧键连接 醚基键合相与环糊精反应,:
O
SiO2
O
HO
O Si
+ (CH2)3oCH2CHCH2
O
SiO2
O O Si O
HPLC中的手性固定相

经典手性固定相
• 配体交换型手性固定相:
经典手性固定相
• 配体交换型手性固定相:
– 配体结合型的手性固定相主要用于生物相关性 物质的手性分离,如氨基酸和羟基酸。只有那 些具有2个或以上可供螯合的基团的对映体, 才能在这一类固定相上分离。 – 常见的金属离子,有Cu(II)、Zn(II)、Ni (II)等,其中以Cu(II)为多用,Zn(II)分 离含羟基的氨基酸效果最好。 – 如分子结构中含有芳香基团或杂原子时,分离 情况会有所不同。
经典手性固定相
• 环糊精型手性固定相:
经典手性固定相
• 环糊精型手性固定相:
– 大多数环糊精手性固定相只适用于反相色谱, 分可以被用于正 相色谱,如Cyclobond I RN或SN,因其可作为 π电子供体,具有π电子接受能力的被分析物可 以正相色谱的方式保留在这种手性固定相上。
经典手性固定相
• 人工合成多聚体型手性固定相:
– 通过加聚反应制备的含手性基团的线性聚合单 螺旋聚丙烯酸酯和聚(甲基)丙烯酰胺,是这 类手性固定相的主要代表,最早的该类手性固 定相是1979年合成的单螺旋三苯甲基-甲基丙 烯酸酯。 – 螺旋形是该类固定相产生手性识别能力的主要 原因,碳水化合物、醚类、胺类、卤化物和有 机含磷化合物都有在该类固定相上分离的成功 例子。
经典手性固定相
• Pirkle型手性固定相:
– Pirkle型手性固定相最早于1970年代末由Pirkle课题组 研制。该类手性固定相是将小分子手性选择物质键合 到固体载体(如硅胶)上得到,通常被称作Pirkle型、 刷型或π电子给予或π电子接受型手性固定相。 – 刷型固定相的手性分子主要分布在惰性基质的表面, 容易接触到被分析物质。在被分离物与固定相间的主 要相互作用是π-π相互作用,同时也存在其他类型的相 互作用,如氢键、偶极-偶极作用、空间位阻等。 – 由于良好的载样能力,Pirkle型固定相非常适用于临床 前少量药物的HPLC手性分离制备。
浅谈高效液相色谱(HPLC)在目前手性药物分析领域中的应用

体进行分离。铜和锌等都是常用的配位金属。氨基酸及衍生物、 多巴胺、氧氟沙星等均可用此类方法分离[4]。由于目前为止还未 发现任何一种试剂可以作为通用型试剂,所以在选择手性试剂时 可能会经过多次尝试,选择分离效果最好的手性添加剂。
2.3 手性衍生化试剂法(CDR) 当满足以下条件时可以使用手性衍生化试剂法:①手性化 合物对映体中有氨基、羟基或羧基等基团,其容易发生衍生作 用;②反应产物具有稳定的化学性质,手性试剂具有稳定的手 性性质,以及较高的光学纯度,不易发生变化,不会在色谱条 件下发生消旋化反应[5]。根据手性化合物对映体中有氨基、羟 基或羧基等基团以及分离效率之间的差别,将反应产物进行分 离。胺类试剂、酰化试剂氯甲酸酯类等均是目前常用的衍生化 试剂。因为该类方法是使用普通色谱柱,因此成本较低,分离 的灵敏度较高。
过去常使用酶消化法、分布结晶法等非色谱方法对手性药 物进行拆分,拆分过程耗时、烦琐,具有较大的不可控性,近 年来随着色谱技术的不断发展,在对手性药物进行拆分方面有 了较为广泛的应用[2]。 目前在手性药物进行拆分时较为常用的 方法有气象色谱、毛细管电泳和毛细管色谱以及高效液相色谱 法等,其中高效液相色谱法(HPLC)以其反应速度快、效率 高、准确性强等特点被广泛应用。
究进展[J].药物分析杂志,2015,35(7):1127-1133. [2] 刘丽敏.高效液相色谱在中草药和抗生素类药物分析中的应用
[D].成都:西南大学,2008. [3] 潘永玉.手性药物的对映体分离方法与药物动力学研究[D].沈阳:
沈阳药科大学,2007. [4] 康自华,阳小成,陈婷.高效液相色谱法在药物分析中的应用[J].广
高效液相色谱(HPLC)是一种在近年来被广泛应用的色 谱分析方法,其与传统色谱法相比,具有效率高、灵敏性高和 分析分离速度快等优点。高效液相色谱法原理上可对所有的 热稳定性差、沸点高和相对分子质量大的有机物进行分离和分 析,其不仅可用于对手性药物的定量分析,而且可用于制备分 离,在手性药物分析领域具有较为广泛的应用。
HPLC法在手性药物分离中的应用

环 糊 精 ( 一- D) 分 氯 噻 酮 对 映 体 , HP C 分 离 效 HP1C 拆 3 但 一 D
( . 昌大 学 医学 院临床 药理研 究所 , 昌 3 0 0 ; 1南 南 3 0 6
2 江 西 医学 院上饶 分 院 药理教 研 室 , 西 上 饶 3 40 ) . 江 3 0 0
关 键 词 : P C 手性药 物 ; HL ; 对映体分 离
中图 分类 号 :R 9
文 献标 识码 : A
主 要 有 、 、 环 糊 精 b t—yld xr p 7型 eacco eti 其 衍 生 物 。宁 凤 n及
容 等 _ 采 用 L脯 氨 酸 、 一 糊 精 (- D) 羟 丙 基 一一 糊 精 2 一 口环 1C 、 3 p环 ( 一- D) 甲 基 一 糊 精 ( -- D) 为 手 性 流 动 相 添 HP ̄C 和 环 Me ̄C 作 加剂 , 以反 相 C 。 为 固 定 相 , HP 法 对 S R 萘 普 生 进 柱 用 I C ,一 行 了 系 统 的拆 分 研 究 。蔡 小 淦 等 ¨ 使 用 天 然 8C 作 HP C 3 ‘D L 手性 流 动 相 添 加 剂 拆 分 氯 噻 酮 对 映 体 , 尝 试 了 羟 丙 基 一 也
) 衍 生 物都 成 功 地 应 用 于 分 离 对 映 体 。研 究 结 果 发 现 , 的 如 果 分 子 中 的 手 性 中心 与 伯胺 基 邻 近 , 获 得 最 佳 的 分 离 效 可 果 _ 。( ) 维 素 衍 生 物 手 性 固 定 相 : 维 素 是 以 G葡 萄 糖 】 3纤 纤 一 为 结 构 单 元 的 天 然 光 活 性 线 性 高 聚 物 , 个 结 构 单 元 有 一 个 每 伯 羟 基 和 2个 仲 羟 基 , 别 位 于 C 分 6和 C 、 3位 上 。通 过 对 2C
手性药物拆分技术及分析

手性药物拆分技术及分析在药物研究和开发中,手性药物是一个非常重要的领域。
手性药物指的是分子结构中含有手性中心(手性碳原子)的化合物,左旋和右旋两种异构体具有不同的生物活性和体内代谢途径。
因此,正确地分析和分离手性药物对于药物研究和有效性的评估至关重要。
手性药物分析技术主要包括色谱法、光学活性法和核磁共振(NMR)法。
色谱法是一种常用的手性药物分析方法。
它基于手性药物的两种对映异构体在手性固定相上的不同吸附能力进行分离。
常见的色谱法包括高效液相色谱法(HPLC)和毛细管电泳法。
HPLC通常使用手性固定相柱,通过选择性地吸附左旋或右旋手性分子,实现对手性药物的分离。
毛细管电泳是一种高效的手性药物分析方法,基于对映异构体在电场中的迁移速率不同,通过毛细管中背景电解质的浓度和pH值调节来分离手性药物。
光学活性法是一种基于光学活性性质来分析和测定手性药物的方法。
光学活性手性药物由于具有旋光性,可以引起光的偏振方向发生旋转。
常用的光学活性法包括旋光仪法和圆二色光谱法。
旋光仪法是通过测定手性分子对光的旋转角度来判断手性药物的对映异构体的含量和比例。
圆二色光谱法则是测量手性分子对不同波长光的吸收性质,通过对波长的差异来判断手性药物的对映异构体。
核磁共振(NMR)是一种基于核磁共振现象来分析手性药物的方法。
NMR技术通过检测手性碳原子或核自旋的信号来确定手性药物的结构和对映异构体的比例。
通过对样品进行核磁共振实验后,通过解释谱图的峰位和峰形等信息,可以得到手性药物的分析结果。
此外,还有一些其他的手性药物分析方法,如质谱法、X射线衍射法和环光谱法等。
这些方法在手性药物分析中各有优劣,适用于不同类别和性质的手性药物。
总之,手性药物分析技术对于药物研究和评估的重要性不可忽视。
科学家们通过不断研究和发展新的手性分析技术,为新药开发和治疗提供了更可靠和准确的手性药物分析方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 三种手性分离方法的比较
CDR优点:条件相对简易,只需采用普通HPLC的 固定相和流动相即可,而且通过衍生化有利于增 加检测灵敏度;缺点:样品中相关化合物须预先 分离、衍生化手性试剂的光学纯度的要求高以及 异构体对的衍生化反应速率不一 CMP优点:不必做柱前衍生化;对固定相也无特 殊要求;样品的非对映异构化络合具有可逆性而 且有利于制备。缺点:可拆分的化合物范围有限; 某些添加剂不够稳定而且往往会干扰检测 CSP优点:能广泛用于各类化合物,制备分离方便, 定量分析的可靠性较高。缺点:样品有时须做柱 前衍生化,对样品结果有一定的限制,其适用性 尚不及普通HPLC的固定相那样广泛
• 手性拆分发分为直接法和间接法两大类 • 对映体混合物以手性试剂作为柱前衍生,形成一对非对
映异构体,然后以常规固定相分离,成为间接法也叫手 性衍生试剂法;未做上述处理中,使用手性流动相或手 性固定相拆分者为间接法
• 共同点是:均以现代Hபைடு நூலகம்LC技术为基础,并引入不对称
中心;不同是CDR法将其引入分子内,而CMP和CSP则 引入分子间
一、手性药物的拆分方法与机制
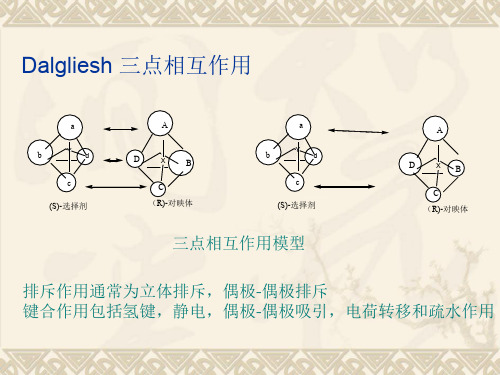
1950年Dalgliesh采用纸色谱拆分了手性药物芳族氨基 酸,由此提出三点相互作用的理论概念,这就是“三点 手性识别模式”他认为至少有三个作用力,其中一个要 有立体选择性,可以是吸引的也可以是排斥的。这些作 用力可以是氢键、偶极-偶极作用、π-π作用,经典作用 疏水作用或空间作用
药品质量控制中现代分析方 法的进展
手性HPLC技术与应用
建立和发展快速而灵敏的分离(或拆分)和测定 对映体药物的方法,以有效地进行以下四个主要 方面的工作是十分重要和必要的①对某些手性药 物进行对映体的纯度检查;②生物体液中药物对 映体的分离分析研究可探索血药浓度与临床疗效 的关系;③在研究手性药物过程中,可分别评价 单个对映体的效价、毒性、不良反应以及药动学 性质;④必要时,可进行药物对映体的制备分离 (或拆分)
二、手性HPLC应用 (一)柱前手性衍生化法 (二)手性流动相拆分法 (三)手性固定相拆分法
(一)柱前手性衍生化法
对映异构体与手性试剂反应,其产物为相应的非对映异构 体对。本法需要高化学纯度的手性衍生化试剂,衍生化反 应往往比较繁琐时,各对映体生化反应的速率有时也不同
(二)手性流动相拆分法
1.配基交换型手性添加剂 2.环糊精类添加剂 3.手性离子对络合剂 (三)手性固定相拆分法
1.Pirkle型手性固定相 2.蛋白质类手性固定相 3.环糊精类 4.手性聚合物固定相
