4 多组分系统热力学
物理化学:第4章_多组分系统热力学_
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
hx04多组分系统热力学

VB def
V n B T , p,nC(CB)
U B def
U n B T , p,nC(CB)
H B def
H n B T , p,nC(CB)
SB def
S n B T , p,nC(CB)
AB def
A n B T , p,nC(CB)
GB def
G n B T , p,nC(CB)
上一内容 下一内容 回主目录
返回
2024/7/4
4.2.2 偏摩尔量的定义
(4) 偏摩尔量是两个广度性质X、nB之比,因此它是一强度性质,与体积的量无关。
上一内容 下一内容 回主目录
返回
2024/7/4
4.2.3 偏摩尔量的加和公式
已知
k X
dX
B=1
nB
T , p,nC(CB)
dnB
量和除B以外的其他组分不变时,热力学函数对B 物质的量求偏导。
上一内容 下一内容 回主目录
返回
2024/7/4
4.3.2 化学势的定义
把化学势的广义定义代入热力学函数的微分式:
dU TdS pdV BdnB B
dH TdS Vdp BdnB B
dA SdT pdV BdnB B
溶剂,含量少的称为溶质。
上一内容 下一内容 回主目录
返回
2024/7/4
4.1.2 多组分系统的组成表示法
1. B的物质的量浓度
cB def
nB V
溶质 B 的物质的量与溶液体积V 的比
值称为溶质 B 的物质的量浓度,或称为溶
质 B 的浓度.
物质的量浓度的单位 mol ×m-3
或
mol ×dm-3
南京大学物理化学(第五版)04章_多组分系统热力学
(
Gm p
)T
Vm
对多组分系统,把 Gm 换为 B ,则摩尔体积变为偏
摩尔体积 VB 。
化学势与温度的关系
(
B
T
)
p
,nB
,
nc
[ T
G ( ) ] T , p,nc p,nB ,nc nB
[ nB
G ( T ) p,nB ,nc ]T , p,nc
(S) [ nB ]T , p,nc
nk 0
dnk
k
n1Z1 n2 Z2 nk Zk nBZB B=1
偏摩尔量的加和公式
k
Z= nB ZB
B=1
这就是偏摩尔量的加和公式,说明系统的总 的容量性质等于各组分偏摩尔量的加和。
例如:系统只有两个组分,其物质的量和偏 摩尔体积分别为 n1,V1 和 n2 ,V2 ,则系统的总体积为:
(1)热力学能
设系统中有 1, 2,3, , k 个组分
所含的量分别为 n1, n2, , nk
U U (S,V , n1, n2, , nk )
化学势的定义
U U (S,V , n1, n2, , nk )
其全微分为
dU
U ( S )V ,nB dS
(
U V
)
S
,nB
dV
k U B1 ( nB )S ,V ,nc(cB) dnB
如果转移是在平衡条件下进行,则
dG 0 又
dnB dnB
所以 (B B )dnB 0
化学势在相平衡中的应用
(B B )dnB 0
因为 dnB 0 所以
B B
组分B在α,β两相中,达平衡的条件是该
大学物理化学--第四章

混合物(mixture):对系统中的各组分采用同样 的标准态和研究方法,系统中的各组分是平等的。
溶液(solution): 各组分区分为溶剂(solvent) 和溶质(solute ),并对二者采用不同的标准态和研 究方法;系统中的各组分是不平等的。
偏摩尔量
XB
(
X nB
)T
,
p
,
,下标必须是
nC
T
,
p。, nC
只有广度量才有偏摩尔量(质量除外)。
偏摩尔量是强度量。
偏摩尔量随温度、压力、组成(浓度)变化而变, 与系统的总量无关。
上一内容 下一内容 回主目录
返回
2020/8/23
§4.1 偏摩尔量
偏摩尔量的加和公式
X nB X B
B
它的含义是:在一定温度、压力下,一定组成混合
物理化学电子教案—第四章
多组分系统热力学
上一内容 下一内容 回主目录
返回
2020/8/23
第四章 多组分系统热力学
目录
§4.1 偏摩尔量 §4.2 化学势 §4.3 气体组分的化学势 §4.4 逸度及逸度因子 §4.5 拉乌尔定律和亨利定律 §4.6 理想液态混合物 §4.7 理想稀溶液
§4.8 活度及活度因子 §4.9 稀溶液的依数性
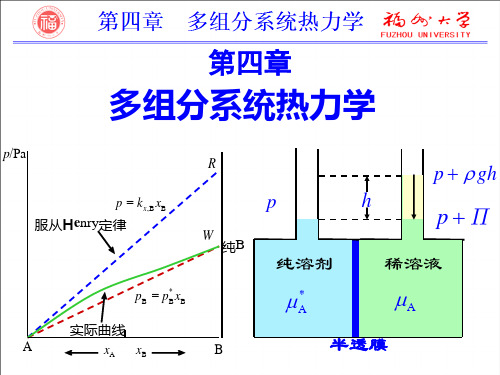
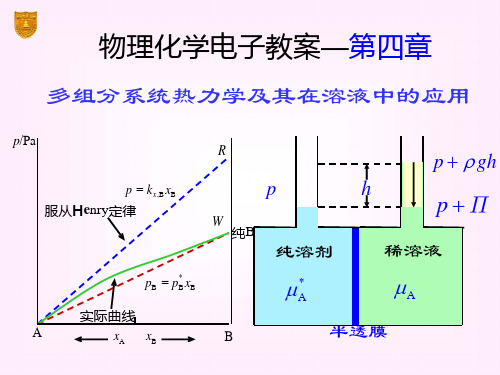
标准态 kb,B ( p p )
实际溶液 pB - bB 关系曲线
pB
O
b
上一内容 下一内容 回主目录
bB
返回
2020/8/23
4.7 理想稀溶液
理想稀溶液中溶质的化学势
B(溶 质)
0 B(溶 质)
物理化学 第四章 多组分系统热力学

Vm
T,p一定
V*m,C VC
V*m,B VB
d c· b·
0 B
a xC
C
图4.1.2 二组分液态混合物的 偏摩尔体积示意图
若B,C形成真实液态混合物: 则混合物体积为由V*m,B至V*m,C的曲线。对于任一 组成a时,两组分的偏摩尔体积可用下法表示: 过组成点a所对应的系统体积点d作Vm-xC曲线的 切线,此切线在左右两纵坐标上的截距即分别 为该组成下两组分的偏摩尔体积VB,VC。
B
系统中各广度量的偏摩尔量: 对于多组分系统中的组分B,有: 偏摩尔体积: VB=(ƽV/ƽnB)T,p,n C 偏摩尔热力学能: UB=(ƽU/ƽnB)T,p,n C 偏摩尔焓: HB=(ƽH/ƽnB)T,p,n C 偏摩尔熵: SB=(ƽS/ƽnB)T,p,n C 偏摩尔亥姆霍兹函数:AB=(ƽA/ƽnB)T,p,n C 偏摩尔吉布斯函数: GB=(ƽG/ƽnB)T,p,n
C
几点说明: (1)偏摩尔量为两个广度性质之比,所以为强度 性质; (2)偏摩尔量的定义中明确是在恒温、恒压及系 统组成不变的条件下,偏导数式的下标为T,p 时才是偏摩尔量; (3)同一物质在相同温度、压力但组成不同的多 组分均相系统中,偏摩尔量不同; (4)若系统为单组分系统,则该组分的偏摩尔量 与该组分的摩尔量相等,即: XB=X*B,m
C
=VB (数学知识:二阶偏导与求导的顺序无关) 得证。
4.2化学势 4.2化学势
1.化学势的定义 混合物(或溶液中)组分B的偏摩尔吉布斯函数GB 定义为B的化学势,用符号μB表示:
μB = GB=(ƽG/ƽnB)T,p,n
def
C
对于纯物质,其化学势等于它的摩尔吉布斯函 数。
第四章 多组分系统热力学及其在溶液中的应用

第四章 多组分系统热力学及其在溶液中的应用1.在298K 时,有0.10kg 质量分数为0.0947的硫酸H 2SO 4水溶液,试分别用(1)质量摩尔浓度B m ;(2)物质的量浓度和B c (3)摩尔分数B x 来表示硫酸的含量。
已知在该条件下,硫酸溶液的密度为331.060310kg m -⨯⋅ ,纯水的浓度为3997.1kg m -⋅ 。
解:质量摩尔浓度:()2410.19.47%/1009.47%0.1981.067mol H SO B n m W kg -⨯==-⨯=⋅水物质量浓度:()24331009.47%0.10.19.47%/98997.11.02310mol H SO B n c V m --⨯⨯===⨯g 水 摩尔分数:242420.0189H SO B H SO H On x n n ==+2、在K 298和大气压力下,含甲醇()B 的摩尔分数B x 为0.458的水溶液密度为30.8946kg dm -⋅,甲醇的偏摩尔体积313()39.80V CH OH cm mol -=⋅,试求该水溶液中水的摩尔体积2()V H O 。
解:3322CH OH CH OH H O H O V n V n V =+3322CH OH CH OHH O H OV n V V n -=以1mol 甲醇水溶液为基准,则330.45832(10.458)180.027290.894610m V dm ρ⨯+-⨯===⨯ ∴23310.027290.45839.801016.7210.458H OV cm mol ---⨯⨯==⋅-3.在298K 和大气压下,某酒窖中存在酒10.0m3,其中含乙醇的质量分数为0.96。
今欲加水调制含乙醇的质量分数为0.56的酒,试计算(1)应加入水的体积;(2)加水后,能得到含乙醇的质量分数为0.56的酒的体积已知该条件下,纯水的密度为3997.1kg m -⋅,水和乙醇的偏摩尔体积为()25C H OH ω()()6312/10V H O m mol --⋅()()63125/10V C H OH m mol --⋅0.96 14.61 58.0 0.5617.1156.58解:设加入水的物质的量为O H n 2',根据题意,未加水时,2520.9610.96::9.3914618C H OH H O n n -== 2525221C H OHC H OH H O H O V n V n V =⋅+⋅ 即 661001.581061.1410522--⨯⨯+⨯⨯=OH H C O H n n解出:25167882C H OH n mol =217877H O n mol = 加入水后,25220.5610.56:():0.4984618C H OH H O H O n n n -'+== 20.5610.56167882:(17877):0.4984618H O n -'+==2'317887H On mol = 加入水的物质的体积为23331788718105.727()999.1H O V m -⨯⨯'== 2525222252'26'6()56.5810(17877)17.1110C H OH C H OH H O H OH OC H OH H OV n V n n V n n --=++=⨯⨯++⨯⨯329.4984495 5.76753115.266V m =+=4.在K 298和kPa 100下,甲醇)(B 的摩尔分数B x 为30.0的水溶液中,水)(A 和甲醇)(B 的偏摩尔体积分别为:132765.17)(-⋅=mol cm O H V ,133632.38)(-⋅=mol cm OH CH V 。
第四章、多组分系统热力学
第四章,多组分系统热力学一、选择题1. 在 298K 时,A 和 B 两种气体单独在某一溶剂中溶解,遵守亨利定律,亨利常数分别为 kA 和 KB,且知 KA>KB,则当 A 和 B 压力(平衡时的)相同时,在一定量的该溶剂中所溶解的关系为 ( ) B (A) A 的量大于 B 的量 (B) A 的量小于 B 的量(C) A 的量等于 B 的量 (D) A 的量与 B 的量无法比较2. 在 400K 时,液体 A 的蒸气压为 4×104Pa,液体 B 的蒸气压为 6×104Pa,两者组成理想液体混合物,平衡时,溶液中 A 的物质的量分数为 0.6,则气相中 B 的物质的量分数为: ( ) B(A) 0.60 (B) 0.50 (C) 0.40 (D) 0.313. 已知挥发性纯溶质 A 液体的蒸气压为 67 Pa,纯溶剂 B 的蒸气压为 26665Pa,该溶质在此溶剂的饱和溶液的物质的量分数为 0.02,则此饱和溶液(假设为理想液体混合物)的蒸气压为:( ) C(A) 600 Pa (B) 26198 Pa (C) 26133 Pa (D) 599 Pa4. 已知 373.2K 时,液体 A 的饱和蒸气压为 133.32 kPa,另一液体 B 可与 A构成理想液体混合物。
当 A 在溶液中的物质的量分数为 0.5 时,A 在气相中的物质量分数为 2/3 时,则在 373.2K时,液体 B 的饱和蒸气压应为: ( ) A(A) 66.66 kPa (B) 88.88 kPa (C) 133.32 kPa (D) 266.64 kPa5. 已知 373K 时液体 A 的饱和蒸气压为 133.24kPa,液体 B 的饱和蒸气压为66.62kPa。
设 A 和 B形成理想溶液,当 A 在溶液中的摩尔分数为 0.5 时,在气相中 A 的摩尔分数为: ( ) D(A) 1 (B) 1/2 (C) 1/3 (D) 2/36. 关于亨利系数,下列说法中正确的是: ( ) D(A) 其值与温度、浓度和压力有关(B) 其值与温度、溶剂性质和浓度有关(C) 其值与温度、溶质性质和浓度有关(D) 其值与温度、溶质和溶剂性质及浓度的标度有关7. 已知 373K 时,液体 A 的饱和蒸气压为 5×104 Pa,液体 B 的饱和蒸气压为 105Pa,A 和 B构成理想液体混合物,当 A 在溶液中的物质的量分数为 0.5时,气相中 B 的物质的量分数为:( ) A(A) 1/1.5 (B) 1/2 (C) 1/2.5 (D) 1/38.2molA物质和3molB物质在等温、等压下,混合形成理想液态混合物,该系统中A和B的偏摩尔体积分别为1.79×10-5m3×mol-1,2.15×10-5m3×mol-1,则混合物的总体积为:() C(A)9.67×10-5m3 (B)9.85×10-5m3(C)1.003×10-4m3 (D)8.95×10-5m39.298K,标准压力下,苯和甲苯形成理想液态混合物。
物理化学第四版 第四章 多组分系统热力学2014.2
)
p,n
(
B
)
,V
(
G P
)T
,n(
B
)
k
dG SdT VdP BdnB
证毕
B 1
14
又 dA d(G PV ) dG pdV Vdp
将上式dG 代入,整理得:
k
dA sdT PdV BdnB ……..(3) B 1
同理可得出另二个热力学基本方程。
因 A=A(T,V,n1,n2…….nk)
B
B
B
........
n B
相平衡条件
有N 个组分,就有N 个这样的式子
19
例:在、 两相中均含有A和B两种物质,达到相平衡时,下列
各式正确的是(
)。
A、
A
B
B、
B
B
C、
A
B
D、
B
A
例:组分B从相扩散入相中,则以下说法正确的有( A、总是从浓度低的相扩散入浓度高的相 B、平衡时两相浓度相等 C、总是从化学势高的相移向低化学势低的相
dA
(
A T
)V
,n
(
B
)
dT
( A V
)T ,n(B)
dV
k B 1
(
A n(B)
)T
,V
,n
(
c,c
B)
dnB
将式(4)和式(3)比较
B
A ( nB
)T ,V ,n(c,cB)
同样可得出
B
U ( nB
)S ,V ,n(c,cB)
H ( nB
)S ,P.n(c,cB)
…..(4)
15
例 2: 下列偏导数中那些是偏摩尔量?那些是化学势?
第四章 多组分系统热力学
前两章-单组分均相封闭系统,如:纯物质或某种 理想气体系统。 科学研究及生产实践-多组分系统 纯物质单相封闭系统:确定n(对于单相封闭系统, 此为一定值)、T、p,系统的状态即可确定。此时, 系统的一切性质,不只是强度性质而且全部容量性 质都有了确定值。若以X代表任意一种容量性质, 如V、U、S、G等,对于物质的量固定的纯物质单 相系统,都有: X=f(T,p) 其微小改变量为:
10
XB物理意义为:在恒温、恒压、均相封闭系统中, 只增加任一组分B,同时不引起原来nj改变,且不 发生缔合、沉淀、化学反应时: (1)dnB量B物质的加入,系统容量性质X对nB的变 化率。或在原有nB中加入dnB的B,使X改变了dX的 比值; (2)条件同前,在一个无限大的系统中,加入1 mol 的B物质,引起容量性质X的改变量。 如:向一大缸某白酒中,加入1 mol的水,引起V增 大了17.0 ml (<18.0 ml), 则此时V水=17.0 ml· -1。 mol
X X X dp dX dT d n1 p n T p , ni T , ni 1 T , p , n2 , n3 ,nk
X n 2 X d n2 n T , p , n1 , n3 ,nk k d nk T , p , n1 , n2 ,nk 1
W (乙) 10
W (水) 90
V (乙) 12.67
V (水) 90.36
V 103.30
V (实) 101.84
V 1.19
20 g乙醇+180 g水,其V=2×1.19=2.38 ml
7
描述一多组分均相系统的状态,除指明系统的T和p, 还必须指明系统的组成ni。为此,需要引入偏摩尔 量(XB)来代替单组分系统中的摩尔量(Xm)。 一、偏摩尔量的定义 含有k个组分的均相系统,其任一容量性质X (可为 V, U, H, S, A, G)可写成下列函数式: X=f(T,p,n1,n2,…nk) 2+k个变量 当系统的T、p及各组分的n均发生一微小变化时, 该容量性质X也相应发生微小变化。根据状态函数的 性质,此变化可用全微分表示,即:
第4章 多组分系统热力学1
§4.2 化学势
1.化学势的定义 混合物(或溶液)中组分B的偏摩尔吉布斯函 数GB 定义为B的化学势,用μB表示。
定义为 G B GB nB T .P.nC
对于纯物质,其化学势就是它的摩尔吉布斯函数。
化学势是最重要的热力学函数,系统中的其它偏摩 尔量均可以通过化学势、它的偏导数或组合表示。
B
得到
dA B ( )dnB ( ) 0
B
自发 平衡
化学势判据
封闭系统恒温恒压,W’=0 ,由dGT,p≤0,
dG SdT Vdp B ( )dnB ( )
B
得到
dG B ( )dnB ( ) 0
B
<自发 =平衡
化学势判据
化学势在多相平衡中的应用
设系统有α和β两相,两相中均不仅一种物 质。在恒温恒压下若α 相中有dnB的 B物质 转移到β相,则 若上述转移是自发进行的,则有
相dnB ( )
相
相转移
dGT . p 0
即
B( ) B( )
dG 0
即
当系统达平衡时
B( ) B( )
μ
B(α )=μ B(β )
= …=μ
B(ρ )
如果有某物质在各相中的化学势不等,则根据 dGT,p<0为自发过程的原理,该物质必然要从化学 势较大的相向化学势较小的相转移。
化学势在化学平衡中的应用
参加反应的物质都有化学势,平衡条件为
dG vi i (产物) vi i (反应物) 0
B
dA SdT pdV B ( ) dnB ( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
( p p* H 2 O ) 0.40 (105.4 7.33) 0.40kPa 39.23kPa
p N2 p p * H 2 O p H 2 (105.4 7.33 39.23) kPa 58.84kPa
M H 2 2.0158, x H2 pH2 k x,H2 M N 2 28.0134 mH2 / M H 2 m H 2O / M H 2O m H 2 / M H 2 m N 2 / M N 2 mH 2 / M H 2 m H 2O / M H 2O
* p甲苯 y苯
p p
* 苯
* 甲苯
y苯 p y苯
* 苯
38.7 0.3 0.142 ; x甲苯 1 x苯 0.858 100 38.7 0.3 100 0.3
4-6 在 18℃,气体的压力为 101.325kPa 下,1dm3 的水中能 溶解 O20.045g,能溶解 N20.02g。现 1dm3 将被 202.65kPa 空气饱 和了的水溶液加热沸腾,赶出所溶解 O2 的和 N2,并干燥之,求此 干燥气体在 101.325kPa、18℃下的体积及组成。设空气为理想 气体混合物,其组成(体积百分数)为: (O 解: M
x 2 d 2 RTdx2 x1 d 1 x 2 d 2
x 1 d 1 RTdx 2 RTd (1 x1 ) RTdx1
d1 RTdx1 / x1
1
1
d 1 RT d ln x1
x1 1
x1
1 1 RT ln x1 1 ( pg ) RT ln( p1* / p ) RT ln x1 1 1 ( pg ) RT ln( p1 / p )
p N 2 m H 2O M N2 k x, N M H 2O
2
4-9 试用吉布斯-杜亥姆方程证明在稀溶液中溶质服从亨利定 律,则溶剂服从拉乌尔定律。 证:p2=kx,2x2
d 2 RTdx2 / x2
2 x , 2 RT ln x 2
(恒温、恒压)
(恒温、恒压) 联立得: (恒温、恒压)
4-5
80℃时纯苯的蒸气压为 100kPa,纯甲苯的蒸气压为
38.7kPa。两液体可形成理想液态混合物。若有苯-甲苯的气-液 平衡混合物,80℃时气相中苯的摩尔分数 y 苯=0.300,求液相的 组成。 解: x
x苯
苯
py苯
* p苯
* * ( 1 x苯) p苯 x苯 p甲苯 y苯 * p苯
O2
2
) 21%, ( N 2 ) 79%。
31 .9988,
M N 2 28.0134
p O2 k c , O 2 c O2 k c , O 2 k c , O2 k c, N2 p O2 V 液 M O2 m O2 p N 2 V液 M N 2 mN2
4-3 在 25℃、1kg 水(A)溶解有醋酸(B) ,当醋酸的质量 摩尔浓度 bB 介于 0.16 和 2.5mol·kg-1 之间时,溶液的总体积 V/cm3=1002.935+51.832× ( bB/ mol·kg-1 ) +0.1394 ( bB/ mol·kg-1)2。 (1)把水(A)和醋酸的偏摩尔体积分别表示成 bB 的函数关系式; (2)求 bB =1.5 mol·kg-1 时水和醋酸的偏摩尔体 积。 解: (1)V
B
B
WB / M B 0.095 / 180 0.0104 WB / M B (1 WB ) / M B 0.095 / 180 0.905 10 3 mol dm 3 0.547mol dm 3 1 / 1.0365
B
0.095 / 180 10 3 mol kg 1 0.583mol kg 1 (1 0.095) / 1000
B
(V / n B ) T , p ,nC nB (V / b B ) T , p , n A 55.5 mol
={51.832+0.2788 bB/ mol·kg-1} cm3·mol-1
V VB n B V A n A V B bB / kg 1 V A VA V VB bB / kg 1 55.5mol 1000 mol 18.015 1002.935 0.1394(bB / mol kg 1 ) 2 cm 3 mol 1 55.5
cB cB ( nB M B / V ) ( cB M B ) cB cB MA MA
式中 ρ 为溶液的密度,单位为 kg·m-3;A 代表溶剂。 而物质 B 的质量摩尔浓度则是溶液中溶质 B 的物质的量除以 溶剂的质量即
bB nB mA
其单位为 mol·kg-1。在二组分溶液中溶质 B 的摩尔分数 xB 与质 量摩尔浓度 bB 的关系为
4-7
20℃下 HCl 溶于苯中达平衡,气相中 HCl 的分压为
101.325kPa 时,溶液中 HCl 的摩尔分数为 0.0425,已知 20℃时 苯的饱和蒸气压为 10.0kPa。若 20℃时 HCl 和苯蒸气总压为 101.325kPa,求 100g 苯中溶解多少 HCl。 解: k
x , HCl
m O2 V 液 M O2 101.325 1 31.9988 kPa dm 3 mol 1 72.05 10 3 kPa dm 3 mol 1 0.045 101.325 1 28.0134 kPa dm 3 mol 1 14.19 10 4 kPa dm 3 mol 1 0.02
比较上述两式可得
p1 p1* x1
4-10 A、B 两液体能形成理想液态混合物。已知在 t 时纯 A 的饱和蒸气压 p =400kPa,纯 B 的饱和蒸气压 p =120kPa。
* A * B
(1)在温度 t 下,于气缸中将组成为 y(A)=0.4 的 A、B 混
合气体恒温缓慢压缩, 求凝结出第一滴微细液滴时总压及该液滴 的组成(以摩尔分数表示)为多少? (2)若将 A、B 两液体混合,并使此混合物在 100kPa、温度 t 下开始沸腾,求该液态混合物的组成及沸腾时饱和蒸气的组成 (摩尔分数)? 解: (1) p
∴
mH 2 mN2
p H 2 m H 2O M H 2 k x , H M H 2O
2
39.23 100 2.0158 g 60.6g 7.24 10 6 18.015 58.84 100 28.0134 g 871g 10.5 10 6 18.015
MHCl=34.461, M 苯=78.113,W 苯=100g XHCl=(mHCl/ MHCl)/{(mHCl/ MHCl)+(m 苯/ M 苯)} 所以 4-8
mHCl 36.41 100 0.03847 1.867 g M苯 (1 x HCl) 78.113 (1 0.03847) M HCl m苯 x HCl
第四章
多组分系统热力学
4-1 由溶剂 A 与溶质 B 形成一定组成的溶液。此溶液中 B 的 浓度为 cB,质量摩尔浓度为 bB,此溶液的密度为 ρ。以 MA,MB 分别代表溶剂和溶质的摩尔质量, 若溶液的组成用 B 的摩尔分数 xB 表示时,试导出 xB 与 cB,xB 与 bB 之间的关系式。 解:对于 A, B 二组分溶液, 溶液中物质 B 的物质的量 nB 与溶 液的物质的量之比,称为物质 B 的摩尔分数,符号 xB 。即
所以
V nRT / p (n O2 n N 2 ) RT / p {(5.907 11.28) 10 4 8.314 291.15 / 101325}m 3 41.1cm 3 y O2 n O2 /( nO2 n N 2 ) 5.907 /(5.907 11.28) 0.344 y N 2 1 y O2 0.656
气压是 47.0kPa。二者可形成理想液态混合物,若混合物的组成 为质量百分数各 50%,求 60℃时此混合物的平衡蒸气组成,以摩
尔分数表示。 解:M 甲醇=32.042,M 乙醇=46.069
x甲醇 50 / 32.042 0.58979 ; 50 / 32.042 50 / 46.069
p HCl / x HCl (101 .325 / 0.0425)kPa 2384 kPa
* p p苯 p HCl p苯 ( 1 x HCl) k x,HCl x HCl
x HCl
* p p苯 * k x,HCl p苯
101.325 10.0 0.03847 2384 10.0
={18.0681-0.0025(bB/ mol·kg-1)2} cm3·mol-1 ( 2 ) VA= ( 18.0681-0.0025×0.152 ) cm3·mol-1=18.0625 cm3·mol-1 VB=(51.832+0.2788×0.15)cm3·mol-1=52.25 cm3·mol-1 4-4 60℃时甲醇的饱和蒸气压是 83.4kPa,乙醇的饱和蒸
xB nB / m A bB bB n B / m A n A / m A bB n A /(n A M A ) bB 1 / M A
4-2 D-果糖 C6H12O6(B)溶于水(A)中形成的某溶液,质量
分数 WB=0.095,此溶液在 20℃时的密度 ρ=1.0365Mg·m-3。求此 果糖溶液的(1)摩尔分数; (2)浓度; (3)质量摩尔浓度。 解: (1) x (2) c (3) b
* p甲醇 p甲醇 x甲醇 83 .4 0.58979 49 .19 kPa
