第四章__酸碱滴定法
分析化学_第四章_酸碱滴定法

[H+]+[Na+] =[H2PO4-]+2[HPO42-]+3[PO43-]+[OH-],
• 为了消去式(2)中的非质子转移反应产物[Na+] 和[H2PO4-],将式(1)代入 式(2),整理后既得出PBE: • [H+]+[H3PO4] =[HPO42-]+2[PO43-]+[OH-]
酸的电离,其反应式严格地讲都应按(4.1)式的模式来书写,
但为了简便起见,有时仍把弱酸(HB)的电离简写成: HB 中所起的作用。 H+ + B-
但要注意,这仅仅是简式而已,切记溶剂水在弱酸的电离
23:10:02
例2 NH3在水中的离解 NH3接受H+的半反应 H2O给出H+的半反应
H& H2O
总量(mol)一定等于各种碱所获得的质子的总量 (mol) ;
根据这一原则,各种得质子产物的浓度与各种失质子产物 的浓度之间一定存在某种定量关系。用得质子产物和失质 子产物的浓度来表示酸碱反应中得失质子相等的关系式称 为质子平衡方程简称质子平衡或质子条件。
23:10:03
例 浓度为c(mol/L-1)的NaH2PO4溶液:
例如HAc,它在水中反应的平衡常数称为该酸的解离常数 HAc + H2O H3O+ + Ac-
- [ H O ][ Ac ] 3 Ka = [HAc ]
23:10:02
或可简写成
[H ][ Ac ] K = [HAc ]
第四章 酸碱滴定法 (分析化学人民卫生出版社第8版)

1、强酸(Ca )
HA H2O
H++AH + + OH -
[H+]=[A-]+[OH-]
[A-]=Ca
[H+]=Ca+Kw/[H+]
精确式
《 第四章 酸碱滴定法 1 》
- 6/125页 -
当Ca ≥ 20[OH-],忽略水的解离
[H+] ≈Ca
近似式
pH=-lg [H+]=-lgCa
《 第四章 酸碱滴定法 1 》
理论变色范围 pH=2.4~4.4
《 第四章 酸碱滴定法 1 》
- 35/125页 -
常用酸碱指示剂(P46)
人对不同颜色的敏感程度不同,红色易辨别,实际变色 范围与理论变色范围稍有区别。
《 第四章 酸碱滴定法 1 》
- 36/125页 -
注意 : 1、酸碱指示剂的变色范围不一定正好位于pH=7左右 ,
例:计算0.10 mol/L的邻苯二甲酸氢钾溶液的 pH。 解:查表得邻苯二甲酸的pKa1=2.94, pKa2=5.43
cKa2 ≥ 20Kw c≥ 20Ka1
1 mol/L的邻苯二甲酸氢钾溶液的 pH?
《 第四章 酸碱滴定法 1 》
- 22/125页 -
例:分别计算0.05 mol/L的NaH2PO4和3.33×10-2 mol/L的 Na2HPO4溶液的pH。
溶液的颜色随溶液pH的变化而变化,当pH=pKHIn 时 , [In-]=[HIn],这一点的pH称为理论变色点,溶液显酸 式色和碱式色的混合色。
《 第四章 酸碱滴定法 1 》
- 33/125页 -
由于人眼对颜色的辨别能力有限,在一点上不容易观察出,必须有一
第4章 酸碱滴定法

三种酸强弱顺序:HCl>HAC>H2S 在共轭酸碱对中,如果酸愈易给出质子,酸性愈弱,则其共轭碱对质子的亲和 力就愈弱,就愈不容易接受质子碱性就愈弱。 其共轭碱强弱顺序:Cl-1<AC-<HS2.Ka 和 Kb 之间关系: 共轭酸碱相互依存关系 [H + ][A − ] Ka= , [HA] 例: NH 3 + H 2 O Kb= Ka 和 Kb 之间关系 Ka·Kb=Kw NH + 4 + H 2O Ka= NH 3 + H 3 O +
−
δ1 =
[HC 2 O 4 ] [HC 2 O 4 ] = 2c [H 2 C 2 O 4 ] + [HC 2 O 4 ] + [C 2 O 4 ] K a1 [ H + ] = + 2 [ H ] + K a1 [ H + ] + K a1 K a 2
[C O ] [C 2 O 4 ] δ2 = 2 4 = 2c [H 2 C 2 O 4 ] + [HC 2 O 4 ] + [C 2 O 4 ] = K a1 K a 2 [ H ] + K a1 [ H + ] + K a1 K a 2
注意:Ka 和 Kb 之间的对应关系
§4-2 不同 pH 值溶液中酸碱存在形式的分布情况--分布曲线
引言:上次课上我们对酸碱平衡的基础理论进行简要的讨论,从这节课开始我 们介绍酸碱滴定法的有关理论和应用。这堂课我们学习分布曲线,学习它可帮 助我们深入理解酸碱滴定的过程、滴定误差以及分布滴定的可能性,而且对于 了解络合滴定与沉淀反应条件也是有用的。 任意的离解反应: HB + H 2 O 达平衡时 aq 中存在 [H3O+] H 3O + + B− [HB] [B-]
第四章 酸碱滴定法

图 HAc各型体的δi -pH曲线 HAc各型体的 pH曲线 各型体的δ
例:计算pH=5 00时 HAc溶液( 1000mol/L) 例:计算pH=5.00时,HAc溶液(0.1000mol/L) 中HAc和Ac-的分布系数及平衡浓度 HAc和
解: δ HAc =
[H + ]
+
Ka +[H ] 1.78×10
δ 0 + δ1 + δ 2 = 1
讨论
Ka一定时,δ0 ,δ1和δ2与[H+ ]有关 Ka一定时, 一定时
• •
•••来自pH < pKa1,H2C2O4为主 pH = pKa1, [H2C2O4] = [HC2O4-] pKa1 < pH < pKa2 , HC2O4-为主 pH = pKa2, [HC2O4-] = [C2O42-] pH > pKa2,C2O42-为主
H2PO− 4
H3PO4
H3O
+
零水准
+ NH4
+H
+
失质子 −H+ NH
3
+ 2H +H+
+
H 4− PO2
−H+ PO3− 4 −H+
H2O
OH −
PBE: :
− 3 [H+ ] +[H2PO4 ] + 2[H3PO4 ] =[NH3] +[PO4− ] +[OH − ]
的质子条件式: 例: (HAc(c1)-NaAc(c2))的质子条件式: 的质子条件式
-lgγi=0.512zi2⋅
I 1+Bå I
极限公式
-lgγi=0.512zi2 I
4第四章 酸碱滴定法
NH3CH 2COOH的K a1 4.5 103 ; K a 2 2.5 1010 ;
NH 4 a
解:(1) [H ] K a K
Kw Ka Kb
1.8 104 1.0 1014 3.2 107 (mol L1 ) 1.8 105 pH 6.50
•
•
强酸强碱溶液pH值的计算 弱酸弱碱溶液pH值的计算 两性物质溶液(C ) 缓冲溶液pH值的计算
水溶液中[H+]的计算方法: 1. 列出PBE式; 2. 代入有关常数和浓度数据; 3. 计算出[H+]。 注:在计算中可以进行合理的近似处理, 最后用近似式或最简式进行计算。
一、一元酸(碱)溶液的氢离子浓度计算
[ NH ] 4
精确式
[H ] K a1 ( K a 2 K
NH 4 Na H2PO4 Na2HPO4
H
K a1 K a 2 K a1 K a 2
H
H
Ka 2 Ka 3
练习题: (1)计算0.10mol HCOONH4溶液的pH值。 L-1 (2)计算0.10mol L-1氨基乙酸(NH2CH2COOH)溶液的pH 值。 HCOOH的K a 1.8 104 ; NH3的Kb 1.8 105
23 3
2
NH 4 a
[ NH ] 4 [H ] 2- 2[H ] [CO 3 ] 1 1 Ka2 K a1 Kw K
NH 4 a
精确式
[H ] 2 K a 2 K
NH 4 a
最简式***
2. 酸式盐:NH4HCO3
2 [H ] [OH ] [CO3 ] - [H2CO3 ] [NH3 ]
分析化学课件 第四章 酸碱滴定法

[OH-]=(0.1000×0.02)/(20.00+20.02)
= 5.0×10-5 mol·L-1 pOH=4.30, pH=14-4.30= 9.70
2020年11月7日星期六3时
37分22秒
上一页 下一页 返回
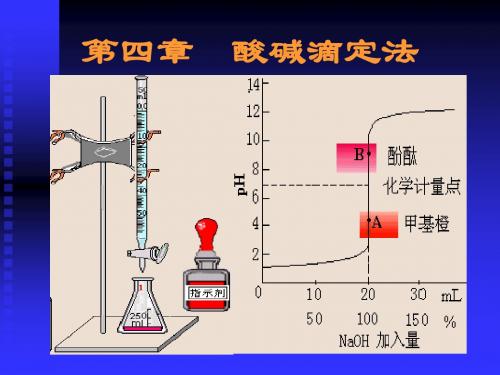
讨论:强碱滴定强酸的滴定曲线
1)滴定前加入18mL,溶液pH变化仅 为:2.28-1=1.28;而化学计量点前 后共0.04 mL(约1滴),溶液pH 变化 为:9.70-4.30=5.40 (突跃)。
碱式色
2020年11月7日星期六3时 37分22秒
上一页 下一页 返回
→甲基橙(methyl orange,MO)-双色
pH≤ 3.1,酸式色,红色; pH 4.4, 碱式色,黄色; pH 3.1-4.4,两种形式共存,为混合色,橙色。
2020年11月7日星期六3时 37分22秒
上一页 下一页 返回
上一页 下一页 返回
若±0.1%误差范围内突跃范围为 4.30~9.70
酚酞(8.0 ~ 10.0):半滴溶液, 无色变粉红。
甲基红(4.4 ~6.2):半滴溶液, 红变橙;
甲基橙(3.1 ~ 4.4):半滴溶液, 橙变黄;
3)选择指示剂的原则:
1.变色范围全部或部分在突跃范围内的指示剂指示
终点,即可保证终点误差在允许的范围。
02.00.102000 1050..130 ~9.87.070
上一页 下一页 返回
5)影响强酸强碱滴定突跃范围大小的因素
酸碱的浓度:浓度变为原1/10,则计量点前后H+、OH-的浓度均 为原来的1/10,所以突跃范围约减小2个pH单位。 故:酸碱滴定中,滴定剂和被测物溶液的浓度不低于~ 0.1mol/L
分析化学 第四章_酸碱滴定法一 图文
H2CO3 H HCO3 H CO32
H3O H H2O H OH
质子条件式为:
H 2CO 3 H 3O
C
O
2 3
O
H
分析化学
第四章 酸碱滴定法
14
• 方法要点:
• 1.从酸碱平衡体系中选取质子参考水准(又称 零水准),它们是溶液中大量存在并参与质子 转移反应的物质。
方法。 • 理论基础: • 酸碱平衡理论及酸碱质子理论。 • 优点: • 方法简单、快速,应用广泛。 • 应用: • 一般酸、碱以及能与酸、碱直接或间接发生质子
转移反应的物质。
分析化学
第四章 酸碱滴定法
2
酸碱质子理论
• 能给出质子的是酸,能接受质子的是碱,酸和 碱是相互依存和相互转化的。酸碱不是彼此独立 的,而是统一在 对质子的关系上。
9
酸碱质子理论的基本要点:
• 1. 能给出质子的是酸,能接受质子的是碱; • 2. 统一在对质子的关系上,共轭酸碱对之间具有
相互依存、相互转换的关系; • 3. 酸或碱的离解常数是物质酸或碱性强弱的定量
指标; • 4. 物质的酸碱性不仅与此物质的本质有关,还与
溶剂的性质有关; • 5. 在溶液中,质子不能单独存及其理论基础 • 第一节 酸碱溶液中氢离子浓度的计算 • 第二节 酸碱指示剂 • 第三节 酸碱滴定法的基本原理 • 第四节 滴定终点误差 • 第五节 非水溶液中的酸碱滴定法
分析化学
第四章 酸碱滴定法
1
• 酸碱滴定法的定义: • 酸碱滴定法是以质子转移反应为基础的滴定分析
分析化学
第四章 酸碱滴定法
12
• (二)电荷平衡
第四章酸碱滴定法
第四章酸碱滴定法第四章酸碱滴定法酸碱滴定法(acid-base titrations)是以⽔溶液中的质⼦转移反应为基础的滴定分析⽅法。
⼀般酸、碱以及能与酸碱直接或间接发⽣质⼦反应的物质,⼏乎都可以⽤酸碱滴定法测定。
因此,酸碱滴定法是分析化学的基础内容之⼀。
这个⽅法的关键问题是计量点的确定。
因为酸碱反应通常不发⽣外观的变化,在滴定中需选⽤适当的指⽰剂,利⽤它的变⾊作为到达计量点的标志。
因为不同的指⽰剂的变⾊有其不同的pH,⽽不同类型的酸碱反应的计量点时pH⼜不相同,为了正确地确定计量点,就需要选择⼀个刚好能在计量点时变⾊的指⽰剂。
要解决这个问题,必须了解滴定过程中溶液pH的变化情况。
因此,在学习酸碱滴定时,不仅要了解指⽰剂的变⾊原理和变⾊范围,同时也要了解滴定过程中溶液pH的变化规律和指⽰剂的选择原则,以便能正确地选择合适的指⽰剂,获得准确的分析结果。
基于上述原因,我们先讨论酸碱溶液平衡的基本原理,然后再介绍酸碱滴定中的理论及应⽤。
第⼀节⽔溶液中的酸碱平衡⼀、酸碱的质⼦理论根据质⼦理论,凡能给出质⼦(H+)的物质是酸,能接收质⼦的物质是碱。
酸碱关系可⽤下式表⽰:酸HA与碱A-处于⼀种相互依存的关系中,即:HA失去质⼦转化为它的共轭碱A-,A-得到质⼦后,转化为它的共轭酸HA,则HA与A-被称为共轭酸碱对。
如:由上述酸碱的半反应可知:酸碱可以是中性分⼦,也可以是阳离⼦或阴离⼦,酸碱是相对的。
⼜如:离⼦(H2PO4-)在H3PO4-H2PO4-共轭体系中为碱,⽽在H2PO4--HPO42-共轭体系中为酸。
同⼀物质在某些场合是酸,⽽在另⼀场合是碱,其原因是共存物质彼此间给出质⼦能⼒相对强弱不同。
因此同⼀物质在不同的环境(介质或溶剂)中,常会引起其酸碱性的改变。
既能给出质⼦⼜能接受质⼦的物质称为两性物质。
酸碱质⼦理论认为,酸碱反应的实质是质⼦转移。
例如HAc在⽔中离解,溶剂⽔就起着碱的作⽤,否则HAc⽆法实现其在⽔中的离解,即质⼦转移是在两个共轭酸碱对间进⾏。
分析化学酸碱第四章酸碱滴定法
HAc
δ0 δ Ac
Ac
cHAc
δ1 δ 0 δ HAc δ Ac
Ac Ka HAc Ac Ka H H K a 1 Ka H K a H
由上式我们可以看出: 值是H+浓度的函数,而与其 分析浓度无关。有了分布系数及分析浓度即可求得溶 液中酸碱各种存在形式的平衡浓度。
参考水准法
⑴选取基准态物质。基准态物质是与质子转换有关的酸碱组分, 通常以起始酸碱组分和溶剂分子作基准态物质。 ⑵ 根据溶液中酸碱平衡情况,以质子基准态物质为基准,将溶 液中其它组份与之比较,那些是得质子的,哪些是失质子的, 然后绘出得失质子图。 ⑶由得失质子示意图,写出质子平衡式。 例如:在HAc水溶液中,大量存在并参加质子转移的物质是 HAc和H2O(不要漏掉溶剂分子!)选择两者做为参考水准。 对于HAc来说,其失去一个质子的产物为Ac -;对H2O来说, 其即可以得质子而生成H3O+,又可以失质子而生成OH-,画出 得失质子产物示意图:
OH 1 1 Ka NH H H Ka OH K 4 b 1 1 NH Ka 3
δ NH 4
NH H Kb NH NH H Ka O H Kb
分布系数δ 与pH之间的关系曲线δ -pH称为分布曲线。 p51,图4-1是HAc溶液的分布曲线。从图中可以看出: (1) HAc 随pH增高而减小,而 Ac随pH增高而增大。 (2)pH<<pKa时(pH≈pKa-2), HAc 1 ,溶液中存在的主要形 式为HAc。当 pH>>pKa时(pH≈pKa+2) , ,溶液中存 1 Ac 在的主要形式为Ac-。 (3)pH=pKa时(pH=4.74),两曲线相交, 此时 HAc Ac
分析化学-第四章 酸碱滴定
1. 酸碱平衡理论基础复习 2. 当pH变化时酸碱存在形式的变化(分布曲线)(重点) 3. 酸碱溶液pH计算
酸碱滴定
4. 滴定终点指示办法 5. 一元酸碱滴定
6. 多元酸、碱滴定
(重点) (重点)
酸碱滴定 7. 酸碱滴定应用 的应用 8. ~9 示例
§4.1 酸碱平衡的理论基础
1 酸碱质子理论
7
例1:
试求 HPO42- 的 pKb2和 Kb2。
解:经查表可知 Ka2 = 6.3×10-8,即 pKa2 = 7.20
由于
Ka2·Kb2 = 10-14
所以
pKb2 = 14 - pKa2
= 14 - 7.20
= 6.80
即
Kb2=1.6×10 -7
&
8
§4.2 不同pH溶液中酸碱存在形式 的分布情况—分布曲线
以δ对pH作图,关系曲线叫分布曲线.
分布系数与溶液pH关系曲线的讨论:
基本原则: δ0 + δ1= 1 (1) [H+]>Ka, pH<pKa时, δ1>δ1(以HOAc为主);
(2) pH=pKa, [H+]=Ka时, δ0 = δ1= 0.5;
(3) [H+]<Ka, pH>pKa 时, δ1<δ0(以OAc- 为主)。
例:酸、碱在水中的解离过程:
NH3 + H2O
OH- + NH4+
HOAc + H2O
H3O+ + OAc-
2 酸碱解离平衡
一元弱酸的解离:HA + H2O
[H ][A ]
Ka HA
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ka Kb KW 1.0 1014 (25 C)
Kb
2015-7-20
KW Ka
pKb pKw pKa
pKa pKb pK w 14.00
t 0C pKw 0 14.96 10 14.53 20 14.16
25
30 13.83
40 13.53
50 13.26
HC2O4- + H+
HC2O4H2C2O4
C2O42- + H+
C2O42- + 2 H+
2 [C2O4 ][H ] K a2 [HC2O4 ]
2 [C2O4 ][H ]2 K1K a2 [H 2C2O4 ]
2 c[C2O4 ][H C2O4 ][H 2C2O4 ]
失去质子后的产物失去质子的摩尔数相等,按
此列出的方程称质子平衡方程。
2015-7-20
2、用途: 根据质子条件,可得到溶液中浓度与有关组 分浓度的关系式,即计算公式。
2015-7-20
3、方法: 根据参考水准来写质子平衡方程。
参考水准的选择:
选择一些酸碱组分做参考,以他们作为水准来 考虑质子的得失。通常是原始的酸碱组分,大
碱
+
质子
酸碱可以是阳离子,阴离子,也可以是中性分子。
有酸才有碱,有碱必有酸,酸中有碱,碱可变酸。
2015-7-20
3、共轭酸碱对
HAc
H2O + H+
H+ + AcH3O+
HAc + H2O
H3O+ + Ac-
酸1
碱2
酸2
碱1
2015-7-20
H2O +
NH3
NH4+ + OH-
酸1
碱2
酸2
碱1
PO43-
PBE:
3 [H ] [ H 2PO4 ] 2[ H3PO4 ] [OH ] [ PO4 ]
2015-7-20
例4 写出c mol· L-1 NH4H2PO4溶液的PBE
得质子 参考水准 H2O
失质子 OH-
H+
+H+
-H+
NH4+
+H+ H3PO4 H2PO4-
由得失一个质子而发生共轭关系的一对酸碱,称为共 轭酸碱对
2015-7-20
4、水分子的两性
H2O + 酸1
H2O
碱2
H3O
酸2
+
+ OH
碱1
-
KW [H3O ][OH ] 1.0 1014 (25 C)
pKw 14.0
质子自递常数(水的离子积)
2015-7-20
5、酸碱反应实质
PO4
3
[H ]3 Ka1[H ]2 K a1K a2[H ] K a1K a2 K a3
Ka1Ka2 Ka3
H
2015-7-20
3PO4
H 2 PO4
2 HPO4
3 PO4
1
2015-7-20
四、大于三元酸的多元酸溶液
分母为一含有n+1项的多项式
系数δNH3仅仅决定于溶液的pH值 ,是溶液酸度的函
数。
2015-7-20
2、磷酸的pKa1 、pKa2、 pKa3分别为2.12、7.20、 12.36,在pH=1.0的磷酸溶液中,磷酸的主要存在 形体为: A. 磷酸根 C. 磷酸二氢根
D
B. 磷酸一氢根 D. 磷酸分子
2015-7-20
第三节 酸碱溶液pH值的计算
2015-7-20
2、平衡浓度与分析浓度 (1)平衡浓度: 共扼酸碱处于平衡状态时的浓度,用[ ]表示; (2)分析浓度: 各种存在形式的平衡浓度的总和,用 c 表示 C = [ ] +[ ] +[ ] +…
2015-7-20
3.分布系数 某种平衡浓度占总浓度的分数,用δ表示 δ =[ ] / c
2015-7-20
一、一元酸溶液
以HAc为例
HAc
Ac- + H+
c [ HAc] [ Ac ]
HAc
[ HAc] [ HAc] [ HAc ] [ Ac ] c
] 1 [ H Ka 1 [H ] K a [H ]
2015-7-20
[ H ][ Ac ] Ka [ HAc]
第四章 酸碱滴定法
以酸碱反应为基础的滴定方法
2015-7-20
第一节 酸碱平衡的理论基础
酸碱理论
电离理论 电子理论 质子理论
酸——能电离出H+的物质 碱——电离出OH-的物质 酸——凡能接受电子的物质 碱——凡能给出电子的物质 酸——凡能给出质子的物质 碱——凡能接受质子的物质
2015-7-20
H
2015-7-20
2 1 C O HC2O4 C2O4 2 2 4
pKa1=1.23 pKa2=4.19
2015-7-20
2015-7-20
三、三元酸溶液
H 3 PO4 [H ]3 K [H ]2 K K [H ] K K K a1 a1 a 2 a1 a 2 a3
2015-7-20
练习题
1. 在 NH3· H2O溶液中, NH3的分布系数决定于下
列因素中的哪一个?
A. NH3· H2O的分析浓度
C B. 平衡浓度[NH3]
C. 溶液的pH值
D. NH3的pKb
•原因:公式中虽然含有Kb和pH,但对于 NH3· H2O
来讲,它在水溶液中的Kb是一个常数,因此,分布
+H+
参考水准
-H+
失质子 OH-
-H+
H2O HB
B-
PBE:
[ H ] [OH ] [ B ]
2015-7-20
例3 写出c mol· L-1 Na2HPO4溶液的PBE
得质子 参考水准 -H+ 失质子 OH-
H+
+H+
H2O
-
H2PO4 H3PO4
+H+ +2H+
HPO42-
-H+
HCl + NH3 NH4+ + Cl-
酸1
碱2
酸2
碱1
结果是各反应物转化为它们各自的共轭酸或共轭碱。 实质: 质子传递过程
2015-7-20
二、酸碱离解平衡
1、离解常数: 溶液中有以下弱酸化学平衡
HA
A- + H+
[ H ][ A ] c Ka [ HA]
2015-7-20
2、酸碱的强弱 酸碱的强弱定量地用酸碱的离解常数Ka、Kb
B. H3O+是水溶液中的最强酸
C. H3O+的共轭碱是OHD. OH-是水溶液中的最强碱
2015-7-20
3、根据酸碱质子理论下列化合物中不属于酸的 是 (
D
)
A. HCO3-
B. NH4+
C. HAc
D. Ac-
2015-7-20
第二节 不同pH溶液中酸碱存在形式分布
1、重要性: 酸碱平衡体系中,酸或碱的各种存在形式的 分布,在分析化学中非常重要。 了解酸度对溶液中酸或碱的各种存在形式分 布的影响规律。
[ H ][ Ac ] Ka [ HAc]
Ac- + H2O
OH-
[OH ][ HAc] + HAc Kb [ Ac ]
a (H + ) a (A) a (HA) a (OH ) Ka Kb Kw a (HA) a (A)
[ H ][OH ]
1 [ Ac ] 1 [ HAc]
Ac
1 [ Ac ] [ Ac ] [ HAc ] [ HAc ] [ Ac ] c 1 [ Ac ] K 1 a [ H ] [ H ] K 1 a Ka
HAc
2015-7-20
Ac
2015-7-20
[H ]2 H C O [H ]2 K [ H ] K K 2 2 4 1 a2 a1
K [H ] a1 HC2O4 [H ]2 K [H ] K1K a2 a1
K1K a2 2 C2O4 [H ]2 K [H ] K K 1 a2 a1
NH3 + H2O
-
OH + HAc
OH
-
-
Kb 5.60 1010
Kb 1.80 105
+ NH4
+
S2- + H2O
OH- + HS-
Kb 1.41
强弱顺序: S 2- > NH3 > Ac-
2015-7-20
3、共扼酸碱对Ka及Kb之间的关系
HAc + H2O
H3O+ + Ac
-H+ -H+ -2H+
NH3 HPO42PO43-
3 2 PBE: [H ] [H3PO4 ] [OH ] 2[PO4 ] [HPO4 ] [ NH3 ]
60 13.02
14.00
2015-7-20
1、H3O+是水溶液中能够存在的最强的酸 2、OH-是水溶液中能够存在的最强的碱 酸的强度 强酸 中强酸 弱酸 极弱酸 pKa <0 >0, <3 >3, <11 >11 碱的强度 强碱 中强碱 弱碱 极弱碱 pKb <0 >0, <3 >3, <11 >11
