ICH 生物技术药物的临床前安全性评价 S6 R1
生物药物安全性评价

生物药物安全性评价生物药物是基于生物技术的药物,主要包括蛋白质药物、基因治疗药物和细胞治疗药物等。
这些药物具有高度的特异性和活性,可以治疗多种疾病,包括癌症、自身免疫性疾病和感染性疾病等。
然而,与传统的化学药物相比,生物药物的安全性评价更为复杂,需要考虑许多因素。
本文将对生物药物安全性评价的相关内容进行分析和总结。
1. 生物药物安全性评价的主要内容生物药物安全性评价涉及许多方面,主要包括以下几个方面:1.1 毒性研究毒性研究是生物药物安全性评价的重要组成部分。
它主要评估药物在体内的毒性及其对组织和器官的影响。
包括急性毒性、慢性毒性、致突变性、致癌性等。
在毒性研究中,需要进行的实验包括体内实验和体外实验。
体内实验包括常规的动物实验,例如小鼠、大鼠、猴子等。
而体外实验一般采用细胞实验或人血清。
1.2 免疫原性评价免疫原性评价是生物药物安全性评价的另一个重要方面。
药物在体内可能会引起免疫反应,包括过敏反应、免疫抗原性和免疫抑制作用等。
在免疫原性评价中,首先需要对药物进行免疫学检测。
免疫学检测包括抗体检测和细胞免疫检测。
通过检测抗体水平或细胞免疫反应,可以评估药物的免疫原性。
1.3 稳定性评价稳定性评价是生物药物安全性评价的另一方面。
由于生物药物具有活性,因此需要考虑药物的稳定性。
包括温度、离子强度、pH值等等因素的影响。
药物在运输和储存过程中,需要考虑温度和湿度等因素的影响。
稳定性评价包括物理稳定性和化学稳定性。
物理稳定性评价主要考虑药物的杂质含量、颗粒度和输液过滤性。
化学稳定性评价主要考虑药物分解和降解等。
1.4 药代动力学和药效学评价药代动力学和药效学也是生物药物安全性评价的重要方面。
药代动力学评价主要关注药物在体内的药代动力学行为。
药效学评价主要考虑药物的治疗效果和其与体内靶点的相互作用。
药代动力学评价主要包括药物的吸收、分布、代谢和排泄等方面。
这些方面对药物治疗效果、毒性和免疫原性都有着重要影响。
ICH相关文件说明

人用药品注册技术要求国际协调会(ICH)文件目录ICH官方主页以《ICH 药品注册的国际要求》一书为参考,花费了点时间,对人用药品注册技术要求国际协调会(ICH)指导原则的目录进行了整理,这样有需要的话,去ICH网站上查询也就简便得多了。
一、ICH.质量部分稳定性1.Q1A(R2)新原料药和制剂的稳定性试验2.Q1B新原料药和制剂的光稳定性试验3.Q1C新剂型的稳定性试验分析方法的验证4.Q1D新原料药和制剂稳定性试验的括号设计法和矩阵设计法5.Q1E稳定性数据的评价6.Q1F气候带Ⅲ和Ⅳ注册用稳定性数据分析方法的验证7.Q2A分析方法验证的术语8.Q2B分析方法的论证:方法学杂质9.Q3A(R)新原料药中的杂质10.Q3B(R)新制剂中的杂质11.Q3C杂质:残留溶剂的指导原则12.Q3C(M)杂质:残留溶剂(修订)N-甲基吡咯烷酮(NMP)的日允许接触剂量(PDE)13.Q3C(M)杂质:残留溶剂(修订)四氢呋喃的日允许接触剂量(PDE)药典14.Q4药典15.Q4A药典的协调16.Q4B药典可互换性的法规认同生物技术产品的质量17.Q5A生物技术产品的病毒安全性评价18.Q5B对用于生产rDNA来源蛋白质产品的细胞的表达构建体分析(遗传稳定性)19.Q5C生物技术/生物制品质量:生物技术/生物制品稳定性试验20.Q5D用于生物技术产品及生物制品生产的细胞基质的来源和鉴定21.Q5E生产工艺变更后生物技术产品/生物制品的可比性质量标准22.Q6A规范:新原料药和新制剂的测试方法和认可标准:化学物质23.Q6B规范:生物技术产品及生物制品的测试方法和认可标准良好的生产质量管理规范(GMP)24.Q7A药物活性成分的GMP指南药物开发25.Q8药物开发风险管理26.Q9质量风险管理二、ICH.安全性部分致癌试验1.S1A药物致癌试验的必要性2.S1B药物致癌试验3.S1C药物致癌试验的剂量选择4.S1C’ 药物致癌试验的剂量选择的附件:补充剂量限度和有关注释遗传毒性5.S2A药物审评遗传毒性试验的特殊性指导原则6.S2B遗传毒性:药物遗传毒性试验标准组合药代7.S3A毒代动力学指导原则:毒性研究中全身暴露的评价8.S3B药代动力学:重复给药的组织分布研究指导原则慢性毒性9.S4动物慢性毒性试验的周期(啮齿类和非啮齿类)生殖毒性10.S5A药品的生殖毒性检测11.S5B雄性生育力毒性其他12.S6生物技术药品的临床前安全性试验13.S7A人类药品的安全性药理研究14.S7B人用药延迟心室复极化(QT间期延长)潜在作用的非临床评价指导原则15.S8人类药品的免疫毒性研究三、ICH.临床部分1.E1评价临床安全性的给药方案2.E2A加速报告的定义和标准3.E2B/M个体病例安全性报告传递的数据要素4.E2C上市药品定期安全性更新报告5.E2D批准后安全性数据管理:快速报告的定义和标准6.E2E药物警戒计划7.E2B传送不良反应报告的资料要求8.E3临床研究报告的结构与内容9.E4新药注册所需量效关系的资料10.E5对国外临床研究资料的种族因素的可接受性11.E6药品临床研究规范(GCP)统一的指导原则12.E7老年人群的临床研究13.E8临床研究总则14.E9统计原则15.E10对照组的选择16.E11儿童人群的临床研究17.E12按治疗分类的各类药物临床评价18.E14非抗心律失常药物致QT/QTc间期延长及潜在心律失常作用的临床评价四、ICH.综合部分1.M1医学术语MedDRA2.M2注册资料传递所需的电子代码3.M3与临床研究有关的临床前研究的时间安排4.M4 CTD(common technical document)(包括CTD、CTD-Q、CTD-S、CTD-E和eCTD)5.药品词汇的数据要素和标准ICH的论题主要分为四类,因此ICH根据论题的类别不同而进行相应的编码分类:1. “Q”类论题:Q代表QUALITY,指那些与化工和医药,质量保证方面的相关的论题。
生物药物安全性评价

5. 国际共识
创新性疫苗进行临床前安全性评价已成为 疫苗开发的国际化要求。世界卫生组织 (WHO)在2003年底正式对外公布了疫苗非 临床评价指导原则,而美国FDA和欧盟EMEA 也公布了相关的指导原则。
临床给药剂量,同时也需考虑容量、浓度、 制剂和给药部位的影响。如果活性成分清 除较快或溶解度低,可适当增加实验动物 的给药次数或给药容量。
4、免疫原性 一般化学药品在动物体内很少具有免
疫原性。生物技术药物由于分子量较高, 往往在动物体内具有免疫原性。在重复给 药毒性试验期间应注意检测抗体滴度、出 现抗体的动物数、中和抗体等。
2. 基于使用人群的特殊性,对 疫苗的安全性有着更高的要求
由于大部分疫苗的使用人群是健康人群, 尤其是健康儿童,因此从药物评价的角度 出发,对于疫苗安全性方面的要求应高于 一般治疗性药物。目前国内研发的治疗性 疫苗(包括治疗恶性肿瘤和爱滋病的治疗 性疫苗)已开始重视临床前安全性评价研 究。
用于健康人群的治疗性疫苗的临床前安评 工作,没有理由不引起应有的重视。倘若 在临床前研究阶段缺少安全性评价的研究, 极有可能会给健康受试者,特别是儿童带 来或者增加风险。这无论从科学的角度还 是伦理的角度均是不允许的。
基本概念
生物药物是指运用生物学、医学、生物化 学等的研究成果,综合利用物理学、化学、 生物化学、生物技术和药学等学科的原理 和方法,利用生物体、生物组织、细胞、 体液等制造的一类用于预防、治疗和诊断 的制品。
生化药物
Biochemical drugs
生物提取物
生命基本物质及其衍
ICH生物技术生物药品的质量要求

精品课件
1
基因工程药物的质量控制
基因工程产品的质量控制与传统生产方法所 得产品有本质的差别。可能会含有用传统生产 方法不可能存在的有害杂质。例如在细菌中表 达的产品可能有内毒素、致敏原,在动物细胞 中表达的产品可能有DNA杂质和病毒。
精品课件
2
基因工程产品审评的要点
(1)化学物理鉴定的一致性 (2)污染物限度控制的重要性(热原、病毒、宿主细胞DNA) (3)全过程控制质量的必要性 (4)效价测定的重要性 (5)标准化的趋势
以上所规定的测试次数适用于产品在批准前的稳定性试验,如在该产
品批准后,提供的数据说明产品仍是相当稳定的,则可减少稳定性试验
次数。
精品课件
19
细胞基质的来源和鉴定(Q5D)
“细胞基质”是指微生物细胞或来自于人或动物的细胞系。 动物来源的细胞系是指所有后生动物,包括体外无限生长的传代
细胞系以及体外有限代次的二倍体细胞。 微生物的来源包括细菌、真菌、酵母和其他单细胞生物。
由于用的模型病毒不会与实际污染病毒相同,因此要根据 生产品种和知识加以判断。
研究的模型病毒要有针对性
病毒污染可来自起始材料,亦可能来自工艺过程。
精品课件
11
去除或灭活病毒安全性指南 (Q5A)
评价灭活或去除病毒的能力,应考虑
滴度降低
灭活的速度,灭活曲线形状
方法耐用性,即条件改变后的适用性
对不同种类病毒的可选择性
18
生物技术/生物制品稳定性试验(Q5C)
6. 生物技术产品及生物制品的货架寿命一般在半年到5年之间。
如预定货架寿命在1年或1年以内,真实时间稳定性研究应为前3个月 每月进行一次,以后每3个月一次。
如预定货架寿命在1年以上,稳定性试验应在贮藏期的第一年每3个 月进行一次;第二年每6个月进行一次,以后每年进行一次。
ICH简介

ICH概述Product by 苏才凤延俊鸟张春生CONTENTSIntroduction of ICHICH GuidelinesWork ProductsDiscussion前言The International Council for Harmonisation of TechnicalRequirements for Pharmaceuticals for Human Use人用药品注册技术要求国际协调理事会The International Conference for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use国际协调会议International Council on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use国际协调理事会2015年10月正式宣布ICH组织机构变更,现已成为瑞士法律下的法律实体PART ONE Introduction of ICH一、ICH的成立美国欧盟日本监管部门authority制药部门industry美国食品药品监督管理局(FDA)美国药物研究和生产联合会(PRMA)欧盟,European Union(EU)欧洲制药工业协会联合会(EFPIA)日本厚生省(MHW)日本制药工业协会(JPMA)1990年,ICH成立意义:对世界范围内的药物研制、开发过程有所革新,避免重复,节约开支,统一申报注册技术要求,提高质量、缩短时间。
二、成员三、组织架构负责日常管理协调工作,为大会,MC ,WG 提供支持,设在日内瓦负责ICH 的监管运营工作,由6个创始机构,2个常务规章会员国组成每个成员机构有一名协调员,负责与ICH 秘书处、MC 、WG 直接接触。
29个ICH三级指导原则转化实施建议
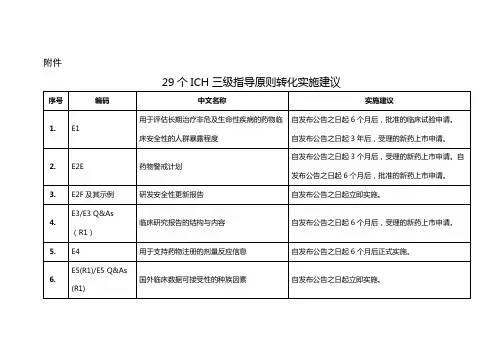
E2F及其示例
研发安全性更新报告
自发布公告之日起立即实施。
4.
E3/E3 Q&As(R1)
临床研究报告的结构与内容
自发布公告之日起6个月后,受理的新药上市申请。
5.
E4
用于支持药物注册的剂量反应信息
自发布公告之日起6个月后正式实施。
6.
E5(R1)/E5 Q&As (R1)
国外临床数据可接受性的种族因素
自发布公告之日起6个月后正式实施。
14.
E16
与药物或生物制品研发相关的生物标志物:资质提交材料的背景、结构以及格式
自发布公告之日起6个月后正式实施。
15.
E17
多区域临床试验计划与设计的总体原则
自发布公告之日起立即实施。
16.
S1A
药物致癌性试验必要性指导原则
申请人需在现行技术要求基础上尽早按照ICH指导原则开展研究;自发布公告之日起,6个月后开始的非临床研究按照ICH指导原则执行。
附件
29个ICH三级指导原则转化实施建议
序号
编码
中文名称
实施建议
1.
E1
用于评估长期治疗非危及生命性疾病的药物临床安全性的人群暴露程度
自发布公告之日起6个月后,批准的临床试验申请。
自发布公告之日起3年后,受理的新药上市申请。
2.
E2E
药物警戒计划
自发布公告之日起3个月后,受理的新药上市申请。自发布公告之日起6个月后,批准的新药上市申请。
S10
药物光安全评价
29.
M7(R1)
评估和控制药物中的DNA活性(致突变)杂质以限制潜在的致癌风险
申请人需在现行技术要求基础上尽早按照ICH指导原则开展研究;自发布公告之日起,6个月后开始的研究,以试验记录时间点为准,按照ICH指导原则执行。
ICHQSEM指导原则有哪些?马上给您列出来
ICHQSEM指导原则有哪些?马上给您列出来一、总目录类别主要内容ICH指导原则数量Quality Guidelines 质量指导原则化工、医药、质量保证相关指导原则44Safety Guidelines 安全性指导原则实验室动物实验等临床前研究相关指导原则16Efficacy Guidelines有效性指导原则人类临床研究相关指导原则30Multidisciplinary Guidelines多学科指导原则内容交叉涉及以上三个分类,不可单独划入任何一类的指导原则59总数149二、分目录2.1质量(Quality Guidelines)编号英文题目中文译文发布时间Q1 Stability/稳定性Q1A(R2): Stability Testing ofNew Drug Substances andProductsQ1A(R2):新型原料药和药品的稳定性测试2003.2.6Q1B: Stability Testing:Photostability Testing of NewDrug Substances and ProductsQ1B: 稳定性测试: 新型原料药和药品的光稳定性测试1996.11.6Q1C: Stability Testing for NewDosage FormsQ1C:新剂型的稳定性1996.11.6测试Q1D: Bracketing and MatrixingDesigns for Stability Testingof New Drug Substances andProductsQ1D :新型原料药和药品稳定性测试的交叉和矩阵设计 2002.2.7Q1E: Evaluation for StabilityDataQ1E :稳定性数据的评价2003.2.6Q1F: Stabilitiy Guidelines_WHO Q1F :WHO 稳定性指导原则2009Q2 Analytical Validation/分析方法验证 Q2(R1): Validation of Analytical Procedures Text and Methodology Q2(R1): 分析过程和方法的确证2005.11 Q3A - Q3DImpurities/杂质Q3A(R2): Impurities in New Drug Substances Q3A(R2): 新型原料药中的杂质问题 2006.10.25Q3B(R2): Impurities in New DrugProductsQ3B(R2): 新型药品中的杂质问题2006.6.2Q3C(R6): Impurities Guideline for Residual Solvents Q3C(R6):杂质:残留溶剂的指导原则2016.10.20Q3D: Guideline for Elemental Impurities Q3D :元素杂质的指导原则2014.12.16Q4 - Q4BPharmacopoeias/药典 Q4B: Evaluation and Recommendation of Pharmacopoeial Texts for Use in the ICH Regions Q4B :ICH 区域所用药典文本的评价和建议2007.11.1Q4B Frequently Asked Questions Q4B :常见问题与解答2012.4.26Q4B Annex 1 (R1): Residue onIgnition/Sulphated Ash General ChapterQ4B 附录1(R1): 关于灼烧残渣/灰分 常规篇2010.9.27Q4B Annex 2 (R1): Test for Extractable Volume of Parenteral Preparations General Chapter Q4B 附录2(R1): 关于注射剂可提取容量测试2010.9.27常规篇Q4B Annex 3 (R1): Test for Particulate Contamination: Sub-Visible Particles General Chapter Q4B 附录3(R1): 关于颗粒污染物测试:不溶性微粒 常规篇2010.9.27Q4B Annex 4A (R1):Microbiological Examination ofNon-SterileProducts: MicrobialEnumeration Tests GeneralChapterQ4B 附录4A(R1):非无菌药品的微生物检查:微生物计数试验 常规篇2010.9.27Q4B Annex 4B (R1):Microbiological Examination ofNon-Sterile Products Tests for Specified Micro-OrganismsGeneral ChapterQ4B 附录4B(R1): 非无菌产品的微生物检查—特定微生物 常规篇 2010.9.27Q4B Annex 4C (R1):Microbiological Examination ofNon-SterileProducts: AcceptanceCriteria for PharmaceuticalPreparations and Substancesfor Pharmaceutical UseGeneral ChapterQ4B 附录4C(R1): 非无菌产品的微生物检查:药物制备以及药物使用物质的接受标准 常规篇2010.9.27Q4B Annex 5 (R1):Disintegration Test General ChapterQ4B 附录5(R1):崩解试验 常规篇2010.9.27Q4B Annex 6 Uniformity of Dosage Units General Chapter Q4B 附录6: 统一剂量单位常规篇2013.11.13Q4B Annex 7 (R2): Dissolution Test General Chapter Q4B 附录7(R2): 溶出试验 常规篇2010.11.11Q4B Annex 8 (R1): Sterility Test General Chapter Q4B 附录8(R1): 无菌2010.9.27试验 常规篇Q4B Annex 9 (R1): Tablet Friability General Chapter Q4B 附录9(R1): 片剂易碎性 常规篇2010.9.27Q4B Annex 10 (R1):Polyacrylamide GelElectrophoresis GeneralChapterQ4B 附录10(R1): 聚丙烯酰胺凝胶电泳 常规篇2010.9.27Q4B Annex 11: Capillary Electrophoresis General Chapter Q4B 附录11:毛细管电泳 常规篇2010.6.9 Q4B Annex 12: AnalyticalSieving General ChapterQ4B 附录12:分析筛选 常规篇 2010.6.9Q4B Annex 13: Bulk Density andTapped Density of Powders General ChapterQ4B 附录13:粉末的堆密度和振实密度 2012.6.7Q4B Annex 14: BacterialEndotoxins Test GeneralChapterQ4B 附录14:细菌内毒素试验 常规篇2012.10.18Q5A - Q5E Quality of Biotechnological Products/生物技术产品质量 Q5A(R1): Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin Q5A(R1):人或者动物细胞系来源的生物技术产品的病毒安全性评估 1999.9.23Q5B: Analysis of the Expression Construct in Cells Used for Production of r-DNA Derived Protein Products Q5B: 关于重组DNA 来源的蛋白质产品生产所用的细胞中表达构建的分析1995.11.30 Q5C: Stability Testing ofBiotechnological/BiologicalProductsQ5C: 生物技术/生物产品的稳定性试验1995.11.3Q5D:Derivationand Q 5D: 用于生1997.7.16Characterisation of Cell Substrates Used for Production of BiotechnologicalBiological Products 产生物技术/生物产品的细胞底物的起源和特征描述Q5E: Comparability of BiotechnologicalBiological Products Subject to Changes in their Manufacturing Process Q5E: 基于不同生产工艺的生物技术产品/生物产品的可比较性2004.11.18 Q6A- Q6BSpecifications/规格 Q6A: Specifications: Test Procedures and Acceptance Criteria for New Drug Substances and New Drug Products: Chemical Substances Q6A: 质量规格:新原料药和药品的检验程序和可接收标准:化学物质 1999.10.6 Q6B: Specifications: TestProcedures and AcceptanceCriteria for Biotechnological/Biological ProductsQ6B: 质量规格:生物技术/生物产品的检验程序和可接收标准1999.3.10Q7 GoodManufacturingPractice/GMP Q7: Good ManufacturingPractice Guide for Active Pharmaceutical Ingredients Q7: 原料药GMP 指南 2000.11.1Q7 Questions and Answers Q7 问答部分2015.6.10Q8 Pharmaceutica l Development/药物研发 Q8(R2): Pharmaceutical DevelopmentQ8(R2): 药物研发 2009.8Q8, Q9 and Q10 Questions & Answers (R4) Q8/Q9/Q10问答部分(R4)2010.11.11Q9 Quality RiskManagement/质量风险管理Q9: Quality Risk ManagementQ9: 质量风险管理 2005.11.09Q10 Pharmaceutical Quality System/药物质量体系Q10: Pharmaceutical Quality System Q10: 药物质量体系2008.6.4Q11 Development and Manufacture of Drug Substances/化Q11: Development and Manufacture of Drug Substances (Chemical Entities and Q11:化学药品的研发与生产(化2012.5.1学药品的研发与生产 Biotechnological/BiologicalEntities)学实体以及生物科技/生物制品)Q11:Questions and AnswersQ11:问答部分 2016.10.132.2安全性(Safety Guidelines)编号英文题目 中文译文 发布时间S1A - S1C Carcinogenicity Studies/致癌性研究S1A: Need for Carcinogenicity Studies of Pharmaceuticals S1A: 药物致癌性的研究需求 1995.11.29 S1B: Testing forCarcinogenicity of PharmaceuticalsS1B: 药物致癌性测试1997.7.16S1C(R2): Dose Selectionfor Carcinogenicity Studies of PharmaceuticalsS1C(R2): 药物致癌性研究的剂量选择2008.3.11S2 GenotoxicityStudies/基因毒性研究S2(R1): Guidance on Genotoxicity Testing and Data Interpretation for Pharmaceuticals Intended for Human Use S2(R1): 关于人用药基因毒性试验和数据解读的指导原则2011.11.9S3A - S3BToxicokinetics andPharmacokinetics/毒代动力学和药代动力学S3A: Note for Guidance onToxicokinetics: TheAssessment of Systemic Exposure inToxicity StudiesS3A :毒理动力学指导原则说明:毒性研究中系统性暴露的评价1994.10.27S3A Implementation Working Group Questions and Answers S3A 实施工作组问答:毒代动力学指导原则说明:毒性研究中的全身暴露量评价集中于微量采样(中文版:征求意见稿)2016.1.19 S3B: Pharmacokinetics Guidance for Repeated Dose S3B :关于重复剂量组织1994.10.27TissueDistribution Studies分布研究的药代动力学指导原则 S4 ToxicityTesting/毒性试验S4: Duration of Chronic Toxicity Testing in Animals (Rodent and Non Rodent Toxicity Testing) S4:动物慢性毒性试验的持续时间(啮齿动物和非啮齿动物毒性试验)1998.9.2S5 Reproductive Toxicology/生殖毒性 S5(R2):Detection ofToxicity to Reproductionfor Medicinal Products &Toxicity to Male FertilityS5(R2): 检测药品的生殖毒性以及对雄性生殖能力的毒性 2000.11S6 Biotechnological Products/生物技术产品 S6(R1): Preclinical SafetyEvaluation ofBiotechnology-Derived PharmaceuticalsS6(R1): 生物科技来源药品的临床前安全性评价2011.6.12S7A - S7B Pharmacology Studies/药理学研究 S7A: SAFETY PHARMACOLOGY STUDIES FOR HUMAN PHARMACEUTICALS S7A :人用药的安全性药理学研究 2000.11.8 S7B: The Non-ClinicalEvaluation of thePotential forDelayed Ventricular Repolarization (QTInterval Prolongation) byHuman PharmaceuticalsS7B :人用药延迟心室复极化(QT 间期延长)潜力的非临床评价2005.5.12S8 Immunotoxicology Studies 免疫毒理学研究 S8: Immunotoxicity Studiesfor Human PharmaceuticalsS8:人用药免疫毒性研究2005.9.15S9 NonclinicalEvaluation forAnticancerPharmaceuticals/抗癌药物的非临床评价S9: Nonclinical Evaluation for Anticancer Pharmaceuticals S9:抗癌药物的非临床评价2009.10.29S9 Implementation Working Group Questions and Answers S9 实施工作组问答部分2016.6.8S10 Photosafety Evaluation/光安全性评价 S10: Photosafety Evaluation of Pharmaceuticals S10:药物的光安全性评价2013.11.132.3有效性(Efficacy Guidelines)编号英文题目中文译文发布时间E1 Clinical Safety for Drugs used in Long-Term Treatment/长期使用的药物的临床安全性 E1: The extent of PopulationExposure to Assess ClinicalSafety for Drugs Intended for Long-term Treatment of Non-life-threateningConditionsE1: 用于评估长期治疗非危及生命性疾病的药物临床安全性的人群暴露程度1994.10.27E2A - E2FPharmacovigilance/药物警戒性E2A: Clinical Safety DataManagement: Definitions and Standards for Expedited ReportingE2A: 临床安全性数据管理:快速报告的定义和标准(中文版:征求意见稿) 1994.10.27E2B(R3):ImplementationGuide for ElectronicTransmission ofIndividual Case SafetyReports (ICSRs) E2B(R3)Data Elements and MessageSpecificationE2B(R3):个例安全报告(ICSR )电子传输执行指导原则 E2B (R3)数据元素和信息规范元素(中文版:征求意见稿) 2016.11.10 E2B(R3) QA document_v2_1 E2B(R3) 问答文件(中文版:征求意见稿) 2017.6.1E2C(R2): Periodic Benefit-Risk Evaluation Report E2C(R2):定期获益—风险2012.12.17间评估报告E2C(R2) Implementation Working Group Questions & Answers E2C(R2)实施工作组问答部分2014.3.31E2D: Post-Approval SafetyData Management: Definitions and Standards for Expedited ReportingE2D: 上市后安全性数据的管理:快速报告的定义和标准(中文版:征求意见稿) 2003.11.12E2E: Pharmacovigilance Planning E2E:药物警戒规性划2004.11.18E2F: Development Safety Update Report E2F: 研发安全性更新报告 2010.8.17E3 Clinical StudyReports/临床研究报告 E3: Structure and Content of Clinical Study Reports E3: 临床研究报告的结构与内容 1995.11.30E3 Questions & Answers(R1) : Structure and Content of Clinical Study ReportsE3 实施工作组 问答部分2012.7.6E4 Dose-Response Studies/剂量反应研究 E4: Dose-Response Information to Support Drug Registration E4: 用于支持药物注册的剂量反应信息 1994.3.10E5 Ethnic Factors/种族因素E5(R1): Ethnic Factors in the Acceptability of Foreign Clinical Data E5(R1):国外临床数据可接受性的种族因素1998.2.5E5 Implementation WorkingGroup Questions & Answers(R1)E5 实施工作组 问答部分(R1)2006.6.2间E6 GCP/药物临床试验管理规范 E6(R1): Guideline for Good Clinical Practice E6(R1):药物临床试验管理规范指导原则 1996.6.10E6(R2):Integrated Addendum to Good Clinical Practice (GCP) E6(R2):药物临床试验管理规范综合附录2016.11.9E7 Clinical Trials inGeriatric Population/老人中开展的临床试验E7: Studies in Support of Special Populations: GeriatricsE7: 特殊人群的支持性研究:老人病学 1993.6.24E7 Questions & AnswersE7 问答部分 2010.7.6E8 GeneralConsiderations for Clinical Trials/临床试验的一般性考虑 E8: General Considerations for Clinical Trials E8: 临床试验的一般性考虑1997.7.17E9 StatisticalPrinciples for Clinical Trials/临床试验的统计原则E9: Statistical Principles for Clinical Trials E9: 临床试验的统计原则1998.2.5E10 Choice of Control Group in Clinical Trials/试验中对照组的选择 E10: Choice of Control Group and Related Issues in Clinical Trials E10: 临床试验中对照组的选择以及相关问题2000.7.20E11 Clinical Trials inPediatric Population/儿童人群临床研究 E11: Clinical Investigation of Medicinal Products in the Pediatric Population E11:儿科人群药物临床试验 2000.7.20E11(R1): Addendum: Clinical Investigation of Medicinal Products in the Pediatric Population E11(R1): 儿科人群药物临床试验补充2017.8.18 E12 Clinical Evaluation by Therapeutic Category/根据治疗类别进行临床评价 E12: Principles for Clinical Evaluation of New Antihypertensive Drugs E12: 新型抗高血压药物的临床评价原则2000.3.2间E14 Clinical Evaluationof QT/QT 临床评价E14: The Clinical Evaluation of QT/QTc Interval Prolongation and Proarrhythmic Potential for Non-Antiarrhythmic Drugs E14:非抗心律失常药物QT/QTc 间期延长及致心律失常潜力的临床评价2005.5.12E14 Implementation Working Group Questions & Answers (R3) E14 实施工作组 问答部分(R3)2015.12.10 E15 Definitions in Pharmacogenetics/Pharmac ogenomics/药物基因组学以及遗传药理学相关定义 E15: Definitions for Genomic Biomarkers, Pharmacogenomics, Pharmac ogenetics, Genomic Data and Sample Coding Categories E15: 基因组生物标志物、药物基因组学、遗传药理学、基因组数据以及样本编码分类的定义2007.11.1 E16 Qualification of Genomic Biomarkers/基因组生物标志物的合格条件 E16: Biomarkers Related to Drug or Biotechnology Product Development: Context, Structure and Format of Qualification Submissions E16:与药物或生物制品研发相关的生物标志物:资质提交材料的背景、结构以及格式2010.8.20 E17 Multi-Regional Clinical Trials/多地区临床试验 E17: General principle on planning and Designing Multi-Regional Clinical Trials E17:计划和设计多地区临床试验的一般性原则2016.5.6 E18 Genomic Sampling/基因组取样 E18: Genomic Sampling and Management of Genomic Data E18:基因组采样和基因组数据管理指导原则(中2015.12.10间文版:征求意见稿)2.4多学科(MultidisciplinaryGuidelines)编号 英文题目中文译文 发布时间M1 MedDRA Terminology 监管活动医学词典 MedDRA Data Retrieval and Presentation: Points to Consider MedDRA 数据检索与呈现: 考虑要点(中文版:征求意见稿) 2017.9.1 MedDRA Term Selection: Points to Consider MedDRA 术语选择: 考虑要点(中文版:征求意见稿)2017.9.1 M2 Electronic Standards 电子标准 ICH M2 EWG Work Plan M2专家工作组工作计划2017.3.27 M2: ElectronicStandards for the Transfer of Regulatory Information Final Concept PaperM2监管信息转移的电子标准终版概念文件1994.10.27 ElectronicTransmission of Individual Case Safety Reports Message Specification个例病例安全性报告的电子传输信息规范 2000.11.9 ICH M2 EWG The eCTDBackbone File Specification for Study Tagging FileseCTD 研究标签文件主文件规范2008.6.3 Electronic Standardsfor the Transfer of Regulatory Information (ESTRI) General Recommendation -Procedure监管信息转移的电子标准一般性建议—程序 2015.6.11 Electronic Standards for the Transfer of Regulatory Information (ESTRI) General Recommendation – ESTRI 监管信息转移的电子标准一般性建议—ESTRI 网关 2015.6.11Gateway Electronic Standardsfor the Transfer of Regulatory Information (ESTRI) File Format Recommendation – PDF监管信息转移的电子标准文件格式建议—PDF2011.4.5Electronic Standardsfor the Transfer of Regulatory Information (ESTRI) File Format Recommendation – XML监管信息转移的电子标准文件格式建议—XML2005.11.10 Electronic Standardsfor the Transfer of Regulatory Information (ESTRI) File Format Recommendation – PDF/A监管信息转移的电子标准文件格式建议—PDF/A2014.6.2Electronic Standardsfor the Transfer of Regulatory Information (ESTRI) File Format Recommendation – DOCX监管信息转移的电子标准文件格式建议—DOCX2015.6.11Electronic Standardsfor the Transfer ofRegulatory Information (ESTRI) Controlled Vocabularies Recommendation -Genericode监管信息转移的电子标准控制词汇建议—代码2015.6.11Electronic Standardsfor the Transfer of Regulatory Information (ESTRI) Information Transfer Recommendation – EDIINT AS1/AS2监管信息转移的电子标准信息转移建议—EDIINT AS1/AS22010.6.10Electronic Standardsfor the Transfer of Regulatory Information (ESTRI) File Integrity – MD5监管信息转移的电子标准文件完整性—MD52010.6.10Electronic Standards for the Transfer of 监管信息转移的电子标准文件完2015.6.11Regulatory Informaation (ESTRI) File IntegrityRecommendation - SHA-256整性建议—SHA-256M2 Glossary of Terms and Abbreviations M2术语和简写词汇表2015.6.11 ICH M2 File Format Criteria M2文件格式标准 2014.11.10Use of OIDs & UUIDs in ICH Messages OIDs & UUIDs 在ICH 信息中的使用2015.6.11 M3 Nonclinical Safety Studies 非临床研究 M3(R2) Questions and Answers (R2)M3(R2)问答 (R2) 2012.3.5 M3(R2): Guidance onNonclinical Safety Studies for the Conduct of Human Clinical Trials and Marketing Authorization for PharmaceuticalsM3(R2):关于实施药物人体临床试验以及上市批准非临床安全性研究的指导原则2009.6.11M4 : The Common Technical Document 通用技术文件 M4 (R4): Organization of the Common Technical Document for the Registration of Pharmaceuticals for Human UseM4(R4):人用药物注册通用技术文档的组织(中文版:征求意见稿) 2016.6.15 M4 Implementation Working Group Questions & Answers (R3) M4执行工作组问答(R3)(中文版:征求意见稿) 2004.6.10 The Common Technical Document for the Registration of Pharmaceuticals for Human Use: Quality – M4Q(R1)M4Q (R1):人用药物注册通用技术文档:药学部分(中文版:征求意见稿) 2002.9.12 M4Q Implementation Working Group Questions & Answers (R1) M4Q 执行工作组问答(R1)(中文版:征求意见稿)2003.7.17 The Common Technical Document for the M4S (R2):人用药物注册通用技2002.12.2Registration of Pharmaceuticals for Human Use: Safety – M4S(R2)术文档:安全性部分(中文版:征求意见稿)M4S Implementation Working Group Questions & Answers (R4) M4S 执行工作组问答 (R4)(中文版:征求意见稿)2003.11.11 Efficacy- M4E(R2) M4E (R2):人用药物注册通用技术文档:有效性部分(中文版:征求意见稿)2016.6.15M4E Implementation Working Group Questions & Answers (R4) M4E 执行工作组问答(R4)(中文版:征求意见稿)2004.6.10 M5 Data Elements and Standards for Drug Dictionaries 药物词典的数据要素和标准 The Re-development ofthe Standard forE2B(R3) and the Development of Standards for the Identification of Medicinal Products(IDMP)(ICH M5)ICH M5:E2B(R3)标准的再制定及医药产品鉴定标准的制定2010.11.1 ICH E2B(R3)Implementation Working Group ICH E2B(R3) Guideline: Electroni c Transmission of Individual Case Safety Reports (ICSRs) E2B(R3)实施工作组个例病例安全报告的电子传输问答部分 2016.11.10 Appendix I (B) to theImplementation Guide for Electronic Transmission of Individual Case SafetyReports (ICSRs)个例病例安全报告的电子传输实施指南附录 I (B) 2016.11.10 Appendix I (G) to theImplementation Guide for Electronic Transmission of Individual Case Safety个例病例安全报告的电子传输实施指南附录 I (G)2016.11.10Reports (ICSRs) Implementation Guidefor Electronic Transmission of Individual Case Safety Reports(ICSRs)个例病例安全报告的电子传输实施指南 2016.11.10 M6 Gene Therapy 基因治疗 Final Concept Paper M6: Guideline on Virus and Gene Therapy Vector Shedding and TransmissionM6: 病毒和基因治疗载体的脱落和传播终版概念文件 2009.8.26 General Principles to Address Virus and Vector Shedding 解决病毒和基因治疗载体脱落的基本原则 2009.6An inventory of shedding data from clinical gene therapy trials临床基因疗法试验脱落数据目录2007.7.30 Final Business Plan M6: Guideline on Virus and Gene Therapy Vector Shedding and TransmissionM6: 病毒和基因治疗载体的脱落和传播终版业务计划 2009.8.27 M7 Genotoxic Impurities 遗传毒性杂质 M7: Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk M7:评估和控制药物中的DNA 活性(致突变)杂质以限制潜在的致癌风险 2014.6.23 M7(R1): Addendum to M7: Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic RiskM7(R1): 评估和控制药物中 DNA 反应性(致突变)杂质以限制潜在的致癌风险(中文版:征求意见稿) 2017.3.31 M8 Electronic Common Technical Document (eCTD) 电子通用技术文件 Electronic Common Technical Document Specification V3.2.2电子通用技术文件规范 V3.2.2 2008.7.16 M8 : Electronic Common M 8: 电子通用2015.12.9Technical Document Concept Paper 技术文件概念文件ICH M8 EWG/IWG Work Plan M8: 电子通用技术文件工作计划2017.3.13 Support Documentation for M8: eCTD EWG eCTD v4.0 Implementation Package v1.2 M8:eCTD 专家工作组eCTD v4.0实施包 v1.2 支持性证明文件2016.11 Orientation Material forM8: eCTD EWG eCTD v4.0 Implementation Package v1.2 M8:eCTD 专家工作组eCTD v4.0实施包 v1.2 培训材料2016.11 ICH Electronic CommonTechnical Document (eCTD) v4.0 Implementation Guidev1.2ICH eCTD v4.0 实施指南 v1.2 2016.11.10 eCTD v4.0 Implementation Package v1.2eCTD v4.0 实施包 v1.2 USFDA eCTD v4.0 Implementation Package History v1.1 美国FDA eCTDv4.0 实施包历史 v1.1USFDA Module 1Electronic Common Technical Document (eCTD) v4.0 ImplementationGuide v1.1美国FDA 模块1 eCTD v4.0 实施指南 v1.1 2017.2.20 ICH eCTD v4.0 Requirements ICH eCTD v4.0 要求ICH M8 Expert WorkingGroup Specification for Submission Formats for eCTDeCTD 提交格式规范 2016.11.1Change Control Process for the eCTD eCTD 变更控制过程2017.4 Request for change 请求变更表M9 Biopharmaceutic s Classification System-based M9: Biopharmaceutics Classification System-based Biowaivers Final M9:基于生物药剂学分类系统的生物豁免业务计2016.10.7Biowaivers 基于生物药剂学分类系统的生物豁免 endorsed Business Plan划ICH M9 EWG Work Plan M9 专家工作组工作计划2017.2.9 M9: Biopharmaceutics Classification System-based Biowaivers Final endorsed Concept PaperM9:基于生物药剂学分类系统的生物豁免概念文件 2016.10.7 M10 Bioanalytical Method Validation 生物样品分析的方法验证 M10: Bioanalytical Method Validation Final endorsed Business Plan M10: 生物样品分析的方法验证业务计划 2016.10.7ICH M10 EWG Work Plan M10: 专家工作组工作计划 2017.3.10 M10: Bioanalytical Method Validation Final endorsed Concept Paper M10: 生物样品分析的方法验证概念文件2016.10.7文章来源:龙腾整理。
新药研发临床前安全性评价
新药研发临床前安全性评价新药研发临床前安全性评价是一项非常重要的工作,它旨在评估新药在人体内使用的安全性,以确保新药在进入临床试验阶段之前不会对患者造成不必要的风险。
新药研发临床前安全性评价可以分为临床前药理学评价、安全性毒理学评价和药代动力学评价。
首先,临床前药理学评价是评估新药在体内作用机制和药理学特性的重要步骤。
通过临床前药理学评价可以确定新药的药物靶点、作用途径和药物代谢途径,并预测其在人体内可能的药效和药效学特性。
临床前药理学评价通常通过体外实验和动物实验进行,包括分子生物学实验、细胞实验、动物模型实验等。
通过这些实验的结果,可以初步判断新药的效能和安全性。
其次,安全性毒理学评价是评估新药在动物体内是否具有潜在的毒性和不良反应的重要步骤。
安全性毒理学评价通常包括急性毒性实验、亚急性毒性实验和慢性毒性实验等。
这些实验通过给动物不同剂量的新药进行观察和检测,评估新药对动物器官、组织和生理功能的影响。
此外,还会进行生殖毒性实验和致癌性实验等,以评估新药对动物繁殖能力和致癌潜能的影响。
通过安全性毒理学评价,可以初步判断新药是否具有潜在的毒性和安全性问题。
最后,药代动力学评价是评估新药在体内代谢和排泄过程中的动力学参数的重要步骤。
药代动力学评价包括吸收动力学、分布动力学、代谢动力学和排泄动力学等。
通过对新药在体内的代谢和排泄过程进行动力学研究,可以了解新药在体内的药物浓度和药代动力学参数,判断其在人体内的药效和安全性。
药代动力学评价通常通过体外实验和动物实验进行,包括体外代谢实验、体外药代动力学实验和动物药代动力学实验等。
总之,新药研发临床前安全性评价是一个多方面、多学科的综合工作,需要结合临床前药理学评价、安全性毒理学评价和药代动力学评价等方面的研究结果。
只有通过全面、科学和严格的评价,才能确保新药在进入临床试验阶段之前的安全性,为新药研发的后续工作提供可靠的依据。
ICH-指导原则文件目录
ICH 的论题主要分为四类,因此ICH 根据论题的类别不同而进行相应的编码分类:1.“Q”类论题:Q 代表QUALITY,指那些与化工和医药,质量保证方面的相关的论题。
Q1/Q2...Q10 都属于这种。
2.“S”类论题:S 代表SAFETY,指那些与实验室和动物实验,临床前研究方面的相关的论题。
3.“E”类论题:E 代表EFFICACY ,指那些与人类临床研究相关的课题。
4.“M”类论题:M 代表MULTIDISCIPLINARY,指那些不可单独划入以上三个分类的交叉涉及的论题。
1. Q1A(R2): Stability Testing of New Drug Substances and Products新原料药和制剂的稳定性试验2. Q1B: Photostability Testing of New Drug Substances and Products新原料药和制剂的光稳定性试验3. Q1C: Stability Testing for New Dosage Forms新剂型的稳定性试验4. Q1D: Bracketing and Matrixing Designs for Stability Testing of Drug Substances and DrugProducts原料药和制剂稳定性试验的交叉和矩阵设计5. Q1E: Evaluation of Stability Data稳定性数据的评估6. Q1F: Stability Data Package for Registration Applications in Climatic Zones III and IV在气候带III 和IV,药物注册申请所提供的稳定性数据7. Q2(R1): Validation of Analytical Procedures: Text and Methodology分析程序的验证:正文及方法论8. Q3A(R2): Impurities in New Drug Substances新原料药中的杂质9. Q3B(R2): Impurities in New Drug Products (Revised Guideline)新制剂中的杂质10. Q3C(R5): Impurities: Guideline for Residual Solvents杂质:残留溶剂指南11. Q3C(R6): Impurities: Guideline for Residual SolventsPDE for Triethylamine and PDE for Methylisobutylketone杂质:残留溶剂指南三乙胺的日允许接触剂量及甲基异丁基酮的日允许接触剂量12. Q3D: Guideline for Elemental impurities主要杂质指南13. Q4A: Pharmacopoeial Harmonisation 药典的协调14. Q4B: Evaluation and Recommendation of Pharmacopoeial Texts for Use in the ICH RegionsICH 地区使用的药典正文评估和建议15. Q4B Annex1(R1) Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Residue on Ignition/Sulphated Ash General Chapter附录1 ICH 地区使用的药典正文评估和建议灼烧残渣/灰分通则16. Q4B Annex2(R1) Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Test for Extractable Volume of Parenteral Preparations General Chapter附录2 ICH 地区使用的药典正文评估和建议注射剂可提取体积测试通则17. Q4B Annex3(R1) Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Test for Particulate Contamination: Sub-Visible Particles General Chapter 附录3 地区使用的药典正文评估和建议颗粒污染物测试:不溶性微粒通则18. Q4B ANNEX 4A(R1) Evaluation and Recommendation of Pharmacopoeial Texts for Use inthe ICH Regions on Microbiological Examination of Non-sterile Products :Microbial Enumerations Tests General Chapter附录4A(R1) 地区使用的药典正文评估和建议非无菌产品微生物检验:微生物计数法通则19. Q4B ANNEX 4B(R1) Evaluation and Recommendation of Pharmacopoeial Texts for Use inthe ICH Regions on Microbiological Examination of Non-sterile Products :Test for Specified Micro-organisms General Chapter附录4B(R1) 地区使用的药典正文评估和建议非无菌产品微生物检验:控制菌检查法通则20. Q4B ANNEX 4C(R1) Evaluation and Recommendation of Pharmacopoeial Texts for Use inthe ICH Regions on Microbiological Examination of Non-sterile Products :Acceptance Criteria For Pharmaceutical Preparations and Substances for Pharmaceutical Use General Chapter附录4C(R1) 地区使用的药典正文评估和建议非无菌产品微生物检验:药物制剂及原料药的认可标准通则21. Q4B ANNEX 5(R1) Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Disintegration Test General Chapter附录5(R1) ICH 地区使用的药典正文评估和建议崩解试验通则22. Q4B ANNEX 6 Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Uniformity of dosage units General Chapter附录6 ICH 地区使用的药典正文评估和建议含量均匀度通则word 格式-可编辑-感谢下载支持23. Q4B ANNEX 7(R2) Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Dissolution Test General Chapter附录7(R2) ICH 地区使用的药典正文评估和建议溶解度测试通则24. Q4B ANNEX 8(R1) Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Sterility Test General Chapter附录8(R1) ICH 地区使用的药典正文评估和建议无菌检查通则25. Q4B ANNEX 9(R1) Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Tablet Friability General Chapter附录9(R1) ICH 地区使用的药典正文评估和建议片剂脆碎度检查通则26. Q4B ANNEX 10(R1) Evaluation and Recommendation of Pharmacopoeial Texts for Use inthe ICH Regions on Polyacrylamide Gel Electrophoresis General Chapter附录10(R1) ICH 地区使用的药典正文评估和建议聚丙烯酰胺凝胶电泳通则27. Q4B ANNEX 11 Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Capillary Electrophoresis General Chapter附录11 ICH 地区使用的药典正文评估和建议毛细管电泳通则28. Q4B ANNEX 12 Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Analytical Sieving General Chapter附录12 ICH 地区使用的药典正文评估和建议分析筛选通则29. Q4B ANNEX 13 Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Bulk Density and Tapped Density of Powders General Chapter附录13 ICH 地区使用的药典正文评估和建议粉末的松密度与密切度30. Q4B ANNEX 14 Evaluation and Recommendation of Pharmacopoeial Texts for Use in theICH Regions on Bacterial Endotoxins Test General Chapter附录14 ICH 地区使用的药典正文评估和建议细菌内毒素检测通则31. Q5A(R1): Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines ofHuman or Animal Origin来源于人或者动物细胞系的生物技术产品的病毒安全性评估32. Q5B: Quality of Biotechnological Products: Analysis of the Expression Construct in CellsUsed for Production of r-DNA Derived Protein Products生物技术产品的质量:rDNA 衍生蛋白质产品生产细胞的表达构建体分析33. Q5C: Quality of Biotechnological Products: Stability Testing of Biotechnological/BiologicalProducts生物技术产品的质量:生物技术产品/生物制品的稳定性试验34. Q5D: Derivation and Characterization of Cell Substrates Used for Production ofBiotechnological/Biological Products用于生产生物技术产品/生物制品的细胞基质的来源和鉴定35. Q5E: Comparability of Biotechnological/Biological Products Subject to Changes in TheirManufacturing Process生产工艺变更后生物技术产品/生物制品的可比性质量标准36. Q6A: Specifications: Test Procedures and Acceptance Criteria for New Drug Substances andNew Drug Products: Chemical Substances (including decision trees)规范:新原料药和新制剂的检测方法和可接收标准:化学物质(包括决定过程)37. Q6B: Specifications: Test Procedures and Acceptance Criteria for Biotechnological/BiologicalProducts规范:生物技术产品/生物制品的检验方法和可接收标准38. Q7A: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients药物活性成份的GMP 指南39. Q8(R2): Pharmaceutical Development药物开辟40. Q9: Quality Risk Management质量风险管理41. Q10: Pharmaceutical Quality System药物质量体系42. Q11:Development and Manufacture of Drug Substances (Chemical Entities andBiotechnological/Biological Entities)原料药的开辟与创造(化学实体与生物技术/生物制品实体)1. S1A: Guideline on the Need for Carcinogenicity Studies of Pharmaceuticals药物致癌试验的必要性2. S1B: Testing for Carcinogenicity of Pharmaceuticals药物致癌试验3. S1C(R2): Dose Selection for Carcinogenicity Studies of Pharmaceuticals药物致癌试验的剂量选择4. S2(R1) : Guidance on Genotoxicity Testing and Data Interpretation for PharmaceuticalsIntended for Human Use人用药物的遗传毒性试验和数据分析指导原则5. S3A: Note for Guidance on Toxicokinetics: The Assessment of Systemic Exposure in ToxicityStudies毒物代谢动力学指南的注释:毒性研究中全身暴露的评价6. S3B: Pharmacokinetics: Guidance for Repeated Dose Tissue Distribution Studies药物代谢动力学:重复给药的组织分布研究指导原则7. S4: Duration of Chronic Toxicity Testing in Animals (Rodent and Non Rodent ToxicityTesting)动物体内慢性毒性持续时间的检验(啮齿类和非啮齿类毒性试验)8. S5(R2) : Detection of Toxicity to Reproduction for Medicinal Products and Toxicity to MaleFertility药品的繁殖毒性检测及雄性生育力毒性9. S6: Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals生物技术药品的临床前安全性试验10. S7A: Safety Pharmacology Studies for Human Pharmaceuticals人用药物的安全性药理研究11. S7B: The Non-clinical Evaluation of the Potential for Delayed Ventricular Repolarization (QTInterval Prolongation) by Human Pharmaceuticals 人用药延迟心室复极化(QT 间期延长) 潜在作用的非临床评价指导原则12. S8: Immunotoxicity Studies for Human Pharmaceuticals人用药品的免疫毒理学研究13. S9: Nonclinical Evaluation for Anticancer Pharmaceuticals抗癌药物的临床前评价14. S10: Photosafety Evaluation of Pharmaceuticals药物的光安全评价1. E1: The Extent of Population Exposure to Assess Clinical Safety for Drugs Intended forLong-Term Treatment of Non-Life-Threatening Conditions对非危及生命的疾病的长期治疗药物进行临床安全性评估的人群暴露程度2. E2A: Definitions and Standards for Expedited Reporting快速报告的定义和标准3. E2C(R2): Periodic Benefit-Risk Evaluation Report上市药品定期风险效益评估报告4. E2D: Post-Approval Safety Data Management: Definitions and Standards for ExpeditedReporting 批准后安全性数据管理:快速报告的定义和标准5. E2E: Pharmacovigilance Planning 药物警戒计划6. E2F: Development Safety Update Report 安全性更新报告7. E3: Structure and Content of Clinical Study Reports临床研究报告的结构与内容8. E4: Dose-Response Information to Support Drug Registration新药注册所需量-效关系的资料9. E5(R1): Ethnic Factors in the Acceptability of Foreign Clinical Data对国外临床研究资料的种族因素的可接受性10. E6(R1): Good Clinical Practice: Consolidated Guideline药品临床研究规范(GCP)一致性指导原则11. E6(R2): Integrated Addendum to ich E6(R1): Guideline for Good Clinical Practice E6(R1)整合的附录:药品临床研究规范指南12. E7: Studies in Support of Special Populations: Geriatrics老年人群的临床研究13. E8: General Considerations for Clinical Trials临床研究总则14. E9: Statistical Principles for Clinical Trials临床研究统计原则15. E10: Choice of Control Group and Related Issues in Clinical Trials临床研究对照组的选择及相关问题16. E11: Clinical Investigation of Medicinal Products in the Pediatric Population儿童人群的临床研究17. E12: Principles for Clinical Evaluation of New Antihypertensive Drugs抗高血压新药的临床评价指导原则18. E14: The Clinical Evaluation of QT/QTc Interval Prolongation and ProarrhythmicPotential for Non-Antiarrhythmic Drugs非抗心律失常药物致QT/QTc 间期延长及潜在心律失常作用的临床评价19. E15: Definitions for Genomic Biomarkers, Pharmacogenomics, Pharmacogenetics, GenomicData and Sample Coding Categories基因组生物标记物、药物基因组学、遗传药理学、基因组数据和样本编码分类的定义20. E16: Biomarkers Related to Drug or Biotechnology Product Development: Context, Structureand Format of Qualification Submissions与药物或者生物技术产品相关的生物标记物研发: 申请资料的内容、结构和格式21. E17: General principle on planning/designing Multi-Regional Clinical Trials规划多地区临床试验的普通原则22. E18: Guideline on Genomic Sampling and Management of Genomic Data基因组数据采集与管理的指导原则1. M3: Guidance on Nonclinical Safety Studies for the Conduct of Human Clinical Trials andMarketing Authorization for Pharmaceuticals药物进行人体临床试验和上市许可申请的临床前安全性研究指导原则2. M4(R3): Organisation of the Common Technical Document for the Registration ofPharmaceuticals for Human Use人用药物注册申请的通用技术文件组织结构3. M4E(R1): The Common Technical Document for Registration of Pharmaceuticals for HumanUse Clinical人用药物注册申请的通用技术文件:临床4. M4E(R2): Revision of M4E Guideline on Enhancing Format and Structure of Benefit-riskInformation in ICH EfficacyM4E 指南修订,优化临床研究风险评估的格式与结构5. M4Q(R1): The Common Technical Document for the Registration of Pharmaceuticals forHuman Use: Quality人用药物注册申请的通用技术文件:质量6. M4S(R2): The Common Technical Document for the Registration of Pharmaceuticals forHuman Use: Safety人用药物注册申请的通用技术文件:安全性7. M4E(R1): The Common Technical Document for the Registration of Pharmaceuticals forHuman Use: Efficacy人用药物注册申请的通用技术文件:有效性8. M7: Assessment and Control of DNA Reactive (Mutagenic) Impurities in Pharmaceuticals toLimit Potential Carcinogenic Risk为限制潜在致癌风险而对药物中DNA 活性(诱变性)杂质进行的评估和控制。
药研发临床前安全性评价
生物制品
小分子化合物
*
广州蓝韵医药研究有限公司 专注中药新药及保健食品研发技术服务
谢谢!
*
鼠伤寒沙门氏菌营养缺陷型回复突变试验 (Ames试验) 阴性及阳性对照 S9代谢激活 中国仓鼠肺成纤维细胞(CHL)染色体畸变试验 空白、溶剂、阳性对照 S9代谢激活 啮齿动物(小鼠)微核试验 阴性及阳性对照
遗传毒性(致突变)研究
生殖毒性研究
*
致癌性研究
创新药
小鼠肿瘤诱发试验
短期致癌试验
TWO
急性毒性研究
一次或24小时内多次给予
动物
阴性对照组
给药途径
判断安全范围
*
急性毒性研究
最大无反应剂量 未见反应剂量(NOEL) :No Observed Effect Level 未见不良反应剂量(NOAEL): No Observed Adverse Effect Level 最小毒性反应剂量 最大耐受量(MTD):Maximal Tolerance Dose 最小致死剂量(MLD):Minimal Lethal Dose 半数致死量(LD50):Median Lethal Dose
尿液分析指标:9项(非啮齿类)
体温、血压、呼吸、心电图及眼科检查(非啮 齿类)
组织病理学检查
脏器系数:12项
组织病理学检查:30项(非啮齿类33项)
恢复期
*
局部用药特殊毒性研究
刺激性 给药部位的可逆性炎症改变 过敏性(变态反应或超敏反应) 特异性免疫反应,表现为组织损伤或生理功能紊乱,异常或病理性的 Ⅰ型,快发或速发过敏型,IgE介导 Ⅱ型,细胞毒型或溶细胞型,IgG介导 Ⅲ型,免疫复合物型或血管炎型,IgG、IgM介导 Ⅳ型,迟发型或结核菌素型,T淋巴细胞介导 光敏性 光毒性(光刺激性) 光过敏性(光变态反应) ——Ⅳ型变态反应 溶血性 溶血及红细胞凝聚 免疫性溶血——Ⅱ型和 Ⅲ型过敏反应 非免疫性溶血
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人用药品注册技术要求国际协调会ICH三方协调指导原则生物技术药物的临床前安全性评价S6(R1)1997年7月16日总指导原则现行第四阶段版本2011年6月底整合2011年6月12日的附录本指导原则由相应的ICH专家小组制定,按照ICH进程,已递交管理部门讨论。
在ICH进程第四阶段,最终草案被推荐给欧盟、日本和美国的管理机构采纳。
生物技术药物的临床前安全性评价ICH三方协调指导原则目录第I部分: (1)1.前言 (1)1.1背景 (1)1.2目的 (1)1.3范围 (1)2.受试物的质量标准 (2)3.临床前安全性试验 (2)3.1 一般原则 (2)3.2生物活性/药效学 (3)3.3动物种属/模型选择 (3)3.4动物的数量/性别 (4)3.5给药途径/剂量选择 (4)3.6免疫原性 (4)4.特殊考虑 (5)4.1安全药理学 (5)4.2暴露评价 (5)4.2.1药代动力学和毒代动力学 (5)4.2.2测定 (6)4.2.3代谢 (6)4.3单次给药毒性研究 (6)4.4重复给药毒性研究 (6)4.5免疫毒性研究 (7)4.6生殖能力和发育毒性研究 (7)4.7遗传毒性研究 (7)4.8致癌性研究 (7)4.9局部耐受性研究 (8)注释 (8)第II部分: (9)1.前言 (9)1.1附录目的 (9)1.2背景 (9)1.3指导原则的范围 (9)2.种属的选择 (10)2.1一般原则 (10)2.2一或两个种属 (10)2.3同源蛋白的使用 (11)3.研究设计 (11)3.1剂量选择和PK/PD原则的应用 (11)3.2研究期限 (11)3.3恢复 (11)3.4探索性临床研究 (12)4.免疫原性 (12)5.生殖和发育毒性 (12)5.1一般评论 (12)5.2生育能力 (13)5.3胚胎–胎儿发育(EFD)和出生前/后的发育(PPND) (13)5.4研究的时间安排 (14)6. 致癌性 (14)注释 (15)参考文献 (18)第I部分:生物技术药物的临床前安全性评价ICH三方协调指导原则在1997年7月16日的ICH指导委员会会议上进入ICH进程第四阶段,本指导原则被推荐给三方ICH管理机构采纳。
1. 前言1.1 背景生物技术药物(生物药物)的开发始于20世纪80年代初。
80年代后期批准了第一个上市许可。
对于生物技术药物的安全性评价,不同的管理机构已发布了一些指导原则和考虑要点文件。
管理机构对这些文件的回顾,可能会为开发新生物药物提供有用的背景资料。
目前,生物药物的申报已积累了大量的经验。
对这些经验的重要回顾,为本指导原则的制定奠定了基础。
本文的目的在于为设计科学合理的临床前安全性评价试验提供总体原则。
1.2 目的目前,欧盟、日本和美国对于生物技术药物的监管标准基本一致。
三方均采用灵活、个案处理和基于科学的方法评价临床前安全性,支持临床开发和上市许可。
在这一快速发展的科学领域,需要地区之间达成共识并且保持持续对话。
临床前安全性评价的主要目的是:1)确定人体使用的安全起始剂量和随后的剂量递增方案;2)确定潜在毒性靶器官并研究这种毒性是否可逆;以及3)确定临床监测的安全性参数。
本文件提供的原则旨在提高支持性临床前安全性数据的质量和一致性,以利于生物药物的开发。
1.3 范围本指导原则的主要目的是推荐一种评价生物技术药物临床前安全性的基本模式,适用于采用多种表达系统的已鉴定细胞(如细菌、真菌、昆虫、植物和哺乳动物细胞)所制备的产品。
这些产品可用于体内诊断、治疗或预防。
其活性物质包括蛋白质、多肽及其衍生物或由其组成的产品;它们可能是细胞培养衍生物,或者采用重组DNA技术,包括通过转基因植物和动物生产的产品。
例如(包括但不限于):细胞因子、纤维蛋白溶酶原激活因子、重组血浆因子、生长因子、融合蛋白、酶、受体、激素和单克隆抗体。
本文中的原则可能也适用于重组DNA蛋白疫苗、化学合成多肽、血浆衍生产品、从人组织提取的内源性蛋白和寡核苷酸药物。
本文件适用范围不包括抗生素、变应原提取物、肝素、维生素、血细胞成分、常规的细菌Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals 或病毒疫苗、DNA疫苗或者细胞和基因疗法。
2. 受试物的质量标准安全性考虑可能涉及药物中存在的杂质或污染物。
最好通过纯化处理去除杂质和污染物,而不是为确保其质量建立一套临床前研究计划。
在任何情况下,都应该充分确证产品的特征,以便对临床前安全性研究进行合理设计。
宿主细胞如细菌、酵母、昆虫、植物和哺乳动物细胞的污染存在潜在的危险性。
宿主细胞污染物可导致过敏反应和其他免疫病理学反应。
理论上有与核酸污染物相关的不良反应,但也存在整合到宿主细胞基因组的可能性。
源于昆虫、植物和哺乳动物细胞或转基因植物和动物的产品,还可能有额外的病毒感染风险。
一般来讲,用于正规药理和毒理试验的产品应与拟用于初期临床试验的产品具有可比性。
但是,在药物开发进程中允许为提高产品的质量和产量进行正常的生产工艺改进。
但应考虑这种变更对于动物试验结果外推至人体的可能影响。
在药物开发过程中,如果采用了一种新的或改进的生产工艺,或者产品或处方出现了重大变更时,应证明产品的可比性。
可比性评价可基于生化和生物学特征(即鉴别、纯度、稳定性和效价)。
有些情况下可能需要进行附加研究(即药代动力学、药效学和/或安全性研究)。
应阐明所用方法的科学合理性。
3. 临床前安全性试验3.1 一般原则临床前安全性研究的目的在于解释人体研究启动前至整个临床开发过程中的药理学和毒理学作用。
体外和体内研究都有助于确定这种特性。
对于那些在结构和药理作用上与已大量临床使用的产品类似的生物药物,可酌情减少毒性试验。
临床前安全性试验应考虑:1)相关动物种属的选择;2)年龄;3)生理状态;4)给药方式,包括剂量、给药途径和给药方案;5)受试品在使用条件下的稳定性。
毒性试验应遵循药物非临床试验质量管理规范(GLP);但因为有些生物药物往往需要采用特殊试验系统,可能无法完全符合GLP的要求。
应区分不符合GLP的条件,并且评价其相对于总体安全性评价的相对意义。
在某些情况下,不完全符合GLP要求并不一定意味着这些试验Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals数据不能用于支持临床试验和上市许可。
药物毒性试验的常规方法不一定适用于生物药物,因为后者结构和生物学性质具有专一性和多样性,包括种属特异性、免疫原性和非预期的多功能活性。
3.2 生物活性/药效学生物活性可用体外测定法评价,以确定产品的何种作用及与临床药效的相关性。
细胞系和/或原代细胞培养的应用,可能有助于检测药物对细胞表型和增殖的直接作用。
因为许多生物技术药物具有种属特异性,选择相关动物种属进行毒性试验非常重要。
哺乳动物细胞系可用于预测体内活性的特异性,并且可以定量评价生物药物对不同种属(包括人类)的相对灵敏度。
设计此类试验可测定受体结合、受体亲和力和/或药理作用,帮助选择合适的动物种属进行进一步的体内药理和毒理试验。
综合考虑体外和体内试验结果有助于将发现的情况外推至人体。
评价药理作用的体内研究,包括作用机理的解释,通常用于支持临床研究中产品拟定用途的合理性。
对于单克隆抗体,应详细描述抗体的免疫学特性,包括抗体的抗原特异性、补体结合、对人非靶组织的任何非预期反应和/或细胞毒性。
应采用适当的免疫组织化学方法在一系列的人组织上进行此类交叉反应试验。
3.3 动物种属/模型选择由于许多生物技术药物的生物学活性与种属和/或组织特异性相关,通常无法在常用种属(如大鼠和犬)中进行标准的毒性试验,而应使用相关种属动物。
所谓相关种属,是指受试物在此类动物上,由于受体或抗原决定簇(对单克隆抗体而言)的表达,能产生药理学活性。
可以使用多种技术(如免疫化学或者功能试验)确定相关种属。
有关受体/抗原决定簇分布的知识,有助于更多的了解潜在的体内毒性。
用于单克隆抗体试验的相关动物种属应能表达所预期的抗原决定簇,并能证明其与人体组织具有类似的组织交叉反应。
这将使评价结合抗原决定簇所致毒性和任何非预期组织交叉反应的能力显著提高。
如果能证明非预期的组织交叉反应与人体相似,即使是一种不表达预期抗原决定簇的动物种属,对毒性评价仍有一定意义。
安全性评价项目中一般应包括两种相关种属的动物,但在某些已经证明合理的情况下(如只能确定一种相关种属的动物,或对该生物药物的生物学活性已经十分了解),一种相关种属可能已足够。
此外,即使短期毒性研究中必须用两种动物确定毒性,随后的长期毒性研究可能仍有理由使用一种动物(如当两种动物的短期毒性试验结果相似时)。
不相关种属动物的毒性研究可能会产生误导,因而应避免。
当无相关种属时,应该考虑使用表达人源受体的相关转基因动物或者使用同源蛋白。
如果表达人源受体的相关转基因动物产品与人源受体的相互作用和人体的预期生理结果相似,可以完善使用此类产品而获取的信息。
Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals尽管使用同源蛋白也能得到有用的信息,但应该注意到,同源蛋白和临床拟用的产品之间,在生产工艺、杂质/污染物的范围、药代动力学和确切的药理学机制方面都可能有不同之处。
如不能使用转基因动物模型或者同源蛋白时,对采用单一种属进行的有限毒性评价(例如包括重要功能终点如心血管和呼吸系统评价的重复给药<14天的毒性研究)中发现的某些潜在毒性的评价应谨慎。
近年来,被认为与人类疾病相似的动物模型开发取得了很大进步。
这些动物模型包括诱发的和自发的疾病模型、基因敲除和转基因动物。
这些模型不仅可对产品的药理作用、药代动力学和剂量确定提供进一步的认识,也有助于确定安全性(如评价疾病的不良进展?)。
在某些情况下,可以用动物疾病模型替代正常动物进行毒性研究(注释1)。
应注意提供使用动物疾病模型评价安全性的科学合理性。
3.4 动物的数量/性别每个剂量使用的动物数量直接影响毒性检测能力。
样本量小可能会由于仅考虑观察次数而忽略严重程度,导致未能观察到毒性事件。
因受样本量小所受到的限制(往往见于非人类灵长动物研究)可以通过增加观察次数和延长观察时间而得到部分补偿。
一般应该使用两种性别的动物,仅使用单一性别动物时,应阐明其合理性。
3.5 给药途径/剂量选择应该尽可能接近拟用于临床的给药途径和次数。
需要考虑产品在所用动物种属中的药代动力学和生物利用度,以及安全、人道?的给药量。
例如,如果活性成分在动物体内清除较快或者溶解度低,可采用补偿的方式,增加实验动物的给药次数(与临床研究拟用的给药方案相比)。
