专题:混合物的分离和提纯
几种常见的混合物的分离和提纯方法

一、几种常见的混合物的分离和提纯方法
分离和提纯方法分离的物质主要仪器应用举例
倾析从液体中分离密度较大且不溶的固体烧杯、玻璃棒分离沙和水
过滤从液体中分离不溶的固体漏斗、滤纸、铁架台(带铁圈)、玻璃棒、烧杯粗盐提纯
溶解和
过滤分离两种固体,一种能溶于某溶剂,另一种则不溶分离食盐和沙
离心分离法从液体中分离不溶的固体离心试管,离心机分离泥和水
结晶法从溶液中分离已溶解的溶质烧杯、玻璃棒、蒸发皿、铁架台(带铁圈)、酒精灯从海水中提取食盐
分液分离两种不互溶的液体分液漏斗、铁架台(带铁圈)、烧杯分离油和水
萃取加入适当溶剂把混合物中某成分溶解及分离用苯提取水溶液中的溴
蒸馏从溶液中分离溶剂和非挥发性溶质蒸馏烧瓶、冷凝管、锥形瓶、酒精灯、石棉网、铁架台、牛角管、温度计从海水中制取纯水
分馏分离两种互溶而沸点差别较大的液体石油的分离
升华分离两种固体,其中只有一种可以升华铁架台(带铁圈)、酒精灯、烧杯、圆底烧瓶分离碘和沙
吸附除去混合物中的气态或固态杂质干燥管或U形管用活性炭除去黄糖中的有色杂质
色层分
析法分离溶液中的溶质层析纸及层析试剂分离黑色墨水中不同颜色的物质。
混合物的分离与提纯

(4)蒸馏 ①适用范围:利用沸点不同分离互 相溶解的混合物。 ②主要仪器: ③操作要点:垫上石棉网加热;瓶 内放碎瓷片;温度计水银球在支管 口处;冷凝水流向和蒸气流向相反。 实例:分离乙酸乙酯和乙酸钠的混 合物。
(5)萃取 ①适用范围:利用溶质在两种互不 相溶的溶剂中的溶解度不同,用一 种溶剂把溶质从另一种溶剂中提取 出来。 ②主要仪器: ③操作要点:互溶的溶剂不能作为 萃取剂。 实例:用四氯化碳从溴水中提取溴 单质。
(6)分液 ①适用范围:两种互不相溶的液体 的分离。 ②主要仪器: ③操作要点:下层液体从漏斗下方 流出,上层液体由漏斗上口倒出。 实例:分离苯和水;溴苯和水
1、使CO2气体通过填充___的玻璃管,可 除去CO2中的少量水分。 2、FeCl3溶液里含有少量FeCl2,可加入少 量____除去。 3、使氨气通过填充___的玻璃管,可除去 其中少量的水分。 4、使乙烯通过___水溶液,可除去其中少 量的SO2。 5、Fe2O3里混有少量Al2O3,可用___溶液 冲洗除去。 6、用___水溶液冲洗,可除去乙酸乙酯中 少量的乙酸。
(2)蒸发 ①适用范围:通过加热蒸发掉溶 剂而得到固体。 ②主要仪器: ③操作要点:液体不得超过蒸发 皿容积的2/3;接近沸腾时,要用 玻棒不断搅动;出现大量固体时, 停止加热,让余热蒸干溶液。 实例:从NaCl溶液中得到NaCl固 体。
(3)结晶(重结晶) ①适用范围:分离在同一溶剂中 的溶解度受温度影响不同的各种 可溶性固态物质。 ②主要仪器:蒸发仪器和过滤仪 器。 实例:从NaCl和KCl的混合溶液 中分离出KCl晶体。
混合物的分离与提纯
(1)过滤 ①适用范围:不溶性固体物质和 液体物 实例:除去氯化钠溶液中的 BaSO4。
④洗涤沉淀的操作:向有滤渣的 漏斗中注入蒸馏水至水面没过滤 渣,带水自然流完后,重复2~3次。 ⑤检验沉淀洗涤干净的操作:用干 净试管取最后一次流出的洗涤液, 滴加适当的试剂,如果没有沉淀生 成,说明沉淀洗涤干净,否则还要 继续洗涤。
混合物分离和提纯的方法

混合物分离和提纯的方法
混合物的分离和提纯可以通过以下几种方法实现:
1. 蒸馏:适用于分离具有不同沸点的液体混合物。
通过加热混合物,其中具有较低沸点的成分首先蒸发出来,然后通过冷凝收集。
2. 结晶:适用于分离溶液中的固体成分。
通过控制溶液的温度和浓度,使固体成分结晶出来,然后通过过滤或离心分离出来。
3. 过滤:适用于分离悬浮物和溶液的固体成分。
通过过滤纸或筛网,将固体颗粒从混合物中分离出来。
4. 萃取:适用于分离具有不同亲疏水性的物质。
通过溶剂的选择性提取,将需要分离的成分溶解于溶剂中,然后通过分离溶剂的蒸发或萃取剂的分离得到纯净物质。
5. 离心:适用于对混合物中的固体和液体进行分离。
通过离心机的旋转力将固体颗粒或微粒沉积到管底或管壁上,然后将上层液体倾倒或吸出。
6. 色谱:适用于分离混合物中的成分。
通过固定相和移动相之间的互作用,使成分按照一定的速率在固定相上移动,从而实现分离。
以上仅是一些常见的分离和提纯方法,具体选择方法需要根据混合物的性质和分离成分的差异来确定。
混合物的分离与提纯
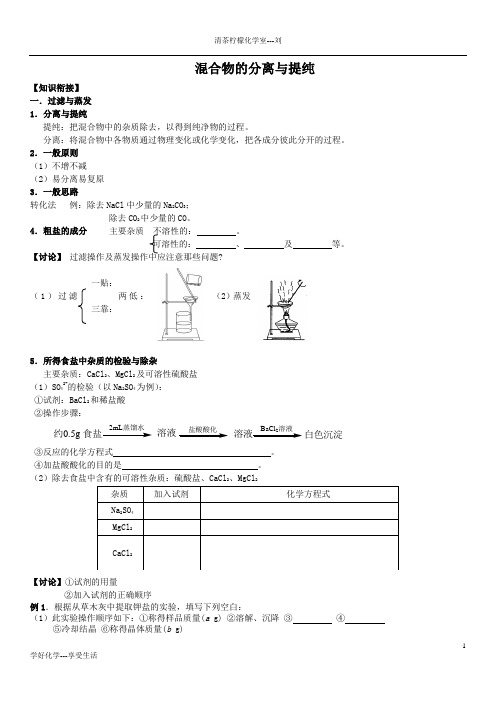
1学好化学---享受生活混合物的分离与提纯【知识衔接】一.过滤与蒸发1.分离与提纯提纯:把混合物中的杂质除去,以得到纯净物的过程。
分离:将混合物中各物质通过物理变化或化学变化,把各成分彼此分开的过程。
2.一般原则(1)不增不减(2)易分离易复原3.一般思路转化法 例:除去NaCl 中少量的Na 2CO 3;除去CO 2中少量的CO 。
4.粗盐的成分 主要杂质不溶性的: 。
可溶性的: 、 及 等。
【讨论】 过滤操作及蒸发操作中应注意那些问题?一贴:(1)过滤 两低: (2)蒸发三靠:5.所得食盐中杂质的检验与除杂主要杂质:CaCl 2、MgCl 2及可溶性硫酸盐(1)SO 42-的检验(以Na 2SO 4为例):①试剂:BaCl 2和稀盐酸②操作步骤:2约0.5g 溶液溶液白色沉淀③反应的化学方程式 。
④加盐酸酸化的目的是 。
(2)除去食盐中含有的可溶性杂质:硫酸盐、CaCl 2、MgCl 2【讨论】①试剂的用量②加入试剂的正确顺序例1.根据从草木灰中提取钾盐的实验,填写下列空白:(1)此实验操作顺序如下:①称得样品质量(a g) ②溶解、沉降 ③ ④⑤冷却结晶 ⑥称得晶体质量(b g)2学好化学---享受生活(2)用托盘天平称量样品时,若指针偏向右边,则表示 (填下列正确选项的代码)。
A .左盘重,样品轻B .左盘轻,砝码重C .右盘重,砝码轻D .右盘轻,样品重(3)在第③步操作时,有可能要重复进行,这是由于 ,从操作的角度分析原因可能有、 。
(4)在第④步操作时,要用玻璃棒不断小心地搅动液体,目的是防止 。
(5)所得产物中的钾盐除K 2CO 3外,还有 、 等。
6.蒸发和结晶(1)蒸发:通过蒸发或气化,减少一部分溶剂使溶液达到饱和而析出晶体。
此法主要用于溶解度随温度改变而变化 的物质。
仪器:铁架台(铁圈)、酒精灯、 、 。
(2)冷却热的饱和溶液:通过降低温度,使溶液冷却达到饱和而析出晶体。
重结晶指的是重复冷却结晶。
混合物的分离与提纯整理

混合物的分离与提纯1,混合物的提纯(即除杂质)是把混合物中的杂质除去而得到较纯净的物质,其基本原则是:不增,提纯过程中不增加新的物质;不变,被提纯的物质不能改变,并恢复原来的状态;易分,被提纯的物质与杂质易分离。
2,混合物的分离是指把混合物中的几种成份分开得到几种纯净物,其原则和方法与混合物的提纯(即除杂质)基本相似,不同之处是除杂质的题目只需把杂质除去恢复所需物质原来的状态即可,而混合物分离则要求被分离的每种纯净物都要恢复原来状态。
常用方法如下:原理:把不溶于液体的固体与液体通过过滤而分开的方法称为过滤法。
如:氯化钙中含有少量碳酸钙杂质,先将混合物加水溶解,由于氯化钙溶于水,而碳酸钙难溶于水,过滤除去杂质碳酸钙,然后蒸发滤液,得到固体氯化钙。
如果要获得杂质碳酸钙,可洗涤烘干。
2. 结晶法原理:几种可溶性固态物质的混合物,根据它们在同一溶剂中的溶解度或溶解度随温度的变化趋势不同,可用结晶的方法分离。
例如:除去固体硝酸钾中混有的氯化钠杂质,先在较高温度下制成硝酸钾的饱和溶液,然后逐步冷却,由于硝酸钾的溶解度随温度的升高而显著增大,温度降低,大部分硝酸钾成为晶体析出,而氧化钠的溶解度随温度的升高而增大得不显著,所以大部分氯化钠仍留在母液中,通过过滤把硝酸钾和氧化钠溶液分开。
为进一步提纯硝酸钾,可再重复操作一次,叫重结晶或再结晶。
原理:(一).加入的试剂只与杂质反应,不与原物反应。
(二).反应后不能带人新的杂质。
(三).反应后恢复原物状态。
(四).操作方法简便易行。
初中常用化学除杂方法有以下几种:1.沉淀法使混合物中的杂质与适当试剂反应,生成沉淀通过过滤而除去。
2.气体法将混合物中的杂质与适当试剂反应变成气体而除去。
如:硝酸钠固体中含有少量碳酸钠杂质,可将混合物加水溶解,再加入适量稀硝酸溶液,硝酸与碳酸钠反应生成硝酸钠、水和二氧化碳,再蒸发滤液,获得硝酸钠固体。
3.置换法将混合物中的杂质与适量试剂通过发生置换反应而除去。
混合物分离和提纯方法

混合物分离和提纯方法混合物分离和提纯方法是化学实验和工业中常用的一项重要技术。
混合物由两个或多个不同的物质组成,而这些物质可以是固体、液体或气体。
分离和提纯混合物的目的是将其中的成分分开,进一步研究或利用这些物质。
1. 过滤法:过滤是将固体颗粒从液体中分离出来的方法。
它主要基于固体颗粒的粒径较大,而在液体中悬浮或溶解的特点。
在实验室中,常用滤纸和漏斗进行过滤。
工业上,还常用旋流分离器、离心机等设备进行高效的过滤操作。
2. 蒸发法:蒸发法是将溶液中的溶质分离出来的方法。
通过加热溶液,使液体中的溶质挥发和沉淀成固体的方式,可以得到纯净的溶质。
常用的蒸发设备包括烧杯、蒸发皿、旋转蒸发仪等。
3. 结晶法:结晶法是通过溶液中的溶质结晶来实现纯化的一种方法。
在溶液中加入一种溶质溶剂,通过加热或降低温度使溶质逐渐结晶出来,然后通过过滤或离心等操作分离出纯净的结晶体。
4. 溶解度差异法:溶解度差异法是根据不同物质在溶液中的溶解度差异来进行分离和提纯的方法。
当混合物中的两种或多种物质具有不同的溶解度时,可以通过逐渐改变温度、压力或溶剂成分等条件,使其中的某一种物质溶解或结晶出来,从而实现分离和提纯。
常见的溶解度差异法有结晶分离法、结晶等温反应法等。
5. 萃取法:萃取法是利用不同溶剂对不同成分的溶解能力差异进行分离和提纯的方法。
在混合物中加入适当的溶剂,能使其中一种成分溶解,而另一种成分不溶解,然后通过分液漏斗、萃取柱等设备,将两种成分分离出来。
6. 蒸馏法:蒸馏法是根据不同物质的沸点差异来进行分离和提纯的方法。
通过加热混合物,使沸点较低的物质先蒸发,然后经过冷凝和收集,得到纯净的物质。
蒸馏法有常压蒸馏、减压蒸馏、分馏蒸馏等不同的操作模式。
7. 气体分离法:气体分离法是根据气体分子的特性来进行分离和提纯的方法。
可以通过调节压力、温度或通过适当的吸附剂等,使混合气体中的一种或多种气体被吸附或吸附后释放,达到分离和提纯目的。
混合物的分离和提纯
(A)NaNO3和NaCl (B)MnO2和KCl (C)CuO和木炭粉 (D)BaSO4和AgCl
例2 欲除去硝酸钾溶液中含有的少量碳酸钾杂质,可加入
适量的 (A)石灰水
(BD )
(B)硝酸钡溶液
(C)稀硫酸
(D)稀硝酸
例3 某溶液中含有Cu(NO3)2、AgNO3、Ba(NO3)2三种 物质,要使三种物质分别转化为沉淀分离出来,现
A为 Ba(OH)2 溶液;B为 HNO3 溶液;C为 AgNO3 溶液。
例7 粗盐中含有钙、镁、钾的氯化物和硫酸钠等杂质。现按下列实 验操作步骤加以分离和提纯:
粗盐 加水 溶液 过量的BaCl2溶液 ①
BaSO4↓ 滤液a
滤液a
过量的NaOH、Na2CO3溶液 ②
W↓ 滤液b
加试剂X至pH=7
滤液b
③
滤液c ④
NaCl KCl溶液
(1)步骤①中,除去的杂质离子是 SO42-
。
(2)步骤②中,除去的杂质离子是Ca2+、Mg2+、Ba2+ ,沉淀
W的组成为(用化学式表示)CaCO3、Mg(OH)2、BaCO3 。
(3)在步骤③中,加入的试剂X应是 盐酸 ,控制pH=7
的目的是 将OH-和CO32-两种离子完全除去而又不引入其他杂质 。 (4)步骤④应进行的操作是 蒸发结晶 。
结晶法 适用于两种或多种可溶性固体混 合物的分离或提纯。通常有两种 结晶方法:
蒸发溶剂法 适用于溶解度受温度变 化影响不大的物质的分离或提纯
冷却热饱和溶液法 适用于溶解度受 温度变化影响较大的混合物的分 离或提纯。
化学方法
用化学方法进行混合物的分离或提 纯时要注意的原则是:
高中常见液体混合物的分离与提纯
高中常见液体混合物的分离与提纯1. 蒸馏法蒸馏法是一种常见的液体混合物分离方法,适用于两种具有不同沸点的组分的混合物。
通过加热混合物,并在一定条件下进行蒸发和冷凝,可以将低沸点的组分分离出来。
这种方法常用于分离液体和液体之间的混合物,例如纯化酒精或提取香精物质。
2. 结晶法结晶法适用于含有可溶性固体的液体混合物。
通过在适当的溶剂中溶解混合物,并进行冷却或蒸发,可以使其中一种或多种固体溶质结晶出来,从而实现分离和提纯的目的。
这种方法常用于分离溶液中的杂质或纯化某些化合物。
3. 过滤法过滤法是一种用于分离固体和液体的混合物的常见方法。
通过使用不同孔径的滤纸、滤网或过滤膜,可以将固体颗粒分离出来,而将液体通过。
这种方法常用于分离悬浮物、沉淀物或其他杂质。
4. 萃取法萃取法适用于存在两种或更多互不相溶的液体组分的混合物。
通过将混合物与一个适合的溶剂混合并搅拌,目标组分可以在两个液体相之间转移。
这种方法常用于分离有机物或提取天然物质。
5. 色谱法色谱法是一种常用的分离和提纯液体混合物的方法。
通过利用不同组分在固定相和流动相之间的相互作用和迁移速度差异,可以实现分离和提纯的目的。
常见的色谱法包括薄层色谱、气相色谱和高效液相色谱。
6. 离心法离心法适用于含有固体颗粒或悬浮物的液体混合物。
通过使用离心机,可以通过离心力使固体颗粒沉积到管底,从而与液体分离。
这种方法常用于分离血液中的血细胞、沉淀物或其他悬浮物。
以上是高中常见液体混合物的分离与提纯方法的简要介绍。
在进行实验操作时,请注意安全性和操作规范,并根据具体情况选择最合适的方法。
混合物的分离和提纯
3、常用的分离和提纯的方法
(1)过滤、结晶、分液、萃取、蒸馏、升 华、渗析等物理方法 (2)沉淀、 加热分解、洗气等化学方法。
三、混合物的分离和提纯
方法一、过滤(沉淀洗涤)
固体(不溶) 一液体分离
例:除去粗盐 中的泥沙
操作要点:(1)对折法 折叠滤纸后紧贴漏斗壁, 用水打湿不出气泡为止, 滤纸边缘低于漏斗;过 滤时加入漏斗的溶液面 低于滤纸边缘,即“一 贴两低三靠”。 (2)过滤时:烧杯嘴与 玻璃棒接触;玻璃棒与 三层滤纸处相接触;漏 斗嘴紧靠玻璃烧杯壁。 (3)加水,水面高于沉 淀,浸洗三次,达到净 化沉淀。
实
仪器 : 天平,烧杯,玻璃棒,漏斗,铁
例
架台,铁圈等
步骤
现象
1.溶解:称取4克粗盐加到盛有12mL水 的小烧杯中,用玻璃棒搅拌使氯化钠充 分溶解
粗盐逐渐
溶解,溶液 浑浊。
2.过滤:组装好仪器,将1中所得到的混 合物进行过滤。若滤液浑浊,要再次过 滤,直到滤液澄清为止。
滤纸上有不
溶物残留, 溶液澄清。
注意事项:
① ②温蒸蒸度馏计 烧的 瓶方水 中法银 放温球少三度在量、计蒸碎蒸馏瓷馏烧片瓶—分—的馏防支冷液管体口暴处沸。。 ③冷馏凝管中冷却水从下(口1进),蒸上馏口凝烧出瓶。加热尾要垫
④先烧打开冷凝水,再加石热棉。网,温管度计水银接球
适瓶用范围(混和 放在支管口略向下的管位
物)
置。
例分:馏出1、各从馏石分油热。中水2
除杂步骤
①
NaCl混 稍过量的
NaCl、Ca2+
合溶液 NaOH溶液
NaCl、CO32-
③
稍过量的
BaCl2
SO42-、NaOH
混合物的分离和提纯
现象
粗盐逐渐溶解, 溶液有浑浊。
2.过滤:组装好仪器,将1中所得到的混合物 滤纸上有不溶
沿玻璃棒倒入过滤器中进行过滤。若滤液浑浊, 物残留,溶液
要再次过滤,直到滤液澄清为止。
澄清
3.蒸发:将过滤后的澄清溶液转入蒸 发皿,加热,并用玻璃棒搅拌,防止 液滴飞溅。当出现较多固体时停止加 热,余热蒸干。
蒸发皿中产生 了白色固体。
► 3. NaOH →BaCl2→ Na2CO3 →HCl
1、为了能完全除去杂质离子,加入的除 杂试剂必须过量
2、只要Na2CO3加在BaCl2之后便合理 3、食盐精制过程中至少过滤几次? 4、最后加入的盐酸只能适量,在过滤前还是 之后?
除杂原则:不增、不减、易分离、 易提纯。
除杂试剂要过量、过量试剂要除尽。去 除多种杂质要考虑加入试剂的顺序、用 量、选择最佳的除杂途径
思考:通过溶解、过滤、蒸发操作之后,得到的固体 就是纯净的食盐了吗?
粗盐 溶解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
过滤
不溶性杂 质(泥沙)
NaCl、MgCl2、CaCl2、 硫酸盐的溶液(含SO42-)
如何检验SO42-?
如何除去粗盐中的可溶性杂质
要除去可溶性杂质离子是: SO42变成不溶性杂质、气
化学方法: 沉淀、置换、加热等。
过滤——物质的分离和提纯方法之一
(1)适用范围:
不溶性固体与液体 混合物的分离
(2)主要仪器:
漏斗、铁架台(带铁圈)、 烧杯、玻璃棒。
(3)装置图:
过滤操作的注意事项 一贴 二低 三靠
过滤后洗涤沉淀的操作:
①沿着玻璃棒向漏斗内加蒸馏水 至浸没沉淀;让水自然流下 ②重复此操作2-3次。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题:混合物的分离和提纯
一.混合物分离提纯(除杂)的基本原理
混合物的分离就是通过物理或化学的方法,将混合物中的各组分一一分开,并且恢复到各种物质的原来存在状态,分别得到纯净物。
而混合物的提纯是通过适当的方法把混合物中的杂质除去得到纯净物,只要求被提纯的物质最终复原,不要求将除去的杂质复原。
除杂(提纯)的原则:“不减、不增、易分、简单、环保”
(1)加入试剂只与杂质反应,不能与所需要提纯的物质反应,简记为不能“玉石俱焚”。
(2)除杂过程中不能引进新的杂质。
(3)生成的物质与被提纯物质易分离,杂质应转化为沉淀、气体或水等易分离的物质。
(4)步骤简单、操作简便。
(5)注意环保,要求所选世纪和方法,不能产生对环境有污染的物质,简记为“绿色环保”。
(6)保持原状,即除杂结束前,要恢复所需物质原有状态,可简记为不能“改头换面”
二.混合物分离和提纯的主要方法
1.物理方法
(1)过滤法:一般适用于不溶于液体的固体和液体混合物的分离或提纯,或可溶性固体与不溶性固体混合物之间的分离或提纯。
如粗盐的提纯,分离KCl和MnO
2
混合物。
(2)蒸馏法:利用物质沸点不同来分离混合物。
如工业上制取氧气、石油分馏。
(3)结晶法:一般适用于两种或多种可溶性固体混合物的分离或提纯。
a.蒸发结晶法:适用于溶解度受温度变化影响不大的物质分离或提纯,
如除去NaCl固体中混有少量KNO
3
杂质,可采用蒸发结晶法
b.降温结晶法:适用于几种固态物质的溶解度受温度较大的混合物的分离或提纯,
如除去KNO
3
固体中混有少量NaCl杂质,可采用降温结晶法
(4)磁铁法:利用磁铁能把铁吸引,可以把铁从其他不能被铁吸引的杂质中分离出来或从不能被铁吸引的物质中把铁杂质除去。
?
2.化学方法
(1)化气法:在溶液中加入适量的试剂(酸),使所含杂质转化为气体除去,主要指碳酸盐,所选的酸主要由主要成分的酸根决定,加入酸要适量。
如除NaCl中Na
2CO
3
,可加适量稀HCl:Na
2
CO
3
+ 2HCl=2NaCl+ CO
2
↑+ H
2
O
(2)沉淀法:在溶液中加入试剂,将杂质转化为沉淀过滤除去。
如除去NaCl中的Na
2CO
3
,可加适量的CaCl
2
:Na
2
CO
3
+ CaCl
2
==CaCO
3
↓+2NaCl
(3)置换法:利用金属活动性顺序除去某些盐溶液中所含杂质(盐),将杂质通过置换反应而
除去,如除FeSO
4中的CuSO
4
,可加过量的铁粉,再过滤:CuSO
4
+Fe==Cu+FeSO
4
(4) 加热法:杂质受热易分解,通过加热将杂质除去,
如除CaO中的CaCO
3可加热:CaCO
3
高温
CaO+ CO
2
↑
(5)溶解法:将杂质溶于某种试剂而除去,
(6)转化法:将杂质通过化学反应转化为主要成分,
如除CO
2中的CO,可将气体通过灼热的Fe
2
O
3
:Fe
2
O
3
+3CO2Fe + 3CO
2
(7)逆推法:当混合物中的杂质无法直接除去时使用,
如除去CaCl
2中NaCl杂质时,杂质Na+无法除去,只好先加Na
2
CO
3
溶液,把Ca2+转化为CaCO
3
沉淀,过滤,洗涤得到CaCO
3,再加适量稀盐酸,得到CaCl
2
2014年中考化学混合物的分离、除杂
2.(2014海南省)下列除去杂质(括号内为杂质)选用的试剂正确的是()(水蒸气)---浓硫酸(CaCO
3
)---稀盐酸
(CuO)---蒸馏水 D. CO
2(H
2
O)--- NaOH固体
)
5.(2014哈尔滨市)除去下列物质中的少量杂质,所选用的试剂和操作方法都正确的是( )
6.(2014襄阳市)要除去CaCl
2溶液中的稀盐酸得到纯净的CaCl
2
溶液,最好的方法是加入()
A.生石灰 B.石灰石 C.熟石灰 D.苛性钠
7.(2014株洲市)河水因含有杂质而需要净化。
下列操作都是净化水的方法,其中一定需要加热的是()A.过滤B.吸附C.蒸馏D.沉淀
)
)
12.(
13.(2014大庆市)下列除去物质所含杂质的方法不正确的是(括号内为杂质)()(KCl),加足量水溶解,过滤,洗涤,干燥
A.MnO
2
B.N(O),将气体缓缓通过灼热的铜网
C.FeSO
4溶液(CuSO
4
),加过量Fe粉,过滤
D.CO
2
(HCl),通过NaOH溶液后用浓硫酸干燥
14.(2014
(
16.(2014泰州市)下列除去杂质(少量)的方法中,正确的是()
17.(2014徐州市)正确的实验方案是顺利完成实验的前提,下列化学实验方案中,不可行的是()
A.用高温煅烧的方法除去生石灰中的石灰石 B用酚酞试液检验氢氧化钠溶液是否变质C.用活性炭、塑料瓶等物品制作简易净水器 D.用灼烧闻气味的方法区分棉纱线和羊毛线
)
19.(2014赤峰市)为了除去物质中的杂质(括号内为杂质),需要选用适当的试剂,其中正
确的是()A.C(Zn)﹣稀硫酸B.CaCl
2溶液(HCl)﹣Ba(OH)
2
溶液
C. CO
2(CO)﹣澄清的石灰水D.NaOH溶液[Ca(OH)
2
]﹣K
2
CO
3
溶液
20.(2014烟台市)同学们做完实验后的玻璃试管中常附着难清洗的物质。
下列清洗方法错
A.内壁有CaCO
的试管用稀盐酸清洗 B.内壁有碘的试管用酒精清洗
3
C.内壁有铜粉的试管用稀硫酸清洗 D.内壁有植物油的试管用洗洁精清洗
21. (
22.(2014盘锦市)除去下列物质中的杂质,所选用的试剂或操作方法有错误的是()
23.
25.(2014济宁市)“电子垃圾”中含有金属铜和少量贵金属金、银等,直接废弃将严重污染环境且造成金属资源浪费。
社会实践小组为回收这些金属,设计了以下操作步骤:
①分拆、灼烧:把废弃电子产品分拆后灼烧,将部分金属转化为氧化物;
②酸洗:用硝酸溶解灼烧得到的混合物,过滤,收集残渣中的金;
③回收:利用合适的金属提炼出滤液中的铜和银。
为达到分别提炼金属铜、银的目的,下列方案合理的是()
A.用金属铁同时提炼出铜和银 B.先用金属铜提炼出银,再用金属铁提炼出铜
C.用金属铁提炼出金属铜 D.用金属铜提炼出金属银
28.(2014上海市)除去溶液中的少量杂质,试剂选择正确的是
29. (2014天津市)下表列出了除去物质中所含少量杂质的方法,其中正确的选项是正确的是
30.(2013赤峰市)由NaCl、CuCl
2、Mg(OH)
2
组成的固体混合物,将其逐一进行分离,可选用
的试剂是( )
A.水 NaOH溶液 B.水 KOH溶液稀盐酸 C.水 KOH溶液 D.水 NaOH溶液稀盐酸31.(2013大庆市)下列分离或提纯物质的方法,所依据的原理正确的是()
选项混合物的分离或提纯分离物质的原理
A除去粗盐中的泥沙氯化钠和泥沙的溶解性不同
B将石油分馏得到石油产品石油中各成分的密度不同
C分离硝酸钾和氯化钠组成的混合物硝酸钾和氯化钠分解温度不同
D分离液态空气制取氧气利用氮气和氧气的熔点不同。
