B第十章-醛酮和醌PPT课件
合集下载
华工有机化学11醛酮和醌PPT课件

10
2) 羧酸衍生物的还原
O
① DIBA–H,己烷,-78℃
R C OR'
② H3O+
O RC H
注:
(CH3)2CHCH2
CH2CH(CH3)2 Al H
DIBA–H 二异丁基氢化铝
O
C Cl
① LiAl(OBu–t)3H,乙醚,-78℃
OCH3
② H3O+
CH3
第11页/共77页
CHO
OCH3 CH3
R'''
O
Wittig 试剂:
(C6H5)3P C
内盐
R'' R'''
R''
(C6H5)3P
C R'''
44
第44页/共77页
Wittig 试剂的制备:
a)
的制备
(C6H5)3P
R'' + R''' CH X
RX: 1°,2°
(C6H5)3P
季盐
R'' CH X
R'''
b) 季 盐在强碱的作用下,生成Wittig试剂。
11
O CH3CH2CH2C Cl
+ H2
Pd–BaSO4 硫–喹啉
O CH3CH2CH2C H
(90%) +
HCl
催化氢化还原,称为Rosenmund 还原法。
12
第12页/共77页
4) 芳环的酰基化
O
+
C Cl AlCl3
(82%)
O
2) 羧酸衍生物的还原
O
① DIBA–H,己烷,-78℃
R C OR'
② H3O+
O RC H
注:
(CH3)2CHCH2
CH2CH(CH3)2 Al H
DIBA–H 二异丁基氢化铝
O
C Cl
① LiAl(OBu–t)3H,乙醚,-78℃
OCH3
② H3O+
CH3
第11页/共77页
CHO
OCH3 CH3
R'''
O
Wittig 试剂:
(C6H5)3P C
内盐
R'' R'''
R''
(C6H5)3P
C R'''
44
第44页/共77页
Wittig 试剂的制备:
a)
的制备
(C6H5)3P
R'' + R''' CH X
RX: 1°,2°
(C6H5)3P
季盐
R'' CH X
R'''
b) 季 盐在强碱的作用下,生成Wittig试剂。
11
O CH3CH2CH2C Cl
+ H2
Pd–BaSO4 硫–喹啉
O CH3CH2CH2C H
(90%) +
HCl
催化氢化还原,称为Rosenmund 还原法。
12
第12页/共77页
4) 芳环的酰基化
O
+
C Cl AlCl3
(82%)
O
《化学醛酮醌》课件

醛酮醌的光化学性质
醛酮醌在光化学反应中展现了独特的性质和行为,了解其光敏性和光化学变换机制对于理解其应用和研究具有 重要意义。
醛酮醌的色谱分析技术
色谱分析技术对于醛酮醌的分离和鉴定至关重要,包括气相色谱、液相色谱 和高效液相色谱等方法。
醛酮醌在有机合成中的应用
醛酮醌在有机合成中具有广泛的应用价值,包括催化反应、合成中间体和功 能化合物的构建等方面。
《化学醛酮醌》PPT课件
《化学醛酮醌》PPT课件将带你深入了解醛酮醌的特性、结构、合成方法、应 用前景和影响,希望与你分,具有丰富的结构和化学性质。了解它的特 点对于相关领域的研究和应用至关重要。
醛的性质和结构
醛作为一种有机化合物,具有特殊的功能团和结构特征,对于化学反应和生 物体内的相关机制具有重要影响。
醛酮醌研究的前景
醛酮醌作为一个热门研究领域,具有广阔的发展前景和应用潜力,相关科学 家和研究者将继续探索其新的特性和应用。
醛酮醌与生活相关的案例介绍
通过实际案例介绍,让大家更直观地了解醛酮醌与生活的关系,包括食品、 医药和化妆品等方面的应用。
醛酮醌在工业生产中的用途
醛酮醌在工业生产中具有各种重要的用途,从普通化学品到高附加值产品, 涉及多个领域的广泛应用。
酮的性质和结构
酮是一种常见的有机化合物,其独特的化学性质和结构特征赋予了它广泛的应用价值和独特的反应特性。
醌的性质和结构
醌是一类具有重要生物活性的有机化合物,其特殊的结构和化学性质对于生 命体系中的氧化还原反应至关重要。
醛酮醌的命名法和分类
了解醛酮醌的命名法规和分类体系,有助于更好地理解其结构和性质,并为 进一步研究和应用提供指导。
醛酮醌的天然来源和医药应用
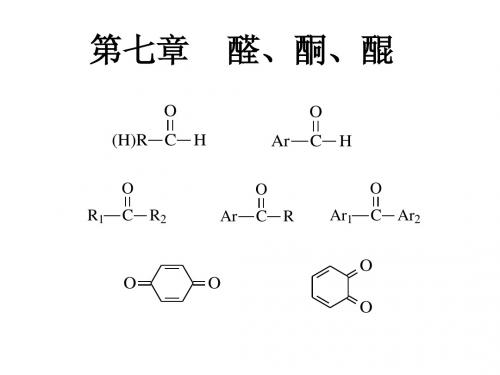
醛、酮、醌
R H C O + R' OH H
无水HCl
R C
OH OR'
R'OH
无水HCl
R C H
OR' OR'
半缩醛
缩醛
醛与醇生成半缩醛、缩醛的反应是按下列历程进行的:
R H C O H
+
R H
R C O H
Ⅰ
+ +
H
C OH
+
.. R'OH
R C H
OH
+ .OR' .
H
Ⅱ
-H
+
R C H
OH OR'
H O C CHOH CHOH CHOH .. CH2 OH
分子内的六员环状半缩醛
H
OH C CHOH CHOH O CHOH CH2
4. 与格氏试剂的加成反应
格氏试剂是较强的亲核试剂,非常容易与醛、酮 进行加成反应,加成的产物不必分离便可直接水解生 成相应的醇,是制备醇的最重要的方法之一。
无水 乙 醚 R C O MgX H2O H
+
C O + RMgX
R C
OH
+ Mg(OH)X
甲醛与格氏试剂加成产物水解后可以得到比格氏试剂 分子中的烃基多一个碳原子的伯醇;其它醛与格氏试剂 加成后,水解的最终产物是仲醇;酮与格氏试剂加成后, 水解的最终产物是叔醇。
H C O + R MgX H
无水乙醚
H R C OMgX H H2O H
+
HCl OH R C SO3Na R Na2CO3 (CH3)H C O + Na2SO3 + NaHCO3 H(CH3) R C O (CH3)H + NaCl + SO2 + H2O
无水HCl
R C
OH OR'
R'OH
无水HCl
R C H
OR' OR'
半缩醛
缩醛
醛与醇生成半缩醛、缩醛的反应是按下列历程进行的:
R H C O H
+
R H
R C O H
Ⅰ
+ +
H
C OH
+
.. R'OH
R C H
OH
+ .OR' .
H
Ⅱ
-H
+
R C H
OH OR'
H O C CHOH CHOH CHOH .. CH2 OH
分子内的六员环状半缩醛
H
OH C CHOH CHOH O CHOH CH2
4. 与格氏试剂的加成反应
格氏试剂是较强的亲核试剂,非常容易与醛、酮 进行加成反应,加成的产物不必分离便可直接水解生 成相应的醇,是制备醇的最重要的方法之一。
无水 乙 醚 R C O MgX H2O H
+
C O + RMgX
R C
OH
+ Mg(OH)X
甲醛与格氏试剂加成产物水解后可以得到比格氏试剂 分子中的烃基多一个碳原子的伯醇;其它醛与格氏试剂 加成后,水解的最终产物是仲醇;酮与格氏试剂加成后, 水解的最终产物是叔醇。
H C O + R MgX H
无水乙醚
H R C OMgX H H2O H
+
HCl OH R C SO3Na R Na2CO3 (CH3)H C O + Na2SO3 + NaHCO3 H(CH3) R C O (CH3)H + NaCl + SO2 + H2O
《醛和酮第二节醌》PPT课件

《醛和酮第二节醌》PPT 课件
本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢!
3.氧化反响 醛由于其羰基上连有氢原子,很容易被氧化, 既可被强
(二)乙醛
乙醛是无色、有刺激臭味、易挥发的液体,可溶于水、乙 醇、乙醚中. 三氯乙醛是乙醛的一个重要衍生物,是由乙醇与 氯气作用而得。三氯乙醛由于三个氯原子的吸电子效应,使羰 基活性大为提高,可与水形成稳定的水合物,称为水合三氯乙 醛,简称水合氯醛. 其10%水溶液在临床上作为长时间作用的 催眠药,用于失眠、烦躁不安等。
宁德职业技术学院
一.醌的命名 醌一般由芳香烃衍生物转变而来,命名时是以苯醌、萘醌
等作为母体来命名的, 在“醌“字前加上芳基的名称,并标出 羰基的位置. 两个羰基的位置可用阿拉伯数字标明写在醌名字 前. 母体上如有取代基,可将取代基的位置、数目、名称写在 前面.
宁德职业技术学院
二.醌的性质 (一) 物理性质
(2) 复原成烃 醛、酮可被一些特殊试剂直接复原成烃, 如, 醛、酮
与锌汞齐及浓盐酸回流反响,羰基被复原成亚甲基,这一 反响称为克莱门森复原.
宁德职业技术学院
将醛或酮与氢氧化钠(或钾), 肼的水溶液及二缩乙二醇一 起加热, 也可使羰基被复原成亚甲基(黄鸣龙复原法), 此法产 率高, 可以用来复原对酸不稳定的醛或酮.
维生素K3为黄色晶体, 熔点105-107℃, 难溶解 于水,可溶于植物油或其它 有机溶剂. 由于维生素K3是 油溶性维生素,故医药上用 的是它的可溶于水的亚硫酸 氢钠加成物。
宁德职业技术学院
本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢!
3.氧化反响 醛由于其羰基上连有氢原子,很容易被氧化, 既可被强
(二)乙醛
乙醛是无色、有刺激臭味、易挥发的液体,可溶于水、乙 醇、乙醚中. 三氯乙醛是乙醛的一个重要衍生物,是由乙醇与 氯气作用而得。三氯乙醛由于三个氯原子的吸电子效应,使羰 基活性大为提高,可与水形成稳定的水合物,称为水合三氯乙 醛,简称水合氯醛. 其10%水溶液在临床上作为长时间作用的 催眠药,用于失眠、烦躁不安等。
宁德职业技术学院
一.醌的命名 醌一般由芳香烃衍生物转变而来,命名时是以苯醌、萘醌
等作为母体来命名的, 在“醌“字前加上芳基的名称,并标出 羰基的位置. 两个羰基的位置可用阿拉伯数字标明写在醌名字 前. 母体上如有取代基,可将取代基的位置、数目、名称写在 前面.
宁德职业技术学院
二.醌的性质 (一) 物理性质
(2) 复原成烃 醛、酮可被一些特殊试剂直接复原成烃, 如, 醛、酮
与锌汞齐及浓盐酸回流反响,羰基被复原成亚甲基,这一 反响称为克莱门森复原.
宁德职业技术学院
将醛或酮与氢氧化钠(或钾), 肼的水溶液及二缩乙二醇一 起加热, 也可使羰基被复原成亚甲基(黄鸣龙复原法), 此法产 率高, 可以用来复原对酸不稳定的醛或酮.
维生素K3为黄色晶体, 熔点105-107℃, 难溶解 于水,可溶于植物油或其它 有机溶剂. 由于维生素K3是 油溶性维生素,故医药上用 的是它的可溶于水的亚硫酸 氢钠加成物。
宁德职业技术学院
第十章-醛和酮PPT课件

(5) CH3CHC2CHH3 (6)
OH O
(8)
C CH3
CH3CHC3H OH
-
19
三、氧化和还原反应 1. 氧化反应
醛易被氧化,而酮难氧化。
R C + 2 H [ A g ( N H 3 O ) 2 ] O H R C4 O + 2 A g + O 3 N H 3 + N H 2 O
Tollens试剂——鉴别醛和酮
C3H
-
24
作业: P197 3(与丙酮反应), 8, 9/(1)(3), 12, 13/(1)(3)。 翻译 P16最后一段“If we take……the same carbon atom” P17最后二段 Aldol reaction
练习:鉴别
乙醛 异丙醇
I2/NaOH 淡黄 淡黄 —
2,4-二硝基苯肼 橙黄 — Tollens试剂 Ag Fehling试剂
一、亲核加成反应 nucleophilic addition
机理:R+ - N u-,慢 R O - A +,快
CO
C
R '
R ' Nu
负 氧 离 子 中 间 体
R OA C
R ' Nu
亲核加成反应的难易:
醛比酮活泼。
❖亲核试剂亲核性强弱——亲核性越强,越易反应。
❖醛、酮结构—— C=O所连R基越多,+I效应, 羰基C+;同时空间位阻。不利于亲核反应。
H
练习:如要制备2-甲基-2-丁醇,可用何种羰基化 合物和格氏试剂?
O
OH
C3H CC3H+ C3H C2H MgX
CH 3CCH 2CH 3 CH 3
醛、酮和醌详解演示文稿

第50页,共69页。
强亲核试剂在 1,2位, 弱亲核试剂在 1,4位
第51页,共69页。
14.1.6 乙烯酮与卡宾
• 1. 乙烯酮
磷酸三乙酯
700℃
结构
非常不稳定,光照分解,易与有活泼氢的化合物加成
CH2
C
hν
O
..CH2 + CO
卡宾
第52页,共69页。
第53页,共69页。
• 2.卡宾
结构:
第43页,共69页。
Meerwein-Ponndorf 反应: Oppenauer反应的逆反应
醛酮
醇 (不饱和键不反应)
异丙醇,异丙醇铝催化
Clemmensen 还原:
酮羰基变成亚甲基
PhCOCH2CH2CH3
Zn-Hg,浓HCl 回流,88%
PhCH2CH2CH2CH3
第44页,共69页。
Wolff-Kishner 反应 : (醛酮)
慢
O
快
Br Br
CH3 C
O CH3 C CH2
CHBr + Br 2
注意酸碱催化时反应机理特点
第30页,共69页。
O
快
CH3 C CH3 + H+
+
OH CH3 C CH2
H
OH H+
CH3 C CH2
慢
OH CH3 C CH2
快
+ Br Br
OH
CH3
C
+
CH2 Br
+
OH CH3 C CH2Br + Br
单重态:无单电子,SP2杂化
三重态:两个单电子, SP 杂化,较稳定
有机化学ppt-醛酮醌
a.α-C上含有三个活泼氢的醛,酮与碘的氢氧化钠溶液作用, 生成碘仿(黄色沉淀,有特殊气味)和羧酸钠,称碘仿反应。
b.常用此反应鉴别乙醛和甲基酮以及有( 醇。
)结构的
(2)羟醛缩合反应
O
H
OH
稀OH-
CH3 C H + CH2 CHO
CH3 CH CH2 CHO
乙醛
乙醛
β- 羟基丁醛
是增长碳链的一种方法。
O
O
O
O
O
O
1,4-苯醌 (对苯醌)
1,2-苯醌 (邻苯醌)
O
1,4-萘醌 (α-萘醌)
1,2-萘醌 (β-萘醌)
二、重要的醌及性质 (一) α-萘醌和维生素K
许多天然的植物色素含有α-萘醌的结 构,如维生素K类,它们存在于绿叶蔬菜 中,具有促进凝血作用,故在医学上常用 作止血剂,亦可用于预防长期口服广谱抗 生素药物引起的K族维生素缺乏症。
3-甲基丁醛 β -甲基丁醛
O CH3CHCCH2CH3
CH3 2-甲基-3-戊酮
CH3CH=CHCHO
2-丁烯醛
(CH3)2CHCH2COCH3 4-甲基-2-戊酮
CH3COCH2COCH2CH3 2,4-己二酮
O
CH3CH=CHCCH2CH3
4-己烯-3-酮
OHCCH2CHO 丙二醛
三、醛酮的物理性质
目录
Contents
第一节 醛和酮 第二节 醌
第二节 醌
一、醌的结构和命名 醌是一类具有环状共轭体系的环己二烯二酮类化合物
O
O
O
O 对位
邻位
一、醌的结构和命名
命名:以相应的芳烃衍生物来命名,苯醌、萘醌、蒽醌等,两
醛酮醌jppt课件
水浴
O || Ar—C—O- + Ag↓银镜
R1 C O + Ag+ OH -
水浴
R2
无现象
五、化学性质—氧化反应
CH3CHO
Ag(NH3)+2
△
乙醛
O || CH3—C—ONH4 + Ag↓银镜
—CHO + Ag+ OH -
水浴
O || —C—ONH4 + Ag↓银镜
苯甲醛
CH3 C O + Ag+ OH -
O || CH3—C—H + NaHSO3
OH | CH3—CH—SO3Na↓
乙醛—α—羟基磺酸钠
五、化学性质—加成反应
O || CH3—C—CH3 + N(饱aH和S)O3
OH | CH3—CH—CH3↓ | SO3Na
丙酮—α—羟基磺酸钠
醛、脂肪族甲基酮、8碳以内的脂环酮能与NaHSO3反应
* α—羟基磺酸钠在酸性或碱性环境下都可水解。
OH | R—C—H | SO3Na
H+ Na2CO3
R—CHO + SO2 + H2O + NaCl R—CHO + Na2SO3 + NaHCO3
五、化学性质—加成反应
CH3—CH—OH | SO3Na
Na2CO3
CH3—CHO + Na2SO3 + NaHCO3
OH | CH3—C—CH3 | SO3Na
醛、酮
醛、酮都是醇的氧化产 1. 醛、酮的结构。
物,它们的分子中都含 2. 醛、酮的化学性质。
有羰基( C O),因此
醛和酮常被合称为羰基化合 物。
O || Ar—C—O- + Ag↓银镜
R1 C O + Ag+ OH -
水浴
R2
无现象
五、化学性质—氧化反应
CH3CHO
Ag(NH3)+2
△
乙醛
O || CH3—C—ONH4 + Ag↓银镜
—CHO + Ag+ OH -
水浴
O || —C—ONH4 + Ag↓银镜
苯甲醛
CH3 C O + Ag+ OH -
O || CH3—C—H + NaHSO3
OH | CH3—CH—SO3Na↓
乙醛—α—羟基磺酸钠
五、化学性质—加成反应
O || CH3—C—CH3 + N(饱aH和S)O3
OH | CH3—CH—CH3↓ | SO3Na
丙酮—α—羟基磺酸钠
醛、脂肪族甲基酮、8碳以内的脂环酮能与NaHSO3反应
* α—羟基磺酸钠在酸性或碱性环境下都可水解。
OH | R—C—H | SO3Na
H+ Na2CO3
R—CHO + SO2 + H2O + NaCl R—CHO + Na2SO3 + NaHCO3
五、化学性质—加成反应
CH3—CH—OH | SO3Na
Na2CO3
CH3—CHO + Na2SO3 + NaHCO3
OH | CH3—C—CH3 | SO3Na
醛、酮
醛、酮都是醇的氧化产 1. 醛、酮的结构。
物,它们的分子中都含 2. 醛、酮的化学性质。
有羰基( C O),因此
醛和酮常被合称为羰基化合 物。
chapt醛酮醌课件
机理:
R1 Ph3P-CHR + R2 C O
R1 R2 C CHR
O PPh3
R1 R2 C CHR
O PPh3
R1 R2 C CHR + Ph3P=O
Wittig反应条件温和,产率高,生成的双键位置确 定,没有重排,在合成某些天然产物中作用独特。
Organic Chem
8、亲核加成的立体化学(Cram规则)
C OR' 生成缩醛 的方
H OH2
H
向移动,必须
:
R'OH 使 用 过 量 的 醇
R OR C
H
H OR'
R OR C
H OR' H
或从反应体系 中把水蒸出。
Organic Chem
缩醛对碱、氧化剂、还原剂都比较稳定,但用稀酸处理, 室温就水解生成原来的醛和醇。 以此可用于保护羰基。缩酮也有类似的用途。
Organic Chem
7 与膦Ylide的加成--Wittig反应
Ph3P=CHR +
R1 CO
R2
R1 C CHR
R2
Ph3P=CHR的制 Ph3P 备+ RCH2X
Ph3PCH2R X
鏻盐
碱 - HX Ph3P=CHR
Ph3P=CHR叫ylide,它也可写成:
Ph3P-CHR
Organic Chem
有机玻璃单体
• R-是极强的亲核试剂,RMgX, RLi, RCCNa • 都可以和几乎所有的醛酮发生加成反应:
1) 与格氏试剂加成:可以制备各种醇
RMgX +
无水乙醚 CO
R
或四氢呋喃
C
OMgX H+/H2O 或 NH4Cl
大学有机化学复习——醛酮醌PPT课件
用途:
保护醛基:
例: 由 CH3CH=CHCHO
CH3CH2CH2CHO
CH3CH=CHCHO
HOCH2CH2OH 干HCl
CH3CH2CH2CH
O-CH2 O-CH2
CH3CH=CHCH
O-CH2 O-CH2
H2,Ni
H2O/H+ CH3CH2CH2CHO
2021/8/11
2004 生技
18
第18页/共46页
O
+
C
CH3
+ HCl
(9%)
O CCH2CH2CH3 + HCl
(不重排!)
8
(五) 醛和酮的化学性质
(1) 羰基的亲核加成
(甲) 与氢氰加成 (乙) 与亚硫酸氢钠加成 (丙) 与醇加成 (丁) 与金属有机试剂加
成
(戊) 与氨的衍生物加成 缩合
(2) α-氢原子的反应
(甲) 卤化反应 (乙) 缩合反应
C-C2BHr+
溴苯乙酮
H,受羰基影响,活性增加 (88%-96)
HBr
O
+
C2l
H2O 61%-66%
O Cl+ HCl
醛的活性更高:
CH3CHO + Cl2 H2O ClCH2CHO + Cl2CHCHO + Cl3CCHO
一氯乙醛
二氯乙醛
三氯乙醛
2021/8/11
2004 生技
25
第25页/共46页
③ 根据酮羰基所连的两个烃基是否相同,分为: 单酮,混酮。
2021/8/11
2004 生技
2
第2页/共46页
(一) 醛和酮的命名
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原因:a. 醇分子间可形成氢键,而醛、酮分子间不能形成氢键; b. 醛、酮的偶极矩大于醚、烃的偶极矩
溶解度:与醇相似。低级醛、酮可溶于水;高级醛、酮不溶于水。 因为醇、醛、酮都可与水形成氢键:
HH R-O H-O
R
H
H C=O H-O
-
R
H
R' C=O H-O
11
(五)醛和酮的波谱性质
IR光谱:
νC=O:1680-1850cm-1(很强峰,无其他峰干扰) 注意:丙酮的νC=O为1715 cm-1, 乙醛的νC=O为1730 cm-1。
CH3CH2CH2CHO CH3CHCH2CHO
正丁醛
异C戊H醛3
CH3 C CH2CH3 O
甲基乙基(甲)酮
CH3 C CH CH2 O
甲基乙烯基(甲)酮
(甲乙酮)
(丁烯酮)
CHO
苯甲醛
C O
二苯甲酮
-
4
(2)系统命名法
CH3CH2CH2CHCH2CHCH2CHO
CH3 C2H5
5-甲基-3-乙基辛醛
CH3CH CHCHO
2-丁烯醛(巴豆醛)
CH3CHCH2CCH3
CH3 O 4-甲基-2-戊酮
CH2CHO
苯乙醛
-
5
OH CHO
2-羟基苯甲醛(水杨醛)
OO CH3C CCH2CH3
2,3-戊二酮(α-戊二酮)
O
O
CH3C CH2 CCH3
2,4-戊二酮(β-戊二酮)
O CH3C CH2CH2CHO
νC-H(醛):2720cm-1(中等强度尖峰,特征性强)
-
12
讨论:
①不同羰基的大致吸收位置:
②-I效应、环张力等使νC=O波数升高; 共轭效应(+C、-C)使νC=O波数波数降低
例1:正辛醛的红外光谱
例2:苯乙酮的红外光谱
-
13
NMR谱
O CH3-C
O R-CH2-C-
O R-C-H
例1:丁酮的核磁共振谱 例2:苯甲醛的核磁共振谱
② 根据醛、酮分子中羰基的个数,可分为: 一元醛、酮,二元醛、酮等;
③ 根据酮羰基所连的两个烃基是否相同,分为: 单酮:CH3COCH3 ( R=R’ ) 混酮:CH3COCH2CH3 , C6H5COCH3 ( R≠R’ )
-
3
(二)醛和酮的命名
(1)普通命名法
醛的普通命名法与醇相似; 酮则按所连两个烃基来命名。
O CC H 3
2 伯醇和仲醇的氧化
(C H 3 )3 C C H 2 O H K H 2 C 2 S rO 2 O 4 7
△-
(C H 3 )3 C C H O
(80%)
8
3 羧酸衍生物的还原 酰氯、酯等被还原为醛
O
C Cl
CHO
①LiAl(OBu–t)3H,乙醚,-78℃
OCH3
②H3O+
OCH3
O
羰基:
C
O
醛基
醛:
RC H
酮:
O 酮基
R C R'
-
1
(一) 醛和酮的结构
羰 基 的 结 构 :
CO
C 和 O 都 是 sp2杂 化
CO
电 子 云 分 布 :
CO
CH3 C=O
CH3
H C=O
H
极性分子, 有偶极矩
=7.57x10-30C m =9.50x10-30C m
-
2
醛和酮的分类:
① 根据烃基的不同,可将醛、酮分为: 脂肪族醛、酮:CH3CHO,CH3COCH3 芳香族醛、酮:C6H5CHO,C6H5COCH3 ; 饱和醛、酮:CH3CHO, CH3COCH2CH3 不饱和醛、酮:CH2=CHCHO,CH3COCH=C(CH3)2
CH3
CH3
O ① D IB A – H , 己 烷 , -7 8 ℃
O
RCO R '
② H 3 O +
RCH
(C H 3)2C H C H 2 A C lH 2C H H (C dH iis3)o2bu二ty异la丁lum基i氢nu化m铝hydride
i-–Bu2AlH DIBAL–H9
4 芳环的酰基化 O + C C lA lC l3 合成芳酮的重要方法
4-氧代戊醛或4-戊酮醛(γ-戊酮醛)
-
6
(三) 醛和酮的制法
1 醛和酮的工业合成
(1) 低级伯醇和仲醇的催化脱氢
醇 催化脱氢 醛 催化剂:Cu、Ag、Ni等 C H 3 C H 2 O H ~ C 2 8 u 0 ℃ C H 3 C H O + H 2
吸热反应
(2) 羰基合成
C H 3 C H C H 2 + C O + H 2 C o 1 ( C 6 0 O ℃ ) 6 , [ P ~ ( n 6 – C M 4 H P a 9 ) 3 ] 2
C H 3C H 2C H 2C H O+C H 3C H C H O
C H 3ቤተ መጻሕፍቲ ባይዱ
正丁醛 异丁醛
5
:- 1
7
(3) 烷基苯的氧化
空气
甲苯
CrO2Cl2 CrO3
苯甲醛
C H 3+ O 2V ~ 3 2 O 6 0 5 ℃
C H O + H 2 O
乙苯 O2 苯乙酮
C H 2 C H 3+O 2硬 ~ 脂 1 3 酸 0 ℃ 钴
(d) 羰基的反应活性
① HCHO>CH3CHO>ArCHO>CH3COCH3>CH3COR>RCOR>ArCOAr 活性:醛>酮 ; 脂肪族醛、酮>芳香族醛、酮
② p-NO2-C6H4-CHO>ArCHO>p-CH3-C6H4-CHO 羰基碳愈正,反应活性愈强
O C
(82%)
+ H C l
Gattermann–Koch 反应:
芳烃 Lewis酸催化 CO + HCl 醛
C H 3 + C O + H C lC A u lC C ll 3 C H 3
室 温
对位取代为 主要产物
O
HC Cl
-
C H O
10
(四) 醛和酮的物理性质
物态:CH2O为气体;C2-C12醛、酮为液体;C13以上醛、酮为固体。 沸点:与分子量相近的醇、醚、烃相比,b.p:醇>醛、酮>醚>烃。例:
C O- > C+ O
所以亲核试剂首先进攻!即发生亲核加成反应,其通式为:
N u
N u
N u -+(R ')H RCO慢RCO - H + ,快
C R O H
(R ')H
(R ')H
-
16
(c) 电子效应和空间效应的影响
电子效应:羰基碳愈正,愈有利于亲核加成; 空间效应:羰基碳上连接的基团体积愈大,愈不利于亲核加成。
-
14
(六)醛和酮的化学性质
羰基的反应活性
(a) 羰基的极性
由于氧的电负性大于碳,碳氧双键具有极性: C=O
例:
H C=O
CH3 C=O
H
CH3
=7.57x10-30Cm
=9.50x10-30Cm
-
15
(b) 亲电和亲核反应活性
从 C=O 的结构考虑:
a.有双键,可以加成; b.稳定性
Nu
E
