必修一无机化学推断题(二)
高一化学无机推断试题

高一化学无机推断试题1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:(1)写出下列物质的化学式:B 、丙、乙。
(2)写出下列反应的化学方程式:反应①;反应⑤;反应⑥。
【答案】(1) Al HCl Cl2[(2) ① 2Na+2H2O=2NaOH+H2↑⑤2FeCl2+Cl2=2FeCl3⑥3NaOH+FeCl3=Fe(OH)3↓+3NaCl【解析】由金属A焰色反应为黄色知A为钠,则甲为氢气,D为氢氧化钠,B为铝,乙为黄绿色气体,则乙为氯气,丙为氯化氢,E为稀盐酸,H为黄褐色沉淀氢氧化铁,所以C为铁,F为氯化亚铁,G为氯化铁。
所以,(1)B:Al、乙:Cl2、丙:HCl;(2)反应①的方程式:2Na+2H2O=2NaOH+H2↑反应⑤方程式:2FeCl2+Cl2=2FeCl3反应⑥方程式:3NaOH+FeCl3=Fe(OH)3↓+3NaCl【考点】考查物质的推断、化学式、化学反应方程式的书写2.中学常见的某反应的化学方程式为A+B―→C+D+H2O(未配平,反应条件略去)。
请回答下列有关问题:(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中。
则A与B反应的离子方程式为。
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为。
(3)若该反应是实验室制取C气体的反应。
已知C是黄绿色刺激性气味的气体,其水溶液呈酸性写出该反应的化学方程式。
【答案】(1)Fe+4H++NO3- = Fe3++NO↑+2H2O;(2)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O(3)MnO2 + 4 HCl(浓) MnCl2+ Cl2↑ + H2O【解析】(1)金属单质只有铁能溶于三价铁离子的溶液,因此A元素的元素符号为:Fe;Fe+4HNO3=Fe(NO3)3+NO↑+2H2O ;A与B的反应的离子方程式为Fe+4H++NO3- = Fe3++NO↑+2H2O。
无机化学推断题特征反应

五、无机反应中的特征反应1.与碱反应产生气体 (1) (2)铵盐:O H NH NH 234+↑−→−+碱2.与酸反应产生气体 (1) (2)()()()⎪⎪⎩⎪⎪⎨⎧↑−→−↑−→−↑−→−+++------2323222323SO HSO SO S H HS S CO HCO CO H H H 化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O 4.与水反应产生气体 (1)单质 (2)化合物 5.强烈双水解6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
7.与Na 2O 2反应 8.2FeCl 3+H 2S=2FeCl 2+S ↓+2HCl 9.电解10.铝热反应:Al+金属氧化物−−→−高温金属+Al 2O 311. Al 3+ Al(OH)3 AlO 2-⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na ()()()⎪⎪⎩⎪⎪⎨⎧↑+=+↑+↓=+↑+↓=+↑+=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na ()()()()()⎪⎩⎪⎨⎧↓−−→−↓+↑−−→−↓+↑−−→−-----+32322323233222OH Al AlO OH Al S H HS S OH Al CO HCO CO Al O H O H O H 与⎪⎩⎪⎨⎧+↑−−→−+↑−−→−NaOH O CO Na O O H CO 232222()⎪⎪⎩⎪⎪⎨⎧↑+↑+−−→−↑+−−→−↑+↑−−→−22232222H Cl NaOH NaCl O Al O Al O H O H 电解电解电解溶液熔融12.归中反应:2H 2S+SO 2=3S+2H 2O4NH 3+6NO −−→−催化剂4N 2+6H 2O 13.置换反应:(1)金属→金属 (2)金属→非金属 (3)非金属→非金属(4)非金属→金属 14、一些特殊的反应类型:⑴ 化合物+单质 化合物+化合物 如:Cl 2+H 2O 、H 2S+O 2、、NH 3+O 2、CH 4+O 2、Cl 2+FeBr 2 ⑵ 化合物+化合物 化合物+单质NH 3+NO 、 H 2S+SO 2 、Na 2O 2+H 2O 、NaH+H 2O 、Na 2O 2+CO 2、CO+H 2O⑶ 化合物+单质 化合物PCl 3+Cl 2 、Na 2SO 3+O 2 、FeCl 3+Fe 、FeCl 2+Cl 2、CO+O 2、Na 2O+O 214.三角转化:15.受热分解产生2种或3种气体的反应:(1)铵盐(2)硝酸盐16.特征网络: (1))(222酸或碱D C B A O H O O −−→−−→−−→−①323222HNO NO NO NH O H O O −−→−−→−−→−(气体) ②42322222SO H SO SO S H O H O O −−→−−→−−→−(气体)③322222CO H CO CO C OH O O −−→−−→−−→−(固体) ④NaOH O Na O Na Na OH O O −−→−−→−−→−222222(固体) ⎩⎨⎧+→+铝热反应盐金属盐金属.2.1⎪⎩⎪⎨⎧+−−→−+↑−−−→−+C MgO CO Mg H Fe Mg Na O H H 22222点燃或)、、活泼金属(⎪⎪⎩⎪⎪⎨⎧+=++−−→−++−−→−+↑+=+)、(、高温高温HI HBr HCl S S H I Br Cl H CO O H C CO Si SiO C O HF O H F 2)(224222222222222⎪⎩⎪⎨⎧+−−→−++−−→−+222CO C O H H 金属金属氧化物金属金属氧化物高温高温⎧⎪⎩⎪⎨⎧↑+↑+−→−↑+↑+−→−∆∆223222322242)(2O NO Ag AgNO O NO CuO NO Cu ⎪⎩⎪⎨⎧−−→−−−→−C B 气体气体强碱强酸⎪⎩⎪⎨↑+↑−→−+↑+↑−→−+↑+↑−→−∆∆∆S H NH S NH HS NH O H SO NH SO NH HSO NH O H CO NH CO NH HCO NH 232442233243422332434])[(])[(])[((2)A —A 为弱酸的铵盐:(NH 4)2CO 3或NH 4HCO 3;(NH 4)2S 或NH 4HS ;(NH 4)2SO 3或NH 4HSO 3(3)无机框图中常用到催化剂的反应:322223322222223236454222232222NH H N OH NO O NH SO O SO O O H O H O KCl KClO MnO MnO −−−→−++−−−→−+−−−→−+↑+−−→−↑+−−−→−∆∆∆∆催化剂,催化剂,催化剂,,六、既可作氧化剂又可作还原剂的有:S 、SO 32-、HSO 3-、H 2SO 3、SO 2、NO 2-、Fe 2+等,及含-CHO 的有机物七、反应条件对氧化-还原反应的影响.1.浓度:可能导致反应能否进行或产物不同8HNO 3(稀)+3Cu==2NO↑+2Cu(NO 3)2+4H 2O4HNO 3(浓)+Cu==2NO 2↑+Cu(NO 3)2+2H 2OS+6HNO 3(浓)===H 2SO 4+6NO 2↑+2H 2O3S+4 HNO 3(稀)===3SO 2+4NO ↑+2H 2O2.温度:可能导致反应能否进行或产物不同Cl 2+2NaOH=====NaCl+NaClO+H 2O3Cl 2+6NaOH=====5NaCl+NaClO 3+3H 2O3.溶液酸碱性.2S 2- +SO 32-+6H+=3S↓+3H 2O5Cl -+ClO 3-+6H +=3Cl 2↑+3H 2OS 2-、SO 32-,Cl -、ClO 3-在酸性条件下均反应而在碱性条件下共存.Fe 2+与NO 3-共存,但当酸化后即可反应.3Fe 2++NO 3-+4H +=3Fe 3++NO↑+2H 2O一般含氧酸盐作氧化剂时,在酸性条件下,氧化性比在中性及碱性环境中强.故酸性KMnO 4溶液氧化性较强.4.条件不同,生成物则不同1、2P +3Cl 2点燃===2PCl 3(Cl 2不足) ; 2P +5Cl 2点燃===2 PCl 5(Cl 2充足)2、2H 2S +3O 2点燃===2H 2O +2SO 2(O 2充足) ; 2H 2S +O 2点燃===2H 2O +2S(O 2不充足)3、4Na +O 2缓慢氧化=====2Na 2O 2Na +O 2点燃===Na 2O 2冷、稀4高温4、Ca(OH)2+CO 2CO 2适量====CaCO 3↓+H 2O ; Ca(OH)2+2CO 2(过量)==Ca(HCO 3)25、C +O 2点燃===CO 2(O 2充足) ; 2 C +O 2点燃===2CO (O 2不充足)6、8HNO 3(稀)+3Cu==2NO↑+2Cu(NO 3)2+4H 2O 4HNO 3(浓)+Cu==2NO 2↑+Cu(NO 3)2+2H 2O7、AlCl 3+3NaOH==Al(OH)3↓+3NaCl ; AlCl 3+4NaOH(过量)==NaAlO 2+2H 2O8、NaAlO 2+4HCl(过量)==NaCl +2H 2O +AlCl 3 NaAlO 2+HCl +H 2O==NaCl +Al(OH)3↓9、Fe +6HNO 3(热、浓)==Fe(NO 3)3+3NO 2↑+3H 2O Fe +HNO 3(冷、浓)→(钝化)10、Fe +6HNO 3(热、浓)Fe 不足====Fe(NO 3)3+3NO 2↑+3H 2OFe +4HNO 3(热、浓)Fe 过量====Fe(NO 3)2+2NO 2↑+2H 2O11、Fe +4HNO 3(稀)Fe 不足====Fe(NO 3)3+NO↑+2H 2O 3Fe +8HNO 3(稀) Fe 过量====3Fe(NO 3)3+2NO↑+4H 2O 12、C 2H 5OHCH2=CH 2↑+H 2O C 2H 5-OH +HO -C 2H 5 C 2H 5-O-C 2H 5+H 2O13C 2H 5Cl +NaOH H 2O → C 2H 5OH +NaCl C 2H 5Cl +NaOH 醇→CH 2=CH 2↑+NaCl +H 2O14、6FeBr 2+3Cl 2(不足)==4FeBr 3+2FeCl 3 2FeBr 2+3Cl 2(过量)==2Br 2+2FeCl 3浓H 2SO 4170℃ 浓H 2SO 4 140℃。
人教版高中化学必修一《无机推断》练习题.docx
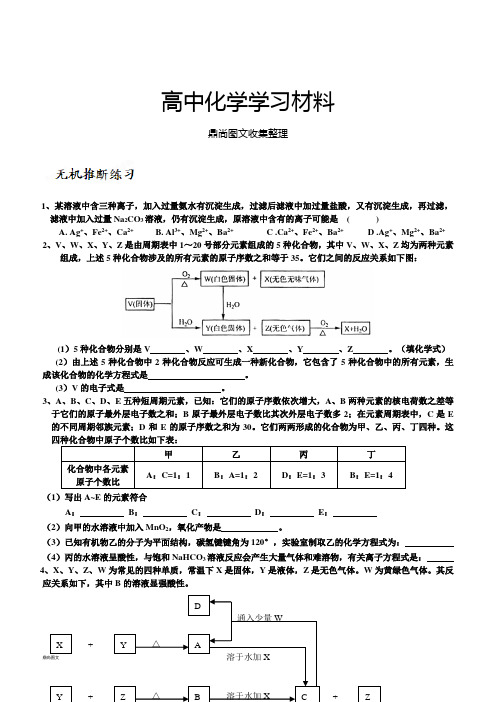
高中化学学习材料鼎尚图文收集整理1、某溶液中含三种离子,加入过量氨水有沉淀生成,过滤后滤液中加过量盐酸,又有沉淀生成,再过滤,滤液中加入过量Na 2CO 3溶液,仍有沉淀生成,原溶液中含有的离子可能是 ( )A. Ag +、Fe 2+、Ca 2+B. Al 3+、Mg 2+、Ba 2+ C .Ca 2+、Fe 2+、Ba 2+ D .Ag +、Mg 2+、Ba 2+ 2、V 、W 、X 、Y 、Z 是由周期表中1~20号部分元素组成的5种化合物,其中V 、W 、X 、Z 均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。
它们之间的反应关系如下图:(1)5种化合物分别是V 、W 、X 、Y 、Z 。
(填化学式) (2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 。
(3)V 的电子式是 。
3、A 、B 、C 、D 、E 五种短周期元素,已知:它们的原子序数依次增大,A 、B 两种元素的核电荷数之差等于它们的原子最外层电子数之和;B 原子最外层电子数比其次外层电子数多2;在元素周期表中,C 是E 的不同周期邻族元素;D 和E 的原子序数之和为30。
它们两两形成的化合物为甲、乙、丙、丁四种。
这四种化合物中原子个数比如下表:甲 乙 丙 丁 化合物中各元素原子个数比A :C=1:1B :A=1:2D :E=1:3B :E=1:4(1)写出A~E 的元素符合A :B :C :D :E : (2)向甲的水溶液中加入MnO 2,氧化产物是 。
(3)已知有机物乙的分子为平面结构,碳氢键键角为120°,实验室制取乙的化学方程式为: (4)丙的水溶液呈酸性,与饱和NaHCO 3溶液反应会产生大量气体和难溶物,有关离子方程式是: 4、X 、Y 、Z 、W 为常见的四种单质,常温下X 是固体,Y 是液体,Z 是无色气体。
W 为黄绿色气体。
高一化学无机推断试题答案及解析

高一化学无机推断试题答案及解析1. (15分)某混合物A ,含有KAl (SO 4)2、Al 2O 3和Fe 2O 3,在一定条件下可实现下图所示的物质之间的变化:据此回答下列问题:(1)I 、II 、III 、IV 四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B 、C 、D 、E 所含物质的化学式 沉淀固体B ;C ; 沉淀D ;溶液E 。
(3)写出①、②、③、④四个反应方程式(是离子反应的写出离子方程式) ① ;② ; ③ ; ④ 。
【答案】(1)过滤 (2)Al 2O 3;Al 2O 3和Fe 2O 3;Fe 2O 3;K 2SO 4和(NH 4)2SO 4 (3)①Al 2O 3+2OH‾=2AlO 2-+H 2O ②Al 3++3NH 3•H 2O=Al(OH)3↓+3NH 4+ ③AlO 2-+H ++H 2O =Al(OH) 3↓+Cl‾ ④2Al(OH) 3Al 2O 3+3H 2O【解析】KAl (SO 4)2易溶于水,Al 2O 3和Fe 2O 3均不溶于水,混合物A 加水溶解后,溶液中是KAl (SO 4)2,沉淀C 为Al 2O 3和Fe 2O 3;由转化关系图可知,向沉淀C 中加NaOH 溶液,Fe 2O 3不反应,沉淀D 为Fe 2O 3,Al 2O 3可与NaOH 溶液反应生成NaAlO 2,向NaAlO 2溶液中通入CO 2可得Al (OH )3沉淀,Al (OH )3受热分解生成固体B 为Al 2O 3;向溶液中加过量氨水,溶液与过量氨水反应,Al 3+被沉淀,得到氢氧化铝沉淀,溶液中E 为K 2SO 4、(NH 4)2SO 4,经过蒸发、结晶,得到K 2SO 4和(NH 4)2SO 4。
(1)溶液和沉淀的分离方法为过滤。
(2)由上述分析知B 为Al 2O 3,C 为Al 2O 3和Fe 2O 3,D 为Fe 2O 3,溶液E 为K 2SO 4和(NH 4)2SO 4。
高一化学无机推断试题答案及解析

高一化学无机推断试题答案及解析1.(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。
其中,I是第三周期原子半径最小的金属元素组成的单质,D是一种红棕色固体粉末,G为单质,K是一种红棕色气体,A、B相对分子质量相差16,J、C都是常见的强酸。
请填写下列空白:(1)写出下列物质的化学式B E 。
(2)反应⑦的化学方程式为。
反应⑦属于。
A.吸热反应B.放热反应C.置换反应D.氧化还原反应(3)反应⑩的离子方程式为。
(4)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2GO4(G显+6价),同时还生成KNO2和H2O。
该反应的化学方程式是:。
(5)反应①中生成的A、D物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物的化学式为。
【答案】(1)B SO3 E Fe(OH)3;(2) Fe2O3+ 2Al Al2O3+2Fe 。
反应⑦属于BCD 。
(3) 3Fe+2NO3-+8H+ = 3Fe2++2NO↑+4H2O 。
(4) Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。
(5) FeS2。
【解析】(1)甲矿石是FeS2,矿石煅烧得到A:SO2和D:Fe2O3;SO2与O2发生反应得到B:SO3,SO3与水作用得到C:硫酸;I是Al,Al与Fe2O3发生铝热反应:Fe2O3+ 2Al Al2O3+2Fe,得到的G的Fe;H是Al2O3。
E是Fe(OH)3;F是Fe2(SO4)3和Fe(NO3)3的混合物,M是Fe(NO3)2.L是NO;K是NO2,J是 HNO3。
(1)B是SO3;E是Fe(OH)3;(2)反应⑦的铝热反应的化学方程式为Fe2O3+ 2Al Al2O3+2Fe,铝热反应是放热反应,因为符合置换反应的定义,所以属于置换反应,有元素的化合价的升高与降低,所以也是氧化反应反应。
因此选项是B、C、D。
必修一无机化学推断题

必修一无机化学推断题1、由短周期元素组成的单质A 、B 、C 和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,工业上电解熔融的甲可制取金属A 。
请回答: (1)写出下列物质的化学式:A 甲 。
(2)写出乙物质的溶液中通入过量CO 2的现象: ; (3)写出丁与过量氨水反应的离子方程式: 。
2、下图中A ~H 均为中学化学中常见的物质,它们之间有如下转化关系。
其中A 为金属单质,B 为非金属单质,A 与水反应生成C 和最轻的气体D ,C 的焰色反应呈黄色。
请回答以下问题:(1)C 的电子式为_____________。
(2)F 的化学式为_____________。
(3)写出某种金属与C 反应生成D 的化学方程式________________________。
(4)写出H 与G 的稀溶液反应生成F 的离子方程式________________________。
3、下图所示各物质是由短周期部分元素组成的单质或其化合物,图中部分反应条件及物质未列出。
已知:A 、C 、D 、F 均为单质,C 、E 、F 、G 常温下是气体,J 为白色沉淀,既能溶于B ,又能溶于E ;物质B 、G 可以使湿润的红色石蕊试纸变蓝,且B 的焰色反应呈黄色。
反应④是化肥工业的重要反应。
请回答下列问题:(1)A 的元素在元素周期表中的位置是 ,物质B 的电子式为 。
(2)上述反应①~⑥中,属于化合反应的是 。
(3)反应⑤的离子方程式为 。
(4)在I 的水溶液滴加B 溶液至过量的过程中,所观察到的现象为 。
通过量CO 2通过量NH 3C乙 NaOH 溶液A+B甲NaOH 溶液HCl 溶液乙丁丙戊4、已知A ~H 是中学化学中的常见物质,A 、C 、G 是金属,E 、F 是氧化物,B 溶于水得蓝色溶液,它们有如下图所示的关系(反应中生成的水已略去)。
试回答下列问题。
(1)推断填写物质化学式:A 是 ,D 是 ,H 是 。
高一化学推断题含答案(已整理分类,独一无二版本)
(一)元素推断题1、周期表前20号元素中,它们形成离子化合物时,原子数之比为1﹕2,且阴阳离子的电子层结构相同。
写出这些化合物的化学式__________________________________________ 。
2、A 、B 两元素,A 的原子序数为X,A 、B 所在周期的元素种类分别为m 和n ,若A 和B 同主族,当B 在A 的上一周期时,B的原子序数为__________________。
B 在A 的下一周期时,B 的原子序数为_____________。
3、A 、B 、C 、D 为短周期元素,A 和B 同周期相邻,A 和C 同主族相邻,ABC 三种元素的原子序数之和为31,D 元素与ABC 既不同周期又不同主族,请回答:(1)元素符号 A ________B _________C_________D____________ . (2)A 、B 、D 组成为D 4B 2A 3的离子化合物,其水溶液的PH 值小于7的原因是(3)比较B 、D 形成的化合物与A 、D 形成的阴离子结合质子能力强弱_______. 请用方程式表示_____________________________________________________________(4)用电子式表示D 2A 形成过程___________________________________________。
4.有A 、B 、C 、D 四种短周期的非金属元素(其单质也可分别用A 、B 、C 、D 表示),四种元素的原子序数按B 、D 、C 、A 顺序增大,D 、C 元素在周期表中位置相邻。
在一定条件下,B 可以分别和A 、C 、D 化合生成甲、乙、丙化合物,C 和D 化合可得丁。
已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:请填写下列空格:(1)甲的浓溶液与一种黑色粉末共热可得A ,则甲为_______,乙为___________。
高一化学必修1推断题专题题库(含答案)
高一化学必修1推断题专题题库1、A、B、C、D、E代表单质或化合物,它们之间的相互转化关系如下图所示。
A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
(1)A的化学式为,最高化合价为。
(2)B和碳反应生成A和E的化学方程式为。
(3)C的化学式为,D的化学式为。
2、下面框图中各单质和化合物间有以下转化关系,且组成各单质和化合物的元素为核电荷数是1~18的元素。
请根据框图关系判断。
(1)单质A是,单质B一定是(填“金属”或“非金属”)(2)各化合物的化学式为:甲,乙,丙,丁。
3、A、B是两种有刺激性气味气体。
试根据下列实验事实填空。
(1)写出A~F各物质的化学式:A ,B ,C ,D ,E ,F 。
(2)写出A、B跟水反应的离子方程式。
4、下图中每一方格表示的有关的一种反应物和生成物。
己知B是一种单质,其余物质都是含有B元素的化合物;C是一种钠盐;E是C对应的酸;B和D的晶体都是高熔点、坚硬的固体,且D为B的氧化物(其它不含B 元素的反应物及各步添加的必要试剂和反应条件均己略去)。
(1)写出A、D、E的化学式:A ;D ;E 。
(2)在工业上,用碳在高温下还原D的方法可制得含少量杂质的B,其化学反应方程式为;A和B的互变在工业上的实际意义是。
(3)写出D→C反应的离子方程式。
5、下图A、B、C、D、E、F六种物质中除D为单质外其余均是常见的化合物,E和F的水溶液均呈碱性,它们的转化关系如下图所示。
请回答下列问题:(1)A、B、D的化学式A ,B ,D 。
(2)E和F可相互转化,图中己标明F向E转化的关系,写出E转化为F的化学方程式6、室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图所示进行反应,又知E溶液是无色的。
请回答:(1)A是,B是,C是。
(2)反应①的化学方程式。
(3)反应③的化学方程式。
(4)反应④的化学方程式。
7、下列物质之间能够发生如下图所示的化学反应。
011高中部分——无机推断题答案
(2) HSO4-+ HCO3-== H2O + CO2↑+ SO42- (4) Cu2O + 2H+== Cu + Cu2++ H2O 五、 (1)检验装置气密性
Cu2O + 3H2SO4(浓)
(2)用生成的 N2 排除装置内的空气,避免空气中 CO2 对实验造成的干扰 F 中不出现浑浊,I 中出现浑浊(H 内固体变红) FeO+CO↑+CO2↑+2H2O
高中部分——无机推断题答案
共 2 页
高中部分——无机推断题答案
一、 (1)7.5mol (2)①A BC ② 8H2O + 2MnSO4 + 5K2S2O8 = 2KMnO4 + 4K2SO4 + 8H2SO4(不配平 或化学式出现错误均错)③氯气( 分子式、名称均可) (3)在通入氯化氢气体的条件下加热除去结晶水。 二、 (1)第 3 周期 I A 族。 (2)S2–>O2–>Na+。 (3)离子键、共价键、配位键。 (4)① 2Al + Fe2O3 三、 (1) Al2O3 + Fe 三角锥型
九、 (1) CuO+2H ==Cu +H2O、Fe2O3+6H+==2Fe3++3H2O、Cu+2Fe3+==2Fe2++ Cu2+ SiO2 + 2NaOH==Na2SiO3 +H2O 水玻璃 (2) FeSO4•7H2O 十、 【假设与猜想】增大 Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深; 勒沙特列原理(或化学平衡移动原理) 。 【实验准备】问题 1: 8﹪;0.5mol/L 问题 2:50mL 容量瓶 【实验现象】问题 3:1.0 16﹪ 问题 4:温度升高影响配合物的稳定性,促进配合物的形成,平衡 (2)A (3)不变 向正反应方向移动。 (或该配合物形成反应是吸热反应) 十一、 (1)0.075mol·L-1·min-1 4Fe2++O2+4H+==4Fe3+ +2H2O (3)4OH--4e-== O2+ 2H2O (4) H2SO443;2H2O
高中化学无机推断题
高中化学无机推断题一、物质的重要特征性质:如物质的颜色、状态、气味、毒性、溶解性等。
1、颜色特征:常见如(1)有色气体:Cl2(),O3 (), NO2、Br2蒸汽();(2)有色溶液:(3)有色固体:(4)使品红溶液褪色的气体:(加热后又恢复红色)、(加热后不恢复红色);(5)既产生淡黄色沉淀又产生刺激性气味的气体的反应:(6)溶液颜色变为浅绿色,并产生淡黄色沉淀的离子反应:(7) 通CO2变白色浑浊:石灰水(过量变清)、Na2SiO3、饱和Na2CO3、浓苯酚钠、NaAlO22、气味特征:3、易挥发、易升华、易吸潮、易液化、可萃取等物质;4、组成特征: 10电子粒子(等);18电子粒子(等)。
组成元素(如不含金属元素的离子化合物、含金属元素的阴离子AlO2-、MnO4-),化合物的化学式(如A2B2、A2B2、A2B、AB3、AB型分子)等。
5、结构特征:正四面体结构的物质()、属于线型结构的分子(CH≡CH、CO2、HClO)、属于平面结构的分子(BCl3、CH2=CH2)、具有三角锥结构的分子(PCl3、NH3)等。
二、重要的实验现象1、燃烧时火焰的颜色:如蓝色火焰:CO、CH4,淡蓝色火焰:H2、H2S、C2H5OH、S,苍白色火焰: 。
2、焰色反应:。
3、沉淀现象:(在溶液中反应生成黄色、黑色、蓝色、红色、白色沉淀的有哪些?)4、先沉淀后溶解的有:。
5、放气现象:与酸反应产生刺激性气味气体的反应有哪些?。
产生能使澄清石灰水变浑浊的气体的反应有哪些?。
与碱反应生产有刺激性气味的气体,且气体可使湿润的蓝色石蕊试纸变红的物质?6、变色现象:Fe(NO3)2与HCl反应现象:酸碱指示剂的颜色变化:卤素单质在各种溶剂中的颜色变化等。
7、吸热放热现象:常见吸热、放热反应;酸碱盐溶解时的热量变化等。
8、爆炸现象:如H2与Cl2混合见光反应;易燃气体与空气混合达到爆炸极限。
三、重要的反应条件1、无机化学中需催化剂的反应;2、高温条件下的反应:N2与H2、C与氧化物、Fe与H2O、制玻璃、制粗硅、铝热反应、分解;3、需放电才能发生的反应:N2与O24、需光照的反应:CH4与Cl2、H2与Cl2、HClO分解、卤化银、硝酸、硝酸银等5、浓硫酸存在下的反应:6、水浴加热的反应:;7、使用温度计的反应:;四、重要特征反应的物质1、能与水反应产生气体的物质:Na、K、F2、Na2O2、Mg3N2、CaC2、Al2S3等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
必修一无机化学推断题(二)
1、由短周期元素组成的单质A 、B 、C 和甲、乙、丙、丁、戊五种化合物有下图所示转换
关系,工业上电解熔融的甲可制取金属A 。
请回答: (1)写出下列物质的化学式:A 甲 。
(2)写出乙物质的溶液中通入过量CO 2的现象: ; (3)写出丁与过量氨水反应的离子方程式: 。
2、下图中A ~H 均为中学化学中常见的物质,它们之间有如下转化关系。
其中A 为金属单质,
B 为非金属单质,A 与水反应生成
C 和最轻的气体
D ,C 的焰色反应呈黄色。
请回答以下问题:
(1)C 的电子式为_____________。
(2)F 的化学式为_____________。
(3)写出某种金属与C 反应生成D 的化
学方程式________________________。
(4)写出H 与G 的稀溶液反应生成F 的离子方程式________________________。
3、下图所示各物质是由短周期部分元素组成的单质或其化合物,图中部分反应条件及物质
未列出。
已知:A 、C 、D 、F 均为单质,C 、E 、F 、G 常温下是气体,J 为白色沉淀,既能溶于B ,又能溶于E ;物质B 、G 可以使湿润的红色石蕊试纸变蓝,且B 的焰色反应呈黄色。
反应④是化肥工业的重要反应。
请回答下列问题:
(1)A 的元素在元素周期表中的位置是 ,物质B 的电子式为 。
(2)上述反应①~⑥中,属于化合反应的是 。
(3)反应⑤的离子方程式为 。
(4)在I 的水溶液滴加B 溶液至过量的过程中,所观察到的现象为 。
通过量CO 2
通过量NH 3
C
乙 NaOH 溶液
A
+B
甲
NaOH 溶液
HCl 溶液
乙
丁
丙
戊
4、已知A ~H 是中学化学中的常见物质,A 、C 、G 是金属,E 、F 是氧化物,B 溶于水得
蓝色溶液,它们有如下图所示的关系(反应中生成的水已略去)。
试回答下列问题。
(1)推断填写物质化学式:A 是 ,D 是 ,H 是 。
(2)F 的类别是 (选填“酸性氧化物”、“碱性氧化物”或“两性氧化物”)。
(3)反应①的化学方程式为____________________________。
(4)反应④的化学方程式为____________________________。
(5)反应⑥的离子方程式为____________________________。
5、下图是中学化学中常见的一些物质之间的转化关系图,其中部分反应中的产物未列全.............。
已知A 为金属单质,B 是实验室常见的气体干燥剂。
请回答下列问题:
(1)C 的分子式为 ;组成C 的元素在周期表中同处于 族。
(2)D 生成F 的离子方程式为 。
(3)E 是两种元素组成的化合物,这两种元素分别是 (写元素符号)。
(4)C 、G 、H 均为形成 的空气污染物;一定条件下,NH 3与G 或H 均能反 应生成对空气无污染的两种物质,请写出一定条件下NH 3与G 或H 反应的化学方程 式 (写其中一种即可,反应条件省略)。
空气
(无色)
稀HNO 3
(白色)
BaCl 2溶液 (无色)
褪色
品红溶液 (黑色)
(蓝色)
△
(无色油状液体)
(红色固体)
A
B
D 溶液 C 气体
E 固体
F 沉淀
D 溶液
G 气体 (红棕色)
H 气体
6、以下框图中A→M 是中学化学中常见的物质,其中A 、E 是金属,F 和J 为气体单质, 其余均为化合物或其溶液,C 为淡黄色固体,D 为红棕色粉末,M 为红褐色固体。
请回答下列问题:
(1)E 在元素周期表中的位置___________; C 物质中所包含的化学键类型____________。
(2)写出反应①的离子方程式:_________________________________。
(3)写出反应②的化学方程式:_________________________________。
7、下图中A~G 均为中学化学中常见的物质,它们之间有如下转化关系(反应条件已略去)。
其中A 、G 为非金属单质,且A 为黑色固体、G 为气态;D 、F 都是大气污染物,主要来源于汽车尾气,而且D 为红棕色气体。
请回答以下问题:
(1)A 的元素在元素周期表中位于__________________,C 的化学式是_______________。
(2)写出D 与E 反应的化学方程式_________________________________。
(3)在常温下,B 的稀溶液也可与Cu 反应生成F 。
写出此反应的离子方程式: ____________________________________。
8、下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。
各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A 、B 、D 在常温下均为无色无刺激性气味的气体,C 是使湿润的红色石蕊试纸变蓝的气体,M 是最常见的无色液体。
(1)物质G 的化学式:__________。
(2)物质B 的电子式:___________。
(3)写出A→D 的化学方程式:__________________________;
G→E 的离子方程式:________________________________。
A
B
B
C D
E
F + G
澄清石灰水
白色沉淀
A
D C
E
B
F G M
H 2D 催化剂
Na 2O 2
Cu
水稀释
Cu 催化剂
9、下图中A~K均为中学化学中常见的物质,它们之间有如下转化关系。
其中A、C为常见的黑色固体且A是单质,E、F是能使澄清石灰水变混浊的气体,且E无色无味、F有刺激性气味,G是最常见的液体,H是黄绿色气体。
(1)A在周期表中的位置,K的化学式
(2)写出①的离子方程式
写出③的化学方程式
写出④的化学方程式
10、下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。
常
温常压下,A为淡黄色的化合物固体,B为金属单质,C为盐酸,E、F为非金属气体单质,H为液体,气体J的水溶液呈碱性,L为白色沉淀。
请回答下列问题:
(1)H的电子式为。
(2)G的化学式为。
(3)写出F与氮气反应生成J的化学方程式:________________________________。
(4)写出L与D反应生成K的离子方程式:________________________________。
(5)写出F生成J的化学方程式:________________________________。
