第4章有机金属化合物-习题
有机化学第四章结构的表征习题答案

第四章 结构的表征4-1 如何用IR 光谱区别下列各组化合物。
(1)异戊烷分子中有异丙基,在1370—1380cm -1 的吸收峰分裂成两峰,强度接近; (2)在3000cm -1以上无吸收峰者为丁烷; (3)在3000—3100cm -1无吸收者为环已烷; (4)在3010cm -1附近有吸收峰者为甲叉基环已烷(亚甲基环已烷); (5)在3025cm -1附近和2720cm -1处有强吸收峰者为4-已烯醛; (6)在1060cm -1附近有强吸收峰者为正戊醇;(7)在1750—1860cm-1出现两个峰,其中高频峰强于低频峰者为乙酐。
4-2 如何用1H-NMR 谱区分下列各组化合物?(1)环丁烷只有一个单峰,而甲基环丙烷有四组吸收峰; (2)新戊烷只有一个单峰,而正戊烷有三组吸收峰;(3)前者(1-氯-2-溴乙烷)有两组峰,而后者(1,2-二溴乙烷)只有一个单峰。
4-3 比较下面两化合物中所标出的质子在1H-NMR 谱中化学位移大小,并从低场到高场的顺序排列。
(1)B →A →C →D ; (2)A →B →C 。
4-4 请将下列各化合物中画线的质子的化学位移按由低场至高场的顺序排列。
(2)→(1)→(3)。
4-5将下列化合物按C=O 健伸缩振动吸收波数由大到小排列成序。
(1)→(2)→(3)。
4-6 请将下列各组化合物按紫外吸收波长由大到小的顺序排列。
(1) B →D →A →C ; (2) D →C →B →A 。
4-7根据NMR 谱推测下列化合物可能的构造式。
C CH 3CH 3H 3CBrCH 2OHCH 3CH BrCH 3(1)(2)(3)(4)CH 2CH 2CHCH 3BrBr4-8某化合物的分子式为C 4H 8O,它的红外光谱在1715cm -1有强吸收峰,它的核磁共振谱有一单峰,相当于三个H ,有一四重峰相当于二个H ,有一三重峰相当于三个H.。
试写出该化合物的构造式。
金属有机化学 第4章 过渡金属有机化合物

烯烃-π配合物
F e (C O ) 5
+
H 2C = C H C H = C H 2
uv -C O H 2C
H2 C Fe OC
H2 C CH2 CO CO
C H C O 2E t F e (C O ) 5 + C H C O 2E t
uv -C O E tO 2 C
OC
×
Fe CO CO
H C
H C
O OC Fe C O C Fe CO
Fe2(5–C5H5)2(-CO)2 (CO)2
35
金属茂的反应性
与亲电试剂反应, 例如酰基化反应:
COCH3
Fe
+
COCH3 C H 3C O C l
Fe
C H 3C O C l
A lC l3
Fe
COCH3
与丁基锂的反应: 锂化反应
Li LiBu +
Fe Fe
trienyl
环戊二烯(η 5) 苯,环庚三烯(η 6)
环庚三烯基(η 7)
12
有效原子序数规则(18电子规则)
这个规则实际上是金属原子与配体成键时倾 向于尽可能完全使用它的九个价轨道(五个d轨道 、1个s、三个p轨道)的表现。 有些时候,它不是 18 而是 16。这是因为18e意 味着全部s、p、d价轨道都被利用,当金属外面电 子过多,意味着负电荷累积, 此时假定能以反馈键 M→L形式将负电荷转移至配体,则18e结构配合 物稳定性较强;如果配体生成反馈键的能力较弱 ,不能从金属原子上移去很多的电子云密度时, 则形成16电子结构配合物。
3 , 1
4 4 5, 3 , 1 6
-烯丙基(allyl) C3H5 1,3-丁二烯 C4H6 环丁二烯 C4H4
有机化学课后第四章习题答案
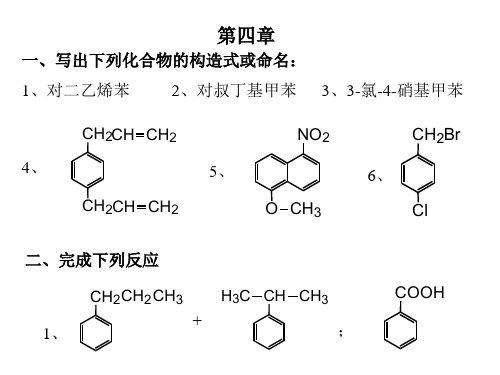
一、写出下列化合物的构造式或命名:
1、对二乙烯苯 2、对叔丁基甲苯 3、3-氯-4-硝基甲苯
CH2CH CH2
4、
5、
NO2CH2Br 6、 NhomakorabeaCH2CH CH2
O CH3
Cl
二、完成下列反应
CH2CH2 CH3
H3C CH CH3
1、
+
;
COOH
2、Cl2/光照; AlCl3 +
3、H2SO4/0~80℃; 165℃
CH3 Cl
NO2
CH3
Br2
CH3
3、
FeBr3
Br
Br
Br
4、
Br2
ClCOCH3
FeBr3
AlCl3
COCH3
CH3 KMnO4
7、
H+,△
COOH
HNO3 H2SO4 O2N
COOH NO2
八、指出下列化合物硝化时,导入的硝基在环上的位置:
CH3 CH3
CH3 OCH3
CH3
OH
SO3H
Cl
1、
>
NO2
NO2
>
>
NO2
OH
2、
>
COCH3 NO2
>
>
五、由苯或甲苯开始合成下列化合物:
CH3 HNO3
2、
H2SO4
CH3
Cl2
FeCl3
NO2
CH3 Cl
NO2
或:
CH3 浓H2SO4 100℃
CH3
Cl2
FeCl3
SO3H
CH3 Cl
H3O+ 150℃
高等有机化学第四部分4-6金属有机化合物

O
四、反应还被用来合成高分子(特殊 的高分子,如导电子分子)
X Ar MgCl
Ni (Ar)n
Br Ar Br+ (HO)2B Ar B(OH)2 Pd
(Ar) (Ar')
*从机理看反应应用了 a)O.A. b)烷基化 c)R.E.
R'M'
RX
M(O) O.A
R MX
M'X R
M R'
R R' +M(o)
实验二:
CH3 CH = CH CH3
+
CO3 CO = CO CO3
CH3 CH = CO CO3
"W"
CH3 CH = CH CO3
CH3 CO = CO CH3
CH3 CH = CO CH3
只有这种产物所以证明反应中没有氢或烷基的转移。
最早认为机理:
R M ⅡⅡ
M
R
R
RR
R
R
到1972年.E.O.Fishec发现:
1、
(CO)5CR = C
Ar OCH3
+ CH2 = C
CO3Et H
Ar CH2 = C OMe
2、
Ar (CO)5W = C Ar +
CH2 = C
OCH3 Ar
(CO)5W = C
R.E.
O ?Ⅱ ?Ⅱ ?Ⅱ
X_ Pd
OH
R
X
O
Pd R
HO ?Ⅱ ?Ⅱ H
O
Ph R CH CH2 + CO
O
Ph
R CH CH2 CO
O
β_ ⅡⅡ
O CH2 Rh CHR
2019第4章金属有机基础

用价值。
高等有机化学
4.2 金属有机化合物分类和命名
• 4.2.1 金属有机化合物的分类 主族金属有机化合物 过渡金属有机配合物 稀土金属有机配合物
高等有机化学
4.2 金属有机化合物分类和命名
烯烃-金属键理论
Dewar (1951):Bull. Soc. Chim. France; Chatt, Duncanson (1953): J. Chem. Soc
用于说明Zeise’s salt 的结构;影响Hoechst-Wacker process
• 1952 H. Gilman LiCu(CH3)2, organocopper chemistry • 1953 G. Wittig (1979 Nobel laureate)
• 1852 CH3HgI ; 1860 B(CH3)3, Sn(C2H5)4 高 等 有 机 化 学
4.1 简介
• 1890 L. Mond Ni(CO)4, 第一个过渡金属羰基化合物 • 1891, Fe(CO)5 • 1899 P. Barbier
Barbier’s student: V. Grignard (starting from 1900-) (1912
高等有机化学
4.1 简介
• 1951:发现二茂铁: 合成 P. L. Pauson, T. J. Kealy
Nature 1951, 168, 1039.
• 1952: S. A. Miller et al. at British Oxygen Co. (already has this compound for three year) J. Chem. Soc. 1952, 632.
有机化合物课后习题答案

有机化合物课后习题答案有机化合物课后习题答案第一章绪论习题答案1 •说明有机化合物的特点。
答案:有机化合物的特点是:数目繁多,结构复杂;稳定性差,容易燃烧;熔点•沸点较低;难溶于水;易溶于有机溶剂;反应速度慢;反应复杂,副产物多。
2•计算C7H702N的不饱和度并写出可能的结构式。
答案:有机化合物的不饱和度计算公式为,代入数字得不饱和度为5,所以可能的部分结构式分别是:3.搞清下列各概念并思考各组概念的区别。
①均裂•异裂;②离子型反应•游离基反应;③亲电反应•亲核反应;④键的极性和键的极化度;⑤键长•键角;⑥键能•键的离解能答案:①均裂共价键断裂后,两个成键原子共用的一对电子由两个原子各保留一个。
异裂共价键断裂后,共用电子对只归属原来生成共价键的两个原子中的一个。
②有离子参加的反应叫离子型反应。
有自由基(游离基)参加的反应叫游离基反应。
③由亲核试剂的进攻而发生的反应叫亲核反应。
由亲电试剂的进攻而发生的反应叫亲电反应。
④键的极性是由于成键原子的电负性不同而引起的。
当成键原子的电负性不同时,核间的电子云密集区域偏向电负性较大的原子一端,使之带部分负电荷,而电负性较小的原子一端则带部分正电荷,键的正电荷重心与负电荷重心不重合,这样的共价键称为极性共价键。
如HC1分子中的H-C1键就是极性共价键。
键的极化度是指在外界电场的影响下,共价键的电子云重新分布。
无论是非极性分子或极性分子的极化状态都将发生变化,使极性分子的极性增强,非极性分子变为极性分子。
⑤键长(Bond length):指分了中两成键原了核间的平衡距离。
键角(Bond angle):指分了中同一原了形成的两个化学键Z间的夹角。
键角是反映分子空间结构的重要因素。
⑥键能(Bond energy):在25。
(2和101. 325kPa压力下,以共价键结合的A. B两个原子在气态时使用键断裂,分解为A和B两个原子(气态)所消耗的能量叫做键能。
键离解能(Dissociation energy): 一个共价键断裂所消耗的能量叫做共价键的离解能。
第4章习题答案(科学出版社)
第四章相平衡思考题1.什么叫自由度?相律的内容是什么?它能够解决什么问题?答:在不引起旧相消失和新相形成的前提下,可以在一定范围内独立变动的强度性质称为系统的自由度。
相律就是在平衡系统中,系统内相数、组分数、自由度数及影响物质性质的外界因素(如温度、压力、重力场、磁场、表面能等)之间关系的规律。
相律是一个定性规律,可以指示相平衡体系中有几个相,可以指导如何去识别由实验绘制的相图。
2.水的三相点与冰点是否相同?答:不相同。
纯水的三相点是气-液-固三相共存,其温度和压力由水本身性质决定,这时的压力为610.62Pa,温度为273.16K。
热力学温标1K就是取水的三相点温度的1/273.16K。
5 水的冰点是在大气压力下,水的三相共存点的温度。
由于冰点受外界压力影响,在10Pa压力下,温度下降0.00747K,由于水中溶解了空气,温度又下降0.0024K,所以在大气压力为105Pa时,水的冰点为273.15K。
3.相点与物系点有什么区别?答:相点是相图中表示某平衡相组成的点。
从相点位置可看出该相的状态、组成、温度、压力等。
相点位置可随压力、温度的改变而改变。
在单组分系统的相图上,所有点全部是相点。
物系点是在多组分系统的相图上表示系统总组成的点,在单相区,物系点可与相点重合,而在两相区内只有物系点。
该物系所对应的两个相组成由两个相点表示。
在T-x图上,物系点可沿着与温度坐标平行的直线上下移动;在水盐系统图上,随着水的含量不同,物系点可沿着与组成坐标平行的直线左右移动。
4.单组分系统的三相点与低共熔点有何异同点?答:共同点:都是三相共存。
不同点:单组分系统的三相点是气-液-固三相共存,这时的自由度为零,它的压力、温度由系统自身性质决定,不受外界因素影响。
而二组分系统的低共熔点在等压的条件下自由度为零。
外压改变,低共熔点的温度和组成也会随之而改变。
5.米粉和面粉混合得十分均匀。
再也无法彼此分开,这时混合体系有几相?答:两相6.金粉和银粉混合后加热,使之熔融后冷却,得到的固体是一相还是两相?答:一相7.低共熔物能不能看作是化合物?答:不能。
有机化学章节习题参考答案(1-5)
第一章 绪论 习题答案1-1、 指出下列分子中官能团类型答案:(1)羟基;(2)羰基;(3)氨基、羧基;(4)酰胺;(5)羰基、双键;(6)羟基、羰基;(7)羧基;(8)羟基1-2、 下列化合物中标出的两根键哪个更短,为什么?答案:(1)a 小于b ,双键原因;(2)b 小于a ,sp 电负性大;(3)a 小于b ,共轭 1-4 答案:(1)C HHH 3COH(2)Na +O -CH 3(3)H 2C CH 2O(4)CH 3NH 2CH 2ClF3HHC CH H 2CCH2sp 23CH 333(5)CH 2SHCH 3OH 2CP(CH 3)3(6)Lewis 酸Lewis 碱(CH 3)2S BF 3Me 3N AlCl 3HCHOBF 31-4、第2章 烷烃和环烷烃习题及答案2-1 用中文系统命名法命名或写出结构式。
答案: (1)2,6,6-三甲基-3-乙基辛烷 (2)2,6,7-三甲基壬烷(3)1-甲基-1-氯环己烷 (4) 顺-1,2-二溴环己烷 (5(6)(7)CCCC CH 3CH 3CH 3CH 3H 3H 3(8) (CH 3)2CHCH 2CH 2CH 32-2 用不同符号标出下列化合物中伯、仲、叔、季碳原子,并给以命名。
答案: (1) CH 3CH CH 2C C CH 3CH 3CH 2CH 3CH 3CH 3CH 2CH 31o 1o 1o1o1o1oo 2o2o 21o o 3o4o 43,3,4,4,6-五甲基辛烷 (2) CH3CH(CH 3)CH 2C(CH 3)2CH(CH 3)CH 2CH31o1o1o1o1oo2o2o 3o 3o 42,4,4,5-四甲基庚烷2-3 指出下列四个化合物的命名中不正确的地方并给以重新命名。
答案: (1)主链选错。
应为:2,4,6-三甲基-6-乙基辛烷 (2)主链、碳原子编号错。
应为:2-甲基-3乙基己烷 (3)碳原子编号错。
有机金属化合物-4
e2u
无对称性匹配 价原子轨道
非键
二茂铁的分子轨道
LUMO非强反键 HOMO非强成键
可能存在非18e物种
如:[Fe(h5-Cp)2]+ [Ni(h5-Cp)2]
酸性溶液中易被氧化为正离子
❖易被Ag+、NO3-等氧化为蓝色的铁茂正离子 [Fe(C5H5)2]+
E = + 0.56 V
吸电子基(如羧基)
—NH2
合成
母体环戊二烯商品一般二聚
蒸馏
HH
2
利用C5H6的弱酸性(pKa 20) 设法得C5H5-
HH
H
-H+
H H Na THF
无机强碱:
Na+C5H5- FeCl2 (h5-C5H5)2Fe + 2NaCl
M(CO)x+3 [CpM(CO)x]- + 3CO
C5H6 + KOH THF KC5H5 + H2O
获1973年诺贝尔化学奖
"for their pioneering work, performed independently, on the chemistry of the organometallic, so called sandwich compounds."
建议阅读材料
诺贝尔奖获奖演说
and research began in Munich, J. Organometal. Chem. 637–639 (2001), 7–12.
4. F. A. Cotton, Cyclopentadienyl–metal chemistry in the Wilkinson Group, Harvard, 1952–1955,
有机化学题库(2)
第四章 炔烃和二烯烃(习题和答案)一、给出下列化合物的名称1.H C CH 3H C CH 3C C HH 2. CH CH CH 2CH 2C(Z ,E)-2,4-己二烯 1-戊烯-4-炔3. CH CH 2CH 3C 2H 5CH 3C C C4. (CH 3)2CH C(CH 3)3C C4-乙基-4-庚烯-2-炔 2,2,,5-三甲基-3-己炔5. CH CH CH CH 2CH C6. CH CH CH CH 3CC C1,3-己二烯-5-炔 5-庚烯-1,3-二炔7. (CH 3)2CH H C C 2H 5C H C C 8.CH 2CH 2CH=CH 2CH 3CH 2CH 3CH C C(E)-2-甲基-3-辛烯-5-炔 3-乙基-1-辛烯-6-炔9. H H C C 2H 5C CH 3C C H H 10. CH H C CH CH 3C CH 3CH 3C(Z ,Z)-2,4-庚二烯 3,5-二甲基-4-己烯-1-炔 二、写出下列化合物的结构1. 丙烯基乙炔 2. 环戊基乙炔CH CH CH CH 3C CHC3.(E)-2-庚烯-4-炔 4.3-乙基-4-己烯-1-炔 CH 2CH 3HC CH 3C H C C CH CHCH 2CH 3CH CH 3CH C5.(Z)-3-甲基-4-乙基-1,3-己二烯-5-炔 6.1-己烯-5-炔CH CH 2CH3CHCH 2C CH 3C C CH CH CH 2CH 2CH 2C 7.(2E ,5Z)-6-甲基-2,5-辛二烯 8.3-甲基-3-戊烯-1-炔H H C C 2H 5CH 2CH 3C CH 3C C H CH3CH CH 3C C9.甲基异丙基乙炔 10.3-戊烯-1-炔CH (CH 3)2CH 3C C CHCH 3CH CH C 三、完成下列反应式 1.Cl 2CH 2CH 2CH CHC ClCH 2CH 2CH CHC2.稀H 2SO 4CH 3CH 2CHCHgSO 4OCH 3CH 3CH 23.+CH CH CH CH 3OCH=CH 2CC CH OOO CH 3C C O O4.NaCH 2CH NH 3O s O 4H 2O 2CH 3CC 液 HHC C 2H 5CH 3C HOC 2H 5(±)OHCH 3HH 5.CH CH 3Br 2CCl 4CH 3CC CH CH Br CH 3Br CH 3C C CH 6.H 2催化剂Lindlar CH 3CH CC H HC CH 3C CH 37.2CHCOCH 3C8.Na2CH 2CHCCH 2CHCCH 2CH 3C9.H 2OCH 24+CH CH 3CH CHgSO 4CH CH 3C OCH 3CH10.KMnO 4KOHCH 3CH 2CCOOK +CO CH 3CH 211.CH ClCH 2CH F +C CAg(NH 3) CH C CH 2FC CAg12.CHCH 3CH 2CCH 2CH 2CH 3CHO13.Na INH 3CH 3CHCH 3C液H 2Pt /PbCNa CH 3C CCH 3CH 3CH HC CH 3C CH 314.H 2OCOOHKMnO 4C 2H 5CH 3CH +B 2H C C 2H 5CH=CH 2CH 2OH C 2H 5CH 15.CH 2CH 2CH HBr CH +CCH 2CH Br CHCH 3C16.CH 2C 3+CH=CH 2 CH 2C CH 3Br +CH CH 3(主)CH 2C CH 3CH CH 3(次)17.CH C 6H 5+CH CH=CH 2 CH C 6H 5CH Cl CH CH 318.CH 3CH CC OCH 3CH 3CH 219.O 3C H 2OCH 3CH 2CH 3C COOH CH 3CH 2CH 3COOH +20.△ClNa NH 2CH 3ClCCHCCH 2CHO四、用化学方法鉴别下列化合物1.(A) 己烷 (B) 1-己炔 (C) 2-己炔答:加入溴水不褪色的为(A),余下两者加入Ag(NH 3)2+溶液有白色沉淀生成的为(B),另者为(C)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.20 为什么金属羰基化合物中,金属元素可以呈零价如Fe(CO)5,甚至可以呈负价如[Co (CO)4]-?
4.21 为什么小分子配体如NO、CN-、N2具有与CO相似的配位性质?
Fe(CO)5 Co(CO)4 Ni(CO)4 (η5-C5H5)2Mn(η6-C6H6)2Cr
Mn2(CO)10
V(CO)6
HCo(CO)4
(η7-C7H7)Mo(CO)
+ 3
4.5 试求下列稳定化合物或物种化学式中的 x 值: Mn(CO)xI Co(CO)x(NO) (η5-C5H5)Fe(η6-C6H6)x+
4.12 如何制备下列金属羰基化合物?简要说明它们的主要物理性质: (1)由铁粉制Fe(CO)5; (2)由水合硫酸钴制Co2(CO)8; (3)由水合氯化铬制Cr(CO)6; (4)由水合氯化亚锰制Mn2(CO)10; (5)由Fe(CO)5 制Fe3(CO)12。
4.13 写出并配平下列反应: (1)Mn2(CO)10 与I2共热; (2)在THF中Mo(CO)6与KI一起回流; (3)Fe(CO)5跟KOH溶液反应; (4)Ni(CO)4跟PCl3反应。
第四章 有机金属化合物
【习题】
4.1 试列举 V、Cr、Fe 和 Ni 的几种金属羰基化合物,写出它们的分子式,并指出哪些符合 EAN 规则?
4.2 为什么过渡金属 Mn、Tc、Re 和 Co、Rh、Ir 易于形成多核羰基化合物?
4.3 为什么稀土元素一般不形成金属羰基化合物?
4.4 试判别下列化合物或物种中,哪些服从 18 电子规则,哪些不服从:
4.14 列举几个简单的羰合酸根离子、卤素羰基化合物的例子,指明其中金属原子的氧化态。
4.15 在一个 OC-M-CO 结构中,当发生下列变化时,CO 的伸缩振动频率如何变化? (1)一个 CO 被一个三乙基胺所取代; (2)在配合物中加入一个正电荷; (3)在配合物中加入一个负电荷。
4.16 如果钒的羰基化合物符合 EAN 规则,那么它的最简单化合物的分子式应该是什么?为 什么它实际上又是不稳定的?
4.24 如何制备二茂铁Fe(η5-C5H5)2?简述晶体二茂铁的结构特点,所属的点群;定性描 述它的化学成键方式。
4.25 氯化锗是一无色发烟液体(沸点 84 ℃),通过蒸馏GeO2的浓盐酸溶液可以方便制得该 液体。试设计一个方法,由氧化锗(IV)制取四乙基锗(沸点 161 ℃)。
3
4.26 实验室中如何制备格氏试剂?举例说明格氏试剂在合成化学中的应用。 4.27 什么是均相催化?什么是非均相催化?各有什么特点? 4.28 什么是 Wilkinson 催化剂,是举一例说明该催化剂是如何催化烯烃加氢的? 4.29 什么是氢甲酰化反应?什么样的有机金属化合物可用作该反应的催化剂? 4.30 简述 Monsanto 醋酸合成法的原理以及所用的催化剂。 4.31 什么是 Ziegler-Natta 催化剂?举例说明它的重要应用。
4.8 举例说明什么叫协同成键作用?
4.9
预言并解释在V(CO)
− 6
、Cr
系列中,CO的伸缩振动频率的变
化趋势。
1
4.10 试画出Fe2(CO)9、Ru3(CO)12和Rh4(CO)12的结构。
4.11 制备金属羰基化合物的一般途径是什么?通常要用到哪些类型的反应物,试举例说明。
Fe(CO)4x-
4.6 试解释下列实验事实: (1)二茂铁鎓离子(η5-C5H5)2Fe+ 是一强氧化剂;(2)二茂钴Co(η5-C5H5)2在合适的 溶剂中是一强还原剂;(3)二茂镍易跟一氧化氮气体反应生成(η5-C5H5)Ni(NO)。
4.7 CO 是一种很不活泼的化合物,试定性解释为什么它能跟过渡金属原子形成稳定的化合 物? 跟金属结合的原子为什么是 C 而不是 O?
频率分别为 2 143、2 004、1 855 和 1 950 cm-1。 (2)在[Fe(CO)4]2-、[Co(CO)4]- 和[Ni(CO)4]中CO的对称伸缩振动频率分别
为 1 788、1 918 和 2 121 cm-1。 (3)[V(CO)6]-和V(CO)6中的V-C键长分别为 193 pm和 200 pm。
4.22 试分析对比蔡斯盐中,乙烯与Pt2+的成键方式与金属羰基化合物中CO与金属原子的成 键方式的相同与区别点。
4.23 在乙醚中用金属锂处理Co2(CO)8时得到一个化学式为LiCo3(CO)10的红色晶体,并 放出一氧化碳,该晶体的红外光谱出现 3 个不同的羰基伸缩振动吸收峰 2 080~2 000、1 850 和 1 600 cm-1,请据此推出它的最合理的结构式(画图)。
4.17 已知Mn2(CO)10只观测到 2 044~1 980 cm-1范围内的伸缩振动带,而Co2(CO)8观 测到 2 071~2 022 cm-1的振动带以及另外两个 1 860 cm-1和 1 858 cm-1的振动带,试画出
2
Mn2(CO)10 和Co2(CO)8的合理的结构式。
4.18 讨论下列实验观测结果: (1)CO、Mo(CO)6、Mo(CO)3(NH3)3和Mo(CO)3(PPh3)3的红外伸缩振动
4
