药品微生物限度检验记录(铜绿甲单胞菌)
药品微生物限度检查控制菌实验记录

十六烷平板
G氏染色
氧化酶试验
绿脓菌素试验
生化试验
结果:(规定不得检出)
金黄色葡萄球菌检查(阳性菌加入CFU/ml)方法:
项目Βιβλιοθήκη 供试品阳性对照阴性对照
营养肉汤增菌
甘露醇氯化钠琼脂平板
G氏染色
血浆凝固酶试验
生化实验
结果:(规定不得检出)
结论:
检验者:校对者:报告日期:
文件编号:J
微生物限度检查实验记录Ⅱ
检品编号:批号:共页第页
沙门菌检查(阳性菌加入CFU/ml)方法:
项目
供试品
阳性对照
阴性对照
营养肉汤
TTB
DHL平板
EMB平板
TSI斜面
生化试验
血清凝集试验
结果:/10g(规定不得检出/10g)
铜绿假单胞菌检查(阳性菌加入CFU/ml)方法:
项目
供试品
阳性对照
阴性对照
微生物检验记录

;
28±2℃培养5天;
培养箱型号
;编号:
;
平皿1
10-1CFU/g 10-2CFU/g 10-3CFU/g
报告 10-1CFU/g 10-2CFU/g 10-3CFU/g
报告
平皿2
平均
耐热大肠菌群(不得检出)
金黄色葡萄球菌(不得检出)
检测项目
乳糖胆盐发 酵24h;继续 培养至48小
时
伊红美兰 24h
XX有限公司 微生物检验记录
□原料; □半成品; □半制品; □成品; □新样品;
订单号码
产品编号
ቤተ መጻሕፍቲ ባይዱ
检验日期: 批号
产品名称
生产/进料日期
取样人
检测标准:《化妆品安全技术规范》
细菌总数(应<100 CFU/ml)
霉菌和酵母菌总数(应<10 CFU/ml)
检测项目
36±1℃培养48±2h; 培养箱型号
;编号:
革兰氏 染色镜检
靛基质 试验
报告
菌落特征
溶血圈
革兰氏 染色镜检
血浆凝 固酶试
验
报告
管1
管2
管3
检测项目
菌落特征
铜绿假单胞菌(不得检出)
革兰氏染色镜检
氧化酶试验
绿脓菌素试 验
硝酸盐还原产气试验
明胶液 化 试验
报告
平皿1
平皿2
平皿3 综合判定: □合格; □不合格
审核:
检验:
【实验】控制菌检查实验报告

【关键字】实验控制菌检查实验报告篇一:控制菌检查方法验证试验记录控制菌检查方法验证试验报告一、目的:确认供试品的抑菌活性及测定方法的可靠性。
二、内容:大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌测定。
三、菌种:金黄色葡萄球菌【CMCC(B)26003】、大肠杆菌【CMCC(F)44102】、乙型副伤寒沙门菌【CMCC(B)50094】、铜绿假单胞菌【CMCC(B)10104】、生孢梭菌【CMCC(B)64941】.四、方法:常规法();培养基稀释法();薄膜法();综合法()(依据《中国药典XX版》二部微生物限度检查法方法验证实验)五、验证方法:(1)试验组取ml供试液及ml(50~100cfu/ml)试验菌加入增菌培养基中,依相应控制菌检查法进行检查(2)阴性菌对照组方法同试验组,验证大肠杆埃希菌、大肠菌群、乙型副伤寒沙门菌检查法时的(本文来自:小草范文网:控制菌检查实验报告)阴性对照菌采用金黄色葡萄球菌;验证铜绿假单胞菌、金黄色葡萄球菌、生孢梭菌检查法时的阴性对照菌采用大肠杆埃希菌。
阴性对照菌不得检出。
六、试验记录:七、结论:通过以上方法学验证实验证明,采用稀释法();培养基稀释法();薄膜法();综合法()阳性代表菌株验证实验均符合要求, 故该方法适用于复核人:试验人:年月日篇二:控制菌检查控制菌检查简述控制菌检查是用于检查某些特定微生物,规定按一次检出结果为准,不再复试。
由于控制菌为一次性报告试验结果,故应注意方法的有效性确证(方法验证或阳性对照)、实验过程保障和结果确证,以提高检验结果的可靠性。
既要躲免漏检造成的假阴性结果,又要躲免实验室污染造成的假阳性结果。
控制菌检查中,涉及实验室监控菌株的分离鉴定、样品阳性菌株的分离分析、方法验证试验中的阳性菌操作等,应在专门的阳性菌实验室进行。
除另有规定外,阳性菌实验室应符合国家二级生物安全标准,阳性菌实验室应配备生物安全柜。
阳性菌操作不得在供试品检验用洁净实验室内进行。
微生物检验记录表
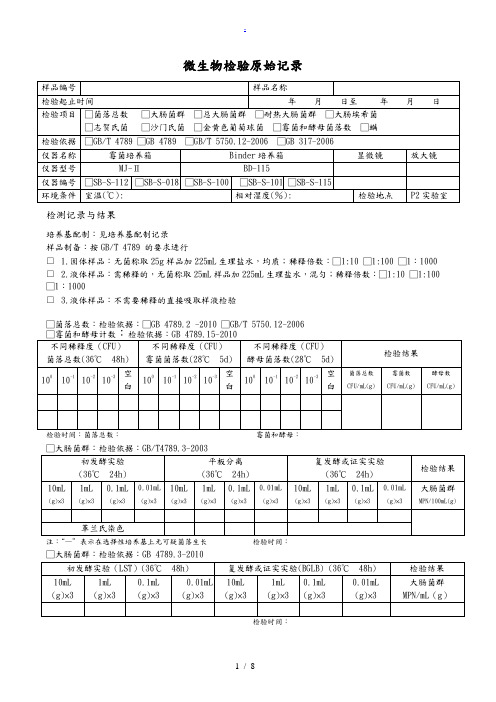
微生物检验原始记录
检测记录与结果
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□耐热大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
□大肠埃希氏菌:检验依据:GB/T 5750.12-2006
检验时间:
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
(2020版)药品片剂微生物限度检查法验证记录

(2020版)药品片剂微生物限度检查法验证记录文件编号:XXX-XX-XXXXXX制药有限责任公司XX年XX月XX日XX片微生物限度检查法标准起草说明XX片由XXXXXXXX药材制成,有XXXXX作用。
根据其用药途径和处方,应进行需氧菌总数、霉菌数和酵母菌总数的测定及控制菌大肠埃希菌检查。
本品参照2015版药典进行过方法适用性验证没有发现抑菌性,所以确定需氧菌总数、霉菌数和酵菌总数及大肠埃希菌采用常规法测定。
经对所采用的方法适用性进行试验,符合《中国药典》2020版四部1105非无菌产品微生物限度检查的微生物计数法和1106非无菌产品微生物限度控制菌检查法与1107非无菌药品微生物限度标准,方法可行。
XX片微生物限度检查法标准正文微生物限度:按微生物限度检查法(《中国药典》2020版四部1105非无菌产品微生物限度检查的微生物计数法和1106非无菌产品微生物限度控制菌检查法与1107非无菌药品微生物限度标准。
取样品10克,加PH7.0无菌氯化钠蛋白胨缓冲液稀释至100ml,制备成溶解均匀的1:10供试液。
需氧菌总数、霉菌与酵母菌总数取本品1:10供试液1ml,注皿,平行制备平皿(2个平皿需氧菌总数和2个平皿霉菌与酵母菌总数),按平皿法测定。
大肠埃希菌取本品1:10供试液10ml直接接至100ml胰酪大豆胨液体培养基中,依法检查。
《中国药典》非无菌制剂项下标准规定:需氧菌总数103cfu/g ; 霉菌和酵母菌总数102cfu/g ; 不得检出大肠埃希菌(1g)。
XX片生物限度检查方法适用性试验1、样品名称:XX片批号XXX、XXX、XXX2、验证用菌种:铜绿假单胞菌CMCC﹙B﹚10104、、枯草杆菌CMCC﹙B﹚63501、金黄色葡萄球菌CMCC﹙B﹚26003、白色念珠菌CMCC﹙F﹚98001、黑曲霉CMCC ﹙F﹚98003 大肠埃希菌CMCC﹙B﹚44102.3.实验方法:《中国药典》2015版四部微生物限度方法适用性检查验证实验。
药品微生物限度检查方法介绍

洁净度的要求
应在环境洁净度 10000级局部洁净度 100 级的单向流空气区域内进行。检验全过程必
须无菌。
工作台面及环境应定期按《医药工业洁
净室(区)悬浮粒子、浮游
菌和沉降菌的
测试方法》的现行国家标准进行洁净度验证。
5
尘埃粒子 洁净级别
尘粒数/m3 ≥0.5um ≥5um 100级 ≤3,500 ≤0 1000级 ≤350,000 ≤20,00 100000级 3,500,000 ≤20,000 GB/T16294-1996 沉降菌 洁净级别 100级 10000级 100000级
27
供试液的制备(4)
非水溶液性供试品 软膏剂、乳膏剂、称供试品5g(5ml),加到 含已灭菌溶化并45℃保温的乳化剂的烧杯中,用无菌玻棒搅拌混 匀后,慢慢加入45℃左右的稀释剂85ml,边加边搅拌,使供试品 充分乳化,作供试液(1:20)。 油剂取供试品10ml,加入无菌聚山梨酯—80 5 –8ml,摇匀,再加 入稀释剂至100ml。
沉降法:自然沉降5min,取上层液置100ml增菌液中
30
供试液的稀释(10倍递增稀释法)
10g 1ml 1ml
100ml 10ml 10ml
1:10 1:100 1:1000
至少3个稀释级,每递增1个稀释级,必须更换吸管。
管内混合吹打不少于10次,吸液在液面下2.5cm处,放 液在液面上1cm处,延内壁缓缓吹出全部溶液,然后将 吸管放入消毒液缸内。
药品的卫生学检查方法介绍
(北京市药品检验所
戴红)
1
无菌室的质量管理 药品的微生物限度检查 药品的无菌检查
微生物限度检验

Cetrimide 琼 脂 35-37 ℃,1872h
金黄色葡萄球 菌 10g (10ml)样 品 90ml 缓冲蛋 白胨水
10ml加入 100ml TSB 35-37 ℃,1848h
Baird Parker 琼脂 35-37 ℃,1872h
11
验证内容
(一)计数方法验证 (二)控制菌检验方法验证
12
微生物限度检验方法验证 (一)
计数方法验证
13
供试液制备( 中国药典2005版)
- 表面活性剂、中和剂或灭活剂:应证明其有效性及 对微生物的生长和存活无影响。
- 供试液从制备至加入检验用培养基,不得超过1小 时。
- 供试液制备若需用水浴加温时,温度不应超过45℃。 - 供试液的体积:100ml。
MacConkey 琼 脂 35-37 ℃,1872h
沙门菌
10g (10ml)样品
90ml TSB 35-37 ℃,1824h
1ml 加入10ml TTB 肉汤 41-43 ℃,1824h
脱氧胆盐琼脂 XLD琼脂 亮绿(BG)琼脂 35-37 ℃,1872h
铜绿假单胞菌
10g (10ml)样 品 90ml 缓冲蛋白 胨水
肠杆菌和G-杆
10g (10ml)样 品 90ml乳糖肉汤 35-37 ℃,2-5h
10ml 加入 100ml Mossel 肉汤 (EE肉汤) 35-37 ℃,1848h VRBG 琼脂 35-37 ℃,1824h
大肠杆菌
10g (10ml)样品
90ml TSB 35-37 ℃,1848h
1ml 加入100ml McConkey 肉 汤 43-45 ℃,1824h
微生物限度检验记录

微生物限度检验记录一、检验目的:确认产品是否满足微生物限度要求,保证产品的安全性和质量。
二、检验项目:1.总大肠菌群:用于评估产品是否受到粪便污染。
2.霉菌和酵母菌:用于评估产品是否受到霉菌和酵母菌的污染。
3.沙门氏菌:用于评估产品是否受到沙门氏菌的污染,沙门氏菌是一种常见的食源性病原菌。
4.铜绿假单胞菌:用于评估产品是否受到铜绿假单胞菌的污染,铜绿假单胞菌是一种常见的致病菌。
5.谷氨酰胺酶阳性菌:用于评估产品是否受到谷氨酰胺酶阳性菌的污染,谷氨酰胺酶阳性菌是一种常见的致病菌。
三、检验步骤:1.样品准备:从产品中取得一定量的样品,确保样品的代表性。
2.样品处理:根据产品的不同特性,选择适当的方法进行样品处理,如水解、稀释等。
3.培养基制备:根据所需的检验项目,制备相应的培养基。
4.培养基接种:将处理后的样品接种到相应的培养基中,利用无菌技术确保操作的无菌。
5.培养:将接种过的培养基培养在适宜的温度和湿度条件下,培养一定的时间,一般为24-72小时。
6.检查结果:观察培养基上是否有菌落形成,记录菌落的数量和形态特征。
7.鉴定:对培养出的菌落进行进一步的鉴定,如形态学观察、生理生化特性测试等。
8.统计和分析:根据检查结果,统计并分析微生物的数量,计算出产品的微生物限度。
四、检验结果:1.总大肠菌群:每克不超过100个。
2.霉菌和酵母菌:每克不超过10个。
3.沙门氏菌:每克不得检出。
4.铜绿假单胞菌:每克不得检出。
5.谷氨酰胺酶阳性菌:每克不得检出。
五、检验记录样例:日期:2024年4月1日样品名称:XXX产品检验员:XXX检验项目:1.总大肠菌群结果:每克10个,符合微生物限度要求。
2.霉菌和酵母菌结果:每克2个,符合微生物限度要求。
3.沙门氏菌结果:未检出,符合微生物限度要求。
4.铜绿假单胞菌结果:未检出,符合微生物限度要求。
5.谷氨酰胺酶阳性菌结果:未检出,符合微生物限度要求。
六、结论:根据检验结果,XXX产品符合微生物限度要求,产品安全可靠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化酶试验
培养基
名称
营养琼脂培养基
绿
脓
菌
试
验
培养基
名称
PDP琼脂培养基
批号
批号
培养
温度
℃
培养
温度
℃
时间
日时至日时,计小时
时间
日时至日时,计小时
现象:
现象:
结果判定:
结果判定:
检验项目标准规定检验结果
铜绿假单胞菌每1不得过检出□未检出 □检出结论:检验人:复核人:
药品微生物限度检验记录
(铜绿假单胞菌)
检验号REC-QC-057-00
品名
跌打活血散(混合生药粉)
规格
批号
数量
来源
紫外消毒时间
时分至时分
取样日期
报告日期
检验依据
铜绿假单胞菌
增菌培养:取供试液10ml,直接接种至适量(不少于100ml)的胆盐乳糖培养基中,培养。
培养基
名称
胆盐乳糖培养基
培养
温度
℃
批号
时间
日时至日时,计小时
分离培养:取上述培养物,划线接种于溴化十六烷基三甲铵琼脂培养基的平板上,培养。
培养基
名称
溴化十六烷基三甲铵琼脂培养基
培养
温度
℃
批号
时间
日时至日时,计小时
现象:
确证试验:从上述分离平板上挑选2〜3个疑似菌落,分别接种于营养琼脂培养基斜面上,培养18〜24小时。取斜面培养物进行革兰染色、镜检及氧化酶试验。
